
Пупочные грыжи
Пупочные грыжи обычно бывают врожденными. Приобретенные пупочные грыжи часто возникают при повышенном внутрибрюшном давлении при беременности, асците или морбидном ожирении. Врожденные пупочные грыжи обычно самопроизвольно закрываются до 2-летнего возраста. Если этого не произошло после 4-х лет или размер дефекта в более раннем возрасте превышает 2 см, необходимо оперативное лечение.
При пробе Вальсальвы в области пупка определяется выпячивание, которое затем вправляется, при этом пальпаторно определяется дефект. Изредка за пупочную грыжу может быть принята липома или эпигастральная грыжа, однако в большинстве наблюдений диагноз оказывается верным. Хронически невправимые грыжи могут быть ошибочно приняты за липому. Если нет показаний сомневаться в правильности диагноза, нет необходимости выполнять какие-либо дополнительные обследования, чтобы направить больного на оперативное лечение.
Выполняют разрез выше или ниже пупка и находят грыжевой мешок. Когда грыжевой мешок выделен из окружающих тканей, его вскрывают, содержимое вправляют в брюшную полость, грыжевой мешок иссекают. Дефект ушивают крепкими плетеными нерассасывающимися нитями. В случае достаточно большого дефекта, когда швы затягиваются с чрезмерным натяжением, следует использовать эндопротез. При пупочных грыжах достаточно редко возникают рецидивы и встречается мало осложнений.
Клиническая картина
Коллатерали между системой воротной и нижней полой вен представляют собой тонкостенные сосуды. С увеличением портального давления они растягиваются и варикозно изменяются. Клиническая картина у пациентов с портальной гипертензией и кровотечением из варикозно расширенных вен зависит от объема и темпа кровопотери. У пациентов с длительной (скрытой) незначительной кровопотерей заболевание проявляется слабостью, анемией и дефицитом железа. Учитывая хроническую природу процесса, при скрытой кровопотере пациент может наблюдать значительное ухудшение состояния. При физикальном обследовании пациент выглядит утомленным и бледным. Артериальное давление, ввиду отсутствия острого кровотечения, остается нормальным. Чаще клинические проявления кровотечения из варикозно расширенных вен пищевода бывают более выраженными, сопровождаясь кровавой рвотой, меленой или кровавым стулом, указывающими на массивное желудочно-кишечное кровотечение.
У пациентов с портальной гипертензией источник кровотечения может локализоваться практически в любом отделе ЖКТ. Однако чаще причиной массивных кровопотерь становится разрыв варикозно расширенных вен пищевода, желудка или обоих этих органов. При обусловленных портальной гипертензией кровопотерях из источников других локализаций должны проводиться сходные реанимационные мероприятия, оценка тяжести и своевременное лечение.
У пациентов с циррозом печени желудочно-кишечные кровотечения далеко не всегда связаны с разрывом варикозно расширенных вен. При тяжелых заболеваниях печени и циррозе увеличивается, по сравнению с общей популяцией, склонность к образованию пептических язв и других поражений ЖКТ. Вследствие плохого общего состояния здоровья и, часто, пагубного образа жизни, у таких пациентов чаще возникают кровотечения из пептических язв. Помимо этого, к кровотечению их нижнего участка пищевода может привести обусловленный рвотой синдром Маллори-Вейсса. Тяжелый эзофагит или гастрит могут привести к острой или, чаще, хронической кровопотере. У пациента с диагностированным циррозом и варикозным расширением вен пищевода, в случае массивного желудочно-кишечного кровотечения в качестве его возможного источника всегда следует рассматривать разрыв варикозных вен. На данном предположении должна основываться как неотложная помощь, так и диагностические мероприятия.
Обследование пациента
Первое и главное при обследовании пациента с подозрением на варикозное кровотечение - всесторонняя клиническая оценка. Уделяют внимание признакам асцита, энцефалопатии и атрофии конечностей. Наличие любого из этих признаков свидетельствует о тяжелом циррозе и плохом печеночном резерве. Зачастую наблюдаются паукообразные гемангиомы на коже и пальмарная эритема, признаки увеличенного сердечного выброса и низкого периферического сосудистого сопротивления и другие проявления тяжелого прогрессирующего цирроза.
При общем обследовании необходимо быстро оценить тяжесть состояния пациента. Выраженная кровавая рвота и мелена с признаками геморрагического шока указывают на тяжелое кровотечение и необходимость в соответствующем лечении. Жизненный параметры, психический статус и интенсивность продолжающегося кровотечения определяют проведение неотложной помощи по схеме ABC(проходимость воздухоносных путей [airway], остановка кровотечения [bleeding], поддержание гемодинамики [circulation]). Крайне важна защита воздухоносных путей и предотвращение аспирации крови в трахеобронхиальное дерево, особенно при наличии обусловленной заболеванием печени энцефалопатии. Пациентов с низким дыхательным резервом, или при неспособности защиты воздухоносных путей до проведения каких-либо вмешательств следует заинтубировать, во избежание аспирации крови. Сразу же после ИВЛ необходимо провести возмещение внутрисосудистого объема и как можно скорейшую остановку кровотечения.
У пациентов с портальной гипертензией и кровотечениями из варикозно расширенных вен часто наблюдают выраженные гематологические отклонения. Анемия может быть следствием как острой, так и хронической кровопотери. В последнем случае может наблюдаться железодефицитная анемия. Нарушения гемостаза могут возникнуть вследствие продолжающейся кровопотери, нарушенной синтетической способности печени или гиперспленизма. У пациентов с кровотечением, вне зависимости от его источника, обязательно следует проводить коррекцию нарушений свертывания при помощи свежезамороженной плазмы и парентерального введения витамина K. Секвестрация тромбоцитов в селезенке у пациентов с портальной гипертензией часто приводит к тромбоцитопении. При этом переливание тромбоцитов неэффективно вследствие их быстрого удаления из кровотока.
Могут также наблюдаться многочисленные отклонения результатов лабораторных исследований. Электролитный дисбаланс может быть следствием приема мочегонных препаратов, злоупотребления алкоголем, перераспределения жидкости в организме, острой кровопотери или реанимационных мероприятий. Для оценки функции печени и определения необходимости в возмещении факторов свертывания должны использоваться уровень альбумина, билирубина и холестерина в сыворотке, а также протромбиновое время.
Обследование пациентов с циррозом печени и кровотечением из варикозно расширенных вен должно включать скрининг на гепатиты и ВИЧ. Скрининг на гепатиты может определить причину цирроза, а также предоставить информацию для назначения соответствующей этиотропной терапии. Лечение пациентов с выраженной вирусной нагрузкой может отличаться от лечения пациентов с длительно существующим гепатитом в терминальной стадии цирроза печени без таковой. Необходимо также проводить поиск признаков ВИЧ-инфекции. Выбор способа лечения портальной гипертензии может зависеть от прогнозируемой продолжительности жизни при ВИЧ-инфекции и СПИДе.
Биопсия печени позволяет установить окончательный диагноз, возможную этиологию и морфологические особенности цирроза. Определенная при помощи биопсии степень активности гепатита может не соответствовать клинической картине печеночного резерва. В экстренных ситуациях биопсию обычно не проводят ввиду ее рискованности и длительности гистологического исследования.
После завершения физикального обследования и получения результатов лабораторных исследований, каждый пациент должен быть оценен по классификации Чайлда и Чайлда-Пью, а также с учетом МТСЗП. Несмотря на известные ограничения этих систем оценки, они остаются лучшим способом определения прогноза и помогают в назначении соответствующего лечения.
Ранняя интенсивная терапия
При лечении пациентов с портальной гипертензией и желудочно-кишечным кровотечением после обеспечения адекватного дыхания следует начинать восполнение внутрисосудистого объема. При планировании реанимационных мероприятий важно оценивать величину и тяжесть кровопотери. При небольших желудочно-кишечных кровотечениях может быть достаточно переливания изотонических кристаллоидных растворов, таких как лактат Рингера. При выраженном кровотечении необходимо раннее переливание эритроцитарной массы. Следует поддерживать адекватный уровень гемоглобина. Введение свежезамороженной плазмы уменьшает исходную коагулопатию и способствует остановке кровотечения.
Ввиду того, что для успешного проведения реанимационных мероприятий часто требуется переливание больших объемов жидкости, важна катетеризация центральной вены и мониторинг центрального венозного давления или давления в легочной артерии. Обычно лучший доступ обеспечивает внутренняя яремная вена, поскольку в данной области легче контролировать образование гематомы, чем при осложнении катетеризации подключичной вены. Важно также не превышать объем переливаемой жидкости. Если инфузионная терапия приводит к чрезмерному повышению центрального венозного давления (например, до 20 мм рт.ст.), происходит значительное повышение портального венозного давления (например, до 40 мм рт.ст.), приводящее к выраженному растяжению варикозно расширенных вен и продолжению кровотечения. Целью реанимационных мероприятий является нормализация артериального давления и внутрисосудистого объема с восстановлением адекватной продукции мочи.
Сразу же после прибытия пациента в больницу следует начинать лечение, направленное на остановку кровотечения из варикозно расширенных вен еще до установления окончательного диагноза. Лечение до постановки диагноза не вполне оптимально, однако при тяжелом варикозном кровотечении его проводят по жизненным показаниям.
Фармакотерапия
Первоначальным лечением у пациентов с циррозом печени и варикозным кровотечением, за исключением реанимационных мероприятий, служит фармакотерапия. Ее обычно начинают до эндоскопических методов диагностики и лечения, поскольку она легкодоступна, относительно нетоксична и достаточно эффективна. Фармакотерапия не усиливает желудочно-кишечные кровотечения, не связанные с портальной гипертензией, и может быть достаточно полезной.
Основными препаратами для фармакотерапии являются вазопрессин♠иоктреотид. Вазопрессин был основой лечения пациентов с кровотечениями, обусловленными портальной гипертензией, на протяжении нескольких десятилетий. Его внутривенное введение следует начинать с дозировки до 1,0 ЕД/мин (не вводить более 20 ЕД за 20 мин), а затем постепенно снижать до 0,4 ЕД/мин. Вазопрессин имеет относительные противопоказания при поражении коронарных артерий, поскольку они снижают кровоток в миокарде, вызывая спазм коронарных сосудов. При лечении пожилых больных или пациентов с диагностированным поражением коронарных сосудов лечение вазопрессином следует сочетать с внутривенным введением нитроглицерина. Кроме того, вазопрессин способствует задержке жидкости в организме и увеличению асцита, поэтому длительность его введения не должна превышать 72 ч.
В последнее время вместо вазопрессина все чаще используют октреотид. Октреотид (синтетический аналог соматостатина) не оказывает негативного влияния на коронарный кровоток и не способствует задержке жидкости с накоплением асцита. В рандомизированных исследованиях, сравнивающих октреотид и вазопрессин, была установлена их равнозначность в лечении кровотечений и по уровню 30-дневной летальности. Октреотид вводят в виде внутривенного болюса от 50 до 100 ЕД с последующим введением от 50 до 100 ЕД/ч. Лечение указанными препаратами обычно продолжают от 2 до 4 дней, в то время как планируют и проводят более специфическое лечение.
Эндоскопическая склеротерапия и перевязка
Экстренная эндоскопия имеет исключительную важность в диагностике и лечении пациентов с циррозом печени при подозрении на кровотечение из варикозно расширенных вен. При ведении таких пациентов показано раннее проведение эндоскопического обследования верхних отделов ЖКТ. Может также потребоваться и колоноскопия, для исключения источника кровотечения в нижних отделах ЖКТ. Перед эндоскопическим исследованием в таких условиях стоят три основные задачи.
- Первая задача заключается в определении причины и локализации кровотечения. Сделать это иногда бывает просто, но порой практически невозможно, например при заполнении пищевода, желудка и двенадцатиперстной кишки свернувшейся кровью, или при заполнении толстой кишки каловыми массами и кровяными сгустками. Важно отличать кровотечения, обусловленные портальной гипертензией, от кровотечений другой этиологии (например, при пептических язвах, синдроме Маллори-Вейсса, эзофагите или раке).
- Вторая задача - определение размера и локализации варикозно расширенных сосудов для планирования лечения. Например, если кровотечение связано с мелкими варикозными сосудами, расположенными в пищеводе, без признаков варикозного расширения вен желудка, шансы на успех при эндоскопическом лечении превышают 90%.
- Третья задача и окончательная цель срочной эндоскопии - лечение. При помощи эндоскопии возможно проведение непосредственного контроля кровотечения из варикозно расширенных вен. Варикозно расширенные вены пищевода, так же как и геморрой, могут быть эндоскопически перевязаны или склерозированы посредством введения в них специального раствора, без неблагоприятного влияния на функцию печени. Крупные варикозно расширенные вены хуже поддаются эндоскопическому лечению и могут являться источником повторных кровотечений. Чрезмерно расширенные варикозные узлы очень сложно перевязывать, поскольку узел может состоять лишь из передней стенки варикозно измененной вены. Перевязка передней стенки не приводит к облитерации варикозно расширенной вены. Она может усилить кровотечение вследствие некроза самой стенки. Таким пациентам часто назначается склеротерапия. В США из склерозирующих средств чаще всего используются тетрадецилсульфат натрия и моррхуат натрия. Склерозирующие вещества обычно вводятся непосредственно в варикозно расширенную вену, хотя некоторые эндоскописты предпочитают вводить склерозирующее средство вдоль стенок варикозно измененного сосуда (параварикозное введение). В ряде исследований не удалось установить преимущество какого-либо из этих двух способов. Варикозно расширенные вены желудка не поддаются эндоскопическому лечению и обычно требуют проведения портальной декомпрессии. Они также не поддаются склеротерапии или перевязке, поскольку тонкая стенка желудка легко подвергается перфорации.
У эндоскопической склеротерапии и перевязки есть множество потенциальных осложнений, хотя серьезные осложнения встречаются нечасто. Выраженное кровотечение из варикозно расширенных вен - осложнение лечения, характерное для параварикозной склеротерапии или неадекватной перевязки. Кровотечение из участка, не подвергавшегося эндоскопическому лечению, обычно возникает вследствие отказа от эндоскопического лечения и не считается его осложнением. При повторных кровотечениях из варикозно расширенных вен вне зависимости от того, возникли они после неудачно проведенного лечения или вследствие отказа от него, также применяют эндоскопическую склеротерапию или перевязку.
Перфорация пищевода - редкое, но грозное осложнение склеротерапии. Чаще наблюдается изъязвление слизистой пищевода в области введения склерозирующего вещества или места перевязки узлов. Язвы могут возникать в течение 1 нед после лечения, порой являясь источником достаточно значимых повторных кровотечений. Заживление выраженных изъязвлений может привести в последующем к образованию стриктур.
Эндоскопическое лечение кровотечений из варикозно расширенных вен сопровождается невысокой летальностью (l-2%). При перевязке наблюдается меньше осложнений, реже образуются стриктуры и язвы. Этот метод лечения позволяет более эффективно останавливать кровотечение из варикозно расширенных вен пищевода, чем склеротерапия. При некоторых обстоятельствах повторное эндоскопическое вмешательство может рассматриваться как окончательное лечение у пациентов с кровотечением из варикозно расширенных вен пищевода. Для окончательности лечения требуется проведение нескольких сеансов в течение длительного периода времени с целью облитерации варикозно измененных вен. Однако повторные эндоскопические процедуры не всегда применимы. Некоторые пациенты не способны выдержать режим лечения, другие ― жут в сельских районах, отдаленных от центров оказания медицинских услуг. Пациенты с варикозным расширением вен желудка или кишечника не подходят для проведения долгосрочной эндоскопической терапии.
Баллонная тампонада
У пациентов с продолжающимся кровотечением и не поддающимся лечению посредством эндоскопических вмешательств (либо с неэффективностью подобного лечения), неконтролируемым приемом фармпрепаратов, следующим этапом лечения должна быть баллонная тампонада при помощи зонда Сенгстакена-Блэйкмора. Параллельно следует проводить подготовку к портальной декомпрессии или другим видам радикального лечения.
Двухбаллонный зонд (рис. 19.4) вводят через рот в желудок. Для предотвращения аспирации к зонду проксимальнее пищеводного баллона присоединяют аспиратор. При этом происходит удаление секрета или крови с предотвращением их аспирации в трахеобронхиальное дерево. После введение зонда нахождение его наконечника в желудке подтверждается рентгенографически. Затем желудочный баллон заполняют 250-300 мл воздуха, и повторно рентгенографически проверяют положение наконечника зонда. После подтверждения положения зонда к нему прилагают тягу в 0,5-1,0 кг. Она обеспечивает положение баллона в области пищеводно-желудочного соединения и сдавление фундальных и кардиальных варикозно расширенных вен. В случае продолжения кровотечения в пищеводный баллон нагнетают воздух, обычно до давления 30 мм рт.ст. После правильной установки зонда Сенгстакена-Блэйкмора канал желудочного зонда и назоэзофагеальный зонд подсоединяют к вакуум-аспиратору для периодической эвакуации секрета пищевода и желудка. Следует внимательно наблюдать за состоянием слизистой губ пациента во избежание образования пролежней.

Рис. 19.4. Зонд Сенгстакена-Блэйкмора и назоэзофагеальный зонд.
Зонд с раздутыми баллонами нельзя оставлять более чем на 48 ч. В течение 48 ч обычно происходит стабилизация состояния пациента и коррекция коагулопатии. Через 48 ч существенно повышается риск образования язв или пролежней, связанных с раздутыми баллонами.
Ключевые моменты
При лечении портальной гипертензии следует надеяться на лучшее, но готовиться к худшему. Любое оперативное вмешательство у пациентов с циррозом и портальной гипертензией может привести к тяжелой кровопотере
Манипуляции на нижней полой и воротной венах значительно облегчаются при использовании тупого гладкого инструмента (например, наконечника аспиратора). Часто множество варикозно расширенных вен обнаруживают в забрюшинно и воротах печени; они могут являться источником достаточно выраженного кровотечения. В таких случаях необходимо производить перевязку сосудов, их электрокоагуляцию, либо сочетать оба метода
При формировании Н-образного портокавального шунта малого диаметра первый анастомоз формируют между трансплантатом и нижней полой веной. При проведении флеботомии важно производить клиновидное иссечение стенки нижней полой вены для обеспечения адекватного оттока от трансплантата. Необходимо быть внимательным во избежание повреждения желчного протока, желчного пузыря или печеночной артерии
Необходимо проверять интраоперационное давление до и после шунтирования. После завершения формирования шунта должно происходить снижение давления в воротной вене по меньшей мере до 10 мм рт.ст., а градиента воротная вена/нижняя полая вена ― менее чем до 10 мм рт.ст. Наличие вибрации в нижней полой вене краниально от шунта свидетельствует о его состоятельности
Радикальное лечение пациентов с кровотечением из варикозно расширенных вен при циррозе печени и портальной гипертензии
Общие положения
При невозможности консервативного ведения, включая эндоскопическую склеротерапию и лигирование, или при его неэффективности, требуется проведение более радикального лечения кровотечения и обусловившей его портальной гипертензии. Идеально, когда оперативное вмешательство выполняется при соответствующей подготовке пациента. Неотложные или срочные операции сопряжены с более высоким риском. Кроме того, большинство хирургов предпочитают улучшить показатели гемостаза, подготовить ЖКТ, получить информированное согласие пациента, а также оценить функцию печени для планирования оптимального лечения.
Оценка по Чайлду, МТСЗП, возраста, причины цирроза и общего состояния здоровья пациента представляет огромное значение для назначения лечения. Приверженность лечению и готовность пациента к сотрудничеству, способность следовать назначениям представляют наиболее важные факторы при выборе способа лечения, требующего многократного проведения процедур с высокой вероятностью неэффективности, таких как длительная фармакологическая терапия с повторной эндоскопической склеротерапией и перевязкой варикозно расширенных вен. Бесспорное влияние на комплаентность оказывает длительный прием пропранолола и нитратов, требующий от пациента надлежащей дисциплины и способный привести к снижению его работоспособности. Для эффективности многократных сеансов склеротерапии и лигирования варикозно расширенных вен требуется значительная готовность и желание пациента сотрудничать с врачом.
До выбора способа радикального лечения следует ответить на ряд вопросов:
? Насколько активно заболевание печени?
? Каковы резервы печеночной клетки?
? Существует ли возможность неоперативного лечения?
? Улучшит ли состояние пациента портальная декомпрессия, селективная деваскуляризация или трансплантация?
? Правильно ли выбрано время для оперативного вмешательства?
Ответы на эти вопросы помогут хирургу в назначении наилучшего лечения для каждого отдельного пациента. Варианты радикального лечения включают трансплантацию печени, портальную декомпрессию посредством хирургического шунтирования или ТВПШ, а также деваскуляризацию.
Трансплантация печени в лечении кровотечения из варикозно расширенных вен, связанного с циррозом печени и портальной гипертензией
Сразу же после остановки острого кровотечения следует рассмотреть варианты радикального лечения. Наилучший вариант для пациентов с циррозом и портальной гипертензией - трансплантация печени. Однако этот метод лечения наиболее трудоемок и требует высокой комплаентности. Сложность оперативного вмешательства, а также ограниченная доступность донорских органов делают трансплантацию печени непригодной в качестве лечения первой линии у пациентов с кровотечением из варикозно расширенных вен.
В 1967 г. доктор Томас Старцл (Штарул) первым сообщил о пациенте с циррозом печени, прожившем 13 мес после трансплантации печени. Успехи в иммуносупрессии, получении донорских органов, хирургической технике и анестезии позволили снизить периоперационную летальность и улучшить долговременную выживаемость после трансплантации. В настоящее время трансплантация печени выполняется приблизительно в 70 центрах США. Несмотря на то что эта операция - радикальное лечение, для определения ее применимости к конкретному пациенту следует рассмотреть ряд положений.
? Окончательная необходимость в трансплантации решается при определении печеночного резерва. В трансплантации нуждаются пациенты с циррозом печени и кровотечением, обусловленным портальной гипертензией, при минимальном или недостаточном печеночном резерве. Точное определение печеночного резерва всегда представляло достаточно серьезную проблему. На сегодняшний день чаще всего используют оценку при помощи МТСЗП. Оценка по МТСЗП, равная или превышающая 18, указывает на неизбежную потребность в трансплантации, а оценка в 13 баллов предусматривает необходимость в трансплантации печени в будущем.
? Некоторым пациентам, нуждающимся в трансплантации печени, ее не проводят ввиду отсутствия донорской печени в регионе их проживания. Несмотря на совершенствование медицинской транспортировки, данная проблема остается актуальной.
? Трансплантация и последующая иммуносупрессивная терапия могут быть недоступными для пациентов без достаточной материальной обеспеченности.
? В качестве хороших кандидатов для трансплантации не рассматривают пациентов в активной фазе алкогольной зависимости, пациентов со значительной вирусной нагрузкой при вирусном гепатите и ВИЧ. Учитывая эпидемиологию цирроза печени в США, трансплантация печени позволяет устранить портальную гипертензию у большого числа пациентов.
? Существует значительная нехватка донорских органов.
? Трансплантация, по возможности, не должна выполняться в экстренном порядке, поскольку в этом случае невозможно проведение адекватной оценки показаний к операции, а также психосоциологического обследования и коррекции.
? Пациенты с острым кровотечением из варикозно расширенных вен зачастую слишком ослаблены, чтобы перенести трансплантацию печени.
? Трансплантация печени не всегда гарантирует успешное излечение. Даже после исключения алкоголиков, пациентов с избыточной вирусной нагрузкой и тяжелобольных, после этой операции все еще остается достаточно высокая периоперационная летальность и частота отторжения пересаженного органа в течение первого года. Тем не менее, у пациентов, переживших 1 год после трансплантации печени, наблюдается высокая долгосрочная выживаемость и функциональная активность трансплантата.
Следует подчеркнуть, что определяющим критерием для трансплантации печени служит функциональный печеночный резерв. В терминальной стадии заболевания печени, при короткой ожидаемой продолжительности жизни обязательно необходимо рассмотреть возможность трансплантации, оказать пациенту психологическую и финансовую поддержку. Если резерв печеночных функций адекватен для продолжительной жизни после остановки острого кровотечения и восстановление общего состояния пациента, то при надлежащем контроле вирусной нагрузки трансплантацию можно отложить.
Оперативная портальная декомпрессия при лечении кровотечения из варикозно расширенных вен, связанного с циррозом печени и портальной гипертензией
При неэффективности неоперативных методов лечения кровотечения из варикозно расширенных вен у пациентов с адекватным печеночным резервом или при высоком риске развития повторных кровотечений следует рассмотреть возможность проведения портальной декомпрессии. Она может производиться как путем традиционных оперативных вмешательств, так и малоинвазивных при помощи лучевого наведения, например ТВПШ. Хирургическое портокавальное шунтирование может быть селективным или неселективным, в зависимости от расположения шунта. Селективное шунтирование направлено на декомпрессию. В его цели не входит снижение общего портального давления. При неселективном шунтировании декомпрессия пищеводно-желудочного комплекса варикозно расширенных сосудов происходит вследствие снижения брыжеечного и портального венозного давления. Неселективное шунтирование в свою очередь разделяется на полное и частичное в зависимости от степени достигаемой декомпрессии. Полное неселективное шунтирование полностью разгружает портальную систему с остаточным градиентом давления воротная вена/НПВ около нуля. Выделяют следующие разновидности этого типа шунтирования: «конец-в-бок», «бок-в-бок» и Н-образный портокавальный шунт большого диаметра (³16 мм); Мезокавальный шунт большого диаметра и проксимальный спленоренальный шунт. Эти виды шунтирования в настоящее время не применяются и представляют лишь исторический интерес. При неселективном частичном шунтировании градиент давления воротная вена/НПВ стремится к своему нормальному значению. Примерами частичного шунтирования являются: Н-образный портокавальный шунт малого диаметра (8 мм и 10 мм), узкий портокавальный шунт «бок в бок» (10 мм) и мезокавальный шунт малого диаметра.
Селективное шунтирование напрямую не снижает градиент давления между воротной веной и НПВ. Оно селективно разгружает пищеводно-желудочный комплекс варикозно расширенных вен. Наиболее распространенный селективный шунт - спленоренальный шунт, часто упоминаемый как шунт Уоррена.
Совсем недавно широкое распространение получило ТВПШ. Ниже этот способ шунтирования рассмотрен более детально. Он позволяет проводить портальную декомпрессию без абдоминальной операции. Шунт представляет собой стент, вводимый через трансюгулярный доступ, который, проходя через паренхиму печени, соединяет воротную вену с печеночной веной. Степень портальной декомпрессии определяется диаметром используемого стента.
Ключевые моменты
Измененное психическое состояние пациента с циррозом печени и портальной гипертензией (энцефалопатия) - предостерегающий признак плохого печеночного резерва и, до его купирования, служит противопоказанием к шунтированию
Допплеровское исследование воротной вены полезно для определения ее проходимости Помимо этого используются КТ, ангиография. Шунтирование проводится на воротной вене достаточного калибра с хорошей проходимостью.
Пациенты с портальной гипертензией и острым кровотечением из верхних отделов ЖКТ должны проходить лечение в отделении интенсивной терапии. Необходимо обеспечить защиту дыхательных путей пациента, произвести переливание соответствующих объемов кристаллоидов, эритроцитарной массы и свежезамороженной плазмы. При интенсивной терапии может оказаться полезным инвазивный мониторинг (например, при помощи катетера Сван-Ганца). Необходимо раннее начало инфузии октреотида. В отделении обязательно должно находиться эндоскопическое оборудование и зонд Сенгстакена-Блэйкмора. Исследование зонда S-B показало его адекватность, безопасность и эффективность
Для пациентов с портальной гипертензией характерна тромбоцитопения. Однако от переливания тромбоцитарной массы следует воздержаться ввиду ее малой эффективности из-за быстрой секвестрации тромбоцитов в селезенке
ТВПШ быстро получило широкое распространение при лечении пациентов с острым кровотечением из варикозно расширенных вен, хотя наиболее оптимально использовать операцию в виде промежуточного этапа перед проведением трансплантации печени.
Неселективное шунтирование
Полное портокавальное шунтирование
Методы полной портальной декомпрессии на протяжении последних 50 лет практически не претерпели изменений. Ее можно достигнуть? формированием портокавального шунта «конец-в-бок», портокавального шунта большого диаметра «бок-в-бок», портокавального (и мезокавального) H-образного протезного шунта большого диаметра, а также проксимального спленоренального шунта (рис. 19.5). Несмотря на анатомические различия указанных видов шунтирования, все они обладают общей особенностью: обеспечивают уравнивание давлениЯ между воротной и нижней полой венами посредством полного переключения портального кровотока в НПВ.

Рис. 19.5. Неселективные полные портосистемные шунты. A - портокавальный шунт «конец-в-бок». B - портокавальный шунт «конец-в-конец». C - Н-образный мезокавальный шунт из синтетического протеза большого диаметра. D - проксимальный спленоренальный шунт.
1 - цирротически измененая печень
2- двенадцатиперстная кишка
3 - общий желчный проток
4 - воротная вена
5 - нижняя полая вена
6 - селезенка
7 - селезеночная вена
8 - 14 мм трансплантат Gore-Tex
9 - верхняя брыжеечная вена
10 - почка
Прототип полного неселективного шунта - портокавальный шунт «конец-в-бок». Его строение требует рассечения воротной вены возле ее бифуркации и формирования анастомоза «конец-в-бок» между ней и НПВ. При этом в печени прекращается портальный кровоток. Портокавальный шунт «бок-в-бок» большого диаметра предусматривает формирование анастомоза между боковой стенкой воротной вены и боковой стенкой НПВ. Шунт направляет почти весь антеградный портальный кровоток в систему нижней полой вены и, более того, может направлять кровь из печени при ретроградном (гепатофугальном) кровотоке через воротную вену в НПВ. Таким образом, портокавальный шунт «бок-в-бок» большого диаметра обеспечивает лучшую декомпрессию печени, чем при шунтировании одного лишь портального кровотока.
Проксимальный спленоренальный шунт относится к группе неселективных шунтов, обеспечивающих полную портальную декомпрессию. Один из этапов операции - проведение спленэктомии. Селезеночную вену отсекают у ворот селезенки, отделяют от поджелудочной железы и накладывают анастомоз с почечной веной «конец-в-бок». Функционально шунт представляет собой портокавальный анастомоз «бок-в-бок» большого диаметра. Несмотря на ранее существовавший в отношении операции энтузиазм, длительное наблюдение выявило отсутствие реальных преимуществ спленоренального шунтирования по сравнению с портокавальными шунтами «конец-в-бок» или «бок-в-бок». При этом виде шунтирования может наблюдаться тромбоз селезеночной вены и окклюзия шунта.
Другим способом достижения полной портальной декомпрессии служит формирование Н-образного портокавального шунта большого диаметра. Такие шунты представляют собой политетрафторэтиленовый или полиэфирный сосудистый протез от 16 до 20 мм в диаметре с помощью которого накладывают анастомоз между воротной веной и нижней полой веной по типу? «конец-в-бок». Гемодинамика и результаты при этом виде шунтирования сходны с прямым портокавальным анастомозом «бок-в-бок» большого диаметра. Формирование таких шунтов проще, чем портокавального шунта «бок-в-бок», однако, по сравнению с прямым анастомозом, они имеют большую склонность к тромбированию.
Полные неселективные шунты позволяют хорошо контролировать кровотечения из варикозно расширенных вен, поскольку они полностью разгружают портальную венозную систему. Однако в настоящее время полное шунтирование применяется редко, поскольку при такой декомпрессии портальной системы существует значительный риск развития энцефалопатии и прогрессирующего ухудшения функции печени, частота которых может достигать 50%.
Частичная портальная декомпрессия
Изучение неблагоприятного влияния полного портокавального шунтирования, включая высокую частоту развития послеоперационной энцефалопатии, заставило хирургов искать альтернативные способы декомпрессии портальной системы. На основании наблюдений о редком возникновении кровотечений из варикозно расширенных вен при градиенте давления воротная вена/НПВ меньше 12 мм рт.ст. было разработана концепция частичной портальной декомпрессии. Частичное шунтирование направлено на создание физиологической замены множества портосистемных коллатералей посредством одного шунта с низким сопротивлением. Уменьшение портосистемного градиента ниже критического уровня без прекращения портального кровотока (гепатопетальный кровоток) предотвращает кровотечение из варикозно расширенных вен и снижает частоту развития послеоперационной дисфункции печени и энцефалопатии.
Первые частичные шунты представляли собой непосредственные портокавальные анастомозы «бок-в-бок». К сожалению, результаты таких операций не сильно отличались от полного шунтирования, поскольку быстро происходило расширение шунта с потерей эффекта частичной декомпрессии. Истинная частичная портальная декомпрессия была разработана лишь с началом применения Н-образных портокавальных шунтов малого диаметра. Эти шунты представляют собой 8-мм политетрафторэтиленовые сосудистые протезы, подшиваемые по принципу «конец-в-конец» к нижней полой, а затем к воротной вене при помощи нерассасывающихся мононитей (рис. 19.6). После шунтирования должно произойти снижение портального давления более чем на 10 мм рт.ст., а градиент воротная вена/НПВ должен составлять менее 10 мм рт.ст., но не приближаться к нулю. Послеоперационная трансфеморальная катетеризация шунта и портальной вены показана на рис. 19.7. Достигаемая посредством этого метода портальная декомпрессия поддерживает градиент давления воротная вена/НПВ (табл. 19.6) и предотвращает гепатопортальный кровоток у 90% оперированных пациентов. Не удивительно, что при использовании частичных шунтов значительно реже, по сравнению с полными шунтами, наблюдается послеоперационная энцефалопатия.
Наблюдение за последствиями формирования Н-образного портокавального шунта малого диаметра доказало его благоприятное влияние. Показаниями к шунтированию у большинства пациентов являются кровотечения из варикозно расширенных вен пищевода после применения склеротерапии и перевязки, а также кровотечения из варикозно расширенных вен желудка. Одновременное существование варикозно измененных вен пищевода и желудка отмечается приблизительно у половины пациентов. Послеоперационная летальность не достигает 10%. При этом основной причиной летальности остается печеночная недостаточность у пациентов класса C по Чайлду. Окклюзия шунта, как ранняя, так и поздняя, наблюдается редко. Раннее тромбирование шунта можно устранить при помощи эндоваскулярного тромболизиса. Эффективность вмешательства приближается к 100%. Долгосрочная проходимость шунта без появления повторных кровотечений составляет 90% в течение 7 лет. Приблизительно у двух третей пациентов отмечают исчезновение асцита и значительное улучшение самочувствия. Долгосрочная выживаемость пациентов напрямую зависит от класса по Чайлду в предоперационном периоде (табл. 19.7). Лучшая долгосрочная выживаемость отмечается у пациентов A или B класса по Чайлду, что в очередной раз доказывает лучшую переносимость портокавального шунтирования пациентами с адекватным печеночным резервом.
Селективная декомпрессия варикозно расширенных вен
Подобно частичному шунтированию, селективная декомпрессия варикозно расширенных вен была разработана в качестве альтернативы полному портокавальному шунтированию. Цель операции состоит в остановке кровотечения из варикозно расширенных вен посредством формирования дополнительного пути оттока крови с низким давлением из пищеводно-желудочного комплекса варикозно расширенных вен. При этом не происходит непосредственного вмешательства в портальный кровоток, что предотвращает риск послеоперационногое нарушения функции печени. Первым селективным шунтом был дистальный спленоренальный шунт (Уоррена). При его формировании производят отсечение селезеночной вены в области ее впадения в воротную вену с последующим анастомозированием ее конца с левой почечной веной. Этот вид шунтирования обеспечивает отток крови под малым давлением через почечную вену из пищеводно-желудочного комплекса варикозно расширенных вен (рис. 19.8). Во избежание повторного формирования коллатералей из вен поджелудочной железы, следует производить перевязку множества венозных ветвей между селезеночной веной и поджелудочной железой. При дальнейшем ходе этой операции проводят деваскуляризацию ― разобщение пищеводно-желудочного комплекса варикозно расширенных вен от портального кровотока и перевязку многочисленных вен, наиболее важными из которых являются левая желудочная (венечная) вена и желудочно-сальниковая вена.
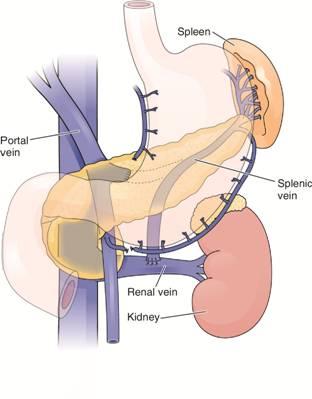
Рис. 19.8. Дистальный спленоренальный шунт.
1 - селезенка
2 - почка
3 - селезеночная вена
4 - воротная вена
5 - почечная вена
Дистальное спленоренальное шунтирование характеризуется хорошими результатами лечения. После его проведения достаточно редко развиваются повторные кровотечения из варикозно расширенных вен и печеночная энцефалопатия. В исследованиях, сравнивающих эндоскопическую склеротерапию с дистальным спленоренальным шунтированием, было установлено, что для последней операции характерна меньшая периоперационная летальность, меньшая частота повторных кровотечений из варикозно расширенных вен и сравнительно низкая частота развития послеоперационной энцефалопатии. Однако у этого вида шунтирования есть и существенные недостатки. Операция технически сложна, и данные о ее эффективности во многом зависят от литературного источника. Поскольку не происходит непосредственного воздействия на портальное давление, у многих пациентов, особенно с тяжелым циррозом, в послеоперационном периоде прогрессирует асцит. Пациентам с гепатофугальным (ретроградным) кровотоком и асцитом проведение этого типа шунтирования не показано. Более того, после указанной операции довольно часто возникает тромбоз воротной вены и селезеночной вены (шунта). Тем не менее дистальное спленоренальное шунтирование остается широко распространенным методом декомпрессии в связи с хорошими отдаленными результатами.
Трансюгулярное внутрипеченочное портосистемное шунтирование при портальной декомпрессии у пациентов с циррозом печени и кровотечением из варикозно расширенных вен
ТВПШ представляет собой портокавальный шунт, устанавливаемый под рентгенологическим контролем. При этом способе шунтирования, разработанном в 1960-е гг., доступ в верхнюю полую вену обеспечивается через внутреннюю яремную вену. Проводник катетера проводят через НПВ в правую печеночную вену, а затем через паренхиму печени в правую воротную вену. После этого производят расширение свища между воротной и печеночной венами, обеспечивающего взаимосвязь между портальным и системным венозным кровотоком. До дополнения этого типа шунтирования в начале 1990-х гг. эндоваскулярным стентированием длительная проходимость шунта была небольшой. Стент, проведенный через сформированный в паренхиме печени свищ, значительно улучшает его долгосрочную проходимость (рис. 19.9). Первоначальный кратковременный успех ТВПШ, относительная простота его выполнения, а также значительные преимущества по сравнению с абдоминальной операцией привели к быстрому распространению ТВПШ в качестве терапии первой линии при лечении осложненной портальной гипертензии.
Несмотря на то что ТВПШ позволяет проводить неоперативную портальную декомпрессию, с его проведением все еще связана достаточно высокая летальность и относительно небольшая долгосрочная проходимость шунта. Достаточно часто возникает стеноз и окклюзия шунта, требующие тщательного наблюдения за его состоянием и проведения повторных вмешательств, направленных на поддержание его проходимости (рис. 19.10). Особенно значимые проблемы связаны с окклюзией шунта, часто сопровождаемой повторными кровотечениями.
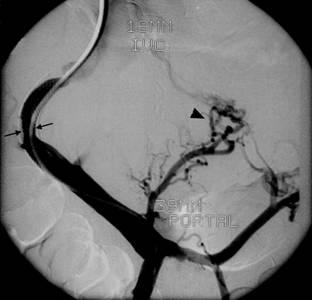
Рис. 19.10. Кавапортограмма. Трансюгулярная катетеризация внутрипеченочного портосистемного шунта. Стеноз (стрелки), укорочение стента и рецидив варикозного расширения вен (крупная стрелка). Ревизия шунта требует установки дополнительного стента.
1 - нижняя полая вена
2 - воротная вена
В проспективном рандомизированном исследовании сравним результаты ТВПШ с результатом Н-образного портокавального шунтирования протезом малого диаметра. В нем участвовали 132 пациента со сходным возрастом и полом, причинами цирроза и оценкой по Чайлду-Пью. Существенной проблемой ТВПШ оказалась ранняя и поздняя окклюзия шунта. При обоих видах шунтирования наблюдали одинаковую 30-дневная летальность (12%). Однако через 1 год летальность после ТВПШ составила 25%, а после хирургического шунтирования лишь 15% (P=0,07). Для Н-образного портокавального шунта малого диаметра, по сравнению с ТВПШ, была характерна значительно более высокая трехлетняя выживаемость. Из-за частой необходимости в повторных вмешательствах после ТВПШ, общая стоимость лечения пациентов была значительно выше, чем после оперативной портальной декомпрессии.
Как формирование Н-образного портокавального шунта синтетическим протезом малого диаметра, так и ТВПШ позволяет достигнуть портальной декомпрессии. Однако при ТВПШ наблюдаются большая летальность, частота повторных кровотечений, окклюзии шунта и контроля его проходимости. Проведение ТВПШ наиболее оптимально у пациентов с кровотечением из варикозно расширенных вен и плохим печеночным резервом (оценка по МТСЗП ³ 18), нуждающихся в подготовке к трансплантации печени, а также при противопоказаниях к абдоминальной операции из-за выраженной сопутствующей патологии. При лечении кровотечений из варикозно расширенных вен у пациентов с портальной гипертензией операцией выбора следует считать формирование Н-образного портокавального шунта протеза малого диаметра.
Деваскуляризирующие методы при лечении кровотечений из варикозно расширенных вен, обусловленных циррозом и портальной гипертензией
Деваскуляризация состоит в ликвидации венозных коллатералей между воротной веной и кровоточащим комплексом варикозно расширенных вен. Во время таких процедур обычно перевязывают коллатерали между воротной веной и пищеводно-желудочными варикозно расширенными венами. Перевязывают венечную, пилорическую, желудочно-сальниковую, короткие желудочные вены, а также многочисленные безымянных венозные коллатерали по задней стенке желудка. Операция обычно включает спленэктомию и, редко, циркулярную резекцию пищевода степлером.
Недостаточно широкое распространение деваскуляризации - следствие неблагоприятных долгосрочных исходов и достаточно большого числа послеоперационных осложнений. Такие операции обычно приводят к повышению портального давления. При этом в послеоперационном периоде наблюдается прогрессирование асцита, снижение функциональной способности печени, замедление выздоровления и развитие поздних кровотечений. В западных странах деваскуляризацию используют в основном для экстренного купирования кровотечений из варикозно расширенных вен при наличии противопоказаний к шунтированию вследствие тромбоза воротной или селезеночной вены.
Долгосрочное лечение, направленное на профилактику повторных кровотечений
При кровотечениях из варикозно расширенных вен у пациентов, не подлежащих радикальному лечению, используют пропранолол, позволяющий уменьшить давление в системе воротной вены. Эндоскопический контроль с регулярным склерозированием или перевязкой варикозно расширенных вен снижает, по сравнению с одной медикаментозной терапией, частоту эпизодов повторных кровотечений и улучшает выживаемость пациентов. Поэтому важно проведение регулярных эндоскопических исследований с повторной склеротерапией или перевязкой. Вне зависимости от вида проводимой консервативной терапии, у пациента перенесшего кровотечение из варикозно расширенных вен пищевода риск повторного кровотечения составляет около 70%.
Перитонит (peritonitis) - общепринятое определение, под которым понимают особую форму ответа организма на контакт патогенного агента (чаще микробного) с серозной оболочкой, покрывающей внутренние органы живота и его стенки. Острый перитонит(peritonitis acuta) - это фазно протекающее воспалительное поражение (чаще гнойно-воспалительное) брюшинного покрова, захватывающее отдельные области или всю брюшную полость.
Брюшина (peritoneum) - покровное образование мезенхимального происхождения, выстилающее внутреннюю поверхность брюшной стенки (париетальная) и в той или иной степени внутренние органы (висцеральная). Общая площадь брюшины у взрослых - 1,72-2,04 м, что примерно соответствует площади кожного покрова. Париетальный и висцеральный листки брюшины образуют щель постоянно изменяющейся конфигурации, покрыты, как смазкой, прозрачной серозной жидкостью, общий объем которой составляет 20,0-50,0 мл. Брюшина делится на серозную оболочку и подсерозную основу, состоящую из четырех соединительнотканных слоев. Кровеносные и лимфатические сосуды залегают в пределах самого глубокого коллагеноэластического слоя (на 1 мм2до 75 тыс. капилляров). Развитая сеть лимфатических сосудов, наличие так называемых насасывающих люков (на диафрагме, слепой кишке, в малом тазу) обеспечивают движение тканевой жидкости из крови в брюшную полость и обратно в кровь. Брюшина в сутки может всосать до 70 л. Перитонеальная жидкость непрерывно обновляется благодаря процессам транссудации и всасывания брюшиной. Выделяют транссудирующие участки брюшины (брюшина кишок, маточных связок), всасывающие (брюшина диафрагмы, слепой кишки) и индифферентные (брюшина желудка и передней брюшной стенки). В норме процессы пропотевания жидкости в брюшную щель и всасывания из нее обычно уравновешены. В случаях когда транссудация преобладает, в брюшной полости скапливается значительное количество жидкости, всасывание которой идет не только по лимфатическим сосудам, но и через систему воротной вены (через печень).
Брюшина обладает выраженной барьерной функцией и большой пластической способностью. Через 1,5-2 ч после нанесения даже поверхностного повреждения происходит слипание листков брюшины, отграничивающих очаг повреждения. Высока ее бактерицидная активность благодаря антителам и макрофагам. При нарушении герметичности брюшины, высушивании, механическом повреждении она ослабевает.
Особое анатомическое образование брюшной полости - большой сальник состоит из четырех листков брюшины, между ними располагаются большое количество кровеносных и лимфатических сосудов, рыхлая соединительная ткань, обильное скопление клеток, способных к фагоцитозу. Сальник
обладает большой пластической активностью, может перемещаться, поэтому его всегда находят в очагах воспаления. При помощи вязкой жидкости он обволакивает инородные тела, посторонние вещества. Сальник обладает бактерицидными, иммунными свойствами, участвует в регуляции висцерального кровообращения.
Историческая справка и статистика. Перитонит был известен древнегреческим врачам еще за 3 тыс. лет до н.э. Тогда же были сделаны попытки лечить его хирургическим путем: Эрзострат для удаления гноя из брюшной полости делал разрез в паховой области. В России со знахарских времен все воспалительные заболевания живота называли «антонов огонь» и считали неизлечимыми. Первое подробное описание перитонита принадлежит военному врачу Василию Шабанову (1816). До конца 70-х гг. XIX в. во всех странах мира был принят консервативный метод лечения этого заболевания, направленный на облегчение состояния больного (пример тому - лечение А.С. Пушкина).
Разработка методов обезболивания, асептики и антисептики открывает второй этап в лечении перитонита - хирургический. Первая успешная операция по поводу гнойного перитонита в России была сделана в 1879 г. Антоном Шмидтом (первая в мире - в 1879 г. Л. Тейтцем). Летальность при перитоните снизилась со 100 до 60-70%.
На третьем этапе (начало 20-х - середина 40-х гг. XX в.) хирургический метод стал единственным методом лечения перитонита; в это время разрабатывались вопросы патогенеза, совершенствовались оперативные приемы, инфузионная терапия. Летальность снизилась до 30-50%.
Новая эра в лечении перитонита началась с открытия антибиотиков, для нее характерен многоплановый подход к лечению. Проблема неоднократно обсуждалась на международных, республиканских, местных форумах хирургов, однако и по настоящее время далека от разрешения. Слова Вегнера, сказанные им в 1876 г., актуальны и сегодня: «Я и мое поколение воспитаны в страхе перед богом и перитонитом». Летальность при тяжелых формах перитонита колеблется от 20 до 50% (Савчук, 1989; Попов, 1985), а при послеоперационном перитоните достигает 45-92%. Не потеряли своего значения слова В.Н. Шамова, произнесенные полвека назад: «Проблема перитонита, как древний сфинкс, стоит перед современным хирургом и продолжает вырывать из хирургических учреждений одну жертву за другой». По мнению А.Н. Бакулева, перитонит является одной из нестареющих проблем хирургии.
Доля перитонита от острых хирургических заболеваний органов брюшной полости, по данным В.С. Савельева (1970), В.Д. Федорова (1979), Б.И. Альперовича (2002), составляет 15-24%. Перитонит является причиной 2/3 смертей при хирургических заболеваниях органов живота и основной причиной смерти при острых хирургических заболеваниях брюшной полости
(от 60 до 90%).
Среди острых заболеваний органов брюшной полости, которые приводят к перитониту, на первом месте стоит острый аппендицит (50-60%), на втором (9-12%) - острый холецистит и злокачественные новообразования желудочно-кишечного тракта, затем идут прободная язва желудка
и ДПК (6-8%), острая кишечная непроходимость (5-7%), ущемленная грыжа (3-5%), острый панкреатит (2-4%), травма живота (4-6%).
Этиология. Основной причиной перитонита является проникновение в брюшную полость инфекции - гноеродных микробов, чаще всего из полых органов в результате механических повреждений их стенок, гнойно-деструктивного воспаления различных органов, некроза их вследствие тромбозов, ущемления, заворотов. Реже к развитию перитонита приводят паранефрит, флегмона брюшной стенки. Еще реже инфекция попадает на брюшину гематогенным и лимфогенным путем из отдаленных гнойных очагов. Брюшина может инфицироваться и при проникающих ранениях брюшной полости, оперативных вмешательствах на органах брюшной полости при нарушении асептики. Преобладает кишечная флора: грамотрицательные аэробы (кишечная палочка, клебсиеллы, синегнойная палочка, протей, энтеробактер и др.), реже стафилококк, стрептококк. Аэробная флора может сочетаться с анаэробной, которая находится в дистальных отделах тонкой кишки и в толстой кишке, - бактероидами, клостридиями и т.д.
Перитонит может быть вызван микрофлорой, не имеющей отношения к желудочно-кишечному тракту, - гонококками, пневмококками, гемолитическими стрептококками, микобактериями туберкулеза. К перитониту может привести воздействие на брюшину агрессивных факторов неинфекционного характера: кровь, желчь, желудочный сок, хилезная жидкость, панкреатический сок, моча. Однако очень быстро микробы из кишечника в результате повышенной проницаемости стенки проникают в брюшную полость, поэтому все асептические перитониты рано или поздно начинают развиваться с участием микробной флоры.
Предрасполагающими моментами являются повреждения серозного покрова различными факторами (высыхание брюшины, инородные тела, термические воздействия, облучение ультрафиолетом, химические вещества). Играет роль и снижение защитных сил организма, в том числе брюшины, при аллергиях, авитаминозах, лучевой болезни.
Патогенез перитонита. Основными факторами патогенеза перитонита являются:
1) микробный;
2) развитие функциональной паралитической непроходимости кишечника;
3) расстройства обмена веществ, в первую очередь белкового и водно-электролитного;
4) нарушения микроциркуляции и кровообращения;
5) нарушения со стороны центральной и периферической нервной системы;
6) изменения реактивности организма.
Все эти факторы развиваются и действуют в тесной взаимосвязи, каждый из них в какой-то момент развития патологического процесса может стать ведущим.
Патогенез определяется начальным повреждением брюшины и темпом поступления инфекта в брюшную полость. При перфорации полых органов начальный этап перитонита характеризуется выраженным раздражением рецепторного аппарата брюшины. Интенсивность болевой импульсации ино-
гда достигает шокогенного уровня, развивается так называемый перитонеаль-ный шок.
С момента попадания инфекционного агента или раздражающей жидкости в брюшную полость развиваются набухание и слущивание мезотелия брюшины, нарушаются процессы продукции жидкости в брюшную полость и всасывание ее оттуда. Сначала наступает спазм мелких сосудов, который сменяется их парезом и параличом. Начинается обильная экссудация в брюшную полость в результате проницаемости сосудистой стенки и воспаления, а всасывание ее через насасывающие люки нарушается. В брюшной полости скапливается большое количество жидкости, она имеет сначала серозный характер. Уменьшается объем циркулирующей крови. Серозный экссудат в результате размножения флоры, выпадения фибрина мутнеет. В нем содержится большое количество микробов, их токсинов, продуктов аутолиза. Вследствие обволакивания фибрином микроорганизмы становятся недоступными для фагоцитов, антибактериальных препаратов. Всасываясь париетальной брюшиной, токсины, продукты аутолиза вызывают эндогенную интоксикацию организма. Процесс переходит из реактивной фазы в токсическую.
Одновременно нарушается равновесие холинергических и адренергиче-ских нервных процессов, повышается активность симпатоадреналовых реакций. В результате этого замедляется кишечная перистальтика, извращается кишечная секреция, развивается кишечный стаз. Парез кишечника сменяется его параличом. Возникает рвота, ведущая к потере жидкости, соков, солей.
В кишечник пропотевает жидкая часть крови. В нем идут процессы гниения, которые усугубляют интоксикацию. Стенки кишки перерастягиваются, становятся проницаемыми для микробов, токсинов, которые проникают в брюшную полость. Экссудат становится гнойным. Скопление жидкости в кишечнике, депонирование крови в паралитически расширенных сосудах органов брюшной полости еще более уменьшают объем циркулирующей крови. Всасывание токсичных веществ из кишечника вследствие угнетения барьерной функции энтероцитов по лимфатическим путям приводит к повреждению паренхимы легких, через притоки воротной вены - к повреждению гепатоцитов.
Сгущение крови становится причиной нарушения реологиии крови и микроциркуляции в сосудах чревной зоны, развивается микротромбоз. Прогрессирование эндогенной интоксикации приводит к нарушению органного кровотока, развиваются нефропатии, вплоть до развития острой почечной недостаточности (ОПН). Из-за восходящей из дистальных отделов кишечника анаэробной флоры, ее избыточного развития основной причиной интоксикации становится уже не воспаленная брюшина, а паралитическая непроходимость кишечника. Портальная эндотоксемия и бактериемия приводят к нарушению функций печени. На фоне прогрессирующей гиповолемии снижается функциональная способность сердца, уменьшается сердечный выброс, что ведет к тахикардии. Последняя усугубляется интоксикацией. За счет повышения процессов катаболизма снижается уровень белка плазмы. Клетки теряют калий. Развиваются дефицит натрия и хлора из-за рвоты, метаболический ацидоз. Повышается уровень мочевины. Интоксикация ведет к нарушению нервной системы, метаболической энцефалопатии.
На конечном этапе развития перитонита решающее значение имеет уже не микробный фактор, который сыграл роль пускового, а вся совокупность нарушений жизненно важных функций и органов жизнеобеспечения (печень, почки, кишечник, сердечная и легочная системы), так называемая полиорганная недостаточность.
В процессе развития перитонита меняется реактивность организма, от исходного состояния которой зависит финал конфликта микробного агента с брюшиной. Местная защита обеспечивается активным фагоцитированием лейкоцитов и макрофагов, которые захватывают и переваривают не только бактерии, но и белки, обеспечивают очищение брюшной полости от слизи, муцина. Бактерии вне зоны воспаления задерживаются и обезвреживаются в печени, селезенке клетками ретикулоэндотелиальной системы. Важная защитная роль принадлежит лимфоцитам кишечника, пейеровых бляшек, лимфоузлов брыжейки, клеткам мезотелия сальника и брюшины, а также иммуноглобулинам. Местной защите способствуют отек, инфильтрация органов, прилежащих к очагу воспаления (сальник, брыжейка, кишечник), слипание их друг с другом и с поврежденным органом благодаря выделению фибрина и густого клейкого экссудата. В результате воспалительный очаг может быть полностью локализован. Особенно важна роль сальника - сторожа брюшной полости, способного окутывать воспаленный орган. Но исходом местного очага воспаления может быть и формирование гнойника. При слабости защитных сил организма воспаление прогрессирует, распространяется по брюшине, развивается диффузный перитонит, чему способствуют высокая вирулентность микробов, интенсивность и длительность загрязнения брюшины, неадекватность лечения; имеют значение и дыхательные экскурсии брюшной стенки, диафрагмы, перистальтика кишечника.
Таким образом, все факторы патогенеза взаимосвязаны, но в зависимости от стадии процесса преобладает один или несколько из них.
На реактивной стадии перитонита развивается серозно-фибринозное воспаление брюшины с характерными резкими нарушениями микроциркуляции в виде стаза, эритроцитарных агрегатов и тромбов в сосудах микроциркуля-торного русла. Наблюдаются отек брюшины, образование на ней фибринозных пленок, умеренная лейкоцитарная инфильтрация с небольшим числом макрофагов и лейкоцитов. Фагоцитоз бактерий выражен незначительно.
В период токсической фазы нарастает интоксикация, в брюшной полости скапливается гнойно-фибринозный экссудат, нарушение микроциркуляции прогрессирует не только в брюшине, но и во внутренних органах. Включаются иммунные реакции: выражена лейкоцитарно-макрофагальная инфильтрация брюшины, в крови и в брюшинных инфильтратах появляются дистрофически измененные нейтрофильные лейкоциты с ослабленными защитными свойствами. Нарастает количество микробов в экссудате, снижается фагоцитарная функция нейтрофилов и макрофагов.
Терминальная фаза перитонита характеризуется гнойно-фибринозным воспалением брюшины с выраженным некротическим компонентом, гнойным тромбофлебитом и тромбоартериитом микрососудов брюшины, тяжелым нарушением микроциркуляции внутренних органов, вплоть до развития
синдрома диссеминированного внутрисосудистого свертывания, отмечаются дистрофические нарушения внутренних органов, особенно сердца, легких, печени и почек, некробиоз нейтрофилов и макрофагов.
Классификация перитонитов. По происхождению перитониты делят на первичные, идиопатические (1%) и вторичные (99%). При первичном перитоните имеют место лимфогенный и гематогенный пути инфицирования брюшины, он может наблюдаться у детей при ангине, пневмонии, ОРВИ. Возбудителем в 2/3 случаев является гемолитический стрептококк, в 1/3 - пневмококк. В 99% наблюдений перитонит - это осложнение острых воспалительных процессов брюшной полости и травм ее органов, когда инфекция распространяется контактным путем.
Различают абактериальные (асептические) и септические перитониты. Асептические вызываются кровью, хилезной жидкостью, желчью, панкреатическими ферментами, мочой, меконием у новорожденных. Но через какое-то время они также становятся инфицированными вследствие проникновения микробов из кишечника. Выделяют также специфические перитониты - туберкулезный, гонококковый, пневмококковый. К особым формам перитонитов относятся канцероматозный, паразитарный, ревматоидный, гранулематозный (при высыхании брюшины во время операции, попадании талька).
По клиническому течению перитонит может быть острым и хроническим. Последний в подавляющем большинстве случаев имеет специфическое происхождение (туберкулезный, паразитарный и т.д.).
По характеру выпота различают серозный, фибринозный, серозно-фибринозный, гнойный, фибринозно-гнойный, гнилостный, геморрагический, желчный, сухой перитониты; по причинам возникновения - перфора-тивный, травматический, послеоперационный и т.д.
Общепринятым является деление перитонита по распространенности процесса [классификация В.Д. Федорова (1974)], поскольку от этого зависит тяжесть течения; различают местный (отграниченный и неотграниченный) и распространенный. Местным неотграниченным перитонит называют, когда воспалительные изменения вышли за пределы очага деструкции или повреждения, но захватывают не более одной анатомической области брюшной полости с возможностью затекания экссудата в смежные области брюшины по пути естественного распространения, например из подвздошной ямки в малый таз. Для местного отграниченного перитонита характерно наличие воспалительных изменений брюшины той же распространенности, но отделенных, отграниченных от свободной брюшной полости слипчивым процессом по периферии воспаления (речь идет об абсцессах, инфильтратах брюшной полости).
Под распространенным перитонитом понимают выход воспалительных изменений и распространение экссудата за пределы расположения первичного очага, но не по пути естественного затекания экссудата. В зависимости от распространенности различают диффузный перитонит (воспалительный процесс занимает менее двух этажей брюшной полости), разлитой (поражена практически вся брюшина), общий (тотальное воспаление всего брюшинного
покрова органов и стенок брюшной полости). Однако в практической деятельности различия между диффузным, разлитым, общим перитонитами бывает сложно установить, поэтому в литературе для обозначения распространенного перитонита термины «диффузный», «разлитой», «общий» часто употребляются как синонимы.
В течении острого перитонита выделяют несколько стадий (фаз). В своих классификациях И.И. Греков, В.И. Казанский, Б.А. Петров и А.А. Беляев различают три стадии. В основу их были положены фактор времени (И.И. Греков), тяжесть состояния больных (В.И. Казанский) либо состояние защитных сил организма (Б.А. Петров, А.А. Беляев). В общих чертах эти классификации совпадают.
Наиболее целесообразной в течение длительного времени считалась классификация перитонитов, предложенная в 1971 г. К.С. Симоняном; преимущество ее состоит в стремлении увязать тяжесть клинических проявлений с патогенетическими механизмами болезни:
1) реактивная стадия (первые 24 ч) - стадия максимальных местных проявлений и менее выраженных общих проявлений;
2) токсическая (24-72 ч) - стадия стихания местных проявлений и превалирования общих реакций, типичных для интоксикации;
3) терминальная (свыше 72 ч) - стадия глубокой интоксикации на грани обратимости; возможности регрессии процесса незначительны.
В.К. Гостищев и соавт. (1992) выделяют IV стадию перитонита (48-96 ч) - стадию прогрессирующей полиорганной недостаточности, подразделяя ее на стадию (до 72 ч) - стадию компенсации, для которой характерны икте-ричность склер, психоз, низкие показатели гемодинамики, одышка, понос, олигурия, и IV6 - стадию декомпенсации.
В 2005 г. на Всероссийской научно-практической конференции РАСХИ была принята современная классификационно-диагностическая схема перитонита, авторами которой являются В.С. Савельев, М.И. Филимонов, Б. Р. Гельфанд.
Основное заболевание (нозологическая причина перитонита)
Этиологическая характеристика:
- первичный;
- вторичный;
- третичный. Распространенность:
- местный (отграниченный, неотграниченный);
- распространенный (разлитой). Характер экссудата:
- серозно-фибринозный;
- фибринозно-гнойный;
- гнойный;
- каловый;
- желчный;
- геморрагический;
- химический.
Фаза течения процесса:
- отсутствие сепсиса;
- сепсис;
- тяжелый сепсис;
- септический (инфекционно-токсический шок). Осложнения:
- внутрибрюшные;
- раневая инфекция;
- инфекция верхних и нижних дыхательных путей (трахеобронхит, нозокомиальная пневмония);
- ангиогенная инфекция;
- уроинфекция.
Принципиально новым в этой классификации является выделение третичного перитонита. Под этим термином понимают воспаление брюшины, носящее рецидивирующий характер (персистирующий или возвратный перитонит). О нем говорят в том случае, если после операции адекватного объема и обоснованной стартовой антибактериальной терапии через 48 ч не наблюдается положительной клинической динамики. Обычно третичный перитонит развивается в послеоперационном периоде у больных или раненых, переживших экстремальные ситуации и имеющих истощение механизмов противо-инфекционной защиты. Факторами риска развития третичного перитонита являются истощение, гипоальбуминемия, наличие возбудителей, резистентных к большинству используемых антибиотиков. При операции установить источник третичного перитонита удается не всегда. Частота третичных перитонитов составляет около 10%, летальность достигает 60-70%.
Новым является и выделение только двух основных категорий распространенности перитонита (местный и распространенный), поскольку это определяет задачи оперативного вмешательства - только удаление источника инфекции или обширная санация брюшной полости.
После введения в последние годы в отечественную литературу понятия «абдоминальный сепсис» как системной воспалительной реакции организма в ответ на инфекционный деструктивный процесс в брюшине и отдельных органах брюшной полости стало возможным достаточно четко выделять фазы развития патологического процесса при перитоните в зависимости от отсутствия или наличия сепсиса и его тяжести, что чрезвычайно важно в условиях внедрения принципов доказательной медицины. В классификации же стадий перитонита К.С. Симоняна признаки разграничения их недостаточно определены, особенно токической и терминальной.
Для оценки тяжести перитонита и прогноза его течения можно применять Мангеймский индекс перитонита (МИП) (табл. 7).
Клиническая картина перитонита многолика, зависит от причины заболевания, стадии процесса и его распространенности, поэтому целесообразно изложение ее в соответствии со стадией перитонита.
Первая стадия (реактивная): длительность ее составляет от нескольких часов до суток и более, в это время местный перитонит начинает переходить в разлитой. Выпот серозный или серозно-фибринозный. Клиническая
картина складывается из симптомов, свойственных основному заболеванию - прободной язве, острому холециститу, острому аппендициту. Общим симптомом является боль; интенсивность ее, динамика развития, локализация, иррадиация соответствуют тому заболеванию, которое стало источником перитонита. Болевой синдром резко выражен при перфорации органов, может привести даже к шоковому состоянию (например, при перфоративной язве). При воспалительных процессах (острый холецистит, аппендицит) отмечается более или менее быстрое прогрессирова-ние болевого синдрома. Боли усиливаются при перемене положения тела, кашле. Всегда отмечаются рефлекторная рвота, не приносящая облегчения, тошнота. Больной обычно лежит на спине с поджатыми к животу ногами, не может глубоко дышать.
Температура тела чаще повышена до субфебрильной, пульс учащен, не соответствует температуре. Артериальное давление в этот период нормальное или снижено, при перфоративной язве, завороте кишок может быть шок. Язык суховат, обложен, но слизистая щек еще влажная.
Таблица 7. Мангеймский индекс перитонита (МИП)
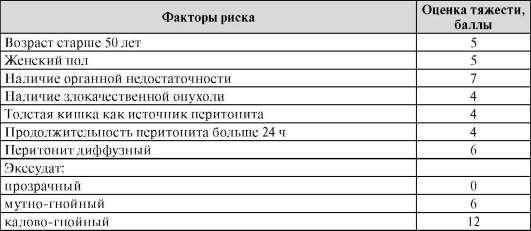
Примечание. Меньше 20 баллов - I степень (летальность - 0); 20-30 баллов - II степень (летальность - 29%); больше 30 баллов - III степень (летальность - 100%).
Брюшная стенка в дыхании не участвует, втягиваются только межреберные промежутки. Над источником перитонита определяется болезненность, усиливающаяся при глубокой пальпации. На этой стадии перитонита важным симптомом является защитное напряжение мышц, определяемое в месте болезненности брюшной стенки. Клиническое значение этого симптома неоценимо. Г. Мондор (1937) писал, что «во всей патологии трудно найти более точный, более полезный и более спасительный показатель». Это - «сверхпризнак всех абдоминальных катастроф». Четко определяется симптом Щеткина-Блюмберга. Положительны симптомы Куленкампфа - болезненность, нависание передней стенки прямой кишки при ректальном осмотре, симптом Менделя - болезненность при постукивании по брюшной стенке кончиками пальцев, симптом Розанова - больной не может активно втягивать и выпячивать брюшную стенку.
Вторая стадия (токсическая) наступает через 24 ч от начала заболевания, характеризуется яркой симптоматикой. Состояние больного прогрессивно ухудшается: жажда, слабость, икота, мучительная рвота, которая к концу принимает характер срыгивания. Рвотные массы темные, с неприятным запахом («каловая» рвота). Кожные покровы бледные, влажные. Черты лица заострены, глаза западают. Выраженный акроцианоз, конечности холодные. Дыхание учащенное, поверхностное. Температура тела 38-39°, гектическая. Артериальное давление падает, пульс учащен до 120-140 уд./мин, мягкий, слабого наполнения. Сердечные тоны глухие. Язык сухой, в темном налете и корках. Слизистая щек тоже сухая.
Живот вздут, умеренно напряжен и умеренно болезненный - результат перераздражения нервных рецепторов. Резко положительный симптом Щеткина-Блюмберга. При аускультации кишечные шумы практически не выслушиваются, положителен симптом падающей капли. Газы не отходят. В отлогих местах определяется свободная жидкость. Резко уменьшается диурез. Больные заторможенны, периодически могут возникать возбуждение,
бред.
Третья стадия (терминальная) наблюдается у нелеченых больных или в случае неэффективного лечения. Защитные силы истощаются, состояние крайне тяжелое, обусловленное глубочайшей интоксикацией, поражением центральной нервной системы, параличом кишечника. Сознание спутанное или отсутствует. Больной периодически мечется. Кожные покровы бледные, с желтушным оттенком, акроцианоз. Артериальное давление низкое, пульс частый, нитевидный. Дыхание поверхностное, иногда типа Чейна-Стокса. Срыгивание полным ртом вонючей грязно-зеленой жидкостью. Живот резко вздут, на пальпацию его больной уже практически не реагирует, при аускуль-тации - «гробовая тишина». Температура тела вследствие ареактивности может снизиться до субфебрильной.
В настоящее время классическая картина перитонита наблюдается не всегда. Консервативное лечение может привести к извращению тех или иных симптомов. На выраженности симптоматики сказывается изначальное состояние реактивности больного. Встречаются молниеносные септические формы перитонита, при которых выделение стадий невозможно. Существует и такой вариант течения, когда защитные силы организма достаточно сильны и происходит отграничение перитонита с образованием инфильтрата или абсцесса. Прорыв этого гнойника в брюшную полость при отсутствии своевременного хирургического вмешательства приводит к перитониту, который имеет еще более злокачественное течение, чем тот, на фоне которого возник абсцесс, поскольку защитные силы организма к этому времени уже истощаются за счет длительной гнойной интоксикации.
Следует остановиться на особенностях клинического течения перитонита у детей. Они обусловлены анатомо-физиологическими характеристиками брюшины, недоразвитием сальника, несостоятельностью иммунитета. Отсюда бурное развитие симптоматики, преобладание общих симптомов (высокая температура тела, токсикоз, рвота), вплоть до появления менингеальных признаков. Выражены процессы экссудации, вследствие недоразвития сальника
отсутствует способность к отграничению. Диагностика затруднена из-за беспокойного поведения детей, неумения локализовать боль, изложить анамнез. Иногда для осмотра приходится давать наркоз.
У детей довольно часто наблюдаются первичные перитониты (пневмококковый и стафилококковый), преимущественно в возрасте от 3 до 12 лет. При опросе выявляются предшествующие заболевания - пневмония, острая респираторная инфекция. Эти перитониты начинаются внезапно: сильная боль в животе, повышение температуры до 39-40°, рвота, иногда поносы, тяжелое общее состояние. При объективном осмотре определяются умеренное напряжение мышц брюшной стенки, тахикардия, иногда herpes labialis; значение лейкоцитов достигает 30-40 тыс. Различают локализованную, токсическую и септико-пиемическую формы. Во время операции в брюшной полости находят белесоватый, мутный, липкий экссудат без запаха. При бактериологическом исследовании чаще всего определяются диплококк, гемолитический стрептококк.
Из специфических чаще приходится сталкиваться с гонококковыми, туберкулезными перитонитами. При гонококковом перитоните инфекция в брюшную полость попадает непосредственно из фаллопиевых труб или лимфатическим путем из воспаленных яичников и матки, у мужчин - из придатков яичка или предстательной железы. Клиника характеризуется резкой колико-образной болью внизу живота, напряжением мышц передней брюшной стенки. Мондор указывает на резкий цианоз лица. Экссудат при гонококковом перитоните серозно-мутный, с большим количеством свободно плавающего фибрина и фибрина, покрывающего петли кишечника. Гонококковый перитонит имеет обычно благоприятное течение.
Туберкулезный перитонит, как правило, вторичного характера. Источник инфекции - легкие, кишечник, кости, суставы. Изолированное туберкулезное поражение брюшины является редким заболеванием, наблюдается чаще у детей и пациентов молодого возраста. Выделяют три основные формы туберкулезного перитонита: 1) экссудативную (асцитическую), 2) сухую (слипчи-вую), 3) казеозно-гнойную. Чаще встречается первая форма: наличие мелких просовидных высыпаний по брюшине и образование серозного или серозно-фибринозного экссудата. Содержание белка в нем выше 3%, значения лимфоцитов высокие. Слипчивая форма характеризуется мощными плотными сращениями между кишечником, сальником, брюшиной. При казеозно-гнойной форме в брюшной полости образуются инфильтраты, содержащие полости с гноем и казеозными массами. Заболевание начинается неопределенными жалобами, упадком сил, диспептическими явлениями, субфебрильной температурой. Туберкулезный перитонит является хроническим заболеванием с периодами обострений и улучшений. Экссудативная форма имеет наиболее благоприятное течение; казеозно-гнойная форма в ряде случаев является причиной диссеминации туберкулезного процесса, приводит к сужению кишечника, внутренним и наружным свищам.
При массивном применении антибиотиков широкого спектра действия может возникнуть грибковый (кандидамикозный) перитонит. Кандиды проникают в брюшную полость извне по дренажам, из гениталий. Постановка диагноза
этого перитонита затруднена, поскольку он не имеет патогномоничных признаков. О возможности его следует думать, когда в процессе длительной антибио-тикотерапии появляются боли в животе, метеоризм, диарея, явления частичной кишечной непроходимости. Экссудат обычно ярко-желтый или геморрагический, брюшина покрыта белесоватыми налетами. Обязательно следует исследовать выпот на грибки, провести биопсию брюшины. Микроскопически определяется диффузная инфильтрация лимфоцитами, плазматическими клетками, эозинофилами, характерна также гранулематозная реакция с наличием гигантских клеток Лангганса и образованием полостей возле них.
Перитонит в своем течении может осложниться острой сердечной недостаточностью, тромбозом в системе мозговых и мезентериальных сосудов, тазовым тромбофлебитом, ТЭЛА, пневмонией, реактивным плевритом, печеночной и печеночно-почечной недостаточностью, эрозивным гастритом и острыми язвами желудочно-кишечного тракта, гнойниками брюшной полости, кишечными свищами, эвентрацией. Каждое из этих осложнений или совокупность их может привести к смерти больного.
Диагностика перитонита основывается прежде всего наклинических признаках, значимость которых неодинакова.
В клинической картине перитонита можно выделить, по В.Я. Шлапо-берскому, постоянные и непостоянные симптомы. Постоянные симптомы:
1) боли в животе;
2) болезненность при пальпации живота;
3) положительный симптом Щеткина-Блюмберга;
4) мышечное напряжение передней брюшной стенки;
5) тахикардия;
6) падение артериального давления;
7) изменение характера дыхания (учащение, реберный тип, отсутствие дыхательных движений живота);
8) повышение температуры тела, отставание ее от пульса;
9) сухой, обложенный язык;
10) тошнота, рвота, жажда;
11) вздутие живота;
12) парез кишечника;
13) положительный симптом Куленкампфа;
14) лейкоцитоз, сдвиг лейкоцитарной формулы влево;
15) анемия, повышение СОЭ;
16) изменения в моче;
17) лицо Гиппократа. Непостоянные симптомы:
1) озноб;
2) экссудат в брюшной полости;
3) икота;
4) понос;
5) газ в брюшной полости;
6) дизурические расстройства.
Наиболее ценные из перечисленных симптомов - мышечное напряжение, боли, положительный симптом Щеткина-Блюмберга и отсутствие брюшного дыхания. Мышечное напряжение - самый точный признак абдоминальной катастрофы. Степень выраженности его бывает разной, в зависимости от характера патологического процесса, возраста больного, степени развития мышц. В выявлении этого симптома многое зависит от умения и опыта врача, проводящего обследование. Боль (также в зависимости от состояния, характера заболевания, возраста больного и характера нервной системы) может быть различной интенсивности, вплоть до развития болевого шока (при пер-форативной язве, остром панкреатите, тромбозе мезентериальных сосудов). Симптом Щеткина-Блюмберга свидетельствует о раздражении брюшины, в сочетании с напряжением брюшной стенки - это всегда бесспорный признак перитонита. Отсутствие брюшного дыхания, отставание брюшной стенки при дыхании свидетельствуют о раздражении брюшины, кроме того, на основании их можно судить о локализации патологического процесса.
Таким образом, ценность перечисленных симптомов различна. Особое значение в диагностике перитонита имеет наличие совокупности нескольких признаков. Наиболее ясна клиническая картина в период реактивной стадии, но, к сожалению, только 50% больных поступают в стационар на этой стадии заболевания.
Стандартные исследования крови, мочи непосредственно в диагностике перитонита большой роли не играют, они свидетельствуют о наличии воспалительного процесса и характеризуют тяжесть состояния больного. В биохимическом анализе крови определяются снижение уровня альбуминов, признаки гиперкоагуляции.
Ценные данные могут быть получены при рентгенологическом исследовании - свободный газ в брюшной полости, свободная жидкость в отлогих местах, признаки паралитической кишечной непроходимости.
Обязательным является ректальное ивагинальное исследование, при котором можно выявить положительный симптом Куленкампфа.
Большой диагностической ценностью обладают инвазивные методы: лапа-роцентез, лапароскопия. Диагностическая точность лапароцентеза с использованием шарящего катетера и микроскопическим исследованием полученной из брюшной полости жидкости составляет 90%. Этот метод впервые применил в 1880 г. И. Микулич, значимость его велика и в настоящее время. Отрицательный результат нельзя расценивать как признак отсутствия перитонита. Самым точным методом, несомненно, является диагностическая лапароскопия, позволяющая определить источник перитонита, его характер и распространенность.
При сомнительных результатах лапароцентеза и невозможности провести лапароскопию показана диагностическая лапаротомия. Она таит меньше опасности для больного, чем промедление с операцией при перитоните. Напрасные релапаротомии, по литературным данным, не приводят к значительному ухудшению состояния. Но тем не менее лапаротомия при отсутствии перитонита у больного с псевдоабдоминальным синдромом нежелательна. Отсюда понятно значение дифференциальной диагностики.
Дифференцировать перитонит необходимо с теми заболеваниями, которые даютпсевдоабдоминальный синдром. К ним относятся:
1) заболевания сердца и сосудов - острый инфаркт миокарда, расслаивающая аневризма брюшной аорты, «абдоминальная» ангина;
2) заболевания легких и плевры - плеврит, нижнедолевая пневмония;
3) гематологические заболевания - лейкоз, гемофилия, лимфогранулематоз;
4) заболевания и повреждения нервной системы - менингиты, рассеянный склероз, опоясывающий лишай, «абдоминальная» эпилепсия;
5) инфекционные заболевания - малярия, брюшной тиф;
6) аллергические заболевания и реакции;
7) заболевания и повреждения брюшной стенки и забрюшинного пространства;
8) заболевания органов брюшной полости, не требующие оперативного лечения, - острый гастрит, регионарный илеит.
Как видно, список заболеваний, могущих дать псевдоабдоминальный синдром, достаточно велик. Знание особенностей течения этих заболеваний поможет исключить острое хирургическое заболевание, осложнившееся перитонитом. В тяжелых диагностических случаях, как уже говорилось, показаны лапароцентез, диагностическая лапароскопия либо, как последний акт диагностики, лапаротомия.
Значение ранней, своевременной диагностики перитонита в исходах лечения определяют слова С.И. Спасокукоцкого: «При перитонитах операция в первые часы дает 90% выздоровлений, в первый день - 50%, позже третьего дня - всего 10%».
Лечение перитонита - сложная и пока еще не до конца решенная задача. Если при местном перитоните основным методом лечения является ранняя операция, то лечение разлитых форм перитонита требует проведения комплекса мероприятий, направленных не только на борьбу с инфекцией, но и на коррекцию нарушений гомеостаза. Принципы лечения разлитых форм перитонита следующие:
1) устранение источника перитонита;
2) борьба с инфекцией;
3) борьба с интоксикацией;
4) борьба с парезом кишечника;
5) восстановление водно-электролитного баланса;
6) улучшение функций важнейших органов и систем;
7) повышение иммунобиологических свойств организма.
Главным и основным является раннее адекватное хирургическое вмешательство. Оно может быть отложено на 2-3, в тяжелых случаях на 4-6 ч только для проведения предоперационной подготовки. Центральные звенья ее следующие:
1. Дозированная по объему, времени и качеству инфузионная терапия с целью ликвидации гиповолемии и электролитных нарушений. Обязательна катетеризация центральных вен. Объем инфузий определяется сроком заболевания. В реактивную стадию дефицит ОЦК составляет 10-15%, в токсическую - 15-25%, в терминальную - 30-35%. Объем инфузии необходимо
увеличивать сверх дефицита ОЦК на 20-30%. В запущенных случаях он составляет 3-4 л в течение 2-3 ч. Состав инфузий: полиглюкин, 10-20%-ный раствор глюкозы, раствор Рингера-Локка, альбумин, плазма, 4%-ный раствор бикарбоната натрия, при нестабильности артериального давления - предни-золон 30-60 мг, коргликон.
2. Катетеризация мочевого пузыря для измерения почасового диуреза как объективного критерия эффективности инфузионной терапии.
3. Аспирация желудочного содержимого с помощью интраназального зонда.
4. Внутривенное введение антибиотиков широкого спектра действия. Основной метод обезболивания - современный многокомпонентный эндо-трахеальный наркоз с применением мышечных релаксантов. Брюшная полость вскрывается срединной лапаротомией, обеспечивающей оптимальный доступ ко всем отделам брюшной полости. Лапаротомия при необходимости может быть продлена вверх и вниз. Задачи оперативного вмешательства при перитоните следующие:
1) удаление экссудата из брюшной полости;
2) ревизия для выявления причины перитонита, его характера и распространенности; устранение источника перитонита;
3) санация брюшной полости;
4) декомпрессия желудочно-кишечного тракта;
5) создание оптимальных условий для лечения в послеоперационном периоде (канюлирование артерий, дренирование брюшной полости, вшивание застежек в лапаротомную рану).
После вскрытия брюшной полости возможно полно и атравматично удаляется ее содержимое (гной, желчь, кишечное содержимое), лучше всего с помощью электроотсоса. После этого можно воспользоваться методом Юдина (введение в отлогие места шести марлевых тампонов на все время операции). Ревизия должна проводиться педантично. Уже характер выпота может дать представление о причинах перитонита (геморрагический выпот - деструктивный панкреатит, мезентериальный тромбоз; скользкий сероватый выпот - перфоративная язва). Наибольшее количество фибринных пленок обычно располагается в районе источника перитонита. Устранение источника перитонита - главная задача операции. Но вместе с тем объем операции должен быть переносимым для тяжелого больного. Поэтому для перфора-тивной язвы методом выбора является ушивание перфоративного отверстия, а не резекция желудка; при опухолевой непроходимости толстой кишки выполняется резекция кишки с выведением колостомы, а анастомоз не накладывается. При невозможности удалить очаг инфекции полностью, оставлении некротических тканей (например, при деструктивном панкреатите) необходимо отграничить его от свободной брюшной полости тампонами.
Лучшим методом санации брюшной полости во время операции является многократное промывание ее теплыми (38-39°) растворами антисептиков или просто солевым раствором с добавлением антибиотиков до «чистой воды». Еще В.Ф. Войно-Ясенецкий писал: «... не подлежит сомнению, что промывание - самый нежный способ удаления гноя, не повреждающий эндотелий брюшины». Для промывания обычно используют малотоксичные антисептики (фурацилин 1:5000, хлоргексидин0,01-0,02%-ный). При анаэробной
флоре обоснованно применение электрохимически активированного раствора калия хлорида (ЭХАР-анолит) и гипохлорита натрия 0,09%-ного, так как они являются донаторами кислорода. Однако В.С. Савельев и соавт. (2006) считают, что применение антибиотиков и антисептиков для интраоперационной санации брюшной полости нецелесообразно из-за краткосрочности контакта, высокого риска местного и общего токсического эффекта, нарушения антибактериального действия их в условиях воспаления брюшины.
Некоторые авторы рекомендуют использовать для промывания брюшной полости, охлажденные до 4-6 °С растворы антисептиков, аргументируя следующим:
1) при гипотермии снижаются обменные процессы, резко повышенные при перитоните;
2) подавляется резорбтивная функция брюшины, что снижает эндотокси-кацию;
3) достигается сосудосуживающий эффект с повышением системного артериального давления.
При санации брюшной полости применяют также ультразвук низкой частоты (26,5 кГц) для механической очистки воспаленной брюшины, а для воздействия на флору - ультрафиолетовое облучение. Плотно фиксированные к брюшине налеты фибрина удалять не следует из-за опасности десерозирования. Декомпрессия кишечника осуществляется с помощью трансназальной интубации на протяжении 1 м от связки Трейтца через микрогастростому по Ю. М. Дедереру, через энтеростому ретроградно по И.Д. Житнюку либо через цекостому. Толстый кишечник интубируют через задний проход. Интубация кишечника абсолютно обязательна в токсическую и терминальную стадии перитонита, когда парез кишечника приобретает самостоятельное значение. Декомпрессия кишечника, кишечный лаваж растворами антисептиков, энтеросорбция, возможность раннего энте-рального питания приводят к раннему восстановлению моторики, снижают проницаемость кишечной стенки для микрофлоры и токсинов, создают условия для заживления анастомозов.
Дренирование брюшной полости зависит от распространенности перитонита, его характера. При местном перитоните достаточно микроирригатора для введения антибиотиков. При разлитом перитоните в реактивную фазу (при серозном выпоте) также можно ограничиться введением в брюшную полость мягких микроирригаторов. В токсическую, терминальную стадии разлитого перитонита применяют силиконовые трубки, которые вводят через проколы в обоих подреберьях и обеих подвздошных областях (рис. 265); возможно дренирование малого таза через прямую кишку, а у женщин - через задний свод влагалища (рис. 266). Эти трубки в послеоперационном периоде можно использовать как для введения антибиотиков, антисептиков и пассивного оттока или активной аспирации экссудата, так и для проведения перито-неального диализа (лаважа) брюшной полости. Для создания более высокой концентрации антибиотиков в брюшной полости канюлируют пупочную вену (при деструктивном холецистите, панкреатите), желудочно-сальниковую артерию (при панкреатите), брюшную аорту по Сельдингеру.
Рис. 265. Схема дренирования брюшной полости при распространенном перитоните
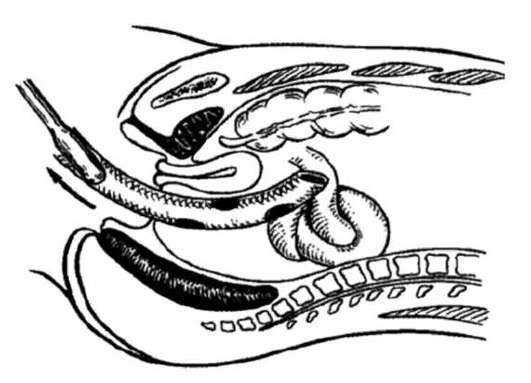
Рис. 266. Дренирование малого таза через задний свод влагалища
В последние годы в лечении запущенных форм перитонита стали активно применять лапаростомию, т.е. открытое ведение брюшной полости. Метод впервые был предложен более 100 лет назад И. Микуличем, вновь возрожден в 80-х гг. XX в. Н.С. Макохой. Сущность его заключается в том, что после операции брюшная стенка не зашивается либо ушивается, но временными швами, дающими возможность проводить через 24-48 ч ревизию и санацию брюшной полости. При первом варианте (открытом ведении брюшной полости) на петли кишечника укладывают сальник, затем салфетку, обильно смоченную подогретой мазью левосин, левомеколь (рис. 267). Вместо марлевой салфетки целесообразнее использовать перфорированную искусственную кожу, полиэтиленовую пленку, викриловую сетку, пластины из полиуретана.
Второй вариант предполагает временное закрытие брюшной стенки при помощи редких лавсановых швов, специальных крючков, вшиваемых в кожу, различных устройств из пластмассы, никелида титана, отрезков силиконовых трубок, в том числе по методике, разработанной в клинике хирургических болезней СибГМУ (рис. 268). Значительно упрощает дело вшивание в края брюшной стенки застежки «молния» промышленного производства (рис. 269). Такое ведение брюшной полости дает возможность осуществлять в послеоперационном периоде плановые перевязки, так называемые программные санации брюшной полости. Первая проводится через 24 ч после операции, последующие, по мере необходимости, - обязательно под общим обезболиванием. Брюшную полость ушивают окончательно через все слои по ликвидации перитонита. Количество программных санаций варьирует от 3 до 14 и более. Во время перевязок вскрываются формирующиеся гнойники, ушиваются дефекты швов, кишечные свищи, брюшная полость промывается 5-6 л антисептиков.
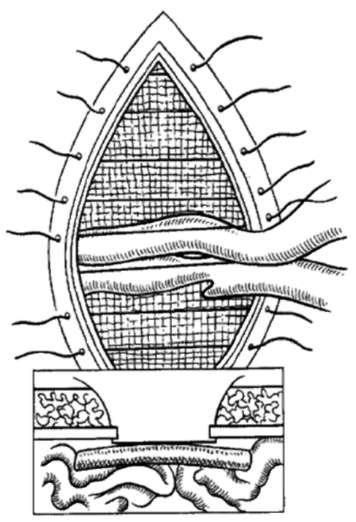
Рис. 267. Схема открытого ведения брюшной полости при перитоните
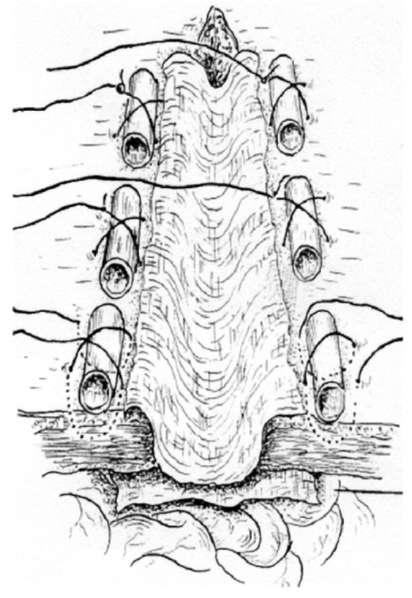
Рис. 268. Схема временного ушивания брюшной полости по методу клиники СибГМУ
Рис. 269. Схема ушивания брюшной полости с помощью застежки «молния»
Лапаростомия - серьезная травматическая агрессия, она сопровождается большими потерями белка, электролитов, травматизацией кишечной трубки, отрицательным психоэмоциональным воздействием на больного, возможно вторичное инфицирование брюшной полости. Показания к ней должны быть строго аргументированы. Ими, по мнению ведущих хирургов, являются:
1) токсическая и терминальная фазы перитонита с полиорганной недостаточностью;
2) массивное каловое загрязнение брюшной полости;
3) гнилостный анаэробный перитонит;
1) распространенный перитонит при сниженных реактивных процессах (анемия, сахарный диабет в стадии субкомпенсации и декомпенсации, раковая кахексия);
4) эвентрация при гнойном перитоните через гнойную рану, флегмоны брюшной стенки;
5) запоздалые релапаротомии при послеоперационном перитоните.
В клинике хирургических болезней СибГМУ применение этого метода позволило снизить послеоперационную летальность при распространенном перитоните с 52,0 до 20,9%. Но, как уже говорилось, он сопровождается гемоконцентрацией, поэтому требует активной инфузионной терапии. С учетом этого некоторые хирурги для послеоперационного контроля за брюшной полостью практикуют фенестрацию брюшной стенки - вшивание в нее во время операции специального устройства типа втулки, позволяющей проводить динамическую лапароскопию и санацию брюшной полости.
Ведение послеоперационного периода должно обеспечить дальнейшую борьбу с инфекцией и коррекцию нарушений. Больной после операции по поводу разлитого перитонита находится в реанимационном отделении или палате интенсивной терапии. Ему придается положение Фовлера, обеспечивающее лучшие условия для работы сердца, легких; выпот при этом стекает вниз, где брюшина обладает меньшей всасывающей способностью. Обязателен контроль диуреза. Основные направления ведения послеоперационного периода следующие:
- борьба с инфекцией;
- борьба с интоксикацией;
- борьба с парезом кишечника;
- восстановление нарушенных водно-солевого и белкового обмена;
- улучшение функций важнейших органов и систем;
- стимуляция защитных сил.
В большинстве случаев (80%) из экссудата брюшной полости высевается кишечная палочка, в чистой культуре - в 47% случаев, в ассоциации с другими микроорганизмами, чаще кокками, - в 33,2%. Учитывая сочетанную флору, ее изменчивость во времени, целесообразно назначать многокомпонентную терапию из 2-3 антибиотиков или антибактериальных препаратов.
«Золотым стандартом» комбинированной антибактериальной терапии является сочетание цефалоспоринов (мандол, цефазолин), аминогликозидов (гентамицин, ванкомицин) и метронидазола либо сочетание цефалоспоринов с клиндомицином и (или) ципрофлоксацином. Можно применять и монотерапию препаратом, действующим на весь спектр микробов: тиенам 50 мг/кг 3-4 раза, меропенем(меронем) 1-2 г через 8 ч. Введение антибиотиков осуществляется различными путями: в брюшную полость через дренажи, внутривенно, внутримышечно, внутрипортально и внутриартериально (концентрация в очаге поражения, по данным авторов, пропагандирующих эти методы,
возрастает в 3-4 раза), эндолимфатически ретроградно через канюлирован-ный грудной лимфатический проток и антеградно через канюлированный лимфатический сосуд на тыле стопы. Используют также иммобилизацию антибиотиков на эритроциты крови больного с последующим введением их в сосудистое русло. В настоящее время наиболее предпочтительным считается внутривенное введение антибактериальных препаратов, поскольку современные антибиотики хорошо проникают в органы, ткани, полости, создавая там терапевтическую концентрацию. С точки зрения доказательной медицины данных о преимуществе других путей введения не получено (В.С. Савельев и соавт., 2006). Длительность антибактериальной терапии в большинстве случаев составляет 7-10 сут.
Действенным методом борьбы с инфекцией брюшной полости является перитонеальный диализ. Этот метод был предложен еще в конце XIX в., но основные положения его были разработаны 20-30 лет назад К.С. Симоняном, В.С. Савельевым, В.Д. Федоровым, А.А. Шалимовым. Задачи перитонеального диализа следующие:
1) вымывание из брюшной полости гноя, фибринных пленок;
2) выведение токсинов;
3) насыщение брюшной полости антибиотиками до нужной концентрации;
4) регуляция минерального обмена путем введения в состав диализата электролитов.
Различают постоянный (проточный, перманентный) и фракционный диализ. В состав диализирующей жидкости вводят электролиты, антибиотики, антисептики, новокаин; по своему рН она должна быть максимально приближена к плазме крови. Объем жидкости за сутки составляет от 5-6 до 25 л. Необходимым условием для проведения диализа является герметичность брюшной полости, т.е. этот метод не применяется в случаях, когда брюшная полость тампонирована (после холецистэктомии, операций по поводу деструктивного панкреатита). Цель проточного диализа - быстрое вымывание из брюшной полости экссудата, фибрина. При фракционном методе через дренажные трубки в подреберьях вводят 3-4 л диализата, трубки в подвздошных областях в это время перекрыты, затем для оттока жидкости их открывают. Время экспозиции и взаимодействия диализата с воспаленной брюшиной увеличено, поэтому антибактериальный эффект этого метода выше. Иногда методы сочетают друг с другом: сначала быстрое механическое вымывание экссудата проточным методом, затем насыщение брюшной полости антибиотиками путем фракционного диализа. Длительность перитонеального лаважа составляет не более 6 сут, так как дренажные трубки к этому сроку отграничиваются от свободной брюшной полости сращениями и обеспечить адекватный ток жидкости уже не удается.
При перитонеальном диализе вместе с диализирующей жидкостью из брюшной полости вымывается большое количество белка (до 50 г в сутки при проточном методе), электролитов. К другим недостаткам его относятся замедление слипания брюшины в области швов, анастомозов, ослабление местных защитных механизмов брюшины за счет вымывания макрофагов, возможность вторичного инфицирования брюшной полости по дренажам.
Проведение брюшного диализа возможно только в тех медицинских учреждениях, где осуществляется круглосуточный контроль водно-солевого и белкового обменов и их коррекция во избежание серьезных расстройств, могущих повлечь остановку сердца.
Для борьбы с интоксикацией широко применяется доступный в любом медицинском учреждении метод управляемой гемодилюции с форсированным диурезом. При условии удовлетворительной функции почек и сердечнососудистой системы объем инфузии может составлять до 5 л. Применяются также гемодиализ, гемосорбция, лимфосорбция, УФО крови, внутривенное лазерное облучение крови. По мнению многих авторов, очень хорошо зарекомендовал себя плазмаферез. Основная масса токсичных продуктов находится в плазме крови, поэтому метод позволяет снизить ее токсичность. Эксфузия обычно составляет 1200-1500 мл плазмы. При печеночной недостаточности используется биоискусственная печень (аллогенные или ксеногенные гепатоциты). Однако из всех методов экстракорпоральной детоксикации исследованиями, проведенными в последние годы, доказана высокая эффективность гемо(диа)фильтрации за счет удаления из кровотока провоспали-тельных медиаторов и других биологически активных веществ. С учетом этого использование в современной интенсивной терапии перитонита других видов экстракорпоральной детоксикации не рекомендуется (В.С. Савельев и соавт.,
2006).
Эндотоксикоз у больных с перитонитом поддерживается паралитической кишечной непроходимостью. Для борьбы с парезом желудочно-кишечного тракта применяются новокаиновая блокада корня брыжейки тонкой кишки, интубация кишечника, осуществляемые во время операции. Абсолютно необходима в послеоперационном периоде постоянная аспирация содержимого желудка. Моторику желудочно-кишечного тракта стимулируют прозерином, калимином форте, питуитрином, убретидом, нибуфином, ацеклидином, регланом, церукалом. Целесообразно сочетание этих препаратов. Хороший эффект дают паранефральная новокаиновая блокада по Вишневскому, внутривенное введение гипертонического раствора хлорида натрия 50,0-60,0 мл, гипертонические клизмы. Можно использовать клизму по Огневу (гипертонический раствор 30,0, глицерин 40,0, перекись водорода 30,0). Эффективна длительная перидуральная блокада. Применяют для борьбы с парезом кишечника внутривенное и внутрибрюшное введение сорбитола, а также электростимуляцию специальными аппаратами либо с помощью автономного электростимулятора желудочно-кишечного тракта («кремлевская таблетка»).
Необходимым условием для восстановления моторики является коррекция водно-электролитного баланса, особенно солей калия. Благоприятно сказывается раннее энтеральное питание, если к нему нет противопоказаний. В патогенезе перитонита одним из центральных звеньев является нарушение водно-электролитного обмена. Оно усугубляется после операции за счет паралитической кишечной непроходимости, потери электролитов вследствие перитонеального диализа. При перитоните больному в среднем следует вводить 40-50 мл жидкости на 1 кг массы, в тяжелых случаях - 50-60 мл и более.
Потеря электролитов восполняется за счет раствора Рингера-Локка до 1,5 л в сутки, хлорида калия 3%-ного - 100 мл, бикарбоната натрия 4%-ного - 400 мл, гипертонического раствора натрия. Потери жидкости с мочой, экссудатом из живота, рвотой, через дыхание и кожу составляют примерно 4,0-4,5 л, поэтому объем инфузий должен быть не менее 4,0-4,5 л, причем повышение температуры тела на 1° увеличивает объем инфузий на 500 мл. Стабилизация показателей центральной гемодинамики достигается применением коллоидных и кристаллоидных растворов (полиглюкин, реополиглюкин), протеина, альбумина, 5-10%-ного раствора глюкозы, сердечных препаратов.
Чрезвычайно важна коррекция энергетических и белковых потерь. Суточная потребность в энергии при перитоните - 2100-2500 ккал. Повышение температуры тела на 1° выше нормы увеличивает потребность в энергии на 10%. Половина необходимой энергии восполняется за счет углеводов (при расщеплении 1 г глюкозы выделяется 4 ккал). Целесообразно применение 10-20%-ного раствора глюкозы с инсулином. За счет жиров восполняется 30-40% энергии. Рекомендуется введение не более 1000 мл жировых эмульсий (интра-липид, липофундин) через 2-3 дня.
У больных с перитонитом после операции интенсивность обмена белков столь высока, что говорят о «катаболической буре» (потребность в белке возрастает в 1,5-2 раза). Для синтеза 1 г белка необходимо 0,16 г азота. Для восполнения белковых потерь применяются белковые гидролизаты и растворы аминокислот (вамин, аминозол и др.). Необходимое количество азота для построения белка содержится примерно в 1 л названных растворов. Плазма крови, цельная кровь не являются хорошим средством для компенсации белковых потерь, так как белки плазмы усваиваются через 18-20 дней, крови - через 100-120 дней, альбумина - через 14-18 дней. При этом нужно помнить, что на метаболизм 1 г азота расходуется 180-200 ккал, поэтому введение белковых гидролизатов должно проводиться одновременно с введением энергоносителей. В целях снижения катаболизма белков применяют анаболические гормоны - ретаболил, нерабол. Уменьшают катаболические процессы и пиримидиновые производные - пентоксил, метилурацил.
У больных пожилого и старческого возраста велика опасность тромбо-эмболических осложнений. Для профилактики сладж-синдрома применяется гепарин в малых дозах - 2500-5000 ЕД, лучше низкомолекулярный (фрак-сипарин). Улучшают реологические свойства крови реополиглюкин, аспирин, аспизол, курантил, трентал, эуфиллин, никотиновая кислота. Необходима интенсивная профилактика пневмоний - банки на грудную клетку, ингаляции кислорода и бронхолитиков, лаваж бронхиального дерева, дыхательная гимнастика, перкуссионный массаж грудной клетки.
В лечении перитонитов нашла применение гипербарическая оксигенация. При этом улучшаются оксигенация тканей, моторика кишечника, подавляется анаэробная флора, повышается активность антибиотиков, иммунологической системы. Гипербарическая оксигенация применяется только при отсутствии гнойных осложнений перитонита.
Нарушение иммунологической защиты организма является одним из важнейших звеньев патогенеза перитонита, к тому же массивная антибиотикоте-
рапия сопровождается иммунодепрессией. Рекомендуется неспецифическая иммунотерапия пирогеналом, левамизолом, продигиозаном. Применяются также иммуноглобулин, антистафилококковый γ-глобулин, тималин, такти-вин, свежезамороженная плазма.
В послеоперационном периоде у больных с разлитым перитонитом возможно развитие ряда осложнений со стороны как брюшной, так и грудной полости. Наиболее часто наблюдаются гнойники, основная их локализация - отлогие места брюшной полости (под диафрагмой, под печенью, в малом тазу). Причины их развития - недостаточность санации и дренирования, высокая вирулентность микрофлоры, несостоятельность защитных сил организма.
Особое место в ведении послеоперационного периода принадлежит рела-паротомии. Чаще всего необходимость в ней возникает при прогрессирующем перитоните, гнойниках брюшной полости, недостаточности швов анастомозов. Диагностика этих осложнений затруднена, поэтому повторные операции часто проводятся с запозданием, когда больному трудно помочь. Поэтому-то хирурги и стали применять лапаростомию с программными санациями брюшной полости, позволяющими своевременно ликвидировать осложнения. При традиционном ушивании брюшной стенки часто развивается эвентрация как результат нарушения регенерации, нагноений. Для профилактики этого осложнения применяются провизорные швы через все слои брюшной стенки, кроме брюшины (рис. 270). Наличие этих швов позволяет к тому же раньше поднимать больных, что важно для предупреждения легочных и сердечно-сосудистых осложнений.
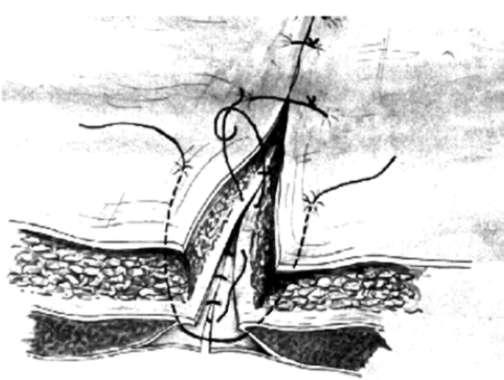
Рис. 270. Схема наложения провизорных швов
Исходы оперативных вмешательств при перитонитах зависят от многих моментов: характера основного заболевания, распространенности перитонита, его периода, своевременности и адекватности операции. По материалам I Международного московского конгресса хирургов (1995), летальность при распространенном перитоните составляет от 20 до 40%. В клинике хирургических болезней СибГМУ в период с 1995 до 2005 г. летальность при местных формах перитонита снизилась до 0,5%, при распространенном перитоните она остается высокой - до 30,7%, что требует поиска новых эффективных методов своевременной диагностики и лечения перитонитов.
Кровотечения из верхних отделов пищеварительного тракта на 75% имеют язвенную этиологию. Хронические язвы желудка и двенадцатиперстной кишки осложняются кровотечением в 15-20% случаев. Такое осложнение развивается в 3-4 раза чаще при язве двенадцатиперстной кишки. Важно отметить, что у больного с кровоточащей язвой обычно выявляется характерный для язвенной болезни желудка или двенадцатиперстной кишки анамнез.
Желудочно-кишечные кровотечения (ЖКК) - одна из наиболее частых причин экстренной госпитализации в стационары хирургического профиля. Терапевтическая задача при кровотечении из желудочно-кишечного тракта (ЖКТ) проста и логична: состояние больного должно быть стабилизировано, кровотечение остановлено и проведено лечение, целью которого является предотвращение впоследствии эпизодов ЖКК. Для этого необходимо установить источник кровотечения и его локализацию. К числу самых серьезных ошибок, которые влекут тяжелые последствия, относят недооценку тяжести состояния больного и начало диагностических и лечебных манипуляций без достаточной подготовки пациента. Чтобы правильно оценить объем кровопотери и состояние больного, необходимо ясно представлять, какие изменения возникают в организме при этой патологии.
В дифференциально-диагностическом плане необходимо также помнить, что кровотечения из дыхательных путей могут симулировать острые желудочно-кишечные кровотечения язвенной этиологии.
Острые кровотечения из носа, носоглотки, трахеи, бронхов и легких составляют 0,3% и возникают при повреждении слизистой, гипертонической болезни, заболеваниях крови, новообразованиях, кавернозном туберкулезе, абсцессах легких и бронхоэктазиях.
Острые кровотечения из пищевода могут возникать при: портальной гипертензии, раке, острых язвах, дивертикуле, эрозивном эзофагите, разрыве аневризмы грудного отдела аорты, лейомиоме, химическом ожоге и травме пищевода инородным телом, вызывающим пролежень слизистой оболочки пищевода и образование пищеводно-трахеального свища.
Острые кровотечения из желудка могут быть обусловлены: хронической язвой, острой язвой, пилородуоденальной язвой, хронической и острой язвой гастроэнтероанастомоза, эрозивным геморрагическим гастритом, раком желудка, гипертонической болезнью и атеросклерозом, грыжей пищеводного отверстия диафрагмы, лейомиомой, синдромом Мэллори-Вейса, болезнью Рандю-Ослера, острым фибринолизом, гломусной опухолью, заболеваниями крови. Кровотечения могут быть обусловлены и другими заболеваниями
(гемангиомой, фибромой, нейрофибромой, липомой, шванномой, туберкулезом, сифилисом, саркомой, лимфогранулематозом, актиномикозом, инородным телом желудка, разрывом аневризмы, дивертикулами, острым расширением желудка, травмой, ожогом, острым панкреатитом, диабетической комой, абсцессом).
Острые кровотечения из двенадцатиперстной кишки возникают при хронической язве, острой язве, дивертикуле, раке двенадцатиперстной кишки, раке поджелудочной железы, разрыве аневризмы аорты, гемобилии, истерии. Более редкими являются кровотечения при аденоме поджелудочной железы, завороте сальника, сепсисе, аппендиците, сирингомиелии, ЖКБ, авитаминозе, пищевой интоксикации, уремии, лучевой болезни, аллергии, лекарственных язвах и оперативных вмешательствах.
В тактике лечения острых желудочно-кишечных кровотечений большое значение имеет степень кровопотери, определяющая состояние больного.
Для определения степени кровопотери необходимо использовать:
1) сведения, полученные от больного, его родственников, окружающих и медицинских работников о количестве потерянной крови, исчисляемом в различных объемных единицах (литрами, стаканами, тазами и т.д.);
2) данные осмотра: окраска кожи и слизистых, частота дыхания, пульса и уровень АД и ЦВД;
3) относительные показатели клинического анализа крови (количество эритроцитов, гемоглобина, величина цветного показателя);
4) уровень гематокритного числа, размеры удельного веса крови и плазмы.
Использование этих показателей для определения степени кровопотери не может вызывать возражений. Однако следует помнить, что субъективные сведения, объективные внешние признаки и лабораторные относительные показатели (исчисляемые в процентах или миллиграмм-процентах) могут дать лишь ориентировочные данные о размерах кровопотери. Даже гематокрит, удельный вес крови и плазмы, исследованные в первые часы после начала кровотечения, не отражают истинных размеров кровопотери, так как оставшаяся в организме кровь разжижается не сразу, а только через несколько часов и даже дней.
Одним из объективных и наиболее точных методов определения кровопотери является исследование ОЦК и ее компонентов и вычисление дефицита гематологических показателей. Только определение
ОЦК и ее компонентов позволяет установить, какая же часть крови осталась после геморрагии в организме и принимает участие в циркуляции.
Определить с наибольшей долей вероятности степень кровопотери и правильно оценить состояние больного можно только после комплексного изучения клинических данных, показателей лабораторных и инструментальных методов диагностики.
Экстренная ФГДС выявляет источник кровотечения, наличие тромбов в язве, опухоли.
В зависимости от интенсивности кровотечения следует делить на явные, проявляющиеся кровавой рвотой или дегтеобразным стулом, и скрытые, оккультные, кровотечения, которые можно определить лишь с помощью реакции Грегерсена. Явные геморрагии могут быть острыми и хроническими, впервые возникшими и повторными. Острые желудочно-кишечные кровотечения бывают однократными и многократными (рецидивирующими). Последний тип кровотечений представляет наибольшую опасность для жизни пациента.
Повторные острые желудочно-кишечные кровотечения, возникающие на фоне нормоволемии через значительный промежуток времени после первого эпизода геморрагии, обычно ничем не отличаются от впервые появившегося кровотечения. Кровотечения, рецидивирующие в течение короткого времени, исчисляемого часами и даже минутами, вызывают тяжелые изменения в системе гомеостаза и являются чрезвычайно опасными.
При поступлении больного в стационар через 24 ч и позднее от начала кровотечения количество эритроцитов, уровень гемоглобина, гематокритное число, удельный вес крови и плазмы отражают степень анемии и могут быть использованы для определения степени кровопотери. Данные этих исследований позволяют составить ориентировочное представление о тяжести кровотечения. Пользуясь показателями этих исследований и клиническими данными, принято выделять три степени кровопотери: легкую, среднюю и тяжелую.
• Легкая степень кровопотери: количество эритроцитов выше 3 500 000, уровень гемоглобина больше 60 ЕД, гематокритное число выше 30%, частота пульса до 80 в минуту, артериальное давление выше 110 мм рт.ст.
• Средняя степень кровопотери: количество эритроцитов в пределах 250 000-3 500 000, уровень гемоглобина от 50 до 60 ЕД, Ht от 25 до 30%, частота пульса от 80 до 100 в минуту, систолическое АД от 100 до 110 мм рт.ст.
• Тяжелая степень кровопотери: количество эритроцитов меньше 2 500 000, уровень гемоглобина ниже 50 ЕД, Ht ниже 25%, частота пульса выше 100 в минуту, систолическое АД ниже 100 мм рт.ст.
Эндоскопическая классификация острых желудочно-кишечных кровотечений отражает причину и патогенез кровотечения, локализацию источника кровотечения, степень кровопотери и факт продолжающегося, остановившегося или рецидивирующего кровотечения. Объективно оценить состояние больных с синдромом желудочно-кишечного кровотечения можно только с использованием данных ЭГДС.
Эндоскопическая классификация желудочно-кишечного кровотечения по Forrest:
FI - продолжающееся кровотечение;
FIA - струйное кровотечение из язвы;
FIB - капельное кровотечение из язвы;
FII - состоявшееся кровотечение;
FIIA - тромбированные сосуды на дне язвы (высокий риск рецидива);
FIIB - сгусток крови, закрывающий язву (низкий риск рецидива);
FIIC - язва без признаков кровотечения;
FIII - источники кровотечения не обнаружены.
Тактика до операции.
1. Экстренная госпитализация пациента в хирургический стационар (транспортировка на носилках).
2. Комплексная гемостатическая терапия:
а) инфузионная (ε-аминокапроновая кислота 5% - 200 мл, дицинон 250 мг, 2мл в/в, при показаниях повторить через 2 ч; хлорид или глюконат кальция 10% - 10 мл; фибриноген 1-2 г на 250 мл изотонического 0,9% раствора хлорада натрия; гемофибин 3% - внутрь; викасол 1% - 3 мл в/м);
б) местная - строгий постельный режим, холод на подложечную область, промывание желудка ледяной водой, желудочная гипотермия, введение зонда Сенгстакена-Блекмура при кровотечении из варикозно расширенных вен пищевода и трещин кардии, введение в желудок по зонду адреналина или норадреналина 0,1% раствор - 4 мл вместе с 100-150 мл 5% ε-аминокапроновой кислоты (или перорально по 1 столовой ложке этой смеси каждые 15 мин);
в) лечебная эндоскопия - обкалывание язвы 1% раствором адреналина или норадреналина, электрокоагуляция, прошивание сосуда металлической клипсой, лигирование, лазерная коагуляция, аппликация медицинского клея МК № 6, 7, 8;
г) эндоваскулярная эмболизация кровоточащего сосуда с помощью суперселективного введения искусственного эмбола через бедренную артерию. 3. Коррекция волемических нарушений:
а) восполнение ОЦК - переливание кровезаменителей, замороженной плазмы, крови;
б) стабилизация гемодинамики;
в) ликвидация метаболического ацидоза;
г) восстановление микроциркуляции.
Классификация по Forrest позволяет определить лечебную тактику при кровотечениях язвенной этиологии. При профузном кровотечении (IA) показана экстренная операция, так как применение консервативных методов приводит к потере времени и ухудшает прогноз. При подтекании крови из язвы (IВ) оправданы попытки остановить кровотечение через эндоскоп путем моноактивной или биполярной электрокоагуляции с помощью тока высокой частоты, фотокоагуляции аргоновым или ИАГ-неодимовым лазером, путем аргоновоплазменной коагуляции ионизированным газом или обкалывания язвы этиловым спиртом. Хорошие результаты дает орошение кровоточащей язвы через катетер раствором капрофера - карбонильного комплекса треххлористого железа и эпсилон-аминокапроновой кислоты. Изредка на кровоточащий сосуд накладывают специальные эндоклипсы.
Экстренная операция показана и при рецидиве кровотечения, возникающем в ближайшие часы после предварительного гемостаза.
При остановившемся кровотечении с высоким риском рецидива (IIA по Forrest) показана неотложная операция в ближайшие сутки, как правило утром следующего дня. Наиболее оправданная хирургическая тактика при кровоточащей язве желудка - ее иссечение или ушивание в сочетании с пилоропластикой и ваготомией (при отсутствии признаков малигнизации язвы), а при язве двенадцатиперстной кишки выполняют экономную резекцию желудка (антрумэктомия) или (у больных с высокой степенью операционного риска) ушивают язву с пилоропластикой и селективной ваготомией.
Клиническая картина и диагностика
Клиническая картина зависит от pаспространенности поражения, клинической формы неспецифического язвенного колита, наличия или отсутствия осложнений. Pазличают острый (первые 6 мес болезни) и хронический колит. Разновидностью острого колита является молниеносный или фульминантный колит (может закончиться фатально в течение 1-2 нед болезни). Хронический колит чаще имеет постоянную или хроническую pецидивирующую форму. По тяжести клинических проявлений болезни выделяют тяжелую форму, характерную для обширного поражения толстой кишки, средней тяжести и легкую, проявляющуюся преимущественно поражением только прямой кишки. В зависимости от эффективности медикаментной терапии выделяют гормоночувствительные, гормонорезистентные и гормонально зависимые формы течения колита.
Ведущие симптомы - диарея и выделение крови (кровавая диарея). Наиболее тяжело протекает фульминантная форма неспецифического язвенного колита, при которой толстая кишка поражается тотально. Острая форма неспецифического язвенного колита нередко сопровождается тяжелыми осложнениями: массивным кровотечением (5-6%), токсической дилатацией (2-6%), pеже - перфорацией толстой кишки.
Кpовотечение может быть настолько сильным, что возникают показания к экстренной операции. В этом случае частота дефекаций достигает 12 раз и более в сутки, объем каловых масс и истекающей из прямой кишки крови составляет более 1000 мл в сутки.
Токсическая дилатация толстой кишки обусловлена повреждением нервного сплетения в стенке кишки, дистрофией мышечных волокон, электролитными нарушениями, сопровождается нарушением защитного барьера слизистой оболочки, повышением проницаемости стенки кишки по отношению к токсинам и микроорганизмам, что может привести к сепсису и перитониту даже без перфорации стенки толстой кишки.
У пациентов отмечаются сильные боли по всему животу, тенезмы, pвота, высокая температура тела. Живот вздут, болезнен при пальпации по ходу толстой кишки. Суточная частота дефекаций урежается в 2 раза, диаметр ободочной кишки быстро увеличивается и достигает 9-15 см (по данным обзорной рентгенографии органов брюшной полости). Развивается SIRS c тахикардией, тахипноэ, высоким лейкоцитозом со сдвигом лейкоцитарной формулы влево, высокой СОЭ, снижением уровня гемоглобина, гематокрита, количества эритроцитов. Нарушаются водно-электролитный баланс и КОС, возникает авитаминоз. Быстро наступает значительная потеря массы тела. Смерть может наступить в первые дни заболевания. Летальность достигает 20-30%.
У преобладающего большинства больных поражение ограничивается прямой и сигмовидной кишкой. Обычно через полгода pазвивается хроническая pецидивирующая форма неспецифического язвенного колита, характеризующаяся сменой периодов обострений и pемиссий, причем периоды pемиссий могут продолжаться несколько лет.
Обострение заболевания провоцируют эмоциональный стресс, переутомление, погрешности в диете, применение антибиотиков,
слабительных средств и дp. В периоды обострения клиническая картина напоминает таковую при острой форме процесса. Затем все проявления болезни стихают, патологические выделения постепенно прекращаются. Исчезает понос, уменьшается количество крови, гноя и слизи в испражнениях. Наступает pемиссия заболевания, во время которой у больных, как правило, жалоб нет, однако стул обычно остается неоформленным.
При хронической непрерывной форме неспецифический язвенный колит, начавшись остро или исподволь, без pемиссий, медленно, но неуклонно прогрессирует.
Для любой формы неспецифического язвенного колита характерны кровавый понос, анемия, боли в животе, повышение температуры в период обострения. Сpеди других - внекишечных - проявлений заболевания отмечают артриты и артралгии, остеопороз, узловатую эритему, увеит, афтозный стоматит, склерозирующий холангит, замедление pоста и полового созревания. Тяжелое течение процесса сопровождается гипоальбуминемией, повышением уровня β- и γ-глобулинов. Большие потери жидкости и электролитов вследствие поноса приводят к нарушениям водно-электролитного баланса, обезвоживанию и гипокалиемии.
Диагностика заболевания основана на оценке данных анамнеза, жалоб больного, pезультатов иppигографии, колоноскопии, биопсии. Характерными pентгенологическими признаками считают неровность и зернистость слизистой оболочки, псевдополипоз, изъязвления, отсутствие гаустрации, укорочение кишки, сужение ее просвета. Эндоскопическая картина определяется стадией процесса - от гиперемии, отечности и зернистости слизистой оболочки до обширных зон изъязвлений, псевдополипоза, наличия гноя и крови в просвете кишки.
Во время тяжелой атаки колита проводить тотальную колоноскопию и ирригографию опасно из-за риска перфорации глубоких язв толстой кишки. В этом случае следует ограничиться только проктоскопией, выполненной без специальной подготовки.
Острая артериальная непроходимость - синдром, характеризующийся внезапным нарушением кровотока в определённом сосудистом бассейне. Её можно обнаружить в артериальном русле конечностей (о чём пойдёт речь в этой главе), головного мозга (приводя к развитию ишемического инсульта), внутренних органов (вызывая инфаркты кишечника, почек, селезёнки и т.д.). Острая артериальная непроходимость - одно из наиболее опасных осложнений заболеваний сердца и магистральных сосудов (таких как ревматические пороки сердца, ИБС, атеросклероз аорты и крупных артерий). Вызывают острую артериальную непроходимость эмболии (60%) и острые тромбозы (40%).
Эмболия - термин, введённый в практику Рудольфом Вирховым для обозначения ситуации, при которой происходит отрыв тромба от места его первоначального образования, «перенос» его по току крови с последующей закупоркой артерии.
Острый тромбоз - развитие обтурируюшего тромба на месте изменённой в результате заболевания (атеросклероза, тромбангиита) или травмы сосудистой стенки.
Типичные уровни эмболических окклюзии - зоны бифуркаций, в частности бифуркация аорты, подвздошных, бедренных, подколенных, подключичных и плечевых артерий. Чаще всего эмболия поражает бедренные артерии (до 40% случаев), на долю бифуркации аорты и подвздошных артерий приходится 25%, окклюзия артерий верхних конечностей происходит реже. В 25% наблюдений встречают этажную эмболию (тромбоэмболы локализуются на разных уровнях артериального русла одной конечности),комбинированную (одновременное поражение двух и более конечностей) илисочетанную (закупорка артерий конечностей, сопровождающаяся поражением церебральных или висцеральных сосудов). В случаях острого тромбоза уровень окклюзии зависит от расположения зоны предшествующего поражения артериальной стенки.
Этиология и патогенез
В 95% случаев наблюдают тромбоэмболию, т.е. эмболию тром-ботическими массами. Её причиной становятся заболевания сердца, такие как атеросклеротические кардиопатии, острый инфаркт миокарда и ревматические пороки сердца. До 70% эмболии связано с ИБС и её осложнениями, причём у каждого 7-го больного её причиной бывает постинфарктная аневризма левого желудочка сердца. При ревматических пороках тромботические массы чаше локализуются в левом предсердии или его ушке, в то время как при атеросклеротической кардиопатии - в левом желудочке. В 80% случаев тромбоэмболии вне зависимости от характера основного заболевания выявляют мерцательную аритмию, что позволяет говорить о её значении в формировании и мобилизации внутрисердечных тромбов.
Более редкие источники эмболии - искусственные клапаны сердца (тромбы при определённых условиях могут образовываться на фиксирующем их кольце); аневризмы аорты и её ветвей, осложнённые пристеночным тромбозом; изъязвлённые атеросклеротические бляшки, расположенные в проксимальном отделе сосудистого русла. Одной из причин эмболии артерий верхних конечностей становится добавочное шейное ребро, способное привести к сегментарному стенозу подключичной артерии и развитию постстенотического расширения, в котором формируются пристеночные тромбы. Иногда причинами эмболии бывают предсердная миксома и вегетации на клапанах у больных эндокардитами.
Наиболее частая причина острого артериального тромбоза - атеросклероз, при котором тромбоз формируется на фоне длительно существующего клинически проявляющегося окклюзионно-сте-нотического процесса либо в зоне бессимптомной изъязвлённой бляшки. Существенно реже тромбоз возникает при эндартериите и травме артерий. В любом случае острые тромбозы всегда вторичны по отношению к поражению патологическим процессом сосудистой стенки.
После возникновения острой обструкции магистральной артерии возможны следующие варианты развития процесса. • Проксимальный (редко) или дистальный (значительно чаще) рост тромба, приводящий к закрытию коллатеральных сосудов и нарастанию ишемии конечности. При этом тромб может как возникать в
зоне эмболии, так и образовываться самостоятельно в дистальных артериях поражённой конечности. • Фрагментация тромбоэмбола с последующей миграцией в более дистальные отделы сосудистого русла, что ведёт к уменьшению зоны ишемии. Частичный спонтанный лизис фрагментированного тромба может служить объяснением регресса ишемии у некоторых пациентов с артериальной эмболией.
При острой ишемии конечности развивается кислородное голодание тканей, в связи с чем нарушаются все виды обмена. В первую очередь возникает ацидоз, связанный с образованием избыточного количества недоокисленных продуктов обмена (молочной и пирови-ноградной кислот).
Нарушение проницаемости клеточных мембран, влекущее за собой гибель клеток, приводит к тому, что внутриклеточные ионы калия попадают в межклеточную жидкость и затем в кровь, следствием чего становится гиперкалиемия. В ишемизированных тканях конечности появляются активные ферменты (кинины, креатининфосфо-киназа), а при тяжёлой ишемии в результате разрушения мышечных клеток в межтканевой жидкостинакапливается миоглобин.
Последовательность изменений при синдроме острой ишемии выглядит следующим образом. Сначала появляются умеренные нарушения макрогемодинамики. В дальнейшем наступает резкое ухудшение микроциркуляции, служащей важным звеном в цепи компенсации гемодинамических расстройств. Вслед за этим происходят качественные изменения функционального состояния нервно-мышечного аппарата конечности, выраженные метаболические и структурные нарушения в тканях. Как следствие нарушения клеточной проницаемости развивается субфасциальный отёк мышц со значительным сдавлением тканей, находящихся в фасциальном футляре, что в свою очередь ещё более ухудшает тканевой кровоток.
В ишемизированных тканях возникают факторы, способствующие местному тромбообразованию: стаз крови, ацидоз, наличие активных клеточных ферментов. Возникает тромботичсское состояние, характеризующееся гиперкоагуляцией, гиперагрегацией и торможением фибринолиза. Образование макроагрегатов форменных элементов и микротромбов в мелких артериях и капиллярах значительно усугубляет ишемию и способствует развитию необратимых изменений в тканях конечности. Большое значение имеет тот факт, что в мелких, а в 5% наблюдений и в крупных магистральных венах развивается тромбоз, способный привести к ТЭЛА.
Клиническая картина
Острая артериальная непроходимость проявляется синдромом острой ишемии конечности, отличающимся значительным полиморфизмом. Для него характерны следующие симптомы.
• Боль в поражённой конечности - в большинстве случаев первый признак острой артериальной непроходимости. Особенно ярко выражен болевой синдром при эмболиях.
• Чувство онемения, похолодания, парестезии - патогномоничные симптомы этого патологического состояния. Пациенты жалуются на ощущение того, что они «отсидели ногу», им кажется, что по конечности у них «ползают мурашки», «проходит электрический ток», «в ногу вонзается множество мелких иголок» и т.д.
• Изменение окраски кожи. Почти во всех случаях выявляют бледность кожных покровов. Впоследствии присоединяется синюшный оттенок, который может превалировать. При тяжёлой ишемии отмечают «мраморный рисунок».
• Отсутствие пульсации артерий на всех уровнях дистальнее окклюзии. Этот симптом - единственный клинический признак, позволяющий определить локализацию эмбола или тромба без каких-либо дополнительных инструментальных методов исследования (рис. 34-1). Наряду с пальпацией следует проводить аускультацию аорты и крупных магистральных артерий. Выслушивание систолического шума позволяет заподозрить стенотическое поражение проксимально
Рис. 34-1. Зоны пальпации бедренной артерии, задней большеберцовой артерии и артерии тыла стопы.
расположенных сосудов, что может принципиально изменить тактику обследования и лечения больных. - Отсутствие пульсации бедренной артерии в паху свидетельствует об окклюзии подвздошной артерии. Если она не определяется с двух сторон, это означает, что препятствие кровотоку возникло на уровне бифуркации аорты. - Эмболия (тромбоз) бедренной артерии приводит к отсутствию пульсации в подколенной ямке (рис. 34-2).
Рис. 34-2. Методика пальпации подколенной артерии.
- Если она определяется, но нет пульса на артериях стопы, окклю-зирована бифуркация подколенной артерии.
- Окклюзия подключичной артерии приводит к исчезновению пульсации на всём протяжении конечности, начиная с подмышечной ямки (рис. 34-3).
- Если пульсация в этой зоне определяется, а дистальнее - нет, препятствие кровотоку локализуется в плечевой артерии. Наличие пульса на плечевой артерии в области локтевого сгиба и его отсутствие на уровне лучезапястного сустава свидетельствует об окклюзии бифуркации плечевой артерии.
• Снижение температуры кожи, наиболее выраженное в дистальных отделах.
Рис. 34-3. Пальпация артерий верхней конечности при подозрении на острую артериальную непроходимость.
• Расстройство поверхностной и глубокой чувствительности от лёгкого снижения до полной анестезии. Нарушение чувствительности всегда по типу «чулка».
• Нарушения активных движений в конечности характерны для выраженной ишемии и проявляются в виде снижения мышечной силы (парез) или отсутствия активных движений (паралич) сначала в дистальных, а затем и в расположенных проксимальнее суставах вплоть до полной обездвиженности конечности. Проксимальная граница ишемичес-ких нарушений зависит от уровня окклюзии.
• Болезненность при пальпации ишемизированных мышц наблюдают при тяжёлой ишемии, это неблагоприятный прогностический признак. Чаше отмечают болезненность икроножных мышц (мышц предплечья), при высоких окклюзиях выявляют болезненность мышц бедра (плеча).
• Субфасциальный отёк мышц голени - признак тяжёлой ишемии. Он характеризуется чрезвычайной плотностью и не распространяется выше коленного сустава на ногах. Отёк может охватывать все мышцы голени (тотальный) или же быть ограниченным передней или задней группой мышц.
• Ишемическая мышечная контрактура - самый грозный симптом острой артериальной непроходимости, он свидетельствует о начинающихся некробиотических явлениях. Различают дистальную (частичную) контрактуру, при которой пассивные движения невозможны лишь в дистальных суставах конечности, и тотальную (полную) контрактуру, когда движения отсутствуют во всех суставах поражённой конечности, находящейся при этом в состоянии, весьма сходном с трупным окоченением.
Разнообразие клинических проявлений и степень их выраженности зависят от многих факторов, прежде всего, от состояния кровообращения в поражённой конечности. Чем тяжелее расстройства кровообращения, тем более выражены проявления ишемии.
Классификация
/. Причина артериальной окклюзии:
• эмболия;
• тромбоз.
//. Степень ишемии конечности (по клиническим признакам).
1. Онемение, парестезии, боль (в покое или при физической нагрузке).
2. Двигательные расстройства и/или отёк.
- 2А. Парез (снижение мышечной силы).
- 2Б. Паралич (отсутствие активных движений).
- 2В. Субфасциальный отёк.
3. Развитие контрактуры.
- ЗА. Парциальная контрактура.
- ЗБ. Тотальная контрактура. ///. Течение ишемии:
• прогрессирующее;
• стабильное;
• регрессирующее.
Выраженность ишемических расстройств определяют по клиническим признакам. В классификации указаны наиболее характерные симптомы для каждой из степеней. Наряду с ними сохраняются признаки, характерные для менее выраженной ишемии.
• / степень ишемии при стабильном течении в ближайший период времени не угрожает жизнеспособности конечности.
• 2 степень характеризуется появлением двигательных расстройств и субфасциального отёка. Прогрессирование подобной ишемии неминуемо ведёт к гангрене конечности.
• 3 степень - финальная стадия ишемии конечности, прежде всего, мышц, но ешё не гангрена. В то же время повреждение тканей при этом носит необратимый характер. Клиническое проявление этой стадии - развитие мышечных контрактур на разном уровне. Кроме того, для тромботической окклюзии, возникающей на фоне хронических облитерирующих заболеваний артерий конечностей, характерны более или менее распространённые некротический дефекты тканей. Восстановление магистрального кровотока при подобной ишемии всегда чревато развитием постишемического синдрома (см. ниже). Как показывают многочисленные клинические наблюдения, реваскуляризация конечности при тотальных контрактурах смертельна. При ограниченных контрактурах (голеностопный сустав, пальцы
стопы) речь может идти о необратимых повреждениях только мышц голени (частичном или полном). Восстановление магистрального кровообращения в этих случаях, безусловно, целесообразно, поскольку последующая ампутация на более низком уровне или даже некрэк-томия значительно повышает шансы на выживание таких больных.
Инструментальная диагностика
В диагностической программе при острой артериальной непроходимости необходимо учесть, что время обследования крайне ограничено. В связи с этим необходимо использовать наиболее информативные методики, позволяющие уточнить уровень, характер и распространённость окклюзии, а также установить состояние магистральных артерий, расположенных как проксимально, так и дисталь-но по отношению к тромбу или эмболу. Этим требованиям отвечают УЗИ и ангиография.
УЗИ пациентов с острой артериальной непроходимостью должно включать аускультативный анализ кровотока и измерение регионарного систолического давления на различных уровнях. Дуплексное сканирование, позволяющее визуализировать сосудистую стенку, внутрисосудистые структуры и кровоток, может быть ценным методом для выявления наличия, уровня и характера обструкции артериального русла.
Выполнение ангиографии (рис. 34-4) целесообразно в следующих случаях:
Рис. 34-4. Тромбоэмбол в подколенной артерии (ангиограмма).
• для уточнения диагноза и выбора метода лечения у пациентов с исходной хронической артериальной недостаточностью;
• при подозрении на наличие сочетанной либо «этажной» эмболии;
• при несоответствии уровня отсутствия пульса и границ ишемии;
• в случаях затруднений в дифференциальной диагностике между эмболией и тромбозом;
• при подозрении на добавочное шейное ребро.
Дифференциальная диагностика
Для установления характера острой артериальной непроходимости необходимо прежде всего провести дифференциальный диагноз между эмболией и острым тромбозом.
При эмболии начало заболевания в большинстве случаев внезапное, острое, особенно сильные боли возникают в момент закупорки артерии. Ишемия всегда выражена резко, быстро прогрессирует и без адекватного лечения приводит к развитию гангрены в ближайшие несколько суток.
При остром тромбозе она обычно выражена умеренно и не столь чревата развитием гангрены. Начало заболевания при остром тромбозе на фоне облитерирующего атеросклероза или артериита не столь бурное, как при эмболии. Вместе с тем артериальный тромбоз иногда может протекать молниеносно, это обусловлено так называемой тромботической готовностью (наличием значительных изменений сосудистой стенки на большом протяжении, резкой гиперкоагуляцией и т.д.).
В части случаев приходится проводить дифференциальную диагностику с острым илиофеморальным флеботромбозом, который может сопровождаться резким артериальным спазмом. Начало заболевания по остроте схоже с картиной эмболии - внезапно появляются сильные боли в конечности, в дальнейшем присоединяется чувство онемения. Кожа становится бледно-цианотичной. Нередко развивается картина вялого паралича конечности с потерей всех видов чувствительности. Основной диффренциально-диагностический признак венозного тромбоза - отёк конечности, который возникает сразу вслед за появлением болей и доходит до паховой складки, а иногда и распространяется на нижнюю половину брюшной стенки, что никогда не происходит при острой артериальной непроходимости. По консистенции отёк более мягкий, захватывает подкожную жировую клетчатку. При эмболии отёк всегда плотный и только субфасциальный.
Возникает он значительно позже, при наступлении тяжёлых органических изменений в мышцах голени.
Острое расслоение аорты может симулировать эмболию бифуркации аорты. Это патологическое состояние характеризуется внезапным возникновением резких болей, преимущественно в области спины и поясницы. Они, как правило, иррадиируют в нижние конечности. Существенно выявление выраженной артериальной гипертензии и расширения тени средостения на рентгенограмме. Ишемия конечностей при расслоении аорты не столь резкая, как при эмболии (сохраняются движения, отсутствует мраморная пятнистость кожных покровов). При расслаивающей аневризме аорты расстройства чувствительности локализуются значительно выше уровня похолодания. Особые диагностические трудности представляют случаи расслоения аорты с образованием интрамурального тромба и закрытием устьев обеих подвздошных артерий. Диагноз подтверждают ультразвуковым ангиосканированием, аортографией, КТ, МРТ и транспищеводной эхокардиографией.
Кроме заболеваний сосудов, острую артериальную непроходимость необходимо дифференцировать с патологией центральной и периферической нервной системы. В частности, поперечный миелит может привести к ошибочной диагностике эмболии бифуркации аорты. Заболевание характеризуется развитием в течение 1-2 ч вялого паралича нижних конечностей, сопровождающегося потерей чувствительности. Правильный диагноз позволяют установить анамнез и исследование пульсации артерий (она всегда сохранена).
Лечение
Алгоритм действия врача у постели больного последовательно складывается из решения следующих задач:
• выявление синдрома острой артериальной непроходимости;
• установление характера окклюзии - эмболия, острый тромбоз, эмболия на фоне хронической артериальной непроходимости;
• определение степени ишемического повреждения тканей конечности.
Лечебно-диагностическая тактика при острой артериальной непроходимости представлена в табл. 34-1.
При первой степени ишемии (без её прогрессирования) необходимости в экстренной операции нет. Существует возможность для
Таблица 34-1. Тактика ведения больных с острой артериальной непроходимостью

обследования больного, проведения пробной консервативной терапии и выбора окончательного метода лечения: будь то простая эмбол-эктомия, сложная артериальная реконструкция, тромболизис или эн-довазальные вмешательства. Между тем, если есть полная уверенность в диагнозе «эмболия» и позволяет состояние пациента, целесообразно выполнить экстренную восстановительную операцию.
При 2А степени ещё есть время для пробной антикоагулянтной или тромболитической терапии при неуверенности в диагнозе «эмболия». Существует возможность для полноценного обследования, включающего УЗИ и ангиографию. В результате может быть принято оптимальное для каждого конкретного больного тактическое решение. Это может быть тромболитическая терапия с чрескатетерным введением фибринолитического средства непосредственно в тромб, катетерная аспирационная тромбэктомия, различного рода эндовазальные вмешательства или открытые операции с необходимым объёмом реконструкции сосудов, обеспечивающие реваскуляризацию поражённой конечности.
Ишемия 2Б степени - показание к незамедлительной реваскуля-ризации. Только при этом конечность, а подчас и жизнь больного, могут быть спасены. Продолжительность обследования и подготовки к операции не должна превышать 2-2,5 ч. При уверенности в эмболическом характере окклюзии потеря времени вообще недопустима. В случаях острого тромбоза экстренная операция также не имеет
альтернативы, поскольку при промедлении с ней придётся выбирать уже не способ реваскуляризации, а уровень ампутации.
Ишемия 2В степени, характеризующаяся отёком мышц, помимо сосудистой восстановительной операции, служит показанием к фас-циотомии.
Ишемия 3-й степени - финальная стадия ишемических повреждений тканей конечностей, прежде всего, мышц. Ишемия при этом носит необратимый характер. Клиническое проявление этой стадии - развитие мышечных контрактур. При парциальной (дисталь-ной) контрактуре показана экстренная восстановительная сосудистая операция с последующей отсроченной ампутацией или некрэктоми-ей. Тотальная контрактура конечности приводит к необходимости первичной высокой ампутации.
Изложенный выше тактический алгоритм целесообразно дополнить следующими положениями, которые необходимо учитывать при принятии решения в каждой конкретной ситуации.
• Лучшее решение проблемы острой окклюзии - возможно быстрое восстановление артериального кровотока.
• Только полноценное устранение окклюзии обеспечивает сохранение жизнеспособности конечности и восстановление её функций.
• У больных с эмболией и исходно непоражёнными сосудами метод выбора - эмболэктомия баллонным катетером через поверхностно расположенные и легко доступные под местной анестезией артерии. Такие вмешательства оправданы даже у соматически очень тяжёлых больных.
• Острая окклюзия (эмболия или тромбоз), возникающая на фоне хронической артериальной недостаточности в результате исходного поражения сосудистого русла, может быть надёжно и радикально устранена только с помощью реконструктивной операции. Характер хирургического вмешательства и его объём определяют на основании результатов специальных методов исследования.
• Абсолютные противопоказания к оперативному лечению - атональное состояние пациента и крайне тяжёлое обшее состояние больного при первой степени ишемии.
• При тотальной ишемической контрактуре конечности (ишемия ЗБ степени) восстановительная операция противопоказана в связи с развитием некорригируемого постишемического синдрома. Экстренная первичная ампутация конечности может быть единственной возможной мерой борьбы за жизнь пациента.
• Лечение больных с острой артериальной непроходимостью необходимо начинать с немедленного введения гепарина в приёмном покое тотчас после установления диагноза.
Консервативная терапия
Консервативная терапия применима для пациентов с острой артериальной непроходимостью в качестве самостоятельного метода лечения или в сочетании с оперативным вмешательством для предоперационной подготовки и послеоперационного ведения. Её направления:
• профилактика нарастания тромбоза;
• лизис тромба;
• улучшение кровообращения в ишемизированных тканях;
• поддержание функций жизненно важных органов (сердца, почек, лёгких, печени), поражённых первичным патологическим процессом.
Первую задачу решают путём назначения антикоагулянтов. Не-фракционированный (обычный)гепарин вводят внутривенно в виде непрерывной инфузии в начальной дозе 1000-1500 ЕД в час либо дробно подкожно каждые 8 ч в дозе 450-500 ЕД на кг массы тела больного в сутки. Регулярно исследуют систему гемостаза по активированному частичному тромбопластиновому времени и корригируют вводимую дозу гепарина. Этот показатель должен быть в 2 раза выше нормального значения через 4 ч после инъекции.Низкомолекулярные гепарины вводят подкожно, обычно 2 раза в сутки. Их дозируют по массе тела больного, при этом нет необходимости в столь тщательном лабораторном контроле. На 4-5-е сутки гепаринизации назначаютнепрямые антикоагулянты (варфарин, синкумар). Гепарин отменяют по достижении международного нормализованного отношения 2,0. В дальнейшем дозу непрямого антикоагулянта подбирают индивидуально, при этом международное нормализованное отношение должно быть в пределах от 2,0 до 3,0. Необходимость в длительном приёме непрямых антикоагулянтов возникает особенно в случаях острого тромбоза на фоне атеросклеротического поражения сосудистой стенки или при эмболической окклюзии в условиях нарушений сердечного ритма и внутрисердечного тромбоза, когда вероятность повторной тромбоэмболии высока.
применением активаторов эндоген-
ного фибринолиза: препаратов стрептокиназы, урокиназы, тканевого активатора плазминогена. Непреложное условие тромболитичес-кой терапии - селективное введение фибринолитиков (непосредственно в толшу тромботических масс). Препараты инфузируют от нескольких часов до 2-3 сут в стандартных дозировках, в зависимости от быстроты восстановления проходимости сосуда поданным контрольных ангиографических исследований. После тромболизиса необходимо использование эндоваскулярных вмешательств (внутри-просветной баллонной ангиопластики или катетсрной аспирацион-ной тромбэктомии) с последующим стентированием поражённого атеросклерозом участка артерии.
Поскольку в генезе артериального тромбоза особое значение имеет тромбоцитарный фактор, целесообразно длительное назначение одного из дезагрегантов в суточной дозе:ацетилсалициловая кислотапо 50-100 мг, тиклопидин по 500 мг, клопидогрел по 75 мг, дипи-ридамол по 400 мг.
Хирургическое лечение
Хирургическое лечение пациентов с острой артериальной непроходимостью необходимо проводить только в специализированных отделениях сосудистой хирургии. Вид восстановительных оперативных вмешательств зависит от характера артериальной окклюзии.
При тромбоэмболической окклюзии выполняют прямую или непрямую эмболэктомию.
• Под прямой эмболэктомией понимают удаление эмбола через доступ непосредственно к зоне острой окклюзии.
• В настоящее время чаще всего выполняют непрямую эмболэктомию, т.е. извлечение эмболов и тромботических масс из артериальных сегментов, расположенных проксимальнее и дистальнее артериотомического отверстия, с помощью баллонного катетера, который позволяет эффективно удалять эмболы и продолженные тромбы через поверхностные, легко доступные артерии.
Эмболэктомию из бедренной и подвздошной артерий выполняют из доступа в верхней трети бедра с обнажением бифуркации бедренной артерии (рис. 34-5).
При эмболии бифуркации аорты применяют двусторонний бедренный доступ, позволяющий путём повторного ретроградного зондирования фрагментировать и по частям удалить проксимально расположенный эмбол.

Рис. 34-5. Схема эмболэктомии из подвздошной артерии с помощью баллонного катетера.
Эмболэктомию из подколенной артерии осуществляют из тибио-медиального доступа. Им же пользуются для ретроградного удаления эмболов и тромбов из берцовых артерий. Доступом позади медиальной лодыжки обнажают заднюю болыиеберцовую артерию. Ревизию передней большеберцовой артерии выполняют через тыльную артерию стопы.
Для эмболэктомии из артерий верхней конечности используют единый доступ - в локтевой ямке с обнажением бифуркации плечевой артерии. Прямой доступ применяют чрезвычайно редко, например для резекции шейного ребра. В части случаев, при невозможности адекватного восстановления кровотока из-за распространённого продолженного тромбоза артерий предплечья, приходится обнажать артерии на запястье.
Оперативные вмешательства при острых тромбозах и эмболии на фоне атеросклероза принципиально отличаются необходимостью выполнения тех или иных артериальных реконструкций одновременно с тромбэктомией.
При остром тромбозе аорты или подвздошных артерий обычно выполняют различные шунтирущие операции. В зависимости от тяжести состояния больного и объёма окклюзионно-стенотического
поражения это может быть аорто-бедренное или подвздошно-бедрен-ное шунтирование, либо экстраанатомическое (перекрёстное под-вздошно-бедренное, бедренно-бедренное или подмышечно-бедрен-ное) шунтирование (см. главу 35).
При остром тромбозе бедренно-подколенного сегмента возможны бедренно-подколенное и бедренно-тибиальное шунтирование, а также различные виды профундопластики (расширение просвета сте-нозированной глубокой артерии бедра).
Осложнения
Изменения, возникающие в организме после восстановления кровообращения в конечности (эмболили тромбэктомии), принято называть постишемическим синдромом. Он имеет много общего с так называемым краш-синдромом, или синдромом жгута. Тяжесть выраженности постишемического синдрома, как правило, прямо пропорциональна степени ишемии конечности, однако зависит также от полноты восстановления кровообращения и компенсаторных возможностей организма. Условно постишемические расстройства можно разделить на общие и местные.
Под местными проявлениями постишемического синдрома подразумевают развитие отёка дистальных отделов конечности, при этом отёк может быть тотальным, захватывающим мышцы и подкожную клетчатку или субфасциальным - поражающим лишь мышцы.
Внезапное поступление оксигенированной крови к ишемически поражённым мышцам вызывает появление и освобождение свободных радикалов кислорода и дальнейшие повреждения клеток. Общие нарушения обусловлены попаданием в кровоток большого количества веществ, обладающих токсическим действием, и заключаются в поражении всех систем и нарушением всех функций организма. Попадание в общий кровоток большого количества недоокисленных продуктов из очага ишемии ведёт к тяжёлому метаболическому ацидозу. Миоглобин из разрушенной мышечной ткани выводят почки. Миогло-бинурия в условиях ацидоза способствует развитию миоглобинуричес-кого тубулярного нефроза, приводящего к острой почечной недостаточности. Её развитию способствуют эпизоды артериальной гипотензии, способные сопровождать период реваскуляризации. Вымывание из венозного отдела капиллярного русла и вен в зоне ишемии макроагрегатов форменных элементов и микротромбов ведёт к эмболизации лёгочного сосудистого русла и дыхательной недостаточности.
Ацидоз, поступление большого количества токсических продуктов повреждённых тканей приводят к развитию сердечно-сосудистой недостаточности, проявляющейся артериальной гипотензией и появлением инфарктоподобных изменений на электрокардиограмме. Постишемический синдром может проявляться как поражением всех трёх систем, так и возможным превалированием острой почечной, дыхательной или сердечно-сосудистой недостаточности.
Профилактика
Проблема предотвращения эмболии артерий большого круга кровообращения связана с коррекцией эмбологенных заболеваний (клапанные пороки левых отделов сердца, ИБС). Своевременное протезирование сердечных клапанов, реваскуляризация миокарда путём аортокоронарного шунтирования или стентирования венечных артерий и устранение нарушений сердечного ритма препятствуют возникновению внутрисердечных тромбов, тем самым предотвращая развитие тромбоэмболии магистральных артерий. Если кардиохирурги-ческие вмешательства невозможны, следует рассмотреть вопрос о длительном (пожизненном) приёме больными непрямых антикоагулянтов, что в 2 раза снижает частоту развития эмболии у подобного контингента больных.
В плане профилактики тромбоза большое значение имеют назначение дезагрегантов больным облитерирующим атеросклерозом и проведение коррекции дислипидемии.
Прогноз
В отношении сохранения жизнеспособности конечности прогноз у больных с артериальной тромбоэмболией при условии быстрого восстановления магистрального кровотока благоприятный. Вместе с тем летальность, обусловленная декомпенсацией кровообращения, достигает 25%. Отдалённый прогноз неблагоприятный: в течение 5 лет до 40% больных погибают от прогрессирования заболеваний сердца и рецидива эмболии церебральных и висцеральных сосудов.
При остром тромбозе прогноз также достаточно серьёзный. Около 30% больных подвергаются ампутации конечности в связи с развитием её гангрены. Летальность за счёт гангрены и тяжёлых фоновых заболеваний сердечно-сосудистой системы также достигает 30%.
