
Анатомия
Анатомия желчевыводящей системы необычайно вариабельна. Это нужно учитывать при любом хирургическом вмешательстве в правом верхнем квадранте брюшной полости. В последнее время данное суждение стало особенно актуальным в свете наступления эпохи лапароскопической хирургии желчевыводящих путей. В начале 1990-х гг., лапароскопические хирургические методы были адаптированы для применения в системе желчных протоков, и лапароскопическая холецистэктомия стала стандартом для желчнокаменной болезни. К сожалению, на ранних этапах освоения метода было множество эпизодов повреждения желчных протоков. Они были в значительной степени результатом недостаточного знания хирургами анатомических вариантов системы желчных протоков. Полное понимание типичной и аномальной анатомии - необходимое условие для безопасной хирургии. Стандартная, или классическая, анатомия желчевыводящих путей наблюдается только у одной трети пациентов, поэтому всегда нужно предвидеть возможность анатомических отклонений (рис. 17.1).
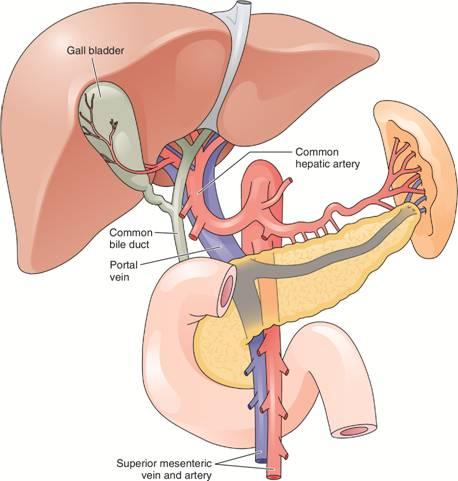
Рис. 17.1. Нормальная, или классическая анатомия желчевыводящей системы.
1 - желчный пузырь
2 - общая печеночная артерия
3 - общий желчный проток
4 - воротная вена
5 - верхняя брыжеечная вена и артерия
Желчная система представена организованной совокупностью протоков, по которым проходит желчь от паренхимы печени, где она образуется, в двенадцатиперстную кишку и в конечном итоге рассредоточивается по всему ЖКТ. Чтобы хорошо разобраться в анатомии желчевыводящей системы, полезно рассматривать внутрипеченочную систему отдельно от внепеченочной. Внутрипеченочная система включает мелкие внутрипеченочные протоки, объединенные в правые и левые печеночные протоки. Последние в свою очередь собирают желчь из правой и левой долей печени соответственно. Левый печеночный проток длиннее правого и часто расширяется первым при дистальной обструкции. Правый и левый протоки сливаясь (обычно за пределами паренхимы, в воротах печени) формируют общий печеночный проток. С общим печеночным протоком через пузырный проток соединяется желчный пузырь. Образовавшийся при их слиянии проток называют общим желчным протоком. Дистальнее он подходит к нисходящему отделу двенадцатиперстной кишки.
Нормальный желчный пузырь - это полый грушевидный орган, вмещающий 30-50 мл жидкости. Выпуклый проксимальный отдел называют дном, округлую среднюю часть - телом, а узкий дистальный отдел - шейкой. Иногда выпячивание шейки называют воронкой или карманом Хартмана. Пузырный проток является продолжением шейки желчного пузыря и имеет длину от 3 мм до 3 см. Обычно он соединяется с общим печеночным протоком с боковой стороны, однако бывают и другие варианты. Именно вариатильность слияния пузырного протока с общим желчным протоком, может быть не распознана и привести к ятрогенным повреждениям желчных протоков (рис. 17.2).
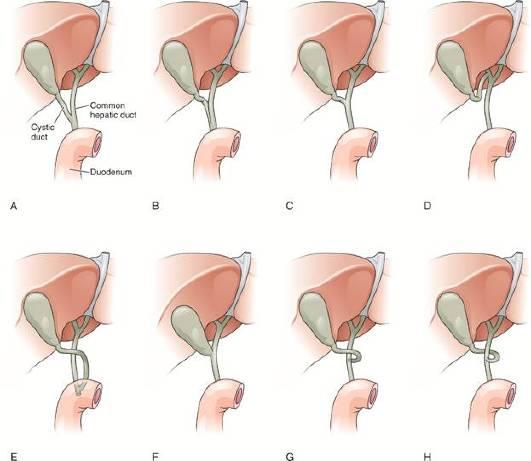
Рис. 17.2. Варианты владения пузырного протока: A - норма; B - параллельный ход пузырного протока общему желчному протоку; C - короткий пузырный проток; D - впадение в правый печеночный проток; E - низкое впадение пузырного протока, пересекающего общий желчныйпроток спереди; F - отсутствие пузырного протока; G - медиальное впадение пузырного протока; H - переднее впадение пузырного протока.
1 - общий печеночный проток
2 - пузырный проток
3 - двенадцатиперстная кишка
Диаметр общего желчного протока у здоровых людей 4-8 мм. Он может стать шире при дистальной обструкции камней или злокачественной опухолью, а также после холецистэктомии и у пациентов преклонного возраста. Как правило, диаметр протока (измеряемый в миллиметрах с помощью УЗИ) у пациентов равен их возрасту разделенному на 10. Например, у 80-летней женщины диаметр протока, вероятно, составит 8 мм. Хотя направление общего желчного протока может изменяться, он обычно проходит позади двенадцатиперстной кишки через головку поджелудочной железы в нисходящий отдел двенадцатиперстной кишки. В конце желчный проток обычно соединяется с протоком поджелудочной железы и впадает в двенадцатиперстную кишку через ампулу фатерова сосочка. В этой области имеется гладкомышечный сфинктер Одди, который окружает оба протока. Ответная реакция на разнообразные раздражители (такие, как холецистокинин) приводит к его расслаблению (часто сопровождаемому сокращением желчного пузыря), что позволяет желчи поступать в кишку. Опухолевая обструкция в этом месте часто дает начало типичному признаку расширения протока при эндоскопической ретроградной холангиопанкреатикографии (рис. 17.3). Необычная форма заболевания, которая затрагивает прежде всего внутрипеченочные желчные протоки, известна как болезнь Кароли и заслуживает отдельного внимания. Хотя она классифицируется как кистозная болезнь печени, данный процесс фактически представляет собой множественные расширения внутрипеченочных желчных протоков, вызывая формирование скоплений желчи, которые при лучевых м етодах диагностики интерпретируют как кисты. Более точно это классифицируется, как кистозная болезнь желчевыводящих протоков. Данный синдром часто сочетается с врожденным фиброзом печени. Иногда развиваются внутрипеченочные камни; у некоторых пациентов может развиться карцинома протоков. Как правило, пациенты преживают периодические приступы холангита, поэтому оказывать помощь лучше всего хирургическим вмешательством и дренированием. Эндоскопическое дренирование желчных протоков также может играть терапевтическую роль в некоторых ситуациях.
Артериальное кровоснабжение желчевыводящей системы осуществляется ветвями артерий, кровоснабжающих печень. Как и в анатомии желчных протоков, изменчивость здесь - правило, а не исключение (рис. 17.4). Отличное от классической анатомии, полное кровоснабжение печени печеночной ветвью чревного ствола выявляют в 25-75% наблюдений. Обычно чревный ствол отходит от передней стенки аорты и в свою очередь, направляясь вперед, делится на левую желудочную, селезеночную и общую печеночную артерии. Общая печеночная артерия, образуя петлю и направляясь вперед и краниально в пределах малого сальника, отдает гастродуоденальную ветвь, кровоснабжающую двенадцатиперстную кишку и поджелудочную железу. Собственная печеночная артерия проходит до ворот печени и делится на правую и левую ветви. Кровоснабжение желчного пузыря осуществляется через пузырную артерию, обычно являющуюся ветвью правой печеночной артерии, но может быть и ветвью «смещенной» правой (5%), левой (10%) или общей печеночной артерией (10%). В некоторых аномальных случаях кровоснабжение может обеспечиваться ветвями, берущими начало от верхней брыжеечной артерии, левой желудочной артерии, аорты и других висцеральных ветвей. Эти отклонения могут быть как сопутствующими (в дополнение к нормальному артериальному кровоснабжению), так и обеспечивать первичное кровоснабжение этой области. Иногда правую печеночную артерию путают (во время операции) с пузырной артерией, когда она проходит параллельно пузырной артерии или в брыжейке желчного пузыря (иногда называют «горб гусеницы»). В такой ситуации путаницы можно ошибочно лигировать или повредить правую печеночную артерию.
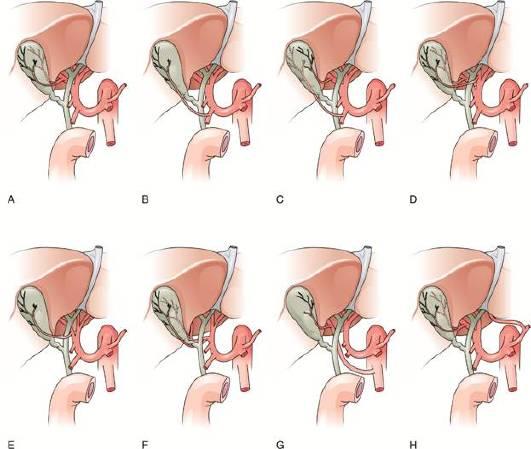
Рис. 17.4. Варианты кровоснабжения желчного пузыря: A - норма; B - H - возможные варианты образования пузырной артерии и ее расположение.
Желчные протоки кровоснабжаются от малых безымянных ветвей печеночной артерии. Венозный отток осуществляется через систему воротной вены. Лимфатические протоки желчного пузыря дренируются в узел пузырного протока (или узел Кало), расположенный между пузырным и общим печеночным протоками. Этот узел служит потенциальным местом метастазирования гепатоцеллюлярного и холангиоцеллюлерного рака и определяет резектабельность.
Треугольник Кало - это критическая анатомическая область, образован пузырным протоком латерально, общим печеночным протоком медиально и печенью сверху[4]. Эта маленькая область содержит многие важные структуры, включая пузырную артерию, правую печеночную артерию, узел Кало; потенциальные варианты сочетания трубчатых структур бесчисленны. Эту область следует тщательно анализировать во время холецистэктомии, чтобы избежать неосторожного повреждения протоков и артерий. При холецистите эта область весьма часто вовлечена в воспаление, таким образом, препарирование может оказаться сложным и опасным. Тем не менее надлежащая идентификация структур в пределах этой и смежных областей - первостепенный фактор безопасной холецистэктомии.
Печеночно-двенадцатиперстная связка включает общий желчный проток, располагающийся спереди и латерально, собственную печеночную артерию, лежащую спереди и медиально и воротную вену сзади. Кроме того, через эту важную структуру проходят нервы и лимфатические сосуды. Доступ к сальниковой сумке осуществляют позади печеночно-двенадцатиперстной связки через сальниковое отверстие, или отверстие Винслоу. При необходимости доступ к сосудам печени может осуществляться посредством захвата печеночно-двенадцатиперстной связки большим и указательным пальцами с пережатием ее сосудистых структур (прием Прингла), помогает избежать кровотечения из паренхимы печени при травмах или во время резекции. Сжатие печеночно-двенадцатиперстной связки при некоторых обстоятельствах может продолжаться до 1 ч, но в этом случае не исключено ишемическое повреждение печени.
Желтуха - синдром, характеризуемый желтушным окрашиванием кожных покровов, слизистых оболочек и склер, обусловленный повышенным накоплением билирубина в сыворотке крови, а также в других жидкостях и тканях организма.
Механическая желтуха - осложнение патологических процессов, нарушающих отток желчи на различных уровнях желчевыводящих протоков.
ПРИЧИНЫ РАЗВИТИЯ ЖЕЛТУХИ
В течение суток печень выделяет в желчь до 250 мг желчного пигмента - билирубина. Он образуется в клетках ретикулоэндотелиальной системы из высвобождающегося гемоглобина зрелых эритроцитов. Схема нормальных биохимических превращений билирубина представлена на рис. 20-1.
Повышение содержания билирубина в сыворотке крови более 40 мкмоль/л вызывает желтушное окрашивание склер, слизистых оболочек и кожных покровов. Билирубин проникает почти во все жидкости и большую часть тканей организма, вызывая желтое прокрашивание экссудатов и транссудатов, секретов различных желез (поджелудочной, слюнных, потовых и др.). У пациентов с анемией и светлой кожей желтуху обнаруживают раньше, в то время как у смуглых больных она дольше остается незамеченной.
В настоящее время известно множество разновидностей желтухи, различающихся по этиологии, механизмам нарушения пигментного обмена и в связи с этим требующих различных лечебно-диагностических мероприятий (рис. 20-2). В повышении концентрации билирубина играют роль три основные причины.
1. Ускоренный распад эритроцитов с избыточным образованием и накоплением непрямого билирубина в сыворотке крови, когда ферментные системы печени неспособны обеспечить дальнейшее превращение
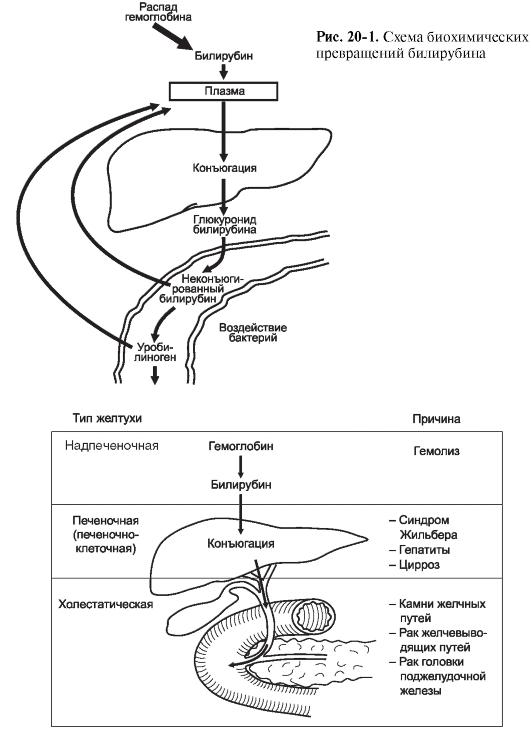
Рис. 20-2. Нарушения пигментного обмена при различных видах желтухи
и выделение избыточного количества пигмента (гемолитическая желтуха). Причиной подобных состояний могут быть интоксикации, отравления, крупные гематомы и др.
2. Поражение печеночных клеток, ведущее к нарушению биохимических превращений билирубина (захвату клетками печени и конъюгации) и проникновению его из крови в желчные капилляры(паренхиматозная желтуха). Такие нарушения развиваются при острых и хронических гепатитах, циррозах печени, гепатозах. Небольшую группу составляют пациенты с различными вариантами наследственно обусловленных нарушений пигментного обмена - так называемыми доброкачественными гипербилирубинемиями (синдромами Жильбера, Криглера-Найяра, Дабина-Джонсона и др.). Как правило, нарушения конъюгации билирубина у этих больных связывают с наследственной недостаточностью ферментов (в частности, глюкуронилтрансферазы). Причиной некоторых форм приобретенной ферментопатии считают использование гепатотоксичных препаратов (парацетамола, экстракта мужского папоротника и др.). Подобные варианты желтухи чаще возникают у лиц молодого возраста, чаще требуют наблюдения без стационарного лечения, однако могут быть причиной диагностических ошибок, обусловливающих неправильную лечебную тактику вплоть до напрасных лапаротомий.
3. Нарушение проходимости желчных путей, ведущее к попаданию билирубина из желчных капилляров в кровеносные и лимфатические сосуды(механическая желтуха).
Механическую желтуху могут вызывать следующие заболевания и состояния.
• Доброкачественные (80%):
- холедохолитиаз;
- стеноз большого сосочка двенадцатиперстной кишки;
- холангит;
- острый папиллит, полипы большого сосочка двенадцатиперстной кишки;
- острый и хронический панкреатит;
- рубцовая стриктура желчевыводящих протоков;
- прочие редкие причины (врожденные аномалии, перихоледохеальный лимфаденит, паразитарные поражения и др.).
• Злокачественные поражения различной локализации (20%):
- рак большого сосочка двенадцатиперстной кишки, поджелудочной железы, желчного пузыря или желчевыводящих протоков;
- первичный и метастатический рак печени.
Синдром механической желтухи следует рассматривать как сложный патофизиологический комплекс, проявляющийся признаками поражения всех органов и систем, преимущественно печени и почек. Несмотря на разнообразие заболеваний, ведущих к развитию механической желтухи, основные патофизиологические звенья синдрома сходны, что позволяет руководствоваться единой лечебно-диагностической тактикой как при доброкачественной, так и при злокачественной его этиологии.
Механизмы развития различных видов желтухи, как правило, сочетаются и редко встречаются в чистом виде. Например, при гемолитической желтухе присоединяется механический компонент в связи со сгущением желчи и обтурацией мелких желчных капилляров. При длительной механической желтухе присоединяется поражение печеночных клеток, и она приобретает некоторые черты желтухи, свойственной гепатиту.
ДИАГНОСТИКА
Диагноз механической желтухи включает два основополагающих момента: подтверждение обтурационного характера желтухи и определение конкретной причины нарушения проходимости желчевыводяших путей.
Решение первой задачи крайне важно, поскольку на догоспитальном этапе возникает до 20% диагностических ошибок, приводящих к госпитализации пациентов в лечебные учреждения, не соответствующие характеру заболевания. Больных с механической желтухой в части случаев ошибочно госпитализируют в инфекционные отделения, несколько реже пациенты с паренхиматозной желтухой первоначально поступают в хирургические стационары. В обоих случаях ошибочная госпитализация приводит к неверной тактике ведения - затягиванию сроков декомпрессии желчных протоков, нарушениям противоэпидемического режима и т.д. Кроме того, следует помнить, что желтое прокрашивание кожи и других тканей организма может происходить и в нормальных условиях при обильном приеме пищи, содержащей красящие вещества, например моркови (каротин), или некоторых лекарственных средств (акрихина).
Механическая желтуха, обусловленная холедохолитиазом, появляется через несколько часов или суток послевыраженного болевого приступа и характеризуется быстрым прогрессированием. Возникновение желтухи сопровождается кожным зудом, вызывающим расчесы, преимущественно на передней брюшной стенке и разгибательных поверхностях конечностей. Для механической желтухи, вызванной опухолью головки поджелудочной железы илибольшого дуоденального сосочка, характерны отсутствие болей и постепенное развитие заболевания. Патогномониченсиндром Курвуазье, характеризуемый пальпируемым увеличенным безболезненным желчным пузырем на фоне желтухи.
Основные клинические проявления, признанные характерными спутниками желтухи, представлены на рис. 20-3. Как правило, выраженность симптомов пропорциональна длительности желтухи.
После оценки клинико-анамнестических и лабораторных данных применяют инструментальные методы исследования. Наибольшее распространение получили следующие способы диагностики:
• УЗИ;
• ЭРХПГ;
• чрескожная чреспеченочная холангиография;
• чреспузырная фистулография (после холецистостомии);
• КТ;
• магнитно-резонансная холангиопанкреатография;
• лапароскопия.
Выбор метода инструментальной диагностики определяется предполагаемой причиной обтурации желчных протоков, возможностью продолжения диагностического исследования в лечебное вмешательство и техническим оснащением лечебного учреждения.
Важную роль в диагностике характера желтухи отводят УЗИ, подтверждающему обтурационный характер заболевания путем выявления дилатации желчных протоков, а в 75% наблюдений позволяющему выявить непосредственную причину механической желтухи (рис. 20-4).
Важнейшие достоинства метода:
• скрининговый характер, неинвазивность, отсутствие осложнений;
• возможность использования при любой степени тяжести состояния пациентов и во время беременности;
• одновременная оценка состояния желчных протоков и других анатомических структур (печени, поджелудочной железы, забрюшинного пространства и т.д.);
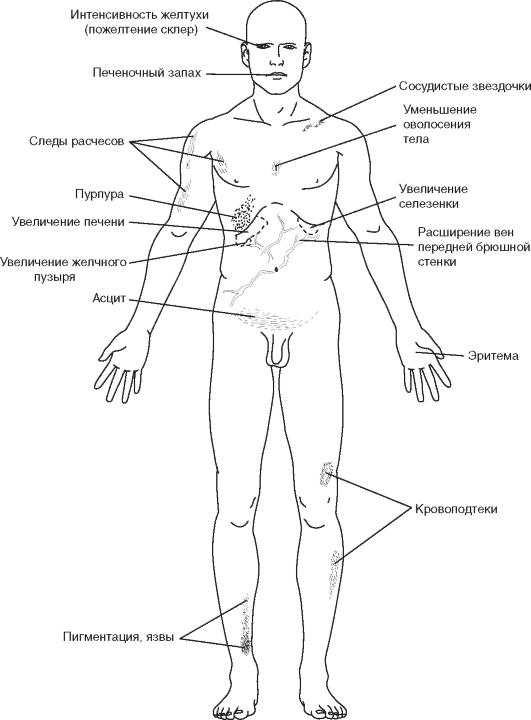
Рис. 20-3. Основные клинические проявления желтухи
• возможность ультразвукового наведения при пункционных методах декомпрессии и биопсии;
• объективный выбор метода декомпрессии желчевыводящих путей.
Несмотря на постоянное совершенствование ультразвуковой диагностики, не всегда с ее помощью удается получить полную информацию о характере патологии желчных путей, достаточную для решения вопроса о методе декомпрессии протоков. Для прогнозирования эффективности вмешательств (в частности, эндоскопической папиллосфинктеротомии) необходимы точные данные о размерах, форме, количестве конкрементов, протяженности и уровне стриктур протоков и других важных деталях.
Наиболее точный способ определения причин механической желтухи - прямое контрастирование желчных путей. Метод выбора - ЭРХПГ (рис. 20-5). Наряду с возможностью контрастирования желчных протоков, метод позволяет визуально оценить состояние желудка и двенадцатиперстной кишки, большого дуоденального сосочка и периампулярной области, а также констатировать факт поступления желчи
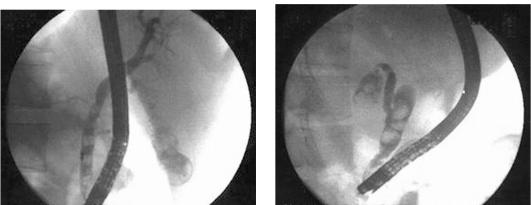
Рис. 20-5. Эндоскопическая ретроградная холангиография при холедохолитиазе
в просвет кишечника. У части больных желтухой возможности эндоскопического ретроградного контрастирования желчных протоков могут быть ограничены рядом обстоятельств, такими как ранее перенесенные операции на желудке, расположение большого дуоденального сосочка в полости крупных дивертикулов, наличие непреодолимого препятствия в устье общего желчного протока (стеноза, вклиненного конкремента, опухоли дистального отдела протока). Подобные трудности встречают приблизительно у 10% больных с обтурационной желтухой.
При неэффективности ретроградного контрастирования желчных протоков используют чрескожную чреспеченочную холангиографию. Для пункции внутрипеченочных желчных протоков применяют специальные тонкие иглы, конструкция которых позволяет избежать свойственных для этого исследования осложнений (крово- и желчеистечения в брюшную полость). Если у больного расширены внутрипеченочные желчные протоки, чрескожная чреспеченочная холангиография позволяет получить информацию об их состоянии в 97% случаев, при отсутствии расширения протоков - в 60% наблюдений.
В части случаев для получения целостного представления о желчевыводящих путях выше и ниже участка сужения (например, при рубцовых или опухолевых стриктурах протоков) целесообразно сочетанное ретро- и антеградное контрастное исследование билиарного тракта. Это позволяет уточнить возможность и характер реконструктивного хирургического вмешательства.
Один из распространенных способов контрастирования билиарного дерева - использование холецистостомы, наложенной прямым (хирургическим) путем либо пункционным под контролем УЗИ или лапароскопии (рис. 20-6). Необходимое условие для подоб-
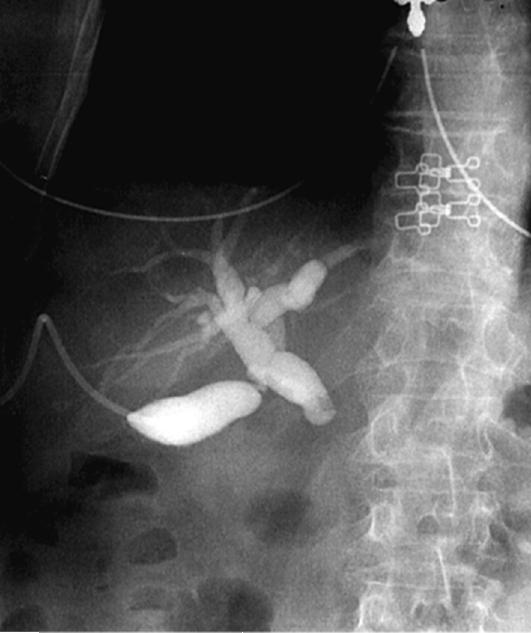
Рис. 20-6. Чрескожная холецистостомия, выполненная под контролем УЗИ. На холецистохолангиограмме определяются дилатация желчных протоков, отсутствие эвакуации контрастного вещества в двенадцатиперстную кишку, обусловленное опухолью головки поджелудочной железы
ного исследования - проходимость пузырного протока. Об этом, как правило, свидетельствует поступающая по дренажу желчь. Чаще всего необходимость в наружном дренировании желчного пузыря возникает при сочетании механической желтухи с острым деструктивным холециститом или при опухолях головки поджелудочной железы (дистального отдела протоков), когда крайне тяжелое состояние больных не позволяет выполнить паллиативное или радикальное вмешательство традиционным хирургическим способом.
Высокую разрешающую способность имеет КТ, позволяющая наряду с выявлением дилатации протоков и причины их обструкции выполнить прицельную биопсию или декомпрессионное вмешательство. В отличие от УЗИ, диагностические возможности метода не снижаются при метеоризме, асците, ожирении.
В последние годы широкое распространение приобретает магнитно-резонансная холангиопанкреатография, обладающая высокой точностью в диагностике причин механической желтухи, особенно в оценке характера и протяженности стриктур желчных путей, а также внутрипротоковых образований. Вместе с тем этот метод лишен пункционнодренажных лечебных возможностей.
Лапароскопию при механической желтухе в настоящее время применяют редко, в основном для подтверждения опухолевого процесса (первичного или метастатического) в гепатодуоденальной области. Цели исследования - определение операбельности злокачественного заболевания и прицельная биопсия.
ЛЕЧЕНИЕ
Основная задача лечебных мероприятий при механической желтухе - ликвидация холестаза и профилактика печеночно-почечной недостаточности. Учитывая высокую летальность при операциях на высоте желтухи, общепринят этапный лечебный подход.
На первом этапе используют комплексную консервативную терапию и малоинвазивные методы, направленные на ликвидацию холестаза. При неразрешающейся или нарастающей желтухе декомпрессионные вмешательства необходимо выполнить в срочном порядке в течение 2-3 сут с момента поступления больного в стационар.
Если малоинвазивные вмешательства не стали окончательными способами лечения, на втором этапе, по мере разрешения желтухи, в более благоприятных обстоятельствах проводят хирургические операции.
Все диагностические мероприятия с первых суток пребывания больного в стационаре выполняют на фоне консервативной терапии, направленной главным образом на профилактику печеночной и почечной недостаточности. При оценке клинического течения и определении тактики ведения пациентов с механической желтухой важнейшим фактором считают степень печеночной недостаточности. По клиниколабораторным данным выделяют три степени ее выраженности
При наличии в момент поступления печеночной недостаточности III степени лечебный комплекс проводят в реанимационном отделении. На фоне диеты (стол № 5а), обогащенной углеводными и белковыми продуктами, проводят массивную инфузионную терапию (переливание глюкозы с инсулином, солевых растворов, гемодеза*, реополиглюкина*, белковых препаратов, кровезаменителей) и форсированный диурез. Консервативная терапия включает также ком-
плексную витаминотерапию и препараты, улучшающие функции печени, - кокарбоксилазу, фосфолипиды.
Назначают также аминокислоты (глутаминовую кислоту и метионин), стимуляторы метаболизма (диоксометилтетрагидропиримидин), анаболические гормоны. Целесообразно назначение стероидных гормонов: преднизолона по 60-120 мг/сут, в тяжелых случаях внутрипеченочного холестаза и холангита - до 1000 мг/сут.
Важный компонент лечения - профилактика эрозий, острых изъязвлений и кровотечений из ЖКТ. Для этого назначают антацидные и обволакивающие слизистую оболочку желудка препараты, ингибиторы протонного насоса.
В случаях тяжелого эндотоксикоза используют методы экстракорпоральной детоксикации (плазмаферез, гемодиализ и др.).
Важнейшей задачей ведения больных с механической желтухой следует считать профилактику острого холангита - инфекционно-воспалительного осложнения обтурации желчных путей. Клиническое течение острого холангита характеризуется тремя основными симптомами: болевым синдромом, ознобом, лихорадкой (триадой Шарко). Замедление тока желчи приводит к быстрому распространению микрофлоры на магистральные и внутрипеченочные желчные ходы, что вызывает тяжелую системную воспалительную реакцию, внутрипеченочные абсцессы, острую гепатоцеребральную и почечную недостаточность. Стремительное развитие генерализованного гнойно-септического процесса обусловлено большой площадью поверхности желчных протоков, прямым билиовенозным шунтом токсинов и бактерий, печеночно-почечной недостаточностью. Эти процессы усугубляются при механической желтухе метаболическими нарушениями, связанными с холемией и ахолией: колонизацией микроорганизмов в кишечнике и их транслокацией в кровоток, токсическим воздействием билирубина, коагулопатией, полиорганными нарушениями и др.
Все это обусловливает высокую летальность при остром холангите (до 30%). В целях предотвращения этого осложнения используют антибиотики цефалоспоринового ряда. При появлении клинико-лабораторных признаков острого холангита декомпрессионные вмешательства и комплексную консервативную терапию проводят в экстренном порядке.
Декомпрессия желчных протоков
Выбор способа декомпрессии желчевыводящих протоков зависит от уровня и характера препятствия для оттока желчи. Арсенал этих мето-
дов достаточно велик и продолжает расширяться. Наибольшее распространение получили следующие мотоды:
• эндоскопическая папиллосфинктеротомия;
• чрескожная чреспеченочная холангиостомия;
• хирургическая холецистостомия;
• пункционная холецистостомия под контролем УЗИ или лапароскопии;
• эндопротезирование желчных протоков;
• интраоперационные (прямые) методы декомпрессии желчных протоков.
Для каждого из методов инструментальной декомпрессии желчных протоков существуют показания и ограничения. Как правило, методы декомпрессии становятся продолжением диагностических процедур, что также следует считать одним из факторов, определяющих целесообразность применения того или иного метода.
Инструментальные малоинвазивные методы декомпрессии желчных путей
Среди малоинвазивных методов разрешения холестаза важнейшее место занимает эндоскопическая папиллосфинктеротомия - метод выбора устранения желтухи, обусловленной холедохолитиазом. Показания к выполнению метода и прогнозирование его результативности основываются на точном представлении о характере препятствия для желчеоттока (размерах конкрементов, их расположении и количестве, состоянии устья общего желчного протока и т.д.). Если размеры конкрементов не превышают диаметра общего печеночного протока, их можно удалить с помощью этой эндоскопической манипуляции и тем самым восстановить пассаж желчи в двенадцатиперстную кишку. Подобную ситуацию встречают более чем в 90% наблюдений, что обеспечивает успешную санацию желчных протоков с помощью эндоскопической папиллосфинктеротомии у большинства пациентов.
В случаях, когда размеры конкрементов велики и превышают диаметр просвета нижележащих отделов желчных путей, не происходит спонтанного отхождения конкрементов после эндоскопической папиллосфинктеротомии. Тогда необходимо их насильственное извлечение с предварительной литотрипсией (рис. 20-7). В ряде случаев плотная структура конкремента делает подобное вмешательство весьма травматичным, что создает опасность развития серьезных осложнений (кровотечения, панкреонекроза, ретродуоденальной перфорации). Именно поэтому при наличии крупных фиксированных конкрементов в маги-
стральных желчных протоках, которые можно выявить при УЗИ, не следует прибегать к ретроградному контрастированию билиарного дерева и попыткам извлечения камней путем эндоскопической папиллосфинктеротомии. В подобной ситуации необходимо предпринять билиодуоденальное стентирование (катетер проводят выше уровня конкремента) или антеградное чрескожное чреспеченочное дренирование. В последующем, по мере разрешения желтухи, следует выполнить традиционное хирургическое вмешательство.
При так называемом высоком блоке желчных протоков (опухоль, стриктура, реже конкремент) наряду с ретроградными эндоскопическими методами декомпрессии можно использовать антеградное чрескожное чреспеченочное дренирование желчных протоков. В случаях, когда стент удается провести ниже места препятствия в двенадцатиперстную кишку, осуществляют двойное наружно-внутреннее дренирование желчных путей (рис. 20-8).
Примерно в половине наблюдений при доброкачественной природе обтурационной желтухи малоинвазивные инструментальные

Рис. 20-7. Схема механической литотрипсии при холедохолитиазе с помощью специального инструмента, проведенного в общий желчный проток после эндоскопической папиллосфинктеротомии: а) большой камень захвачен корзинкой литотриптера; б) при затягивании корзинки конкремент разрушается на фрагменты, которые в дальнейшем удаляются или спонтанно мигрируют в двенадцатиперстную кишку
В случаях, когда размеры конкрементов велики и превышают диаметр просвета нижележащих отделов желчных путей, не происходит спонтанного отхождения конкрементов после эндоскопической папиллосфинктеротомии. Тогда необходимо их насильственное извлечение с предварительной литотрипсией (рис. 20-7). В ряде случаев плотная структура конкремента делает подобное вмешательство весьма травматичным, что создает опасность развития серьезных осложнений (кровотечения, панкреонекроза, ретродуоденальной перфорации). Именно поэтому при наличии крупных фиксированных конкрементов в маги-
стральных желчных протоках, которые можно выявить при УЗИ, не следует прибегать к ретроградному контрастированию билиарного дерева и попыткам извлечения камней путем эндоскопической папиллосфинктеротомии. В подобной ситуации необходимо предпринять билиодуоденальное стентирование (катетер проводят выше уровня конкремента) или антеградное чрескожное чреспеченочное дренирование. В последующем, по мере разрешения желтухи, следует выполнить традиционное хирургическое вмешательство.
При так называемом высоком блоке желчных протоков (опухоль, стриктура, реже конкремент) наряду с ретроградными эндоскопическими методами декомпрессии можно использовать антеградное чрескожное чреспеченочное дренирование желчных протоков. В случаях, когда стент удается провести ниже места препятствия в двенадцатиперстную кишку, осуществляют двойное наружно-внутреннее дренирование желчных путей (рис. 20-8).
Примерно в половине наблюдений при доброкачественной природе обтурационной желтухи малоинвазивные инструментальные
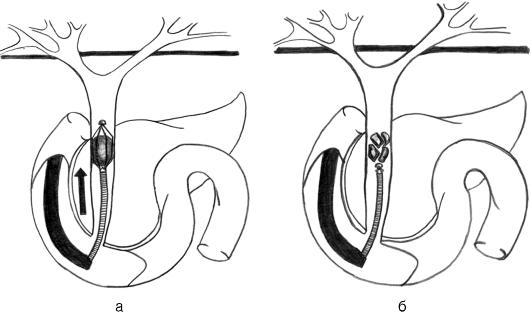
Рис. 20-7. Схема механической литотрипсии при холедохолитиазе с помощью специального инструмента, проведенного в общий желчный проток после эндоскопической папиллосфинктеротомии: а) большой камень захвачен корзинкой литотриптера; б) при затягивании корзинки конкремент разрушается на фрагменты, которые в дальнейшем удаляются или спонтанно мигрируют в двенадцатиперстную кишку
методы позволяют устранить желтуху и ликвидировать патологию, обусловившую ее появление. Это исключает необходимость традиционного хирургического вмешательства. В остальных случаях после инструментальной декомпрессии желчных протоков по мере разрешения механической желтухи и восстановления функций важнейших органов и систем выполняют прямые операции. Сроки хирургических вмешательств зависят от исходной тяжести печеночной недостаточности и составляют 1-4 нед. Как правило, одним из основных ориентиров, свидетельствующих об очевидной тенденции к разрешению холестаза и возможности выполнения хирургического вмешательства, бывает снижение концентрации общего билирубина менее 50 мкмоль/л. Наряду с этим нормализуются и другие параметры, характеризующие функциональное состояние организма.
Прямые хирургические вмешательства на желчных путях
Выбор метода операции основывают на результатах дооперационной диагностики и данных интраоперационной ревизии желчных протоков с учетом общего состояния больного.
Доступ. Наибольшее распространение при операциях на желчных протоках получили косые разрезы в правом подреберье (Кохера, Федорова). Реже применяют верхнесрединный доступ. При необходимости обширных реконструктивных операций используют двухподреберный доступ. Вмешательства на желчных протоках у больных с ЖКБ обычно выполняют после холецистэктомии (см. главу 15).
Идеальная холедохотомия. После удаления единичного конкремента посредством холедохотомии при отсутствии признаков холангита и хорошей проходимости дистального отдела общего желчного протока отверстие в нем ушивают атравматическим монофиламентным шовным материалом. Это позволяет снизить вероятность формирования послеоперационного лигатурного холедохолитиаза.
Наружное дренирование общего желчного протока - наиболее частый способ завершения холедохотомии. Необходимость во временном на-
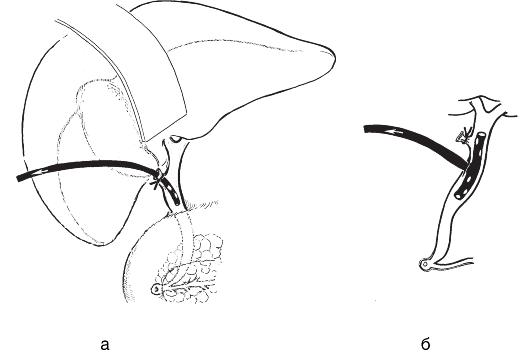
Рис. 20-9. Наружное дренирование общего желчного протока: а - через культю пузырного протока; б - Т-образный дренаж Кера, вводимый через холедохотомию
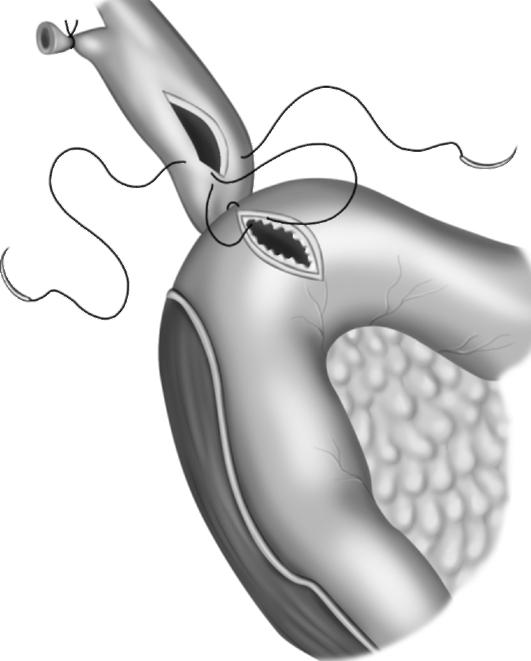
Рис. 20-10. Холедоходуоденостомия (схема операции)
ружном отведении желчи возникает при холангите, панкреатите, папиллите или других обратимых патологических состояниях. Наружное дренирование протоков (рис. 20-9) проводят Т-образным дренажем (по Керу) или через культю пузырного протока (по Холстеду-Пиковскому).
Холедоходуоденостомию (рис. 20-10) илихоледохоэнтеростомию применяют при необратимых препятствиях в дистальном отделе общего желчного протока, которые невозможно устранить с помощью эндоскопической папиллосфинктеротомии (протяженном рубцовом стенозе, индуративном панкреатите, неблагоприятном расположении околососочковых дивертикулов и т.д.).
При высоких рубцовых стриктурах желчных протоков выполняют сложные реконструктивные операции, направленные на восстановление оттока желчи. Среди них наибольшее распространение получили билиодигестивные соустья на различных уровнях желчных протоков с петлей тонкой кишки, выключенной по Ру (рис. 20-11).
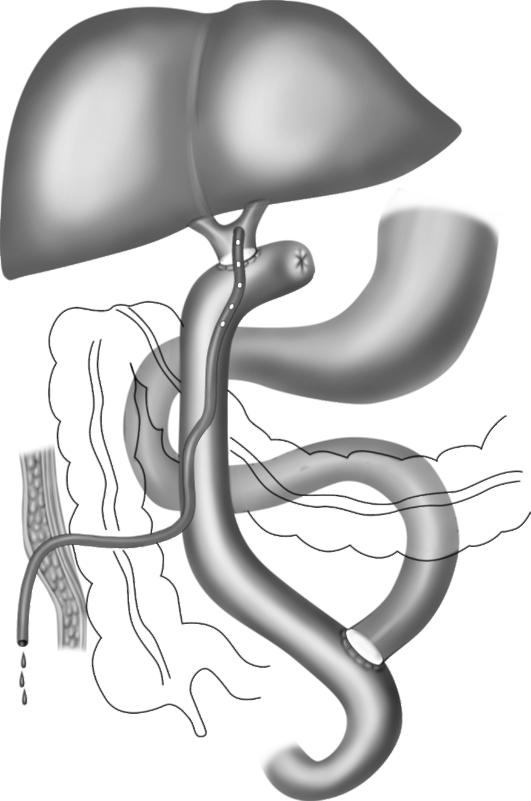
Рис. 20-11. Схема реконструктивной операции на желчных путях. Гепатикоеюностомия с использованием петли тонкой кишки, выключенной по Ру, дополнена наружным дренированием желчных протоков
Операции при желтухе опухолевой природы
Наиболее тяжелую группу составляют больные с обтурацией желчевыводящих путей опухолевого происхождения. После ликвидации желтухи малоинвазивным путем выполняют радикальное или паллиативное хирургическое вмешательство. Возможность выполнения радикальных операций (см. главу 17) у этих пациентов отмечают не более чем в 15-20% случаев.
Паллиативные операции направлены на создание обходных билиодигестивных соустьев. В случае рака головки поджелудочной железы (наиболее частой опухолевой причины механической желтухи) операцией выбора считают холецистоэнтеростомию по Микуличу (рис. 20-12). Условие успешной декомпрессии желчных путей при этой операции - проходимость пузырного протока.
При других локализациях опухоли формируют билиодигестивные соустья либо применяют один из способов эндопротезирования: антеградный чрескожный чреспеченочный или ретроградный эндоскопический. В последние годы методы эндопротезирования желчных протоков расценивают как предпочтительные паллиативные вмешательства при опухолевых поражениях. Это обусловлено их меньшей

Рис. 20-12. Холецистоэнтеростомия с межкишечным соустьем
травматичностью и сходной продолжительностью жизни по сравнению с результатами обходных билиодигестивных анастомозов. Наибольшее распространение нашли саморасширяющиеся металлические сетчатые стенты с памятью формы или размещаемые в желчные протоки с помощью баллонных дилататоров (рис. 20-13).
ПРОГНОЗ
Летальность при механической желтухе зависит от причины обтурации желчных протоков, длительности заболевания и тяжести состояния больных. Современные технические средства позволяют более чем в 90% наблюдений устранить холестаз малоинвазивным путем и оперировать больных, если это необходимо, в благоприятных условиях - после разрешения желтухи. При соблюдении подобного этапного подхода летальность при доброкачественной природе обтурации желчных путей не превышает 5%.
Наиболее сложную группу составляют больные, у которых с помощью инструментальных методов не удается устранить билиарную гипертензию, и прямое хирургическое вмешательство приходится выполнять на высоте желтухи. В таких ситуациях проводят интенсивную подготовку больных в течение суток в условиях отделения реанимации, направленную главным образом на снижение интоксикации и профилактику печеночно-почечной недостаточности. После кратковременной подготовки выполняют минимальное по объему хирургическое вмешательство, направленное лишь на восстановление оттока желчи. Вынужденные операции на фоне нарастающей механической желтухи, холангита, печеночной недостаточности представляют наибольшую опасность и сопровождаются высокой летальностью.
Острый панкреатит - острое асептическое воспаление поджелудочной железы, основу которого составляют процессы аутоферментативного некробиоза и некроза органа. Панкреатит относят к наиболее частым хирургическим заболеваниям органов брюшной полости. В России, странах Западной Европы и Северной Америки заболеваемость острым панкреатитом варьирует от 40 до 80 человек на 100 000 населения. Некротические формы поражения поджелудочной железы составляют 25-30%, летальность при их развитии достигает 40%.
АНАТОМИЯ И ФИЗИОЛОГИЯ
Анатомия
Анатомия, кровоснабжение и иннервация поджелудочной железы изложены в разделе «Приложения» на портале «Консультант студента». Вместе с тем необходимо отметить ряд особенностей анатомии панкреатодуоденобилиарной зоны, определяющих этиологию, патогенез и патоморфологию острого панкреатита.
• Во-первых, в фатеров сосочек двенадцатиперстной кишки впадает главный панкреатический (вирсунгов) проток после слияния с общим желчным протоком, что объясняет частое развитие острого билиарного панкреатита и сопутствующей механической желтухи при ущемлении конкремента в терминальном отделе общего желчного протока.
• Во-вторых, поджелудочная железа окружена рыхлой жировой клетчаткой, образующей парапанкреальное клетчаточное пространство, анатомически связанное с передней паранефральной, околоободочной клетчаткой (с обеих сторон) и левым поддиафрагмальным пространством. Эти топографо-анатомические обстоятельства объясняют высокую частоту развития обширной
некротической флегмоны, включающей парапанкреальную, околотолстокишечные и паранефральные области забрюшинной клетчатки при распространенном панкреонекрозе. • В-третьих, к переднему краю поджелудочной железы прикреплен корень брыжейки поперечно-ободочной кишки, что обусловливает ее воспалительно-некротические изменения и формирование стойкого пареза кишки при деструктивном панкреатите. Для некроза головки поджелудочной железы наиболее типично поражение жировой околоободочной клетчатки восходящего отдела толстой кишки и переднего паранефрия справа, тогда как деструкция тела и хвоста органа чаще всего сопровождается развитием некротической флегмоны в левых поддиафрагмальной, околотолстокишечной и паранефральной областях забрюшинного пространства.
Физиология
Поджелудочная железа - важнейший экзокринный орган пищеварения и эндокринный орган регуляции углеводного обмена.
Экзокринная функция
Поджелудочная железа секретирует панкреатический сок, содержащий ферменты и бикарбонаты. За сутки поджелудочная железа выделяет 1,5-3 л панкреатического сока с основной реакцией среды (с рН = 8,4-8,8), содержащего ферменты (протеазы, липазы, амилазу). Панкреациты выделяют протеазы (трипсиноген, химотрипсиноген, прокарбоксипептидазу, эластазу), а также фосфолипазы А2и В в неактивном состоянии. В физиологических условиях их активация происходит при поступлении в двенадцатиперстную кишку под воздействием энтерокиназы. Образовавшийсятрипсинаутокаталитически активирует дальнейшие порции трипсиногена. Амилаза, липаза, рибонуклеаза и дезоксирибонуклеаза активируются по мере поступления секрета в протоковую систему. Функции ферментов строго специфичны. Трипсин и химотрипсин расщепляют до аминокислот пищевой белок, α-амилаза катализирует расщепление полисахаридов, нуклеазы - нуклеиновые кислоты, эластаза отщепляет от эластина пептид с переводом его в растворимый эластин для дальнейшего его расщепления протеазами, липаза осуществляет гидролиз несвязанных нейтральных жиров на жирные кислоты и глицерин. Поскольку амилаза, кроме поджелудочной железы, образуется в слюнных железах, печени и легочных
альвеолах, нормальная ее активность в крови определяется суммой синтезируемого во всем организме фермента.
В физиологических условиях присутствие внутриклеточных (секреторного ингибитора трипсина) и плазменных (а-антитрипсина и а2-макроглобулина) ингибиторов протеаз обеспечивает основные механизмы биологической защиты организма от разрушительного действия ферментов. При деструктивном панкреатите протео- и липолитические ферменты поджелудочной железы, лишенные естественных факторов физиологической защиты от аутоактивации, оказывают мощное разрушительное действие не только на ткани и структуры близлежащих с поджелудочной железой органов, но и (поступая в кровеносное русло) на системы экстраабдоминальной локализации.
Оптимальную среду для работы ферментов создают бикарбонаты, секретируемые в поджелудочной железе. Ионы кальция панкреатического сока регулируют внутриклеточный синтез ферментов и их поступление в протоки. Экзокринная функция поджелудочной железы регулируется не только парасимпатической системой, но и гуморальной функцией энтерогормонов.
Эндокринная функция
Эндокринная функция поджелудочной железы реализуется в островках Лангерганса, преимущественно локализованных в хвостовой части органа. Инсулин (секретируется β-клетками), глюкагонα-клетками) и липокаин регулируют функции углеводного и тканевого обмена. Гастрин, панкреатический полипептид и соматостатин (секретируются D-клетками островков Лангерганса) угнетают секрецию ферментов поджелудочной железы, регулируют моторику желудка и тонкой кишки.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основной этиологический фактор развития острого панкреатита - заболевания внепеченочных желчных путей, на их долю приходится 45% наблюдений. Анатомическая и функциональная общность панкреатобилиарной системы обусловливает частое развитие острого панкреатита при ЖКБ, холедохолитиазе, стриктуре, спазме или воспалении большого дуоденального сосочка, дискинезии желчных путей различной природы. В этих условиях нарушается отток панкреатического секрета по внепеченочным желчным путям и протоковой системе поджелудочной железы, развивается панкреатобилиарный
или дуоденопанкреатический рефлюкс, а также внутрипротоковая гипертензия.
Второй по частоте предпосылкой развития острого панкреатита бывает хронический алкоголизм, а также алкогольный эксцесс или прием суррогатов алкоголя. Подобную причину заболевания выявляют в среднем у 35% больных. Эти факторы ведут к нарушению дренажной функции панкреатических и желчных протоков, поскольку стимулированная алкоголем секреция приводит к увеличению вязкости панкреатического секрета, повышению внутрипротокового давления.
Повреждения поджелудочной железы вследствие тупой травмы живота, хирургического вмешательства либо эндоскопической ретроградной панкреатохолангиографии и папиллотомии также способны вызвать развитие острого панкреатита.
При заболеваниях двенадцатиперстной кишки (пенетрации язвы в головку поджелудочной железы, дуоденостазе, дуоденальных дивертикулах, дуодените с папиллитом) нарушение эвакуации из кишки, повышение внутриполостного давления, дискинезия сфинктерного аппарата приводят к формированию дуоденопанкреатического рефлюкса и внутрипротоковой гипертензии с последующим возникновением острого панкреатита.
С нарушениями нейрогуморальных и висцеральных взаимоотношений, системного метаболизма связано развитие острого панкреатита при гиперлипидемии, сахарном диабете, вирусном гепатите, СПИДе, васкулитах различной этиологии, заболеваниях печени, паращитовидных желез, различных видах шока. Среди широкого спектра химических соединений, способных стать причиной острого панкреатита, следует отметить следующие лекарственные препараты: фуросемид, индометацин, салицилаты, эритромицин, тетрациклин и некоторые другие антибиотики.
Основу патогенеза острого панкреатита составляют процессы местного и системного воздействия панкреатических ферментов и цитокинов различной природы.
Комбинация нескольких пусковых факторов в рамках полиэтиологичности острого панкреатита приводит к повреждению ацинарной клетки. При этом происходит слияние зимогенных гранул и лизосомальных гидролаз, следствием чего становится активация проферментов с последующим выходом протеаз в интерстиций поджелудочной железы. В результате происходит ее аутокаталитическое переваривание. Активация трипсиногена и переход его в трипсин- мощный активатор всех
остальных проэнзимов с формированием каскада тяжелых патобиохимических реакций.
Активированные ферменты поджелудочной железы выступают в качестве первичных факторов агрессии, оказывают местное действие, а также поступают в забрюшинное пространство, брюшную полость, по воротной вене - в печень, по лимфатическим коллекторам - в системный кровоток. Фосфолипаза А2разрушает мембраны клеток, липаза гидролизует внутриклеточные триглицериды до жирных кислот, которые, соединяясь с ионами кальция, образуют элементы структуры жирового (липолитического) некроза в поджелудочной железе, клетчатке забрюшинного пространства и на брюшине.Трипсини химотрипсин осуществляют протеолиз белков тканей, эластаза разрушает стенку сосудов и межтканевые соединительнотканные структуры, что приводит к геморрагическому (протеолитическому) некрозу. Формируемые очаги некробиоза и некроза с перифокальной демаркационной зоной воспаления в поджелудочной железе и забрюшинной клетчатке первично асептичны.
Важное звено патогенеза острого панкреатита - активация трипсином калликреин-кининовой системы с образованием вторичных факторов агрессии - брадикинина, гистамина, серотонина, что сопровождается увеличением сосудистой проницаемости, нарушениями микроциркуляции, формированием отека в зоне поджелудочной железы и забрюшинном пространстве, повышенной экссудацией в брюшную полость.
К факторам агрессии третьего порядка, участвующим в развитии местной и системной воспалительной реакции, сердечной и дыхательной недостаточности, нарушений микроциркуляции и системной гемодинамики, относят синтез мононуклеарными клетками, макрофагами и нейтрофилами различных медиаторов воспаления (цитокинов): интерлейкинов-1, -6, -8 и -10, фактора некроза опухоли, фактора активации тромбоцитов, непанкреатической формы фосфолипазы А2, простагландинов, тромбоксана, лейкотриенов. В ранние сроки некротического панкреатита концентрация всех медиаторов воспаления резко увеличивается в поджелудочной железе, печени, легких, селезенке и системном кровотоке, а их дисбаланс определяет механизмы развития локальной, органной и системной воспалительных реакций и полиорганной недостаточности.
Ферменты, цитокины и метаболиты различной природы, образуемые в поджелудочной железе, беспрепятственно поступают в воротную вену и/или по грудному лимфатическому протоку в системный
кровоток с развитием панкреатогенной токсинемии. Первыми органами-мишенями на пути их транслокации из забрюшинного пространства становятся печень, легкие, сердце, мозг и почки. Итогом мощного цитотоксического повреждения этих органов в ранние сроки заболевания бывают возникновение выраженных расстройств их функций и развитие панкреатогенного шока.
В патогенезе системных нарушений еще до развития гнойно-септических осложнений важную роль играет токсинемия бактериальной природы и, прежде всего, липополисахарид клеточной стенки грамотрицательных бактерий. При остром панкреатите транслокация эндогенной микрофлоры и эндотоксина грамотрицательных бактерий кишечника происходит в условиях функциональной несостоятельности барьерной функции ЖКТ, ретикулоэндотелиальной системы печени и легких. Транслокация эндогенной микрофлоры из ЖКТ в ткани поджелудочной железы и забрюшинного пространства - ведущее звено патогенеза гнойно-септических осложнений деструктивного панкреатита. Она составляет своеобразное связующее звено между начальной (ранней, доинфекционной) и последующей (поздней, инфекционной) фазами острого панкреатита.
В соответствии с эволюцией заболевания в патогенезе острого панкреатита выделяют две основные фазы.
• Первая фаза обусловлена формированием системной воспалительной реакции в течение первых суток от начала заболевания, когда аутолиз, некробиоз и некроз поджелудочной железы и забрюшинной клетчатки носят абактериальный характер. В эти сроки заболевания в зависимости от степени выраженности патоморфологических нарушений возможно формирование интерстициального (отечного) панкреатита или стерильного панкреонекроза.
• При прогрессировании заболевания закономерен переход патологического процесса во вторую фазу острого панкреатита, которая характеризуется развитием поздних постнекротических осложнений, связанных с инфицированием зон некроза различной локализации на 2-3-й неделе заболевания. В этих условиях происходят реактивация и репродукция аналогичных первой фазе воспалительных медиаторов. Триггером процесса становятся токсины микроорганизмов, колонизирующих зоны некроза.
Существует прямая зависимость между степенью распространенности некротического поражения и вероятностью инфицирования. При-
соединение инфекции в условиях обширного некротического процесса сопровождается развитием распространенного инфицированного панкреонекроза, тогда как при ограниченном некрозе формируется абсцесс.
ПАТОМОРФОЛОГИЯ
Основу патоморфологических изменений при остром панкреатите составляет последовательная или синхронная в различных анатомических зонах смена процессов воспаления, некробиоза, некроза и инфицирования. Чаще возникают комбинированные поражения отдельных частей поджелудочной железы. Варианты патоморфологии варьируют от микроскопически выявленных очагов стеатонекроза и интерстициального отека поджелудочной железы до визуально определяемых областей жирового и/или геморрагического панкреонекроза с вовлечением клетчатки забрюшинного пространства и органов брюшной полости.
Отечный (интерстициальный) панкреатит морфологически и гистологически характеризуется отеком ткани поджелудочной железы, ее уплотнением, встречаются отдельные микроучастки жирового некроза.
Жировой панкреонекроз характеризуется увеличением поджелудочной железы, резким отеком с исчезновением дольчатости ее структуры, наличием очагов и зон стеатонекроза (стеариновых пятен), а также участков геморрагии в поджелудочной железе и забрюшинной клетчатке. В брюшной полости выявляют серозный прозрачный экссудат. При микроскопии отмечают чередование участков отека, кровоизлияний и жировых некрозов, лейкоцитарную инфильтрацию, сосудистые микротромбозы.
Геморрагический панкреонекроз имеет наиболее яркие проявления. В паренхиме поджелудочной железы и окружающих ее тканях определяют обширные участки кровоизлияний, геморрагической имбибиции, зоны некроза черного и серого цветов. Эти изменения сочетаются с наличием белых, стеариновых пятен жирового некроза. В брюшной полости содержится большое количество геморрагического выпота с высокой активностью ферментов и токсических субстанций.
В асептическую фазу заболевания некротический процесс в поджелудочной железе и различных отделах забрюшинного пространства может носить распространенный и ограниченный характер.
• При распространенном панкреонекрозе зоны некроза локализованы более чем в одном отделе поджелудочной железы с обязательным вовлечением в патологический процесс клетчатки,
окружающей поджелудочную железу, а также клетчатки других областей забрюшинного пространства.
• При ограниченном панкреонекрозе в поджелудочной железе мелкие или крупные очаги некроза расположены в пределах какого-либо одного отдела поджелудочной железы и окружающей ее клетчатки.
Среди патоморфологических форм панкреатогенной инфекции выделяют следующие:
• инфицированный панкреонекроз;
• панкреатогенный абсцесс;
• инфицированную псевдокисту.
КЛАССИФИКАЦИЯ
• По форме заболевания:
- отечный (интерстициальный) панкреатит;
- стерильный панкреонекроз:
V жировой;
V геморрагический;
Vсмешанный;
- инфицированный панкреонекроз.
• По распространенности:
- ограниченный (один из отделов железы);
- распространенный (два или три отдела железы + клетчаточные пространства).
• По развитию осложнений:
- местные, возникающие в асептическую фазу панкреонекроза:
Vпарапанкреатический инфильтрат;
Vнекротическая флегмона забрюшинной клетчатки;
Vферментативный (абактериальный) перитонит;
Vпсевдокиста (позднее осложнение);
- местные, возникающие в фазу инфицированного панкреонекроза:
V гнойно-некротическая флегмона забрюшинной клетчатки;
Vабсцессы забрюшинных клетчаточных пространств и брюшной полости;
Vпанкреатические и желудочно-кишечные свищи (внутренние и наружные);
Vаррозивные кровотечения (внутрибрюшные и в ЖКТ);
- системные (внебрюшные):
Vпанкреатогенный (ферментативный) шок;
Vсептический шок;
Vполиорганная недостаточность.
КЛИНИЧЕСКАЯ КАРТИНА
Основные симптомы острого панкреатита - боль, рвота и вздутие живота (триада Мондора).
Боль появляется обычно внезапно, чаще в вечернее или ночное время вскоре после погрешности в диете (например, после употребления жареных или жирных блюд, алкоголя). Как правило, она носит интенсивный характер, без светлых промежутков. Наиболее типичная ее локализация - эпигастральная область, что соответствует анатомическому положению поджелудочной железы. Эпицентр боли ощущается по средней линии, но может располагаться преимущественно справа или слева от срединной линии и даже распространяться по всему животу. Обычно боли иррадиируют вдоль реберного края по направлению к спине, иногда в поясницу, грудь, плечи, левый реберно-позвоночный угол. Часто они носят опоясывающий характер и создают впечатление затягивающегося пояса или обруча. При преимущественном поражении головки поджелудочной железы локализация боли может напоминать острый холецистит, при поражении ее тела - заболевания желудка, а при поражении хвоста - заболевания сердца или левой почки. В ряде ситуаций резкий болевой синдром может приводить к коллапсу и шоку: профузному потоотделению, снижению АД, тахикардии с ослаблением пульса.
Практически одновременно с болями возникает многократная, мучительная и не приносящая облегчения рвота. Ее провоцирует прием пищи или воды. Несмотря на многократный характер рвоты, рвотные массы никогда не имеют застойного (фекалоидного) характера.
Температура тела в начале заболевания чаще носит субфебрильный характер, а при развитии инфицированных форм панкреатита возникает гектическая лихорадка. Характерно поведение пациентов: они беспокойны, просят обезболивающих средств. Важным и ранним диагностическим признаком заболевания считают цианоз лица и конечностей. Цианоз в виде фиолетовых пятен на лице известен как симптом Мондора, пятна цианоза на боковых стенках живота - симптом Грея Тернера, цианоз околопупочной области - симптом Грюнвальда. В поздние сроки заболевания цианоз лица может смениться
яркой гиперемией кожных покровов, особенно лица (калликреиновое лицо). В основе перечисленных признаков лежат быстропрогрессирующие гемодинамические и микроциркуляторные расстройства, гиперферментемия.
При осмотре живота отмечают его вздутие, преимущественно в верхних отделах. В тяжелых случаях живот равномерно вздут, резко чувствителен даже при поверхностной пальпации. При глубокой пальпации боли резко усиливаются, порой носят нестерпимый характер. Пальпация поясничной области, особенно в левом реберно-позвоночном углу, резко болезненна (симптом Мейо-Робсона). В зоне повышенной чувствительности, обнаруживаемой при поверхностной пальпации, выявляют ригидность мышц передней брюшной стенки. Как правило, мышечное напряжение свидетельствует о наличии выпота, богатого ферментами, и явлениях панкреатогенного перитонита. Весьма часто наблюдают поперечную болезненную резистентность передней брюшной стенки в проекции поджелудочной железы (симптом Керте). Один из признаков острого панкреатита - невозможность определения пульсации брюшного отдела аорты вследствие увеличения в размерах поджелудочной железы и отека забрюшинной клетчатки (симптом Воскресенского). В случаях, когда процесс локализуется в сальниковой сумке, мышечное напряжение выявляют преимущественно в надчревной зоне; когда процесс выходит за ее пределы (на клетчатку забрюшинного пространства и малого таза, а также на брюшину), появляются выраженное мышечное напряжение и положительный симптом Щеткина-Блюмберга.
Необходимо помнить, что при локализации некрозов в хвостовой части поджелудочной железы симптомы раздражения брюшины могут быть слабовыраженными, что связано с преимущественно забрюшинной локализацией процесса и отсутствием явлений перитонита. Для поражения головки типично быстрое развитие желтухи и гастродуоденального пареза. При тяжелых формах острого панкреатита можно обнаружить притупление в отлогих местах живота, свидетельствующее о наличии выпота в брюшной полости. При аускультации живота выявляют ослабление или отсутствие кишечных шумов вследствие пареза
ЖКТ.
Многообразие клинических проявлений характерно для различных форм некротического панкреатита и его осложнений.
• Парапанкреатический инфильтрат (оментобурсит) - один из промежуточных вариантов эволюции патоморфологического процес-
са в забрюшинной клетчатке. Клиническая картина представлена длительным болевым синдромом, повышенной температурой тела (37,5-38,0 °С), пальпируемым в верхних отделах брюшной полости болезненным инфильтратом, явлениями гастродуоденальной динамической непроходимости.
• Некротическая флегмона забрюшинной клетчатки проявляется выраженной системной воспалительной реакцией, появлением перитонеальных симптомов, стойким парезом кишечника, панкреатогенным или септическим шоком и полиорганной недостаточностью.
• Инфицированный панкреонекроз, имеющий в большинстве наблюдений распространенный характер, обычно формируется на 1-2-й неделе заболевания. Для него характерны гектическая температура тела, озноб, артериальная гипотензия и полиорганные нарушения.
• Панкреатогенный абсцесс (абсцесс поджелудочной железы, сальниковой сумки, забрюшинной клетчатки) - типичное позднее осложнение ограниченного панкреонекроза, формирующееся на 3-4-й неделе заболевания и позже. Появляются гектическая лихорадка, озноб, пальпируемый болезненный инфильтрат, не имеющий тенденции к уменьшению.
• Псевдокиста характеризуется длительным болевым синдромом в эпигастральной области, симптомами дуоденальной непроходимости и появлением в верхних отделах живота объемного, округлого пальпируемого плотноэластического образования.
ДИАГНОСТИКА
Лабораторные исследования
В клинической практике наиболее распространено определение активности панкреатических ферментов в крови - α-амилазы и липазы. Увеличение сывороточной активности общей и панкреатической амилазы в 4 раза и липазы в 2 раза по отношению к верхней границе нормы свидетельствует о панкреостазе, что в совокупности с клиническими симптомами заболевания подтверждает диагноз острого панкреатита. Максимальные значения активности сывороточной амилазы наблюдают в течение первых 2 сут от начала заболевания. В более поздние сроки определение активности липазы в крови - более значимый диагности-
ческий тест, поскольку ее активность в крови больного с острым панкреатитом сохраняется длительное время.
Традиционно в клинической практике для диагностики острого панкреатита используют определение активности амилазы в моче, поскольку при высокой концентрации в крови она экскретируется почками. В качестве дополнительного теста проводят определение активности амилазы в перитонеальном экссудате, полученном во время лапароскопии (лапароцентеза). При использовании метода Вольгемута (определении суммарной амилолитической активности мочи; норма - 16-64 ЕД) можно обнаружить различное повышение активности - от 128 до 1024 ЕД и более.
Среди других биохимических маркеров, характеризующих тяжесть острого панкреатита, перспективно определение каталитической активности фосфолипазы А2, трипсин-активированных пептидов, интерлейкинов-6 и -8, TNF и эластазы нейтрофилов.
В пользу инфицированного панкреонекроза свидетельствует увеличение количества лейкоцитов крови в динамике наблюдения и лечения. Чаще всего регистрируют лейкоцитоз 12-15х109/л, но при обширном панкреонекрозе, особенно при развитии септических осложнений, возможен значительный лейкоцитоз с увеличением расчетного показателя лейкоцитарного индекса интоксикации. Гемоконцентрация наиболее характерна для деструктивных форм острого панкреатита: гематокрит более 47% на момент госпитализации больного в стационар и отсутствие его снижения в течение 24 ч интенсивной терапии. Стойкая гипергликемия свидетельствует в пользу обширного некроза поджелудочной железы, а ее содержание более 6,9 ммоль/л - неблагоприятный прогностический фактор. При билиарном панкреатите вследствие холедохолитиаза, а также при развитии преимущественного поражения головки поджелудочной железы характерно формирование синдрома холестаза, что выражается в гипербилирубинемии с преобладанием прямой (связанной) фракции билирубина, высокой активности аспартатаминотрасферазы и щелочной фосфатазы.
Дополнительный лабораторный метод, используемый в комплексе диагностической программы у больных с острым панкреатитом, - определение в крови концентрации С-реактивного белка и прокальцитонина. Содержание С-реактивного белка более 120 мг/л в крови больного свидетельствует в пользу некротического поражения поджелудочной железы, тогда как увеличение его концентрации в ди-
намике заболевания более чем на 30% исходного уровня в совокупности с другими клинико-лабораторными данными достоверно подтверждает развитие панкреатогенной инфекции. Исследования последних лет показали, что увеличение концентрации прокальцитонина (предшественника кальцитонина) в крови более 1,8 нг/мл в двух последовательных исследованиях - важный лабораторный маркер бактериального инфицирования очагов некротической деструкции.
Инструментальные исследования
Для диагностики острого панкреатита и его разнообразных форм используют комплекс инструментальных методов: УЗИ, лапароскопию, КТ, результаты чрескожных пункций зон некроза различной локализации под контролем УЗИ и КТ, эндоскопическую ретроградную панкреатохолангиографию. На основании результатов этих исследований в динамике заболевания и лечения четко верифицируют клинико-морфологическую форму острого панкреатита.
Ультразвуковое исследование
УЗИ используют в качестве скрининг-метода при подозрении на острый панкреатит. Ведущие УЗ-признаки острого панкреатита: увеличение размеров головки, тела и хвоста поджелудочной железы, неоднородность ее эхо-структуры и неровность контуров, визуализация жидкостных образований различных размеров в парапанкреальной зоне и брюшной полости.
Лапароскопия
Лапароскопия при остром панкреатите показана в следующих случаях:
• для уточнения характера панкреонекроза (жировой, геморрагический, смешанный);
• оценки распространенности и характера панкреатогенного перитонита (абактериальный, инфицированный) ;
• диагностики сопутствующего деструктивного холецистита;
• исключения других причин острого живота (перфорации полого органа, острого холецистита, внутрибрюшного кровотечения, инфаркта кишечника), требующих экстренного оперативного вмешательства.
При осмотре брюшной полости во время лапароскопии выявляют следующие признаки отечного панкреатита: оттеснение желудка и выбухание желудочно-ободочной связки, «стекловидный» отек околопанкреальных связочных образований, гиперемию брюшины в верхнем этаже брюшной полости. Стеариновые пятна жирового некроза белесоватожелтого цвета, расположенные на париетальной, висцеральной брюшине, сальнике, и серозный экссудат соломенного цвета свидетельствуют о жировом панкреонекрозе. Для геморрагического панкреонекроза характерны геморрагическая имбибиция малого и большого сальников, брыжейки поперечно-ободочной кишки, забрюшинной клетчатки латеральных каналов, появление признаков пареза желудка, тонкой и толстой кишки, значительное количество насыщенного геморрагического выпота («сок чернослива») в брюшной полости.
Под лапароскопическим контролем при панкреонекрозе выполняют декомпрессионные операции на желчном пузыре (холецистостомию), при панкреатогенном перитоните - санацию и дренирование брюшной полости.
Компьютерная томография
КТ позволяет четко дифференцировать плотные некротические массы (некротическую флегмону) от жидкостных образований (абсцесса, псевдокисты) различной локализации, предоставляет информацию об их взаиморасположении, вовлечении в воспалительно-некротический процесс желчевыводящих путей, предлежащих сосудистых структур и отделов ЖКТ (рис. 8-1). Расширяет диагностические возможности КТ с внутривенным контрастным усилением. Для этого внутривенно вводят 100-120 мл водорастворимого контрастного препарата. Отсутствие накопления контраста в определенных отделах поджелудочной железы свидетельствует о ее некротическом
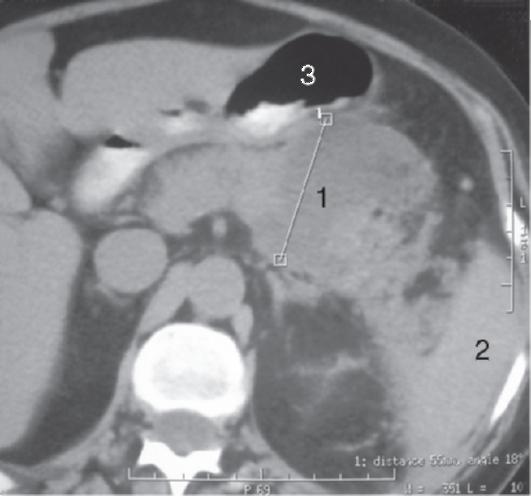
Рис. 8-1. Компьютерная томограмма больного с инфицированным панкреонекрозом, осложненным абсцессом сальниковой сумки: 1 - полость абсцесса с детритом; 2 - селезенка; 3 - желудок
поражении, что позволяет с высокой точностью верифицировать локализацию панкреонекроза.
Метод ранней специальной диагностики инфицированных постнекротических осложнений - чрескожная пункция зон некроза под контролем УЗИ или КТ с последующим бактериологическим исследованием полученного материала, включающим немедленную окраску по Граму, бактериологический посев для определения вида микроорганизмов и их чувствительности к антибиотикам.
Эндоскопическая ретроградная панкреатохолангиография
Эндоскопическая ретроградная панкреатохолангиография и эндоскопическая папиллотомия показаны при наличии синдрома механической желтухи и/или холангита с учетом визуализации при УЗИ расширенного в диаметре общего желчного протока.
Рентгенологические исследования
Рентгенологические диагностические исследования не утратили своей значимости в комплексе методов обследования больных с острым панкреатитом и, в первую очередь, в дифференциации острого панкреатита от перфорации полого органа и механической кишечной непроходимости. При обзорной рентгенографии органов брюшной полости неспецифическими симптомами острого панкреатита считают пневматизацию поперечноободочной кишки, наличие небольших по размерам уровней жидкости в тонкой кишке. Рентгенография органов грудной клетки позволяет выявить плевральный выпот и базальные ателектазы легких, подъем купола диафрагмы, чаще всего синхронные, с поражением соответствующей области забрюшинной клетчатки.
Дифференциальная диагностика
Дифференциальная диагностика острого панкреатита представляет сложную клиническую задачу, поскольку основные проявления заболевания, особенно при развитии деструктивных форм, имеют плюривисцеральный характер. По этим причинам острый панкреатит довольно часто приходится дифференцировать от перфоративной язвы желудка или двенадцатиперстной кишки, острой кишечной непроходимости, острого холецистита, острой окклюзии артерий или вен мезентериального бассейна, разрыва аневризмы брюшного отдела аорты, острого инфаркта миокарда.
ЛЕЧЕНИЕ
Консервативная терапия
Тактика лечения больных с острым панкреатитом определяется формой заболевания в соответствии с фазой развития воспалительного и некротического процессов и степенью тяжести состояния больного.
Лечение всех форм острого панкреатита построено на общих принципах интенсивной консервативной терапии, включающей следующие кардинальные моменты:
• подавление секреции поджелудочной железы, желудка и двенадцатиперстной кишки;
• снижение ферментной токсинемии;
• ликвидацию гиповолемии, водно-электролитных и метаболических расстройств;
• устранение гипертензии в желчевыводящих и панкреатических путях;
• улучшение реологических свойств крови и минимизацию микроциркуляторных расстройств;
• борьбу с гипоксемией;
• лечение пареза ЖКТ;
• купирование болевого синдрома.
Адекватная инфузионная терапия - основа лечения панкреонекроза. Лечение начинают с переливания изотонических растворов и препаратов калия хлорида при гипокалиемии. Поскольку при остром панкреатите возникает дефицит ОЦК за счет потери плазменной части крови, используют коллоидные растворы (препараты крахмала, белки). Критерием адекватного объема инфузии служит нормализация ЦВД, гематокрита и объема мочевыделения. Улучшения реологических свойств крови достигают назначением низкомолекулярных декстранов с пентоксифиллином.
Параллельно проводят мероприятия, направленные на подавление функциональной активности поджелудочной железы, создание физиологического покоя, строгое ограничение приема пищи в течение 5-7 сут. Эффективного снижения панкреатической секреции достигают аспирацией желудочного содержимого через назогастральный зонд, промыванием желудка холодной водой (локальная гипотермия). В целях снижения кислотности желудочного секрета назначают щелочное питье и Н2-блокаторы желудочной секреции (фамотидин, ранитидин)
или препараты омепразола. Для подавления секреторной активности органов гастропанкреатодуоденальной зоны в первые 3-5 сут активной гиперферментемии используют синтетические аналоги соматостатина (октреотид), а для ликвидации энзимной токсинемии применяют ингибиторы протеаз - апротининвнутривенно капельно. В целях системной детоксикации целесообразно использование экстракорпоральных методов детоксикации - плазмафереза, ультрафильтрации крови.
Инфицированные осложнения панкреонекроза в поздней фазе развития заболевания остаются основными причинами высокой летальности. Именно поэтому рациональная антибактериальная профилактика и терапия инфекции при панкреонекрозе имеют ведущее патогенетическое значение. Препараты выбора как для профилактического, так и лечебного применения: карбапенемы, цефалоспорины III и IV поколения + метронидазол, фторхинолоны + метронидазол. Отечная форма панкреатита не требует назначения антибактериальных препаратов.
Развитие метаболического дистресс-синдрома считают основанием для длительного полноценного парентерального питания (растворами глюкозы, аминокислот). При восстановлении функций ЖКТ целесообразно энтеральное питание питательными смесями, которое осуществляют через назоеюнальный зонд, установленный дистальнее связки Трейтца эндоскопическим путем либо во время хирургического вмешательства.
Хирургическое лечение
Принципы хирургического лечения больных панкреонекрозом основаны на дифференцированном подходе к выбору оперативных вмешательств в зависимости от фазы развития заболевания, клиникоморфологической формы, степени тяжести состояния больного и сроков заболевания.
Острый интерстициальный панкреатит и стерильные формы панкреонекроза, осложненные развитием ферментативного перитонита, - показания к лапароскопической санации и дренированию брюшной полости. Если в этих условиях при УЗИ или КТ в забрюшинном пространстве выявляют ограниченное скопление жидкости, ее удаляют путем чрескожной пункции или дренирования под контролем этих визуализирующих методов.
Показанием к лапаротомному вмешательству при стерильном панкреонекрозе считают сохранение или прогрессирование полиорганной недостаточности, несмотря на проведение интенсивной консервативной терапии, лапароскопической санации и дренирования брюшной
полости и/или чрескожных операций, выполняемых под УЗили КТконтролем. В доинфекционную фазу патологического процесса лапаротомное вмешательство, предпринятое по этим показаниям, направлено на удаление некротических тканей, эвакуацию богатого ферментами и токсинами экссудата из забрюшинного пространства и брюшной полости, их адекватное дренирование. Важнейший этап оперативного вмешательства - устранение патологии желчных путей. Наличие признаков билиарной гипертензии - показание к холецистостомии. При деструктивном холецистите выполняют холецистэктомию в сочетании с наружным дренированием общего желчного протока.
Инфицированные формы панкреонекроза, независимо от степени полиорганных нарушений, требуют незамедлительного хирургического вмешательства. В противном случае фатальный исход заболевания неизбежен. При формировании инфицированного панкреонекроза в сочетании с абсцессом на первом этапе хирургического лечения используют малоинвазивные технологии чрескожного дренирования гнойно-некротического очага под УЗили КТ-контролем. Подобная тактика позволяет выполнить лапаротомное вмешательство на 2-3-й неделе заболевания, когда возможно разграничение зон некроза и жизнеспособных тканей, что обеспечивает оптимальные условия для одномоментной и полноценной некр- и секвестрэктомии с минимальной интраоперационной кровопотерей.
Чрескожное дренирование панкреатогенного абсцесса или инфицированной псевдокисты, выполняемое под УЗили КТ-контролем, представляется оптимальным способом их хирургического лечения в тех ситуациях, когда объем некроза минимален, полость абсцесса или псевдокисты не содержит крупных секвестров и замазкообразного детрита, провоцирующих постоянную обтурацию трубчатых дренажей. Эти методы малоинвазивной хирургии имеют несомненные преимущества также в тех случаях, когда в забрюшинном пространстве или брюшной полости формируются ограниченные жидкостные образования в различные сроки после лапаротомных операций.
При распространенном инфицированном панкреонекрозе выполняют лапаротомию, удаляют некротические ткани или секвестры, проводят санацию зон поражения и широкое дренирование ретроперитонеальной клетчатки (рис. 8-2). Невозможность одномоментного устранения всех гнойно-некротических очагов в течение одной операции обосновывает необходимость выполнения этапных (программируемых) некр- и секвестрэктомий.
Выбор лапаротомного хирургического доступа зависит от локализации и распространенности поражения поджелудочной железы и различных отделов забрюшинной клетчатки. Основные оперативные доступы:
• срединная лапаротомия;
• двухподреберный доступ;
• люмботомия.
В зависимости от интраоперационной картины при различных формах панкреонекроза используют резекционные (удаление части некротизированной поджелудочной железы) или органосохраняющие (абдоминизацию поджелудочной железы, некр- и секвестрэктомию) виды операций.
Резекцию поджелудочной железы при панкреонекрозе выполняют в случае полного (на всю толщу органа) некроза в области хвоста и/или тела поджелудочной железы на фоне стабильного состояния больного (при отсутствии признаков шока).
Абдоминизация поджелудочной железы направлена на декомпрессию парапанкреальной клетчатки, адекватную эвакуацию панкреатогенного и/или инфицированного высокотоксичного выпота из забрюшинного пространства. С этой целью рассекают брюшину по нижнему и верхнему краям в области тела и хвоста органа, тупым путем выделяют железу из забрюшинной парапанкреальной клетчатки (рис. 8-3).
Некрэктомия предполагает удаление некротизированных тканей в пределах кровоснабжаемых зон, связанных с паренхимой органа, тогда каксеквестрэктомия включает удаление свободно лежащих некротических масс в пределах нежизнеспособных тканей. Обязательный элемент каждой операции - промывание всех пораженных зон забрюшинной локализации физиологическим раствором или антисептиками.
ПРОГНОЗ
При интерстициальном панкреатите летальность минимальна, тогда как при некротическом панкреатите она варьирует от 20 до 40%. Факторы неблагоприятного исхода острого панкреатита:
• обширный характер некроза поджелудочной железы и различных отделов забрюшинной клетчатки;
• наличие панкреатогенной инфекции;
• выраженные полиорганные нарушения.
Распространенные инфицированные формы панкреонекроза, которым в большинстве наблюдений сопутствует полиорганная недостаточность, имеют фатальную эволюцию заболевания.
В случае благоприятного исхода острого панкреатита основные моменты, определяющие качество жизни пациентов, их физическую, психоэмоциональную и социальную реабилитацию, следующие:
• степень утраты экзо- и эндокринной функций поджелудочной железы;
• адекватность устранения этиологических факторов, приведших к заболеванию.
Так, при полном устранении билиарной или алиментарной причины, приведшей к развитию острого интерстициального панкреатита, функции органа полностью восстанавливаются, качество жизни пациентов существенно не страдает. Наиболее частым последствием перенесенного распространенного панкреонекроза бывает развитие псевдокист, панкреатических свищей, хронического рецидивирующего панкреатита, обусловливающих формирование у пациента синдрома нарушенного пищеварения, сахарного диабета и дислипопротеидемии.
Общеизвестно, что летальность при оперативных вмешательствах по поводу кровотечения, перфорации или стеноза в 10-15 раз выше, чем при плановых операциях по относительным показаниям. Поэтому оперативное лечение целесообразно проводить в плановом порядке, до развития осложнений. Чем чаще возникают обострения заболевания, тем более выраженными становятся сопутствующие нарушения функций поджелудочной железы, печени, желчного пузыря, тем ниже шансы на благоприятный результат плановой операции.
Своевременная плановая операция предупреждает развитие опасных для жизни больного осложнений; одновременно она резко уменьшает риск хирургического вмешательства.
Показания к хирургическому лечению разделяют на абсолютные, условно-абсолютные и относительные.
Абсолютными и условно-абсолютными показаниями считают перфорацию язвы, профузное или рецидивирующее гастродуоденальное кровотечение, пилородуоденальный стеноз и грубые рубцовые деформации желудка, сопровождающиеся нарушениями его эвакуаторной функции, каллезные и пенетрирующие язвы желудка, не рубцующиеся при адекватном консервативном лечении в течение 3-4 мес, рецидив после ранее произведенного ушивания перфоративной язвы.
Относительным показанием к операции является безуспешность полноценного консервативного лечения:
• часто рецидивирующие язвы, плохо поддающиеся повторным курсам консервативной терапии;
• длительно не заживающие вопреки консервативному лечению (резистентные) язвы, сопровождающиеся тяжелыми клиническими симптомами (боли, рвота, скрытое кровотечение);
• множественные язвы с высокой кислотностью желудочного сока;
• социальные показания - у больного нет средств для регулярного полноценного медикаментозного лечения или сам больной выражает желание избавиться от язвенной болезни хирургическим способом;
• непереносимость компонентов медикаментозной терапии. Если 3-4-кратное лечение в стационаре в течение 4-8 нед при
адекватном подборе лекарственных препаратов не приводит к излечению или длительным ремиссиям (5-8 лет), следует формулировать показания к хирургическому лечению, чтобы не допускать появления опасных для жизни осложнений.
Современные плановые операции ваготомии не инвалидизируют больных, как ранее широко применявшиеся резекции желудка, летальность при них составляет менее 0,3%. Своевременная ваготомия, помимо гарантированного оздоровления больного, экономит его личные и государственные средства, улучшает качество жизни.
Хирургическое лечение язвенной болезни двенадцатиперстной кишки преследует те же цели, что и консервативное. Оно направлено на устранение агрессивного кислотно-пептического фактора
и создание условий для свободного прохождения пищи в нижележащие отделы ЖКТ.
Лучшей операцией при язвенной болезни двенадцатиперстной кишки является селективная проксимальная ваготомия (рис. 6.8, а-в). Она заключается в пересечении мелких ветвей желудочного нерва Латарже, иннервирующих тело и свод желудка, где расположены кислотопродуцирующие обкладочные клетки. Дистальные ветви нерва Латарже, иннервирующие антральный отдел и привратник, при этой операции сохраняют, что обеспечивает физиологическую моторику антрального отдела и полноценную эвакуацию содержимого. При отсутствии органического пилородуоденального стеноза в дренирующей желудок операции необходимости нет. При условии стойкого рубцового сужения луковицы или привратника показана операция, шунтирующая стенотический канал или расширяющая его диаметр (дуоденопластика или гастродуоденостомия).
В настоящее время селективная проксимальная ваготомия без пилоропластики является стандартной операцией при лечении не поддающейся стойкому излечению язвы двенадцатиперстной кишки, в том числе язв с осложнениями в анамнезе. Рецидив пептической язвы наблюдается у 2-12% больных, что бывает связано с неадекватной или неполной ваготомией.
Хирургическое лечение язвенной болезни желудка производят по тем же показаниям, что и при язвенной болезни двенадца-
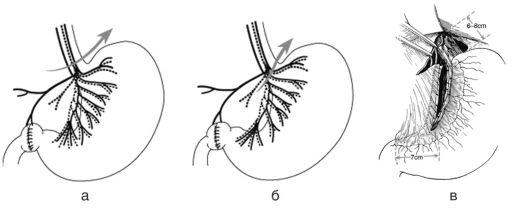
Рис. 6.8. Варианты ваготомии: а - стволовая ваготомия с пилоропластикой; б - селективная ваготомия с пилоропластикой; в - селективная проксимальная ваготомия
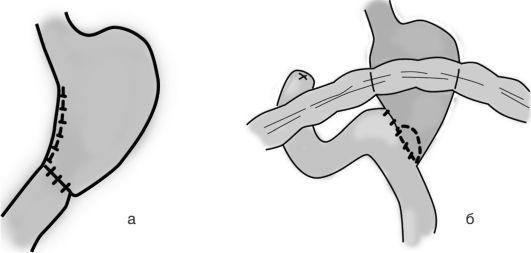
Рис. 6.9. Принципиальные схемы резекции желудка: а - по Бильрот I; б - по Бильрот II
типерстной кишки. Однако сроки консервативного лечения при желудочных язвах нужно сокращать тем увереннее, чем больше размеры и количество язв, глубже ниша, старше больной, длительнее анамнез заболевания и чаще его рецидивы. Сомнительные, неопределенные данные гистологического исследования биоптатов из краев язвы также могут служить дополнительным доводом в пользу оперативного лечения.
Операцией выбора при язве желудка, учитывая опасность неустановленной ранее раковой язвы, является резекция желудка, лучше по Бильрот I. Преимуществом резекции желудка по Бильрот I является сохранение физиологического прохождения пищи через двенадцатиперстную кишку (рис. 6.9).
Хирургическое лечение. При пилородуоденальном стенозе операцией выбора следует считать селективную проксимальную ваготомию с различными вариантами дренирования желудка (пилоро-, дуоденопластика, поперечная гастродуоденостомия при декомпенсированном стенозе; рис. 6.13, а, б) Отдаленные результаты такого оперативного лечения язвенных пилородуоденальных стенозов не отличаются от результатов лечения неосложненных язв.
Консервативная противоязвенная терапия при пенетрирующих язвах часто неэффективна, показано хирургическое лечение. При язве двенадцатиперстной кишки рекомендуют селективную проксимальную ваготомию с удалением язвы или оставлением ее дна на органе, в который она пенетрировала; при язве желудочной локализации выполняют резекцию желудка.
Лечение
При выборе метода лечения необходимо учитывать данные эндоскопии (стадия кровотечения на момент эндоскопии по Форрест), интенсивность кровотечения, его длительность, рецидивы, общее состояние и возраст пациента.
Лечебно-диагностическая эндоскопия на фоне противошоковых мероприятий и коррекции кровопотери играет главную роль на 1-м этапе лечения. Она позволяет выявить источник кровотечения, выполнить эндоскопический гемостаз и оценить вероятность рецидива кровотечения в зависимости от локализации и размера язвы, стадии по Форрест.
Эндоскопический гемостаз осуществляют путем физического воздействия на источник кровотечения (диатермо-, лазеро-, аргоноплазменная и термокоагуляция), механического сдавления кровоточащего сосуда (введение в область язвы этанола, адреналина и других осмотически активных растворов, клиирование). Эндоскопический гемостаз выполняют не только при продолжающемся кровотечении, но и при остановившемся, когда велик риск его рецидива (FIIA). Эффективность окончательной остановки кровотечения методами инструментального гемостаза превышает 90%.
Консервативные мероприятия должны быть направлены на профилактику и лечение шока, подавление продукции HCl и пепсина внутривенным введением блокаторов Н2-рецепторов - ранитидина (и его аналогов - гистак, ранитал), фамотидина (квамател) или блокаторов протонной помпы (лосек). В большинстве случаев (около 90%) острое кровотечение можно остановить консервативными мероприятиями.
Инфузионную терапию проводят с целью нормализации гемодинамики, обеспечения адекватной перфузии тканей. Она включает восполнение ОЦК, улучшение микроциркуляции, предупреждение внутрисосудистой агрегации, микротромбозов, поддержание онкотического давления плазмы, коррекцию водно-электролитного баланса и кислотно-основного состояния, дезинтоксикацию.
При инфузионной терапии стремятся достичь умеренной гемодилюции (содержание Hb должно составлять не менее 100 г/л, а гематокрит - быть в пределах 30%), которая улучшает реологические свойства крови, микроциркуляцию, уменьшает периферическое сосудистое сопротивление току крови, облегчает работу сердца.
Инфузионная терапия должна начинаться с переливания растворов реологического действия, улучшающих микроциркуляцию. При легкой кровопотере производят инфузию реополиглюкина, гемодеза в объеме до 400-600 мл с добавлением солевых и глюкозосодержащих растворов.
При среднетяжелой кровопотере вводят плазмозамещающие растворы, компоненты донорской крови. Общий объем инфузий должен составлять 30-40 мл на 1 кг массы тела больного. Соотношение плазмозамещающих растворов и крови в этом случае должно быть 2 : 1. Назначают полиглюкин и реополиглюкин (до 800 мл), увеличивают дозу солевых и глюкозосодержащих растворов.
При тяжелой кровопотере и геморрагическом шоке соотношение переливаемых растворов и крови составляет 1 : 1 или 1 : 2. Общая доза средств для инфузионной терапии должна превышать количество потерянной крови в среднем на 200-250%.
Для поддержания онкотического давления крови используют внутривенное введение альбумина, протеина, плазмы. Ориентировочный объем инфузий можно определить по величине ЦВД и почасовому диурезу (после терапии он должен быть >50 мл/ч). Коррекция гиповолемии улучшает центральную гемодинамику и адекватную перфузию тканей при условии устранения дефицита кислородной емкости крови.
Хирургическое лечение кровоточащей язвы
Экстренная операция показана больным с активным кровотечением (Форрест I), которое не удается остановить эндоскопическими методами. При геморрагическом шоке и продолжающемся кровотечении операцию проводят на фоне массивного переливания крови, плазмозамещающих растворов и других противошоковых мероприятий.
Срочная операция показана больным после эндоскопической остановки активного кровотечения и после эндоскопического гемостаза стадии FIIA, у которых консервативные мероприятия не позволили стабилизировать состояние.
После остановки кровотечения (Форрест II-III) операция показана больным с длительным язвенным анамнезом, рецидивирующим кровотечением, каллезной и стенозирующей язвой, при возрасте пациента старше 50 лет. Решать вопрос о выборе варианта операции необходимо с учетом сопутствующих заболеваний, которые могут увеличить риск как раннего, так и позднего хирургического вмешательства.
При кровоточащей язве желудка рекомендуются следующие операции: у ослабленных больных предпочтительнее малотравматичная операция - стволовая ваготомия, гастротомия с иссечени-
ем язвы и пилоропластикой. При крайне тяжелом общем состоянии допустимы гастротомия с прошиванием кровоточащего сосуда или иссечение язвы с последующим наложением шва. Риск выполнения резекции желудка на высоте кровотечения очень велик.
При кровоточащей язве двенадцатиперстной кишки производят один из вариантов ваготомии с прошиванием кровоточащих сосудов и пилороили дуоденопластикой.
Больных с небольшим риском рецидива кровотечения оперируют в плановом порядке после предоперационной подготовки, проводимой в течение 2-4 нед в целях заживления язвы или уменьшения периульцерозного воспаления. Летальность после экстренных операций колеблется от 5 до 15%
Острая кишечная непроходимость характеризуется нарушением пассажа кишечного содержимого по направлению от желудка к заднему проходу. Она не представляет собой какую-то отдельную нозологическую форму и бывает осложнением самых различных заболеваний: наружных брюшных грыж, опухолей кишечника, ЖКБ и т.д. Но, возникнув, это патологическое состояние протекает по единому сценарию, вызывая интоксикацию и водно-электролитные расстройства, сопровождается типичными клиническими проявлениями. В связи с этим диагностическая и лечебная тактика во многом едины при несхожей природе непроходимости. По летальным исходам в абсолютных значениях эта патология делит 1-2-е места среди всех острых заболеваний органов брюшной полости.
Острая кишечная непроходимость может возникать во всех возрастных группах. Наиболее часто встречают спаечную непроходимость кишечника.
КЛАССИФИКАЦИЯ
Для острой кишечной непроходимости наиболее приемлема морфофункциональная классификация.
• Динамическая (функциональная) непроходимость:
- спастическая;
- паралитическая;
• Механическая непроходимость:
- по механизму развития:
■ странгуляционная (ущемление, заворот, узлообразование);
■ обтурационная (обтурация опухолью, инородным телом, каловым или желчным камнем, фитобезоаром, клубком аскарид);
■ смешанная (инвагинационная, спаечная);
- по уровню препятствия:
■ высокая (тонкокишечная);
■ низкая (толстокишечная).
Согласно этой классификации, принято выделять динамическую (функциональную) и механическую кишечную непроходимость. При динамической непроходимости нарушается двигательная функция кишечной стенки без механического препятствия продвижению кишечного содержимого. Различают два вида динамической непроходимости:спастическую ипаралитическую.
Механическая непроходимость характеризуется наличием окклюзии кишечной трубки на каком-либо уровне, что и приводит к нарушению кишечного транзита. При этом виде непроходимости принципиально выделение странгуляции и обтурации кишки.
• При странгуляционной непроходимости первично страдает кровообращение вовлеченного в патологический процесс участка кишки. Это связано со сдавлением сосудов брыжейки за счет ущемления, заворота (рис. 11-1) или узлообразования (рис. 11-2), что вызывает довольно быстрое (в течение нескольких часов) развитие гангрены участка кишки.
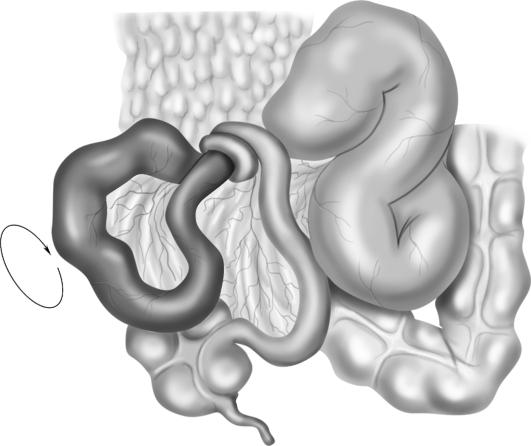
Рис. 11-1. Заворот тонкой кишки (схема)
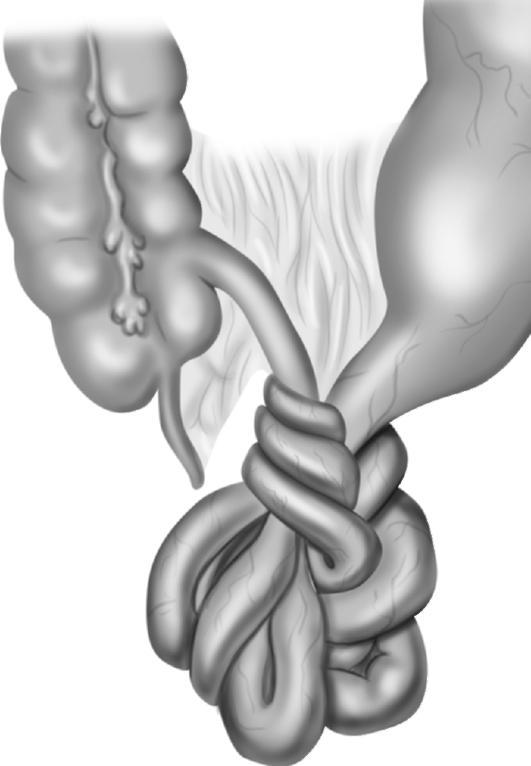
Рис. 11-2. Узлообразование (схема)
• При обтурационной кишечной непроходимости кровообращение расположенного выше препятствия (приводящего) участка кишки нарушаетсявторично в связи с ее чрезмерным растяжением кишечным содержимым. Именно поэтому и при обтурации возможен некроз кишки, но он развивается в течение нескольких суток. Обтурация может быть вызвана злокачественными и доброкачественными опухолями, каловыми и желчными камнями, инородными телами, аскаридами.
• К смешанным формам механической непроходимости относят инвагинацию (рис. 11-3), при которой в инвагинат вовлекается брыжейка кишечника, и спаечную непроходимость, которая может протекать как по странгуляционному типу (сдавление штрангом кишки вместе с брыжейкой) (рис. 11-4, а), так и по типу обтурации (перегиб кишки в виде двустволки) (рис. 11-4, б).
Диагностическая и лечебная тактика во многом зависят от локализации препятствия в кишечнике. В связи с этим по уровню обструкции выделяют высокую (тонкокишечную) инизкую (толстокишечную) непроходимость.
ЭТИОЛОГИЯ
В основе развития механической (особенно странгуляционной) кишечной непроходимости лежат анатомические предпосылки врожденного или приобретенного характера. Такими предрасполагающими факторами могут быть врожденное наличие долихосигмы, подвижной слепой кишки, дополнительных карманов или складок брюшины. Чаще предрасполагающие факторы носят приобретенный характер: спаечный процесс в брюшной полости, удлинение сигмовидной кишки в старческом возрасте, наружные и внутренние брюшные грыжи.
Спаечный процесс в брюшной полости развивается после перенесенных ранее воспалительных заболеваний, травм и операций. Для возникновения острой кишечной непроходимости наибольшее значение имеют изолированные межкишечные, кишечно-париетальные, а также париетально-сальниковые сращения, образующие в брюшной полости грубые тяжи и окна, что может стать причиной странгуляции (внутреннего ущемления) подвижных сегментов кишечника. Не менее опасными в клиническом плане могут быть плоские межкишечные, кишечно-париетальные и кишечно-сальниковые сращения с образованием кишечных конгломератов, приводящих к обтурационной непроходимости при функциональной перегрузке кишечника.
Еще одна группа приобретенных факторов, способствующих кишечной непроходимости, - опухоли различных отделов кишечника (в подавляющем большинстве случаев рак толстой кишки), приводящие к обтурационной непроходимости. Обтурация может возникнуть также вследствие сдавления кишечной трубки опухолью извне, исходящей из соседних органов, а также сужения просвета кишечника в результате перифокальной опухолевой или воспалительной инфильтрации. Экзофитные опухоли (либо полипы) тонкой кишки, а также дивертикул Меккеля могут обусловить инвагинацию.
При наличии указанных предпосылок непроходимость возникает под влиянием производящих факторов. Для грыж таким фактором может служить повышение внутрибрюшного давления. Для других видов непроходимости в качестве провоцирующего фактора нередко становятся нарушения моторики кишечника, связанные с изменением пищевого режима: употреблением большого количества овощей и фруктов в летне-осенний период, обильным приемом пищи после длительного голодания (может вызвать заворот тонкой кишки), переходом с грудного вскармливания на искусственное у детей первого года жизни (частая причина илеоцекальной инвагинации).
Причины динамической кишечной непроходимости весьма разнообразны. Чаще всего отмечают паралитическую непроходимость, развивающуюся в результате травмы (в том числе операционной), метаболических расстройств (гипокалиемии), перитонита. Все острые хирургические заболевания органов брюшной полости, потенциально способные привести к перитониту, протекают с явлениями пареза кишечника. Снижение перистальтической активности ЖКТ происходит при ограничении физической активности (постельном режиме) и в результате длительно некупируемой желчной либо почечной колики. Спастическую кишечную непроходимость вызывают поражения головного или спинного мозга (метастазы злокачественных опухолей, спинная сухотка и др.), отравление солями тяжелых металлов (например, свинцовая колика), истерия.
ПАТОГЕНЕЗ
Острая кишечная непроходимость вызывает в организме больных выраженные нарушения, определяющие тяжесть течения этого патологического состояния. В общем можно констатировать присущие ему расстройства водно-электролитного баланса и кислотно-основного состояния, потерю белка, эндотоксикоз, кишечную недостаточность и болевой синдром.
Гуморальные нарушения связаны с потерей большого количества воды, электролитов и белков. Жидкость теряется с рвотными массами (безвозвратные потери). Также она депонируется в приводящем отделе кишечника, скапливается в отечной кишечной стенке и брыжейке, содержится в брюшной полости в виде экссудата (блокированный резерв). Если непроходимость будет устранена, по мере нормализации процессов фильтрации и реабсорбции этот резерв воды может вновь принять участие в обмене. В условиях не ликвидированной непроходимости потери жидкости в течение суток могут достигать 4 л и более. Это ведет кгиповолемии идегидратации тканей, гемоконцентрации, нарушениям микроциркуляции и тканевой гипоксии. Указанные патофизиологические моменты напрямую отражаются на клинической картине - возникают сухость кожных покровов, олигурия, артериальная гипотензия, высокий гематокрит и относительный эритроцитоз.
Гиповолемия и дегидратация увеличивают синтез антидиуретического гормона и альдостерона. Результатом этого становятся снижение
количества отделяемой мочи, реабсорбция ионов натрия и значительное выделение ионов калия. На место трех ионов калия в клетку входят два иона натрия и один ион водорода. Ионы калия выводятся с мочой и теряются с рвотными массами. Это обусловливает возникновение внутриклеточного ацидоза, гипокалиемии иметаболического внеклеточного алкалоза. Низкое содержание ионов калия в крови чревато снижением мышечного тонуса, уменьшением сократительной способности миокарда и угнетением перистальтической активности кишечника. В дальнейшем, в связи с деструкцией кишечной стенки, развитием перитонита и олигурии, возникают гиперкалиемия (что также далеко небезразлично для организма, и следует помнить о возможности калиевой остановки сердечной деятельности) иметаболический ацидоз.
Наряду с жидкостью и электролитами теряется значительное количество белков (до 300 г в сутки) за счет голодания, рвоты, пропотевания в просвет кишки и брюшную полость. Особенно значимы потери альбумина в плазме. Гипопротеинемия усугубляется превалированием процессов катаболизма.
Отсюда ясно, что для лечения больных с кишечной непроходимостью необходимы не только переливание жидкости (до 5 л в первые сутки терапии), но и введение электролитов, белковых препаратов, нормализация кислотно-основного состояния.
Эндотоксикоз - важное звено патофизиологических процессов при кишечной непроходимости. Жидкость в приводящем отделе кишечника состоит из пищеварительных соков, пищевого химуса и транссудата (он содержит белки плазмы, электролиты и форменные элементы крови), поступающего в просвет кишечника вследствие повышенной проницаемости сосудистой стенки. В условиях нарушенного кишечного пассажа, снижения активности полостного и пристеночного пищеварения и активизации бактериального ферментативного расщепления кишечное содержимое довольно быстро разлагается и подвергается гниению. Этому способствует размножение микрофлоры в застойном кишечном содержимом.
С приобретением доминирующей роли симбионтного пищеварения в кишечном химусе увеличивается количество продуктов неполного гидролиза белков - различных полипептидов, являющихся представителями группы токсических молекул средней величины. В нормальных условиях эти и подобные им соединения не всасываются через кишечную стенку. В условиях же циркуляторной гипоксии стенка кишки
утрачивает функцию биологического барьера, поэтому значительная часть токсических продуктов поступает в общий кровоток, что способствует нарастанию интоксикации.
Вместе с тем главным моментом в генезе эндогенной интоксикации следует признать бактериальный фактор. Застой содержимого способствует бурному росту и размножению микроорганизмов и колонизации тонкой кишки толстокишечной микрофлорой. Выделение экзо- и эндотоксинов, нарушение барьерной функции кишечной стенки приводят к транслокации бактерий в портальный кровоток, лимфу и перитонеальный экссудат. Эти процессы лежат в основе системной воспалительной реакции иабдоминального хирургического сепсиса, характерных для острой кишечной непроходимости. Развитие некроза кишки и гнойного перитонита становится вторым источником эндотоксикоза. Апофеозом данного процесса служат усугубление нарушений тканевого метаболизма и возникновение полиорганной дисфункции и недостаточности, свойственных тяжелому сепсису.
Специфичны для непроходимости нарушения моторной исекреторнорезорбтивной функций кишечника. Их вместе с некоторыми другими патологическими проявлениями (нарушением барьерной функции, подавлением местного иммунитета и др.) в настоящее время принято обозначать термином «кишечная недостаточность».
• В ранней стадии непроходимости перистальтика усиливается, при этом кишечная петля своими сокращениями как бы стремится преодолеть появившееся препятствие. На этом этапе перистальтические движения в приводящей петле укорачиваются по протяженности, но становятся чаще. Возбуждение парасимпатической нервной системы при сохранении препятствия может привести к антиперистальтике.
• Затем в результате гипертонуса симпатической нервной системы развивается фаза значительного угнетения моторной функции. Перистальтические волны становятся более редкими и слабыми, а в поздних стадиях непроходимости развивается полныйпаралич кишечника. В основе этого лежит нарастающая циркуляторная гипоксия кишечной стенки, вследствие которой постепенно утрачивается возможность передачи импульсов по интрамуральному аппарату. Затем уже и сами мышечные клетки оказываются неспособными воспринимать импульсы к сокращению в результате глубоких метаболических расстройств и внутриклеточных электролитных нарушений. Расстройства мета-
болизма кишечных клеток усугубляются нарастающей эндогенной интоксикацией, последняя, в свою очередь, увеличивает тканевую гипоксию.
Выраженный болевой синдром чаще развивается при странгуляционной кишечной непроходимости за счет сдавления нервных стволов брыжейки. Сильные, схваткообразные боли сопровождают и обтурационную непроходимость. Это поддерживает расстройства центральной гемодинамики и микроциркуляции, что определяет тяжелое течение данного патологического состояния.
ПАТОМОРФОЛОГИЯ
Патологические изменения как в кишечнике, так и в брюшной полости при острой кишечной непроходимости зависят от ее вида.
При странгуляционной непроходимости первично нарушается кровообращение участка кишки, поэтому ишемические и некробиотические ее изменения наступают значительно раньше и более выраженны.
Обтурационная непроходимость вызывает вторичные расстройства кровотока в кишечной стенке за счет чрезмерного растяжения приводящего отдела содержимым. При остро развившейся обтурации существенно повышается давление в кишечнике проксимальнее уровня препятствия. Он раздувается от переполняющих его газов и жидкого содержимого. Стенка кишки утолщается за счет отека, а также венозного застоя и стаза, приобретает цианотичный оттенок. В дальнейшем она подвергается перерастяжению и значительно истончается. Повышение внутрикишечного давления до 10 мм рт.ст. через 24 ч вызывает кровоизлияния и изъязвления в стенке кишки, что отражает ее ишемическое повреждение. Если давление возрастает до 20 мм рт.ст., возникают необратимые некротические изменения кишечной стенки.
Деструктивные изменения распространяются как вдоль слизистой оболочки, так и вглубь стенки кишки вплоть до серозного покрова, в связи с чем в ее толще появляется воспалительная лейкоцитарная инфильтрация. Под влиянием биологически активных аминов присоединяется ишемический паралич прекапиллярных сфинктеров, прогрессирует стаз в сосудах микроциркуляторного русла, увеличивается агрегация форменных элементов крови. Высвобождаемые тканевые кинины и гистамин нарушают проницаемость сосудистой стенки, что способствует интерстициальному отеку кишки и ее брыжейки и пропотеванию жидкости сначала в просвет кишки, а затем
и в брюшную полость. При сохранении нарушений кровообращения происходит расширение и углубление участков некробиоза, сливающихся в обширные зоны некроза слизистой оболочки и подслизистых слоев. Некротические изменения серозного покрова кишечной стенки появляются в самую последнюю очередь и, как правило, бывают меньшими по протяженности, что нередко затрудняет точное интраоперационное определение участков нежизнеспособности кишки. Это обстоятельство обязательно необходимо учитывать во время оперативного вмешательства при решении вопроса о границах резекции кишечника.
При прогрессировании некроза может произойти перфорация кишечной стенки. Принципиально значимо, что при различных формах странгуляционной непроходимости кишечника (ретроградном ущемлении, завороте, узлообразовании) нарушения кровообращения кишки нередко происходят в двух местах и более. При этом участок кишечника, изолированный от приводящего и отводящего отделов, как правило, претерпевает особенно глубокие и резко выраженные патоморфологические изменения.
КЛИНИЧЕСКАЯ КАРТИНА
Ведущие симптомы острой кишечной непроходимости
Ведущие симптомы острой кишечной непроходимости - боли в животе, его вздутие, рвота, задержка стула и газов. Они имеют различную степень выраженности, зависящую от вида непроходимости, ее уровня и длительности заболевания.
Боли
Боли обычно возникают внезапно, вне зависимости от приема пищи, в любое время суток, без каких-либо предвестников. Характерен их схваткообразный характер, связанный с периодами гиперперистальтики кишечника, без четкой локализации в каком-либо отделе брюшной полости.
• При обтурационной кишечной непроходимости вне схваткообразного приступа они обычно полностью исчезают.
• Странгуляционной непроходимости свойственны постоянные резкие боли, периодически усиливающиеся. При прогрессировании заболевания острые боли, как правило, стихают на 2-3-и сутки,
когда перистальтическая активность кишечника прекращается, что служит плохим прогностическим признаком. • Паралитическая кишечная непроходимость протекает с постоянными тупыми, распирающими болями в животе.
Рвота
Рвота сначала носит рефлекторный характер, при продолжающейся непроходимости рвотные массы представлены застойным желудочным содержимым. В позднем периоде она становится неукротимой, рвотные массы приобретают каловый вид и запах за счет бурного размножения кишечной палочки в верхних отделах пищеварительной системы. Каловая рвота - несомненный признак механической кишечной непроходимости, но для уверенной диагностики этого патологического состояния не стоит дожидаться данного симптома, так как он часто указывает «на неизбежность летального исхода» (Мондор А.). Чем выше уровень непроходимости, тем сильнее выражена рвота. В промежутках между ней больной испытывает тошноту, его беспокоят отрыжка и икота. При низкой локализации препятствия в кишечнике рвота возникает позже и протекает с большими промежутками.
Задержка стула и газов
Задержка стула и газов - патогномоничный признак непроходимости кишечника. Это ранний симптом низкой непроходимости. При высоком ее характере в начале заболевания, особенно под влиянием лечебных мероприятий, может быть стул, иногда многократный за счет опорожнения отдела кишечника, расположенного ниже препятствия. При инвагинации из заднего прохода иногда появляются кровянистые выделения. Это может стать причиной диагностической ошибки, когда острую кишечную непроходимость принимают за дизентерию.
Диагностика
Анамнез имеет большое значение в успешной диагностике острой кишечной непроходимости. Перенесенные операции на органах брюшной полости, открытые и закрытые травмы живота, воспалительные заболевания нередко бывают предпосылкой возникновения спаечной кишечной непроходимости. Указание на периодические боли в животе, его вздутие, урчание, расстройства стула (особенно чередование запоров с диареей) может помочь в постановке диагноза опухолевой обтурационной непроходимости.
Важно отметить, что клиническая картина высокой кишечной непроходимости очень яркая, с ранним появлением симптомов обезвоживания, выраженными расстройствами кислотно-основного состояния и водно-электролитного баланса.
Общее состояние больного может быть средней тяжести или тяжелым, что зависит от формы, уровня и времени, прошедшего с момента возникновения острой кишечной непроходимости. Температура тела в начальном периоде заболевания не повышается. При странгуляционной непроходимости, когда возникает коллапс, температура тела может снижаться до 35 °С. В дальнейшем, при развитии системной воспалительной реакции и перитонита, появляется гипертермия. Пульс в начале заболевания не изменяется, нарастание признаков эндотоксикоза и обезвоживания проявляется тахикардией. Обращает на себя внимание явное расхождение между относительно низкой температурой тела и частым пульсом (симптом токсических ножниц). Язык становится сухим, покрывается грязным налетом.
Осмотр живота больного с подозрением на кишечную непроходимость обязательно следует начинать собследования всех возможных мест выхождения грыж, чтобы исключить их ущемление как причину возникновения этого опасного синдрома. Особое внимание обращают на бедренные грыжи у пожилых женщин. Ущемление участка кишки без брыжейки в узких грыжевых воротах не сопровождается выраженными локальными болевыми ощущениями, поэтому больные далеко не всегда сами активно жалуются на появление небольшого выпячивания ниже паховой связки, предшествующее возникновению симптомов непроходимости.
Послеоперационные рубцы могут указывать на спаечный характер непроходимости кишечника. К наиболее постоянным признакам непроходимости относят вздутие живота. Степень вздутия может быть различной, что зависит от уровня окклюзии и длительности заболевания. При высокой непроходимости оно может быть незначительным и часто асимметричным, и чем ниже уровень препятствия, тем больше выражен этот симптом. Диффузный метеоризм характерен для паралитической и обтурационной толстокишечной непроходимости. Как правило, по мере увеличения сроков заболевания увеличивается и вздутие живота.
Неправильная форма живота и его асимметрия более присущи странгуляционной кишечной непроходимости. Иногда, особенно у истощенных больных, через брюшную стенку удается увидеть одну или несколько раздутых петель кишечника, периодически перистальтиру-
ющих. Видимая перистальтика - признак механической непроходимости кишечника. Она обычно определяется при медленно развивающейся обтурационной опухолевой непроходимости, когда успевает гипертрофироваться мускулатура приводящего отдела кишечника.
Локальное вздутие живота при пальпируемой в этой зоне раздутой петле кишки, над которой определяется высокий тимпанит (симптом Валя), - ранний симптом механической кишечной непроходимости. При завороте сигмовидной кишки вздутие локализуется ближе к правому подреберью, тогда как в левой подвздошной области, т.е. там, где она обычно пальпируется, отмечают западение живота(симптом Шимана).
Пальпация живота в межприступный период (во время отсутствия схваткообразных болей, обусловленных гиперперистальтикой), до развития перитонита, как правило, безболезненна. Напряжение мышц передней брюшной стенки отсутствует, как и симптом Щеткина- Блюмберга. При странгуляционной непроходимости на почве заворота тонкой кишки бывает положительнымсимптом Тэвенара - резкая болезненность при пальпации живота на 2-3 см ниже пупка по срединой линии, т.е. там, где обычно проецируется корень ее брыжейки. Иногда при пальпации удается определить опухоль, тело инвагината или воспалительный инфильтрат, послуживший причиной непроходимости.
При сукуссии (легком сотрясении живота) можно услышать шум плеска - симптом Склярова (см. рис. 15-4). Его выявлению помогает аускультация живота с помощью фонендоскопа во время нанесения рукой толчкообразных движений передней брюшной стенки в проекции раздутой петли кишки. Обнаружение этого симптома указывает на наличие перерастянутой паретичной петли кишки, переполненной жидким и газообразным содержимым. Этот симптом с большой долей вероятности указывает на механический характер непроходимости.
Перкуссия позволяет определить ограниченные участки зон притупления, что соответствует местоположению петель кишки, наполненных жидкостью, непосредственно прилегающих к брюшной стенке. Эти участки притупления не меняют своего положения при поворотах больного, чем отличаются от притупления, обусловленного выпотом в свободной брюшной полости. Притупление выявляют также над опухолью, воспалительным инфильтратом или инвагинатом кишки.
Аускультация живота, по образному выражению А. Мондора, необходима для того, чтобы «услышать шум начала и тишину конца». В начальном периоде кишечной непроходимости выслушивают звон-
кую, резонирующую перистальтику, что сопровождается появлением или усилением болей в животе. Иногда можно уловить шум падающей капли (симптом Спасокукоцкого-Вильмса) после звуков переливания жидкости в растянутых петлях кишечника. Перистальтику можно вызвать или усилить путем поколачивания брюшной стенки или ее пальпации. По мере развития непроходимости и нарастания пареза кишечные шумы становятся короткими, редкими и более высоких тонов. В позднем периоде все звуковые феномены постепенно исчезают, им на смену приходит мертвая (могильная, гробовая) тишина - зловещий признак тяжелой, запущенной непроходимости кишечника. В этот период при резком вздутии живота над ним можно выслушать не перистальтику, а дыхательные шумы и сердечные тоны, которые в норме через живот не проводятся.
Обследование больного с острой кишечной непроходимостью обязательно должно быть дополнено пальцевым ректальным исследованием. При этом можно определить каловый завал, опухоль прямой кишки, головку инвагината и следы крови. Ценный диагностический признак низкой толстокишечной непроходимости, определяемый при ректальном исследовании, - атония анального жома и баллонообразное вздутие пустой ампулы прямой кишки(симптом Обуховской больницы, описанный Грековым И.И.). Этому виду непроходимости присущ исимптом Цеге-Мантефейля, заключающийся в малой вместимости дистального отдела кишечника при постановке сифонной клизмы. При этом в прямую кишку удается ввести не более 500 мл воды.
Клинические проявления непроходимости зависят не только от ее вида и уровня окклюзии кишечной трубки, но и от фазы (стадии) течения этого патологического процесса. Принято выделять три стадии острой кишечной непроходимости.
• Начальную - стадию местных проявлений острого нарушения кишечного пассажа продолжительностью от 2 до 12 ч (время зависит от формы непроходимости). В этом периоде доминируют болевой синдром и местные симптомы со стороны живота.
• Промежуточную - стадию мнимого благополучия, характеризуемую развитием острой кишечной недостаточности, водно-электролитных расстройств и эндотоксемии. Она обычно продолжается от 12 до 36 ч. В этой фазе боль теряет схваткообразный характер, становится постоянной и менее интенсивной. Живот сильно вздут, перистальтика кишечника слабеет, выслушивается шум плеска. Задержка стула и газов полная.
• Позднюю - стадию перитонита и тяжелого абдоминального сепсиса, часто ее называют терминальной стадией, что недалеко от истины. Она наступает через 36 ч от начала заболевания. Для этого периода характерны проявления тяжелой системной воспалительной реакции, возникновение полиорганной дисфункции и недостаточности, выраженные интоксикация и обезвоживание, а также прогрессирующие расстройства гемодинамики. Живот значительно вздут, перистальтика не выслушивается, определяют перитонеальную симптоматику.
Инструментальные исследования
Инструментальные методы исследования при подозрении на кишечную непроходимость предназначены как для подтверждения диагноза, так и для уточнения уровня обтурации кишечной трубки и причины развития этого патологического состояния.
Рентгенологическое исследование остается основным методом диагностики острой кишечной непроходимости. Оно необходимо при малейшем подозрении на это состояние. Как правило, сначала выполняют обзорную рентгеноскопию (-графию) органов брюшной полости. При этом могут быть выявлены следующие признаки.
Кишечные арки (рис. 11-5) выявляют, если тонкая кишка раздута газами. При этом в нижних коленах арок видны горизонтальные уровни
Рис. 11-5. Обзорная рентгенограмма органов брюшной полости. Кишечные арки
Рис. 11-6. Обзорная рентгенограмма органов брюшной полости. Тонкокишечные уровни жидкости - чаши Клойбера
жидкости, ширина которых уступает высоте газового столба. Они характеризуются преобладанием газов над жидким содержимым кишечника и встречаются, как правило, в относительно более ранних стадиях непроходимости.
Чаши Клойбера (рис. 11-6) - горизонтальные уровни жидкости с куполообразным просветлением (газом) над ними, имеют вид перевернутой вверх дном чаши. Если ширина уровня жидкости превышает высоту газового пузыря, скорее всего, он локализуется в тонкой кишке. Преобладание вертикального размера чаши свидетельствует о локализации уровня жидкости в толстой кишке. В условиях странгуляционной непроходимости этот симптом может появиться уже через 1 ч, а при обтурационной непроходимости - через 3-5 ч с момента заболевания. При тонкокишечной непроходимости количество чаш бывает различным, иногда они могут наслаиваться одна на другую в виде ступенчатой лестницы. Низкая толстокишечная непроходимость в поздние сроки может проявляться как толстокишечными, так и тонкокишечными уровнями жидкости. Расположение чаш Клойбера на одном уровне в одной кишечной петле обычно свидетельствует о глубоком парезе кишечника и характерно для поздних стадий острой механической или паралитической кишечной непроходимости.
Симптом перистости (поперечная исчерченность кишки в форме растянутой пружины) встречается при высокой кишечной непроходимости и связан с отеком и растяжением тощей кишки, имеющей высокие циркулярные складки слизистой оболочки. Этот симптом особенно ярко выражен на фоне контрастирования кишечника (рис. 11-7).
Рентгеноконтрастное исследование ЖКТ применяют при затруднениях в диагностике кишечной непроходимости. В зависимости от пред-
полагаемого уровня окклюзии кишечника рентгеноконтрастный препарат либо дают per os (при признаках высокой обтурационной непроходимости), либо вводят с помощью клизмы (при симптомах низкой непроходимости). Использование рентгеноконтрастного препарата внутрь (в объеме около 50 мл) предполагаетповторное (динамическое) исследование пассажа бария. Задержка его более 6чв желудке и 12 ч в тонкой кишке дает основание заподозрить нарушение проходимости или двигательной активности кишечника. При механической непроходимости контрастная масса ниже препятствия не поступает. Дополнительную информацию можно получить с помощью КТ (рис. 11-8), которая в ряде случаев позволяет уточнить причину непроходимости кишечника.
Экстренная ирригоскопия позволяет выявить обтурацию толстой кишки опухолью, а также обнаружитьсимптом трезубца - признак илеоцекальной инвагинации.
Колоноскопия в настоящее время играет важную роль в своевременной диагностике и лечении опухолевой толстокишечной непроходимости. После клизм, выполненных с лечебной целью, дистальный (отводящий) участок кишки очищается от остатков каловых масс, что позволяет предпринять полноценное эндоскопическое исследование. Оно дает возможность не только точно локализовать патологический процесс, но и выполнить интубацию суженной части кишки, разрешить тем самым явления острой непроходимости и выполнить оперативное вмешательство по поводу онкологического заболевания в более благоприятных условиях.
УЗИ брюшной полости обладает небольшими диагностическими возможностями при острой кишечной непроходимости в связи с выраженной пневматизацией кишечника, затрудняющей визуализацию
Рис. 11-7. Обзорная рентгенограмма органов брюшной полости. Симптом перистости (растянутой пружины)
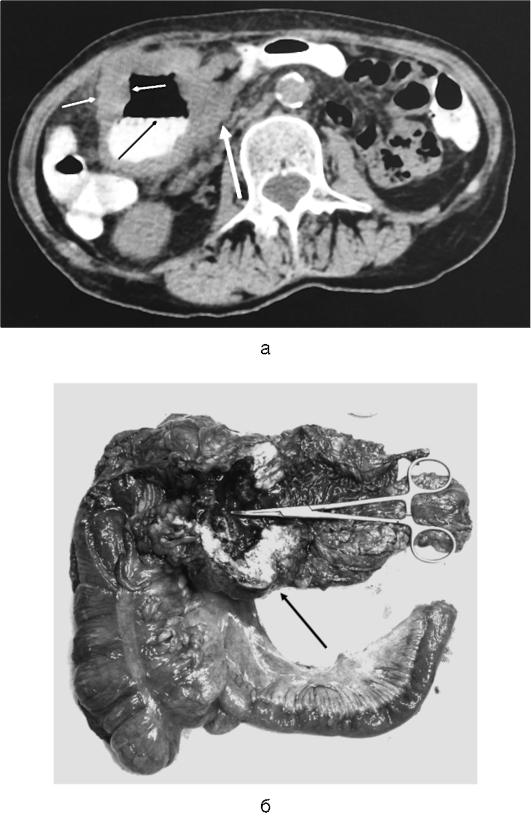
Рис. 11-8. Опухолевая обтурационная непроходимость ободочной кишки: а - компьютерная томограмма брюшной полости после приема рентгеноконтрастного препарата внутрь. Виден уровень жидкости в ободочной кишке (указан черной стрелкой), в этой зоне определяется резкое утолщение кишечной стенки (указано белыми стрелками), что характерно для опухолевого ее поражения; б - операционный препарат - удаленная правая половина ободочной кишки. Передняя стенка кишки рассечена, через резко суженный за счет опухоли просвет проведен хирургический зажим
органов брюшной полости. Вместе с тем в ряде случаев этот метод позволяет обнаружить опухоль в толстой кишке, воспалительный инфильтрат или головку инвагината.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Клинические признаки острой кишечной непроходимости могут появляться при самых различных ургентных заболеваниях. Принципы их диагностики представлены в соответствующих главах настоящего учебника. Принципиально важно, что все острые хирургические заболевания органов брюшной полости, способные привести к развитию перитонита, протекают с явлениями паралитической кишечной непроходимости. Если хирург диагностирует распространенный перитонит, то до операции (она в данном случае обязательна) не столь важно знать, вызван ли он механической кишечной непроходимостью или сам стал причиной тяжелой динамической непроходимости. Это будет ясно во время интраоперационной ревизии брюшной полости. Гораздо важнее для выработки адекватной диагностической и лечебной тактики определить (естественно, до развития перитонита) вид непроходимости.
1. Странгуляционная или обтурационная непроходимость? В первую очередь при осмотре необходимо исключить ущемление наружных брюшных грыж, способных стать причиной странгуляционной непроходимости. Если ущемление обнаружено, необходимо экстренное хирургическое вмешательство без проведения какого-либо сложного инструментального исследования.
На странгуляционный характер непроходимости, вызванной заворотом, узлообразованием или внутренним ущемлением, указывают выраженные постоянные боли, которые могут временами усиливаться, но полностью никогда не проходят. Для него характерны рвота с самого начала заболевания и (довольно часто) асимметрия живота. Состояние больных прогрессивно и быстро ухудшается, отсутствуют светлые промежутки.
2. Высокая или низкая непроходимость? Ответ на этот вопрос важен хотя бы потому, что от него зависит способ рентгеноконтрастного исследования (динамическое наблюдение за пассажем бариевой взвеси или ирригоскопия). Высокая непроходимость характеризуется ранней и частой рвотой, отхождением газов и наличием стула в первые часы заболевания, быстрым обезвоживанием больного (сухие кожные по-
кровы со сниженным тургором, уменьшение количества отделяемой мочи, низкое ЦВД, высокий гематокрит). Для нее более типичны локальный метеоризм и симптом Валя. При обзорной рентгеноскопии определяют тонкокишечные уровни (с преобладанием горизонтального размера чаши Клойбера над вертикальным). Низкая толстокишечная непроходимость проявляется редкой рвотой, значительно менее выраженными признаками дегидратации, положительными симптомами Цеге-Мантефейля и Обуховской больницы. На обзорной рентгенограмме органов брюшной полости видны толстокишечные уровни (они могут сочетаться с тонкокишечными при длительной обтурации кишки).
3. Механическая или динамическая непроходимость? Решение этой задачи не только сложно, но и крайне ответственно. Динамическая непроходимость сама по себе обычно не требует хирургического вмешательства. Более того, необоснованная операция может ее только усугубить. А при механической непроходимости, как правило, показано оперативное лечение.
Отправными точками дифференциальной диагностики в этом случае должны были бы служить особенности болевого синдрома. К сожалению, динамическая непроходимость может проявляться как схваткообразными (спастическая), так и тупыми, распирающими, постоянными (парез кишечника) болями. Мало того, динамическая непроходимость, сопровождающая, например, длительно некупируемый приступ почечной колики, из спастического вида может перейти в паралитический. Конечно, рвота должна быть более выраженна при механической непроходимости, но тяжелый парез ЖКТ также сопровождается обильным количеством застойного отделяемого по зонду из желудка, появлением кишечных уровней на обзорной рентгенограмме органов брюшной полости. Это в первую очередь относится к острому панкреатиту. Выраженный длительный парез желудка и кишечника настолько присущ этому заболеванию, что среди хирургов существует неписанное правило: во всех случаях подозрения на кишечную непроходимость следует исследовать мочу на амилазу (диастазу). Этот простой тест часто бывает единственным способом избежать ненужной лапаротомии. Локальный метеоризм, симптомы Валя, Цеге-Мантефейля и Обуховской больницы присущи только механической непроходимости. С другой стороны, диффузный метеоризм и отсутствие указанных симптомов не исключают ее наличия.
Подобная диагностическая неопределенность (динамическая или механическая непроходимость у больного) характерна для данного патологического состояния. Вот почему во многих случаях прибегают к консервативному лечению без окончательного диагноза и решения вопроса о показаниях к экстренной операции.
ЛЕЧЕНИЕ
Поскольку непроходимость кишечника - осложнение различных заболеваний, нет и не может быть единого способа ее лечения. Вместе с тем принципы лечебных мероприятий при этом патологическом состоянии достаточно единообразны.
1. Всех больных с подозрением на непроходимость кишечника необходимо срочно госпитализировать в хирургический стационар. Сроки поступления таких пациентов в лечебные учреждения во многом предопределяют прогноз и исход заболевания. Чем позже госпитализируют больных с острой кишечной непроходимостью, тем выше уровень летальности.
2. Все виды странгуляционной кишечной непроходимости, как и любые виды обтурациии кишечника, осложненные перитонитом, требуют неотложного хирургического вмешательства. В связи с тяжелым состоянием больных может быть оправдана только кратковременная (не более 1,5-2 ч) интенсивная предоперационная подготовка.
3. Динамическая кишечная непроходимость подлежит консервативному лечению, так как хирургическое вмешательство само по себе приводит к возникновению или усугублению пареза кишечника.
4. Сомнения в диагнозе механической кишечной непроходимости при отсутствии перитонеальной симптоматики указывают на необходимость консервативного лечения. Оно купирует динамическую непроходимость, устраняет некоторые виды механической, служит предоперационной подготовкой в тех случаях, когда это патологическое состояние не разрешается под влиянием терапевтических мероприятий.
5. Консервативное лечение не должно служить оправданием необоснованной задержки хирургического вмешательства, если необходимость его проведения уже назрела. Снижение летальности при кишечной непроходимости может быть обеспечено в первую очередь активной хирургической тактикой.
6. Хирургическое лечение механической кишечной непроходимости предполагает настойчивую послеоперационную терапию водно-электролитных расстройств, эндогенной интоксикации и пареза ЖКТ, способных привести больного к гибели даже после устранения препятствия для пассажа кишечного содержимого.
Консервативное лечение
Консервативное лечение должно целенаправленно воздействовать на звенья патогенеза кишечной непроходимости. Принципы его заключаются в следующем.
Во-первых, следует обеспечить декомпрессию проксимальных отделов ЖКТ путем аспирации содержимого через назогастральный или назоинтестинальный (установленный во время оперативного вмешательства) зонд. Постановка очистительной и сифонной клизм при их эффективности (размывании плотных каловых масс) позволяет опорожнить толстую кишку, расположенную выше препятствия, и в ряде случаев разрешить непроходимость. При опухолевой толстокишечной непроходимости желательна интубация суженного участка кишки для разгрузки приводящего отдела.
Во-вторых, необходимы коррекция водно-электролитных нарушений и ликвидация гиповолемии. Общие правила подобной терапии изложены в главе 5, здесь отметим лишь, что объем инфузии, проводимой под контролем ЦВД и диуреза (желательны катетеризация одной из центральных вен и наличие катетера в мочевом пузыре), должен составлять не менее 3-4 л. Обязательно восполнение дефицита ионов калия, так как он способствует усугублению пареза кишечника.
В-третьих, для устранения расстройств гемодинамики, помимо адекватной регидратации, надлежит использовать реологически активные средства - реополиглюкин*,пентоксифиллини др.
В-четвертых, весьма желательна нормализация белкового баланса с помощью переливания белковых гидролизатов, смеси аминокислот, альбумина, протеина, а в тяжелых случаях - плазмы крови.
В-пятых, следует воздействовать на перистальтическую активность кишечника. При усиленной перистальтике и схваткообразных болях в животе назначают спазмолитики (атропин,платифиллин, дротаверин и др.), при парезе - средства, стимулирующие моторно-эвакуационную способность кишечной трубки: внутривенное введение гипертонического раствора натрия хлорида, ганглиоблокаторы, неостигмина
метилсульфат, дистигмина бромид, многоатомные спирты, например сорбитол, токи Бернара на переднюю брюшную стенку.
И, наконец, последнее (по порядку, но не по значению): жизненно необходимы мероприятия, обеспечивающие детоксикацию и профилактику гнойно-септических осложнений. С этой целью, помимо переливания значительного количества жидкости, следует использовать инфузию низкомолекулярных соединений (гемодеза*, сорбитола, маннитола и др.) и антибактериальные средства.
Консервативная терапия, как правило, купирует динамическую непроходимость (возможно разрешение некоторых видов механической непроходимости: копростаза, инвагинации, заворота сигмовидной кишки и т.д.). В этом заключается ее роль как диагностического и лечебного средства. Если явления непроходимости не разрешаются, проведенная терапия служит мерой предоперационной подготовки, так необходимой при этом патологическом состоянии.
Хирургическое лечение
Оперативное лечение острой кишечной непроходимости предполагает решение следующих задач.
• Устранение препятствия для пассажа кишечного содержимого.
• Ликвидацию (по возможности) заболевания, приведшего к развитию этого патологического состояния.
• Резекцию кишечника при выявлении нежизнеспособности его участка.
• Предупреждение нарастания эндотоксикоза в послеоперационном периоде.
• Предотвращение рецидива непроходимости.
Основные моменты оперативного вмешательства при непроходимости кишечника перечислены ниже.
• Анестезиологическое обеспечение.
• Хирургический доступ.
• Ревизия брюшной полости для обнаружения причины механической непроходимости.
• Восстановление пассажа кишечного содержимого или его отведение наружу.
• Оценка жизнеспособности кишечника.
• Резекция кишечника по показаниям.
• Наложение межкишечного анастомоза.
• Назоинтестинальная интубация.
• Санация и дренирование брюшной полости.
• Закрытие операционной раны.
Оперативное лечение острой кишечной непроходимости предполагает интубационный эндотрахеальный наркоз с миорелаксантами. Осуществляют широкую срединную лапаротомию. Этот доступ необходим в подавляющем большинстве случаев, так как, помимо ревизии всего кишечника, во время вмешательства часто приходится проводить его обширную резекцию и интубацию, а также санацию и дренирование брюшной полости.
Ревизия брюшной полости позволяет выявить точную локализацию непроходимости кишечника и ее причину. Ориентировочно о расположении этой зоны судят по состоянию кишечника: выше препятствия приводящая кишка раздута, переполнена газами и жидким содержимым, стенка ее обычно истончена и по цвету отличается от других отделов (от багрово-цианотичной до грязно-черной окраски); отводящая кишка находится в спавшемся состоянии, стенки ее при отсутствии перитонита не изменены. Важно помнить, чтопрепятствие, обусловившее развитие непроходимости, может находиться в нескольких местах на разных уровнях, вот почему необходим тщательный осмотр всего кишечника - от привратника до прямой кишки.
Назоинтестинальная интубация (рис. 11-9) обеспечивает опорожнение кишечника на операционном столе и в послеоперационном периоде.
После назоинтестинальной интубации и обнаружения препятствия приступают к устранению непроходимости: пересекают спайки, разворачивают заворот или выполняют дезинвагинацию. Ликвидации обтурационной непроходимости в одних случаях достигают путем энтеротомии, в других - с помощью резекции кишки, наложения обходного анастомоза или колостомы.
После устранения причины непроходимости следует оценить жизнеспособность кишки, что при острой кишечной непроходимости бывает одной из самых сложных задач, от правильного решения которой может зависеть исход заболевания. Степень выраженности изменений пораженного участка определяют только после ликвидации непроходимости и декомпрессии кишки.
Основные признаки жизнеспособности кишки: сохраненный розовый цвет, наличие перистальтики и пульсации краевых сосудов брыжейки. При отсутствии указанных признаков, за исключением случаев
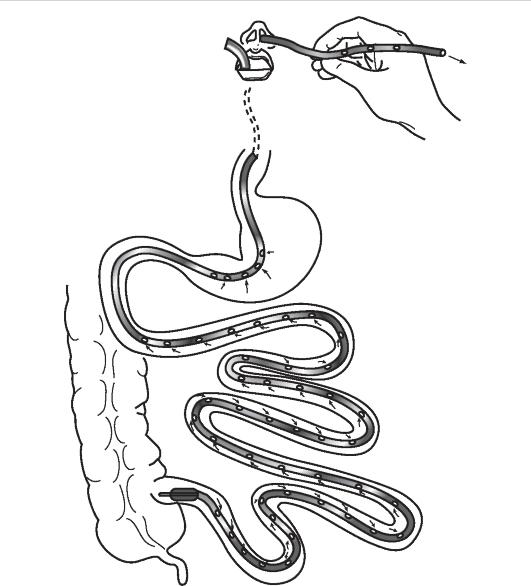
Рис. 11-9. Схема назоинтестинальной интубации
явной гангрены, в брыжейку тонкой кишки вводят 150-200 мл 0,25% раствора прокаина, обкладывают салфетками, смоченными горячим физиологическим раствором. Через 5-10 мин повторно осматривают подозрительный участок. Исчезновение синюшной окраски кишечной стенки, появление отчетливой пульсации краевых сосудов брыжейки и возобновление активной перистальтики позволяют считать его жизнеспособным.
Нежизнеспособную кишку следует резецировать в пределах здоровых тканей. Учитывая, что некротические изменения появляются сначала в слизистой оболочке, а серозные покровы поражаются в последнюю очередь и могут быть мало изменены при обширном некрозе слизистой оболочки кишечника, резекцию выполняют с обязательным удалением не менее 30-40 см приводящей и 15-20 см отводящей петель кишечника (от странгуляционных борозд, зоны обтурации или границ явных гангренозных изменений). При длительной непроходимости может потребоваться более обширная резекция, но всегда удаляемый участок приводящего отдела должен быть вдвое протяженнее отводящего. Любые сомнения в жизнеспособности кишечника при непроходимости - показания к его резекции.
Важная роль в борьбе с эндотоксикозом принадлежит удалению токсичного содержимого, которое скапливается в приводящем отделе и петлях кишечника, подвергшихся странгуляции. Опорожнение кишечника может быть достигнуто через назоинтестинальный зонд либо путем сцеживания его содержимого в участок, подлежащий резекции. Делать это через энтеротомическое отверстие нежелательно из-за опасности инфицирования брюшной полости.
Операцию заканчивают тщательным промыванием иосушением брюшной полости. При значительном количестве экссудата и некротическом поражении кишечника (после его резекции) следуетдренировать через контрапертуры полость малого таза и зону максимально выраженных изменений (например, боковые каналы). Рану передней брюшной стенки тщательно послойно ушивают.
В ряде случаев возможно лечение кишечной непроходимости спаечного генеза с помощью методов видеолапароскопической хирургии. Рассечение спаек (адгезиолизис) при отсутствии выраженного вздутия петель тонкой и толстой кишки выполняют с помощью лапароскопических инструментов. Противопоказанием является спаечная болезнь после перенесенных открытых оперативных вмешательств на органах брюшной полости, в том числе по поводу спаечной кишечной непроходимости. При этом риск повреждения кишечника во время наложения пневмоперитонеума или введения троакаров в брюшную полость многократно возрастает.
Послеоперационное ведение больных. Особенность ближайшего послеоперационного периода при острой кишечной непроходимости - сохранение пареза кишечника, водно-электролитных расстройств,
нарушений кислотно-основного состояния, тяжелой интоксикации. Именно поэтому все мероприятия, направленные на устранение этих патогенетических моментов, начатые в предоперационном периоде и проводимые во время хирургического вмешательства, в обязательном порядке должны быть продолжены и после операции. Большое значение в профилактике и лечении пареза кишечника имеет его декомпрессия. Этого эффективно достигают длительной аспирацией кишечного содержимого через зонд Миллера-Эббота и (в меньшей степени) аспирацией желудочного содержимого. Аспирацию, сочетающуюся с промыванием и средствами селективной деконтаминации кишечника, осуществляют в течение 3-4 сут до уменьшения интоксикации и появления активной перистальтики кишечника. В течение этого времени больной находится на парентеральном питании. Суточный объем инфузионных сред составляет не менее 3-4 л.
Восстановлению функций кишечника способствует коррекция водно-электролитных расстройств. Для стимуляции моторной функции кишечника используют антихолинэстеразные препараты (неостигмина метилсульфат, дистигмина бромид), ганглиоблокаторы, гипертонический раствор натрия хлорида, токи Бернара, очистительные и сифонные клизмы.
Более 75% всех осложнений, развивающихся в послеоперационном периоде у больных, перенесших операцию по поводу острой кишечной непроходимости, связаны с инфицированием (перитонитом, нагноением раны, пневмонией). Именно поэтому обязательно проведение антибактериальной терапии.
Несмотря на успехи в области хирургической герниологии, проблемы лечения больных с грыжами вообще и с ущемленными грыжами в частности по-прежнему остаются актуальными. Высокая заболеваемость, превышающая, по литературным данным, 50 случаев на 10 000 населения, обусловливает и частое развитие одного из грозных осложнений этой патологии - ущемления.
В структуре основных форм острых хирургических заболеваний органов брюшной полости ущемленные грыжи занимают четвертое место после острого аппендицита, острого панкреатита и острого холецистита. Несмотря на то что вопросы хирургической тактики и техники операций при ущемленных грыжах детально разработаны, высокая послеоперационная летальность и большое количество послеоперационных осложнений не дают основания считать проблему хирургического лечения больных с ущемленными грыжами окончательно решенной.
Частота ущемления грыж, по данным ряда авторов, существенно не меняется и находится в пределах 2,34 больных на 10 000 населения. Остается до настоящего
времени и достаточно высокой летальность, колеблющаяся от 1,9 до 3%. Из 180 000 операций, ежегодно выполняемых в нашей стране по поводу грыж различной локализации, более 46 000 приходится на больных с ущемленными грыжами. При этом около 65% операций у больных с ущемленными грыжами приходится на долю пациентов пожилого и старческого возраста. Именно среди больных пожилого и старческого возраста, оперированных по поводу ущемленных грыж, отмечается самая высокая послеоперационная летальность. Так, у больных в возрасте 61-70 лет она составляет 5,6-6,1%, а у больных старше 70 лет - 17-18%. Несмотря на усилия, направленные на плановую хирургическую санацию грыженосителей, количество больных с ущемленными грыжами живота в последние годы не имеет тенденции к снижению. Отмечается неуклонный рост частоты выявления грыженосителей среди лиц пожилого и старческого возраста, что связано, скорее всего, с процессом общего старения населения. Так, по литературным данным, среди больных, оперированных по поводу ущемленных грыж живота, 46,1-63,7% составляют пациенты старше 60 лет, имеющие, как правило, ряд сопутствующих заболеваний
Основной причиной летальности по-прежнему остается позднее поступление больных с ущемленными грыжами в хирургические стационары. Главная причина поздней госпитализации - несвоевременное обращение за медицинской помощью, поскольку больные часто не отдают себе отчета в опасности ущемления грыжи. Литературные публикации свидетельствуют о том, что в первые 6 ч с момента появления клинических признаков ущемления грыжи госпитализируются 40-63,3% больных, в течение 6-24 ч - 24,1-35%, позже 24 ч - около 12,6-25% больных. Нередко причиной поздней госпитализации служат диагностические ошибки как на догоспитальном этапе, так и в условиях стационаров. По данным ряда авторов, ошибки на догоспитальном этапе составляют 7,8-18%. Одной из главных причин диагностических ошибок догоспитального этапа становится отступление от «классических» принципов осмотра больных - отсутствие осмотра мест наиболее вероятного образования грыж.
Все грыжи живота делят на наружные и внутренние. Наружная грыжа - это врожденный или приобретенный дефект целостности мышечно-апоневротических структур брюшной стенки, через который происходит выхождение внутренних органов, покрытых брюшиной, в межмышечные пространства или под кожу.
К внутренним грыжам относятся грыжи, образующиеся в брюшинных карманах и складках брюшной полости, а также проникающие
в плевральную полость или в средостение через естественные или приобретенные (чаще посттравматические) дефекты диафрагмы.
По этиологическому признаку все грыжи живота (в зависимости от их происхождения) делят на врожденные и приобретенные. К врожденным грыжам относятся грыжи, появившиеся сразу после рождения. Иногда появление врожденных грыж происходит через достаточно продолжительный промежуток времени с момента рождения ребенка, что создает определенные трудности в оценке характера их происхождения.
К приобретенным грыжам относят грыжи, возникшие в так называемых предуготованных «слабых» местах брюшной стенки вследствие сложных взаимоотношений анатомо-физиологических предпосылок и нарушений динамического равновесия между внутрибрюшным давлением и способностью брюшной стенки противодействовать этим изменениям. Такими «слабыми» местами брюшной стенки считаются паховый канал, бедренное кольцо, пупочное кольцо, дефекты апоневротической ткани белой линии живота, спигелевой линии, треугольник Пти, промежуток Грюнфельда-Лесгафта, запирательный канал, отверстия и щели в диафрагме и др.
Отдельную группу представляют так называемые послеоперационные (инцизионные) грыжи. Возникновение их связано с оперативными вмешательствами на органах брюшной полости по поводу различных заболеваний. Грыжи, возникающие в местах оперативных вмешательств по поводу грыж, называют рецидивными.
В грыже различают грыжевые ворота, грыжевой мешок и грыжевое содержимое. Внутренняя грыжа может не иметь грыжевого мешка.
Механизм образования грыж сложен, многообразен и до конца не изучен. Считают, что в процессе образования грыж определенную роль играют конституционально-наследственные факторы. Это, прежде всего, типовые половые и возрастные различия в строении тела. Сюда же следует отнести изменения в брюшной стенке, связанные с беременностью, ожирением или истощением, неблагоприятными условиями труда.
Факторы, приводящие к повышению внутрибрюшного давления (тяжелый физический труд, беременность и трудные роды, продолжительные запоры, бронхит и др.), относят к производящим факторам в механизме формирования грыж. Определенную роль в герниогенезе отводят наследственной предрасположенности. Речь здесь ведется не только о наследственной передаче особенностей анатомического строения брюшной стенки. Необходимо также иметь в виду наследственно-генетическую предрасположенность к нарушениям в метаболизме коллагена, а также заболевания соединительной ткани, носящие
характер системного заболевания. Многочисленные морфологические и молекулярные исследования последнего времени у пациентов с грыжами подтверждают гипотезу о значении генетических аспектов как предрасполагающих факторов формирования грыж.
В определенной степени к образованию грыж предрасполагает тип телосложения. Определенному типу телосложения соответствует определенное строение брюшной стенки. Выделяют два типа телосложения:
> гиперстенический (брахиморфный), или мужской;
> астенический (долихоморфный), или женский.
Для каждого типа телосложения характерны соответствующие особенности анатомо-топографического строения брюшной стенки. Особенности топографического строения мышечно-апоневротического слоя брюшной стенки создают определенную предрасположенность к образованию грыж той или иной локализации. У людей брахиморфного типа телосложения чаще выявляются прямые паховые, диафрагмальные и эпигастральные грыжи. Считают, что пупочные, косые паховые и бедренные грыжи чаще наблюдаются у лиц с долихоморфным типом телосложения. На формирование грыж большое влияние оказывает также степень физического развития человека, тонус его мышечной системы, прочность апоневротических структур и связочного аппарата.
Одним из этиологических факторов, обусловливающих образование грыж у женщин, служит беременность, при которой происходит значительная не только пространственная, но и физиологическая трансформация мышечно-апоневротических структур брюшной стенки. Происходит гипертрофия мышц с одновременным истончением апоневротических структур, расширением пупочного кольца, перестройкой кровоснабжения брюшной стенки. Развивающиеся в процессе беременности физиологические изменения со стороны брюшной стенки не исчезают полностью в послеродовом периоде. Брюшная стенка остается атоничной и растянутой, что нередко становится фактором, обусловливающим развитие грыж.
Возраст считается одним из факторов, имеющим определенное значение в происхождении грыж живота. На фоне возрастной инволюции организма наблюдается естественная атрофия и жировое перерождение мышечных и апоневротических структур брюшной стенки. Снижается их способность противодействовать механическим нагрузкам, а следовательно, возрастает вероятность образования грыж у лиц пожилого и старческого возраста.
В клинической классификации выделяют:
> вправимые грыжи;
> невправимые грыжи;
> ущемленные грыжи.
К вправимым относятся грыжи, чье содержимое грыжевого мешка свободно перемещается как из брюшной полости в грыжевой мешок, так и из грыжевого мешка в брюшную полость.
Невправимая грыжа характеризуется тем, что содержимое грыжевого мешка находится в нем постоянно и ни самостоятельно, ни при попытках вправления его не перемещается в брюшную полость. Чаще это обусловлено образованием спаек внутри грыжевого мешка, фиксирующих органы брюшной полости к стенкам грыжевого мешка.
Ущемленная грыжа (hernia incarceratae) - под ущемлением понимают внезапно возникшее сдавление содержимого грыжевого мешка в грыжевых воротах. Ущемленным может оказаться любой орган, находящийся в грыжевом мешке. При этом в ущемленном органе развиваются расстройства крово- и лимфообращения, ведущие к нарушению функции не только ущемленного органа, но и организма в целом. Тяжесть и выраженность общих функциональных расстройств при ущемленных грыжах теснейшим образом связаны с длительностью ущемления. По механизму развития ущемления различают: эластическое, каловое и смешанное ущемление.
В механизме эластического ущемления основным производящим фактором чаще становится процесс внезапного повышения внутрибрюшного давления. В основном это может наблюдаться при кашле, натуживании во время акта дефекации, поднятии тяжести. Под влиянием этого внутренности быстро проходят через грыжевые ворота в грыжевой мешок. Происходящее одновременно с этим быстрое сокращение мышц брюшной стенки приводит к сокращению грыжевых ворот до обычных размеров, что не позволяет вышедшим в грыжевой мешок в несколько большем объеме органам вернуться в брюшную полость. Происходит ущемление их в грыжевых воротах, несмотря на нормализацию внутрибрюшного давления.
Несколько иной механизм развития ущемления наблюдается при так называемом каловом ущемлении. Чаще этот вид ущемления встречается у пожилых людей с длительными сроками грыженосительства, приводящими к формированию больших грыж и развитию спаечного процесса в грыжевом мешке. В петле кишки, находящейся в грыжевом мешке, постепенно или вследствие бурной перистальтики и стремительного продвижения кишечного содержимого из проксимальных отделов кишечника происходит скопление этого содержимого, сдавливающего просвет отводящей петли кишки. При сдавлении отводящей петли по линии грыжевых ворот (ущемляющего кольца) происходит постепенное
сдавление как стенок ущемленной петли кишки, так и сосудов брыжейки. Сдавление сосудов, питающих ущемленную петлю кишки, приводит к венозному застою и отеку стенки кишки, находящейся в грыжевом мешке. Застой кишечного содержимого в ущемленной петле кишки приводит к значительному растяжению ее стенки. Явления венозного застоя и растяжения стенки ущемленной петли кишки ведут к экссудации в основном плазмы как в просвет кишки, так и грыжевой мешок, где скапливается жидкость, так называемая грыжевая вода. В начале ущемления грыжевая вода, как правило, прозрачна и стерильна, затем она окрашивается в розовый цвет в результате нарушения тканевых структур кишечной и сосудистых стенок, а также поступления эритроцитов. По мере прогрессирования деструктивных процессов в стенке ущемленной петли кишки развиваются процессы бактериальной транслокации через кишечную стенку и инфицирования грыжевой воды. По мере проникновения в нее микроорганизмов она становится мутной, приобретает специфический каловый запах. Нередко гнойно-некротический процесс в грыжевом мешке выходит за его пределы, распространяясь на подкожную жировую клетчатку, ткани брюшной стенки, кожу. Формируется так называемая флегмона грыжевого мешка. Выход инфицированного грыжевого экссудата в брюшную полость ведет к развитию перитонита.
N.B. Необходимо помнить, что некротические изменения в ущемленной и приводящей петле кишки всегда развиваются в первую очередь со стороны слизистой оболочки, в то время как брюшинный покров при визуальной интраоперационной его оценке кажется неизмененным. Нельзя забывать и о том, что расстройства микроциркуляции в стенке кишки не ограничиваются лишь ущемленной частью, а распространяются на значительном протяжении (особенно в приводящем отделе кишки) и нередко имеют тенденцию к прогрессированию. Развивающийся артериовенозный тромбоз интрамуральных сосудов склонен к прогрессивному распространению на мезентериальные сосуды. Все это ведет к венозному застою и отеку стенки приводящей петли кишки. Вследствие застоя кишечного содержимого приводящий отрезок кишки подвергается значительному растяжению, усугубляющему нарушение микроциркуляторных процессов в стенке кишки. Создаются условия для венозного стаза и процессов экссудации плазмы как в толщу стенки кишки, так и в ее просвет.
Тяжесть и темпы развития изменений со стороны ущемленного органа как в грыжевом мешке, так и в брюшной полости находятся в определенной зависимости не только от длительности ущемления, но и
от возраста больного. У пожилых больных темпы развития некротических изменений в стенке ущемленной кишки гораздо выше, чем у детей и больных молодого возраста.
Достаточно серьезные трудности встречаются при диагностике редких вариантов ущемления грыж брюшной стенки. К таким грыжам относятся грыжа Рихтера, ретроградное (W-образное) ущемление (грыжа Майдля), а также ущемление меккелева дивертикула, или грыжи Литтре. Диагностика пристеночных ущемлений (грыжи Рихтера), при которых происходит ущемление противобрыжеечной стенки кишки, связана с определенными трудностями. Скудная клиническая картина пристеночного ущемления в первые часы заболевания нередко служит причиной диагностических ошибок, так как пристеночное ущемление не приводит к нарушению пассажа кишечного содержимого, задержке газов и стула - нет явлений кишечной непроходимости. Местные изменения в большинстве случаев таких ущемлений бывают невыраженными, особенно у тучных больных и в случаях, если грыжа была ранее невправимой. Однако быстро развивающийся некроз пристеночно ущемленной стенки кишки приводит к развитию гнойно-воспалительной инфильтрации тканей, нередко к развитию флегмоны, абсцесса, кишечного свища. Чаще пристеночное ущемление наблюдается при бедренных грыжах. Так, по данным Н.А. Бражникова и соавт. (2004), Рихтеровское ущемление при бедренных грыжах наблюдается у 17,5% больных, в то время как паховых у 5,4%, то есть в 3,2 раза чаще. Приводимые в литературе данные о высокой летальности среди больных с грыжами Рихтера свидетельствуют о серьезных проблемах в вопросах своевременной диагностики и оперативного лечения этих больных.
Не менее серьезные трудности, связанные, очевидно, с редкостью наблюдений, отмечаются в диагностике ретроградных (W-образных) ущемлений, или так называемых грыж Майдля (Maydl). Статистические данные, приводимые рядом авторов о частоте наблюдений ретроградных ущемлений, не превышают 2-3% случаев в общей структуре ущемленных грыж. Под ретроградным ущемлением принято понимать ущемление, при котором в грыжевом мешке находятся две ущемленные кишечные петли и брыжейка, а в брюшной полости оказываются наиболее измененная соединяющая их кишечная петля и брыжейка. Дооперационная диагностика ретроградных ущемлений практически невозможна. Единственным характерным клиническим признаком ретроградного ущемления становится несоответствие между общим состоянием больного и местными проявлениями. Как правило, тяжелое состояние больного не соответствует интраоперационным морфологическим изменениям, выявляемым
в органе, ущемленном в грыжевом мешке. Связано это с тем, что некроз происходит гораздо быстрее в петле кишки, находящейся в брюшной полости. Быстро развивающиеся процессы венозного застоя, пропотевание в стенку кишки, ее просвет и брюшную полость экссудата с присоединяющейся бактериальной транслокацией через стенку ущемленной петли кишки, находящейся в брюшной полости, ведут к развитию перитонита. Интраоперационное обнаружение в грыжевом мешке двух и более петель кишечника обязывает к ревизии брюшной полости, чьей основной целью становится исключение вероятности ретроградного ущемления грыжи.
Необходимо помнить о так называемых ложных ущемлениях Брока. «Патогенез» ложного ущемления до банальности прост и, казалось бы, не должен вызывать затруднений в диагностике. Однако поверхностный сбор анамнеза заболевания и недооценка объективных данных во время обследования становятся основными причинами допускаемых диагностических ошибок. Местными проявлениями ложного ущемления грыжи могут быть прободные гастродуоденальные язвы, острый аппендицит, острый холецистит и ряд других заболеваний брюшной полости. Иногда ложное ущемление грыжи может симулировать так называемый грыжевой аппендицит. Попадание червеобразного отростка в грыжевой мешок возможно, когда слепая кишка имеет длинную брыжейку и благодаря своей подвижности может перемещаться в грыжевой мешок. Ложное ущемление Брока может наблюдаться не только при «грыжевом», но и при обычном аппендиците, при расположении червеобразного отростка в брюшной полости и при наличии у больного свободной неущемленной грыжи брюшной стенки любой локализации. Затекающий в грыжевой мешок из брюшной полости экссудат, переполняя его, симулирует картину ущемления грыжи. При ложном ущемлении Брока грыжа становится невправимой не потому, что имеется истинное ущемление, а из-за болезненности, возникающей вследствие раздражения брюшины грыжевого мешка. Подробное выяснение анамнеза о характере болевого синдрома, области первоначального его появления, последующей локализации позволяет выявить истинную причину боли в области грыжи. При ложном ущемлении, как правило, вначале отмечаются боли в животе, нередко повышается температура тела и появляется ряд симптомов, характерных для того или иного острого заболевания органов брюшной полости, и лишь потом возникают боли в области грыжи. Нередко ущемление паховых и бедренных грыж могут симулировать водянка яичка, кисты и водянка семенного канатика, острый орхит, эпидидимит, перекручивание семенного канатика.
При невнимательном поверхностном осмотре больного за ущемленную грыжу может быть ошибочно принята подкожная липома при локализации ее в области паховых или бедренных ворот.
Заслуживает определенного внимания рассмотрение особенностей ущемления так называемых скользящих грыж (hernia labentes). К скользящим грыжам относятся грыжи, при которых в образовании грыжевого мешка кроме париетальной брюшины брюшной стенки принимает участие висцеральная брюшина, покрывающая часть органа, выходящего в грыжевой мешок. Редкость наблюдений скользящих грыж - одна из причин тяжелых послеоперационных осложнений, развивающихся в результате грубых технических интраоперационных ошибок. Именно технические ошибки становятся основной причиной летальных исходов оперативных вмешательств у этой категории больных. Чаще летальный исход наступает от перитонита, развивающегося в результате интраоперационного повреждения полого органа, нередко остающегося незамеченным во время операции.
В практическом отношении наибольшее значение имеют скользящие паховые грыжи мочевого пузыря, слепой кишки, женских половых органов. Значительно реже наблюдается соскальзывание стенки восходящего, нисходящего или сигмовидного отдела ободочной кишки. Казуистикой можно считать обнаружение в скользящей грыже мочеточников и почек.
В основе механизма возникновения и ущемления скользящих грыж лежит совокупность как местных, так и общих факторов. Возникновению скользящих грыж мочевого пузыря способствуют возрастные инволютивно-дегенеративные процессы в стенке мочевого пузыря, сопровождающиеся утратой его тонуса и эластичности. Определенное значение в патогенезе образования скользящих грыж мочевого пузыря имеет скопление значительной массы паравезикальной клетчатки при ожирении. Сочетание местных факторов, включая слабость задней стенки пахового канала, широкие грыжевые ворота, чаще при прямых паховых грыжах, и увеличивающейся подвижности мочевого пузыря способствует процессу постепенного соскальзывания стенки мочевого пузыря через грыжевые ворота в грыжевой мешок. Гиперплазия простаты, стриктуры уретры, препятствуя нормальному оттоку мочи, способствуют увеличению мочевого пузыря, развитию его атонии и соскальзыванию участка одной из его стенок в грыжевой мешок. Особенно часто это наблюдается у лиц пожилого и старческого возраста. Длительность грыженосительства у них служит также одним из факторов, способствующих постепенному увеличению и формированию скользящей грыжи.
Постепенно увеличивающийся грыжевой мешок увлекает за собой в грыжевые ворота одну из стенок мочевого пузыря. При этом необходимо четко дифференцировать существенную разницу между экстраперитонеальной и параперитонеальной скользящей грыжей. При экстраперитонеальных скользящих грыжах в грыжевые ворота оказывается втянутой часть передней стенки мочевого пузыря, не покрытая брюшиной. При параперитонеальных (околобрюшинных) скользящих грыжах мочевого пузыря вначале формируется грыжевой мешок, а затем в него соскальзывает часть стенки мочевого пузыря, покрытая висцеральной брюшиной.
Аналогичные топографо-анатомические взаимоотношения наблюдаются также при скользящих грыжах слепой кишки. Факторами формирования скользящих грыж слепой кишки становятся врожденное низкое расположение слепой и восходящей кишок, наличие длинной брыжейки слепой кишки, врожденная или приобретенная слабость связочного аппарата, а также подвижная слепая кишка (caecum mobile). Большое значение в формировании скользящих грыж слепой кишки имеет слабость поперечной фасции, слабо развитые мышцы брюшной стенки, а также широкие грыжевые ворота. Так же, как и скользящие грыжи мочевого пузыря, скользящие грыжи слепой кишки могут быть как экстраперитонеальными, так и параперитонеальными. При экстраперитонеальной скользящей грыже слепой кишки в грыжевые ворота выпячивается не париетальная брюшина, а участок слепой кишки, не имеющий брюшинного покрова. Грыжевой мешок как таковой при экстраперитонеальной грыже слепой кишки отсутствует.
При параперитонеальной скользящей грыже слепой кишки наружная и задняя стенки грыжевого мешка образованы стенкой слепой кишки, покрытой висцеральной брюшиной. Задняя ее стенка, лишенная брюшинного покрова, лежит всегда вне брюшинного мешка.
Естественно, что при наличии длинной брыжейки в грыжевой мешок при скользящей паховой грыже вместе со стенкой слепой кишки может спускаться червеобразный отросток. При этом в грыжевом мешке может оказаться только верхушка или основание червеобразного отростка, или он может оказаться в грыжевом мешке полностью. Ущемление скользящей грыжи в этом случае неизбежно ведет к ущемлению не только стенки слепой кишки, но и червеобразного отростка. В зависимости от расположения червеобразного отростка ущемленными могут оказаться:
> стенка слепой кишки и верхушка червеобразного отростка;
> только червеобразный отросток;
> стенка кишки и весь червеобразный отросток.
Нередко в этих случаях развивается острое вторичное воспаление в червеобразном отростке из-за стесненного положения в грыжевом мешке смещенных органов (слепой кишки, червеобразного отростка). Острый воспалительный процесс, развивающийся в червеобразном отростке при вправимой скользящей паховой грыже, так называемый грыжевой аппендицит, сам по себе может провоцировать ее ущемление.
Скользящие грыжи женских половых органов чаще бывают врожденными, реже приобретенными. Диагностика ущемлений скользящих грыж женских половых органов связана с определенными трудностями. При ущемлении скользящей грыжи, чьим содержимым оказываются яичник, маточная труба или матка, отсутствует один из кардинальных симптомов ущемления - признак странгуляционной кишечной непроходимости. Отсутствие общих явлений со стороны кишечника, типичных для ущемленных грыж, при наличии болевого синдрома и обнаружении грыжевидных образований в паховых областях у девочек должны настораживать, указывая на вероятность ущемления скользящей грыжи женских половых органов. В этих случаях большое значение в выборе хирургической тактики имеет анамнез заболевания с уточнением длительности болевого синдрома.
Ущемленные паховые грыжи
Независимо от этиологии (врожденная или приобретенная) и анатомической формы (прямая или косая), по статистическим данным, паховые грыжи служат самой частой формой ущемленных грыж передней брюшной стенки. По данным разных авторов, ущемленные паховые грыжи составляют 50-60% от общего объема ущемленных вентральных грыж. В большинстве своем среди больных, оперируемых по поводу ущемленных паховых грыж, по статистическим данным, паховые грыжи становятся самой частой формой ущемленных грыж передней брюшной стенки, при этом среди пациентов преобладают мужчины. Возраст больных, оперируемых по поводу ущемленных паховых грыж, различен. Чаще ущемление паховых грыж наблюдается у лиц старше 60 лет, что служит одной из причин поздней обращаемости больных за медицинской помощью, высокой частоты послеоперационных осложнений и летальных исходов.
В клинической картине ущемленных паховых грыж основными симптомами становятся внезапно возникающая боль в паховой области, увеличение грыжевидного выпячивания в размерах и появление симптома невправимости его в брюшную полость. Интенсивность болей различна, иногда болевой синдром слабо выражен, что становится одной из причин несвоевременного обращения больных за медицинской помощью. Чаще болевой синдром достигает большой интенсивности и может сопровождаться обморочным состоянием. Боль локализуется, как правило, в области грыжевого выпячивания и в брюшной полости, часто сопровождается тошнотой и рвотой рефлекторного характера. Затем, если ущемлена петля кишки, развивается картина острой странгуляционной кишечной непроходимости. Рвота становится многократной, неукротимой. Рвотные массы приобретают зловонный «каловый» запах. Большинство авторов рассматривают ущемление кишечной петли в грыжевых воротах как одну из форм острой странгуляционной кишечной непроходимости. Состояние больных быстро становится тяжелым. Острота клинической картины и темпы патологоморфологических изменений при ущемлении грыж любой локализации, в том числе паховых, зависит от степени нарушения кровообращения в ущемленном органе, длительности этого ущемления и важности функции ущемленного органа, а также от степени сдавления ущемляющим кольцом. Возникающая в области ущемления так называемая странгуляционная борозда вызывает в ущемленном органе вначале венозный стаз, затем некротические изменения. При узком грыжевом кольце происходит быстрое сдавление не только венозных, но и артериальных сосудов, что, естественно, ведет к быстрому некрозу ущемленного органа.
Чаще всего ущемление наблюдается у больных, длительно страдавших грыжами. Гораздо реже ущемление может наступить у лиц, ранее считавших себя здоровыми. Чаще ущемление паховых грыж происходит в наружном отверстии пахового канала. Ущемление во внутреннем отверстии пахового канала наблюдается сравнительно редко и носит обычно характер пристеночного (Рихтеровского) ущемления. Диагностировать пристеночное ущемление наиболее сложно в связи с отсутствием классических симптомов странгуляционной кишечной непроходимости. Для диагностики ущемлений во внутреннем отверстии пахового канала у мужчин необходимо проведение пальцевого исследования пахового канала через наружное паховое отверстие. Наиболее постоянным симптомом, выявляемым при обследовании больных с ущемленными паховыми грыжами, считается симптом Барышникова. Суть этого симптома заключается в появлении или усилении острой
боли в области грыжевых ворот при поднятии вытянутой ноги на стороне ущемления. Феномен этого симптома объясняется сокращением сухожилий и мышц, окружающих грыжевые ворота. Сокращение их приводит к еще большему сдавлению ущемленного органа, обусловливая появление или усиление болей.
В 95% случаев у больных с паховыми грыжами ущемленными оказываются петли кишок с развитием симптомокомплекса острой странгуляционной кишечной непроходимости. Чаще ущемляется петля тонкой кишки, гораздо реже - толстой. Ущемление кишечной петли, как правило, сопровождается схваткообразными болями в животе, нередко появлением асимметрии живота, усилением кишечной перистальтики, появлением симптомов Спасокукоцкого (шум падающей капли), Склярова (шум плеска), симптома Обуховской больницы или Хохенега.
Ущемление большого сальника при паховых грыжах наблюдается реже и сопровождается менее бурной клинической картиной, чем при ущемлении кишок. Развитие некротических изменений в ущемленном участке сальника происходит постепенно с последующим образованием воспалительного инфильтрата, а нередко флегмоны грыжевого мешка. Содержимым грыжевого мешка при ущемлении паховых грыж может оказаться слепая кишка и червеобразный отросток, придатки матки, жировые подвески толстой кишки, мочевой пузырь. К редким наблюдениям относится ущемление Меккелева дивертикула подвздошной кишки - так называемая грыжа Литтре (Littre).
Дифференциальную диагностику ущемления паховых грыж необходимо проводить с невправимой паховой грыжей, паховым лимфаденитом, а также метастазами опухолей в паховые лимфатические узлы, водянкой оболочек яичка, острым орхитом.
Кардинальное отличие невправимой паховой грыжи от ущемленной - отсутствие клинических симптомов кишечной непроходимости, мягкоэластическая консистенция грыжевого выпячивания, отсутствие напряжения и резкой болезненности в нем.
Острый паховый лимфаденит может быть принят за флегмону грыжевого мешка ущемленной паховой грыжи. Детальный анализ анамнеза заболевания позволяет установить признаки постепенного развития воспалительного процесса в паховой области. Объективно, как правило, обнаруживают гиперемию кожного покрова над увеличенными, малоподвижными, болезненными лимфатическими узлами. Не всегда удается выявить входные ворота инфекции. Однако отсутствие клинических признаков кишечной непроходимости в большинстве случаев помогает избежать диагностической ошибки.
Чаще всего ущемляются косые паховые грыжи с узкими грыжевыми воротами. При ущемлении паховой грыжи, как правило, по ходу пахового канала появляется припухлость, нередко распространяющаяся на область паховой складки и мошонку на стороне ущемления. В зависимости от величины грыжевого мешка припухлость может определяться только в проекции пахового канала или за его пределами. Такая припухлость имеет шаровидную или овальную форму, а при ущемлении в наружном паховом кольце может быть слегка подвижной. Нередко распространение такой припухлости на мошонку и подвижность ее при пальпации становится причиной диагностической ошибки. Недооценка анамнестических данных и поверхностный, невнимательный осмотр больного становятся основной причиной, по которой ущемление паховой грыжи принимается за воспалительный процесс при водянке оболочек яичка. Иногда водянка оболочек яичка ошибочно диагностируется как ущемленная паховая грыжа. Дифференциальная диагностика основывается, прежде всего, на данных пальпации, позволяющей отчетливо определить границы «опухоли». При водянке выпячивание чаще округлой или овальной формой, тугоэластической консистенции и остается безболезненным при пальпации. Один из методов дифференциальной диагностики водянки оболочек яичка c ущемленной паховой грыжей - диафаноскопия. При водянке яичка, в отличие от ущемленной паховой грыжи, при диафаноскопии выявляют симптом просвечивания, основанный на том, что водяночная жидкость прозрачна и пропускает свет. Ущемленная грыжа не просвечивается, резко болезненна при пальпации и сопровождается клинической картиной острой кишечной непроходимости.
Ущемленные бедренные грыжи
Частота бедренных грыж не превышает 5-8% от общего числа всех грыж живота. Бедренные грыжи большей частью встречаются у женщин во второй половине жизни. Редко бедренные грыжи встречаются у девушек до 20 лет. У детей бедренные грыжи встречаются крайне редко. Соотношение бедренных грыж у мужчин и женщин составляет 1:4-1:5, что объясняется особенностью анатомического строения таза женщин.
Частое возникновение бедренных грыж у женщин связывается с повторными беременностями и большей шириной таза. Бедренные грыжи никогда не бывают врожденными. Анатомо-физиологическими предпосылками, способствующими возникновению бедренных грыж, становятся растяжения и разволокнения связочного аппарата области
бедренного канала. У здоровых людей бедренного канала не существует, он образуется при формировании бедренной грыжи. Предрасполагающие и производящие факторы, способствующие формированию бедренных грыж, - те же, что и при паховых грыжах. Необходимо подчеркнуть, что в возникновении бедренных грыж основную роль играет фактор несоответствия нарушений динамического равновесия между часто изменяющимся внутрибрюшным давлением и способностью связочного аппарата области бедренного канала противостоять этим изменениям. Такие несоответствия чаще всего возникают у женщин во время повторных беременностей и родов. Тяжелый физический труд, ожирение, запоры также служат производящими факторами в формировании бедренных грыж.
Следует коротко напомнить о топографии бедренных грыж. Бедренная грыжа выходит ниже паховой связки в области бедренного треугольника. Необходимо напомнить, что пространство между паховой связкой и верхним краем лобковой кости за счет подвздошно-гребешковой связки (lig. iliopectineum) делится на две части: сосудистую лакуну(lacuna vasorum) и мышечную(lacuna musculorum). Медиально между паховой связкой и гребешковой фасцией располагается бедренный канал(canalis femoralis) - пространство, ограниченное лакунарной связкой и бедренной веной. Здесь проходят бедренная артерия, бедренные вены, лимфатические сосуды, нервы. Сосудистая лакуна, в чьей медиальной части располагается бедренное кольцо(anulus femoralis), служит основным местом образования бедренных грыж. Диаметр бедренного кольца у женщин в норме не превышает 2 см. Бедренное кольцо - внутреннее отверстие бедренного канала, то есть грыжевые ворота. Длина бедренного канала не превышает 3-4 см. Книзу от внутреннего отверстия бедренного канала лежит овальная ямка, являющаяся наружным кольцом; через нее проходит большая подкожная вена бедра(vena saphena magna).
Необходимо помнить о вариантах топографии сосудов в зоне бедренного канала. В большинстве случаев повреждение бедренной вены, являющейся частью латеральной стенки бедренного канала, возможно при грубых манипуляциях во время выделения грыжевого мешка, пластики грыжевых ворот. Определенную опасность представляет вариант топографии запирательной артерии (a. obturatoria): она отходит от нижней эпигастральной артерии(a. hypogastrica) и, направляясь спереди назад и сверху вниз к запирательному каналу, интимно прилежит к шейке грыжевого мешка, охватывая ее с трех сторон. В этом случае внутреннее отверстие бедренного канала оказывается окруженным спереди, изнутри и отчасти сзади артериальным сосудом, чье ранение при рассечении ущемляющего кольца кнутри (через лакунарную связку) или
кверху (через паховую связку) чревато повреждением данной артерии и опасным кровотечением.
N.B. Следует помнить, что рассечение ущемляющего кольца при медиальных бедренных грыжах следует производить с медиальной стороны грыжевого мешка, чтобы избежать ранения сосудов. Самым частым и самым опасным осложнением бедренных грыж становится их ущемление. Частота ущемления бедренных грыж, по литературным данным, колеблется от 20 до 55%. Ущемление происходит вследствие того, что края бедренного кольца плотны, мало податливы, а бедренный канал очень узок. Естественно, что среди больных с ущемленными бедренными грыжами преобладают женщины пожилого и старческого возраста. Малые размеры грыжевых ворот при бедренной грыже служат основной причиной частых ущемлений, протекающих с тяжелыми деструктивными процессами в ущемленном органе.
Диагностика ущемленных бедренных грыж в ряде случаев представляет определенные трудности. У тучных больных при малых размерах грыжевого выпячивания диагностика бедренной грыжи чрезвычайно трудна. Особенно трудно диагностируются пристеночные (Рихтеровские) ущемления, поскольку они достаточно часто не сопровождаются симптомами острой кишечной непроходимости.
Острый болевой синдром, возникающий в паховой области, невправимость и болезненность при пальпации грыжевого выпячивания служат наиболее постоянными клиническими проявлениями ущемлений бедренных грыж. Следует помнить, что при ущемлении бедренных грыж некротические изменения в ущемленном органе наступают очень быстро. Чаще ущемленным оказывается участок большого сальника, гораздо реже наблюдается ущемление петли тонкой кишки, еще реже - толстой кишки. Нередко из-за позднего обращения больных за медицинской помощью у больных с ущемленной бедренной грыжей наблюдаются резкая гиперемия кожи, отечность тканей, болезненность при пальпации, принимаемые за картину острого лимфаденита. Непостоянным, но достаточно часто наблюдаемым симптомом ущемления бедренной грыжи, является симптом Хаушипа - режущая острая боль в ноге на стороне ущемления грыжи.
Серьезные диагностические трудности часто связаны с диагностикой редких форм бедренных грыж. Так, бедренная грыжа мышечной лакуны - грыжа Гессельбаха, выходящая под пупартовой связкой и спускающаяся во влагалище подвздошно-поясничной мышцы, из-за плоской формы нередко с трудом может быть обнаружена при пальпации. К редким формам бедренных грыж относится так называемая грыжа Клокэ -
выходящая через наружное отверстие бедренного канала и подходящая под гребешковую фасцию. Локализуется на гребешковой мышце, расслаивая ее, иногда может проникать между гребешковой и длинной приводящей мышцей бедра. К крайне редким наблюдениям ущемлений бедренных грыж относится бедренный вариант грыжи Литтре, когда содержимым грыжевого мешка оказывается дивертикул Меккеля.
Дифференциальную диагностику ущемлений бедренных грыж приходится чаще всего проводить с ущемлением паховой грыжи. Особенно трудно выявить такое ущемление у полных женщин, когда становится сложно четко определить расположение пупартовой связки. В этих ситуациях пространственное определение расположения грыжевидной припухлости выше или ниже линии, соединяющей tuberculum pubicum соspina iliaca anterior superior, позволяет с определенной степенью достоверности говорить о виде ущемленной грыжи. Так, если грыжевидная припухлость располагается выше этой воображаемой линии, то это паховая грыжа, а если ниже - бедренная. Определенную значимость в дифференциальной диагностике ущемленной бедренной грыжи с паховой имеет типичная локализация выпячивания - ниже медиальной половины паховой связки. У мужчин при хорошо прощупываемой паховой связке удается пальпировать наружнее отверстие пахового канала. Даже при незначительных размерах ущемленной бедренной грыжи лонный бугорок пальпировать не удается. При паховых грыжах лонный бугорок пальпируется кнаружи от грыжевидного выпячивания - это так называемый симптом Купера.
Серьезные трудности дифференциальной диагностики ущемленных бедренных грыж с острым лимфаденитом в области скарповского треугольника возникают при поздней обращаемости больных за медицинской помощью. Тщательно собранный анамнез с установлением длительности возникновения интенсивного болевого синдрома, проявлений острой кишечной непроходимости и быстро нарастающей интоксикации должны склонять мнение хирурга в пользу ущемления бедренной грыжи. При остром лимфадените пальпируемая в паховой области опухоль имеет, как правило, четкие границы, плотно эластическую консистенцию с гладкой поверхностью. Выраженный болевой синдром и кишечная непроходимость отсутствуют.
Дифференциальная диагностика ущемленной бедренной грыжи с варикозным узлом большой подкожной вены бедра требуется лишь в случаях сочетания варикозного расширения вен и бедренной грыжи. Как правило, при варикозном расширении большой подкожной вены бедра над варикозным узлом отмечается истончение кожи, приобретающей синеватый оттенок. Консистенция такого «грыжевого выпячивания»
настолько мягкая, что при легком прижатии пальцами опухоль исчезает, но тотчас же появляется вновь при прекращении давления на нее. Для варикозного расширения большой подкожной вены бедра характерен симптом Астрова, заключающийся в исчезновении выпячивания в проекции бедренного треугольника при сдавлении большой подкожной вены в средней трети бедра. При сочетании варикозного расширения большой подкожной вены бедра и ущемленной бедренной грыжи исчезновения грыжевидного выпячивания не происходит, а резкая болезненность при пальпации и явления кишечной непроходимости свидетельствуют об ущемлении бедренной грыжи.
Ущемления чрезвычайно редко встречающихся грыж спигелевой линии, поясничных грыж, грыж седалищного отверстия, промежностных, грыж запирательного отверстия относятся к казуистике. Однако знание общих симптомов ущемления грыж и анатомического выявления топографической локализации места болевого синдрома при их ущемлении делают диагностику их не столь сложной.
