
- •Этиология и патогенез
- •Клиническая картина
- •Классификация
- •Дифференциальная диагностика
- •Консервативная терапия
- •Хирургическое лечение
- •Осложнения
- •Профилактика
- •Прогноз
- •Тромбофлебиты и флеботромбозы
- •Ультразвуковая допплерография
- •Ультразвуковое ангиосканирование
- •Радионуклидная флебография
- •Рентгеноконтрастная флебография
- •Мультиспиральная компьютерная томография
- •Операции разобщения
- •Удаление подкожных вен (флебэктомия)
- •Семиотика острого живота, ее патоморфологическая и патофизиологическая природа
- •Организационно-тактические принципы дифференциальной диагностики острого живота на госпитальном этапе
- •Процедура и последующий уход
- •Меры предосторожности
- •Пункция полости плевры
- •VV множественный (одноили двусторонний);
- •Лечение
- •Дополнительные методы исследования (уточняющая диагностика)
- •Пневмоторакс
- •Открытый пневмоторакс
- •Клапанный пневмоторакс
- •Спонтанный пневмоторакс
- •Абсцессы и гангрена легких
- •Паранеопластические процессы
- •Бактероиды
- •Порфиромонады
- •Превотеллы
- •Культуральные свойства
- •Токсины
- •Прочие возбудители газовой ганрены
- •Выделение и идентификация возбудителей
- •Возбудитель столбняка
- •Клинические проявления
- •Принципы микробиологической диагностики
- •Актиномицеты
- •Морфология и культуральные свойства
- •Патогенез поражений
- •Клинические проявления
- •Принципы микробиологической диагностики
- •Современная классификация сепсиса:
- •Клиническая картина
- •Основные черты патологии
- •Лечение
- •Закрытая травма груди
- •Переломы рёбер и грудины
- •Повреждения лёгких
- •Разрывы трахеи и крупных бронхов
- •Травма сердца
- •Разрывы аорты
- •Ранения перикарда и сердца
- •Повреждения пищевода и грудного лимфатического протока
Дополнительные методы исследования (уточняющая диагностика)
1. Рентгенологические исследования:
- рентгеноскопия - изучение функциональных симптомов, подвижности тени опухоли по отношению к другим органам и структурам;
- суперэкспонированная рентгенография;
- бронхография;
- ангиография (ангиопульмонография, селективная ангиография бронхиальных артерий);
- диагностический пневмоторакс;
- исследование скелета грудной стенки (КТ и МРТ);
- КТ других органов.
2. Радионуклидные методы (сканирование костей и других органов).
3. Чреспищеводное УЗИ (эндосонография).
4. Хирургические методы:
- пункция или биопсия (прескаленная) надключичных лимфатических узлов;
- медиастиноскопия;
- парастернальная медиастинотомия;
- лапароскопия или диагностическая лапаротомия;
- диагностическая видеоторакоскопия;
- диагностическая торакотомия.
5. Пункция костного мозга.
6. Лабораторные исследования (определение опухолевых маркеров и др.).
Необходимо отметить, что при мелкоклеточном раке легкого к обязательным методам, наряду с перечисленными, следует относить сцин-тиграфию костей, сканирование и/или КТ головного мозга, пункцию или трепанобиопсию костного мозга.
Для оценки состояния жизненно важных органов и систем организма оценивают функциональные показатели, полученные при электрокардиографии (ЭКГ), эхокардиографии, спирометрии (функция внешнего дыхания) и др.
На основании результатов перечисленных исследований устанавливают клинико-анатомическую форму заболевания и его стадию, гистологическую структуру опухоли, степень ее дифференцировки, фунциональные возможности организма больного.
Применение всего арсенала методов диагностики у каждого больного нецелесообразно. Необходим индивидуальный план обследования, который включал бы минимальное количество диагностических процедур и одновременно обеспечивал бы необходимую информацию.
Рентгенологическое исследование
Рентгенологическое исследование - один из основных методов диагностики опухолей легкого, оно позволяет у 80% больных выявить заболевание, предположить характер опухоли, определить ее распространенность, выяснить состояние внутригрудных лимфатических узлов.
Рентгенологическая семиотика основных двух форм рака легкого состоит из сочетания анатомических изменений и функциональных нарушений, обусловленных возникшей в легком опухолью и сопутствующими воспалительными изменениями. Следовательно, симптомы рака легкого - отображение как самой опухоли, так и нарушения бронхиальной проходимости, вовлечения в опухолевый процесс сосудистой системы легких, соседних органов и структур, а также воспалительных осложнений.
Диагностика центрального рака легкого
Решающее значение в рентгенологической диагностике центрального рака легкого имеют симптомы стеноза бронха (сегментарного или долевого). Стеноз проявляется экспираторной эмфиземой, гиповентиляци-ей, ателектазом, которые отчетливо видны на обзорных рентгенограммах в прямой и боковой проекциях (рис. 31-1). Эти симптомы раньше обнаруживают при эндобронхиальном росте новообразования. При экзоброн-хиальном распространении опухоль увеличивается вначале экспансивно в форме узла, и лишь по достижении им определенных размеров, при сдавлении или прорастании в бронх рентгенологически проявляются нарушения бронхиальной проходимости. Tомография, особенно в специальных проекциях, позволяет получить исчерпывающую информацию о состоянии бронхиального дерева (стенозе, окклюзии, протяженности поражения), характере и степени распространения опухоли на легочную ткань, окружающие органы и структуры (средостение, плевру, грудную стенку, диафрагму, внутригрудные лимфатические узлы). Именно поэтому у всех больных с заболеваниями легких томография - неотъемлемая составная часть рентгенологического исследования, позволяющая выявить или заподозрить стеноз, окклюзию бронха (бронхов) и оценить состояние проксимальных отделов бронхиального дерева.

Рис. 31-1. Рентгенограммы грудной клетки в прямой (а) и боковой (б) проекциях при центральном раке верхней доли левого легкого. Визуализируется ателектаз переднего сегмента верхней доли слева
Экспираторная эмфизема сохраняется в течение 1-2 мес, гиповен-тиляция - 6-8 мес, ателектаз - 4-8 мес. От появления первых симптомов заболевания до установления рентгенологического диагноза рака легкого проходит в среднем 20-24 мес. Примерно у 30-40% больных центральный рак легкого диагностируют в стадии гиповентиляции и у половины - уже при возникновении рентгенологического симптома ателектаза, являющегося лишь завершающим этапом бронхостеноза.
На сегодняшний день отчетливо прослеживается превосходство КТ над рутинным рентгенологическим исследованием в первичной и уточняющей диагностике рака легкого. Это обусловлено высокой разрешающей способностью метода, позволяющей на ранних этапах выявить семиотические признаки злокачественности. Данный метод позволяет не только диагностировать центральный рак до появления симптомов нарушения вентиляции легочной ткани, но выявить начальные его формы, включая перибронхиально (разветвленного, узлового) растущие опухоли (рис. 31-2).
Диагностика периферического рака легкого
Диагностика периферического рака легкого сложна вследствие схожести его рентгенологических симптомов с проявлениями многих забо-
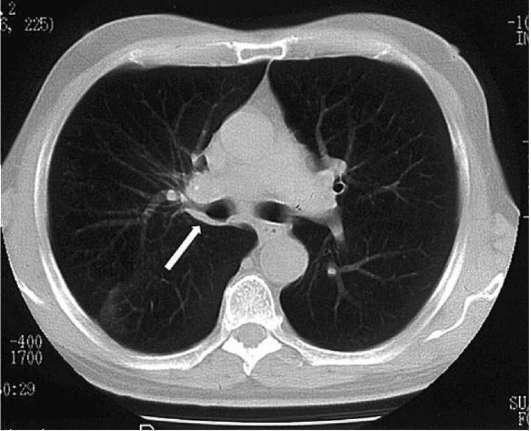
Рис. 31-2. КТ органов грудной клетки при центральном раке верхней доли правого легкого с переходом на главный бронх (указан стрелкой)
леваний. Рентгенологическую диагностику этой формы рака легкого у абсолютного большинства больных начинают с анализа патологических изменений, ранее обнаруженных на флюорограммах. Распространенное мнение о преимущественно шаровидной форме периферического рака легкого относится к опухолям, диаметр которых превышает 3-4 см (рис. 31-3). Опухоль диаметром до 2 см чаще представляет собой полигональную тень в легочной паренхиме с неодинаковыми по протяженности сторонами, напоминая звездчатый рубец. Относительно редко опухоль с самого начала имеет овальную или округлую форму. Характерна нечеткость, как бы размытость контуров тени. Опухолевая инфильтрация окружающей легочной ткани приводит к образованию вокруг узла своеобразной лучистости - так называемой corona maligna. Полицикличность и лучистость контуров более характерны для недифференцированных форм рака, что обусловлено быстрым ростом и высокими инвазивными свойствами этих опухолей. Подобная картина лучше всего выявляется на томограммах, особенно комьютерных.

Рис. 31-3. Рентгенограмма в прямой боковой проекции при периферическом раке нижней доли левого легкого
Неоспорима важность КТ в выявлении дополнительных мелких очагов (метастазов) в легочной ткани и визуальной оценке состояния медиастинальных лимфатических узлов, их взаимосвязи с соседними органами и структурами средостения.
При полостной форме периферического рака на рентгеновских снимках и компьютерных томограммах видна толщина стенок полости, внутренняя их поверхность - шероховатая, бугристая, часто наблюдают перемычки, воспалительные явления в окружающей легочной ткани (рис. 31-4). В подобных случаях
рентгенологического исследования недостаточно, поэтому показаны другие инструментальные методы диагностики.
Рентгенологическая диагностика периферического рака верхушки легкого несложна. Тень имеет слегка дугообразно выпуклую книзу границу, верхние очертания сливаются с окружающими тканями, может визуализироваться деструкция задних отрезков I-III ребер, поперечных отростков нижних шейных и верхних грудных позвонков. Характерен клинический синдром Пэнкоста.
Медиастинальная форма рака легкого рентгенологически характеризуется значительным расширением тени верхнего средостения вследствие симметричного или одностороннего увеличения средостенных лимфатических узлов, нередко сопровождаемого клиническими признаками компрессионного медиастинального синдрома. Контуры тени средостения, как правило, полицикличные, реже прямые, слегка волнистые. Увеличение лимфатических узлов одноименного корня легкого позволяет предположить в первую очередь медиастинальную форму опухоли.
Для милиарного карциноматоза легких на рентгенограммах и особенно на компьютерных томограммах характерна картина множественных мелко- и среднеочаговых теней в легочной ткани при почти полном отсутствии легочного рисунка. Отсутствие опухоли других органов позво-
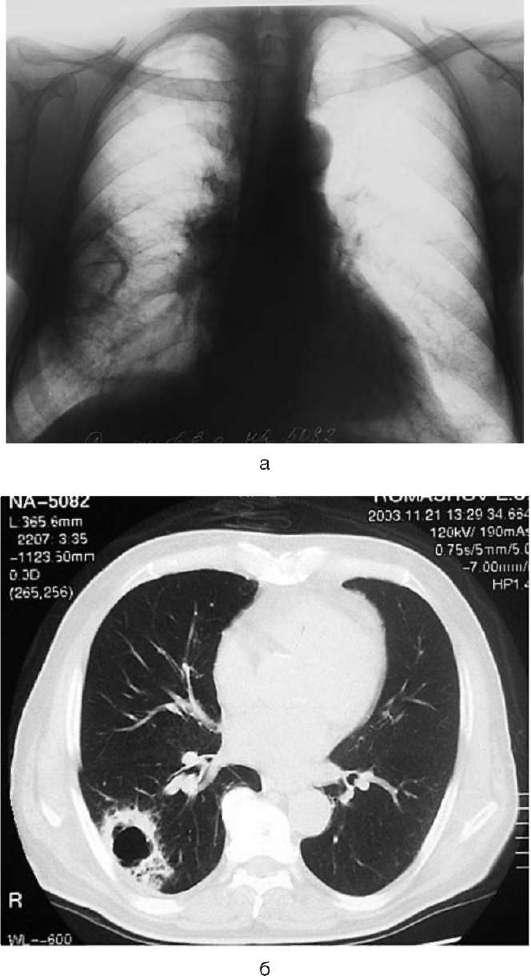
Рис. 31-4. Рентгенограмма в прямой проекции (а) и КТ (б) при полостной форме периферического рака нижней доли правого легкого
ляет утверждать, что речь идет о данной первичной атипичной форме рака легкого. Дифференциальную диагностику проводят с множественными метастазами опухолей других органов, милиарным туберкулезом, пневмокониотической и другими легочными диссеминациями.
Магнитно-резонансная томография (МРТ)
МРT не имеет преимуществ перед KT в диагностике рака легкого. Лишь в ограниченных случаях дополнительные сведения о врастании опухоли в структуры грудной стенки (позвонки) или распространении рака верхушки легкого на плечевое сплетение и подключичные сосуды влияют на выбор плана лечения или объем оперативного вмешательства.
Позитронно-эмиссионная томография
Позитронно-эмиссионная томография - метод, основанный на применении радиофармпрепарата на основе глюкозы. При поступлении в организм он накапливается опухолевыми клетками, что позволяет визуализировать очаги патологической фиксации на сцинтиграммах. Возможности метода значительно повышаются при сочетанном проведении KT, что позволяет четко отображать анатомические структуры и изучать пространственные взаимоотношения выявляемых изменений в легком.
Цитологическое исследование мокроты
Цитологическое исследование мокроты - один из первых диагностических мероприятий у больных с легочной патологией и одновременно простой способ подтверждения диагноза. Раковые клетки обнаруживают у 70% больных центральным и у 40% - периферическим раком легкого. Это исследование позволяет выявить даже прединва-зивный доклинический рак (carcinoma in situ). Выявляемость рака по мокроте, полученной после бронхоскопии, возрастает до 90 и 70% соответственно, а корреляцию цитологических и гистологических данных в отношении типа рака легкого отмечают в 82% наблюдений.
Бронхологическое исследование
Бронхологическое исследование относят к основным и обязательным методам диагностики рака легкого. Оно позволяет не только
визуально исследовать гортань, трахею и все бронхи, увидеть непосредственно опухоль, определить границы ее распространения, косвенно судить об увеличении лимфатических узлов корня легкого и средостения, но и провести биопсию для гистологического исследования, получить материал (браш-биопсию, мазки-отпечатки, соскоб или смыв из бронхиального дерева, транстрахеобронхиальную пункцию) для цитологического изучения, т.е. удается установить как топический, так и морфологический диагноз, уточнив гистологическую структуру опухоли. Морфологическая верификация диагноза достигается в 100% при центральной и в 60% случаев при периферической форме заболевания. Направленная катетеризация бронхов под рентгенологическим контролем повышает частоту морфологической верификации диагноза периферического рака до 95%. Информативность цитологического исследования пунктатов увеличенных средостенных лимфатических узлов при транстрахеобронхиальной пункции достигает 90%. Различают прямые и косвенные, анатомические и функциональные бронхоскопические признаки рака легкого.
• К прямым анатомическим признакам рака относят:
- инфильтраты слизистой оболочки в виде возвышения с бугристой, шероховатой или ровной поверхностью;
- бугристые, папилломатозные опухолевые разрастания различной формы и цвета с грибовидной гранулематозной и бугристой поверхностью;
- сужение просвета бронха эксцентрического или концентрического характера с ригидностью стенок.
- Эти признаки характерны для центрального рака с эндоброн-хиальным ростом и для периферического - с прорастанием в бронхи (рис. 31-5).
• Косвенные анатомические признаки рака:
- седлообразная, уплощенная шпора бифуркации трахеи и главных бронхов;
- уплотнение стенок бронхов, определяемое инструментальной пальпацией;
- деформация гребня межили субсегментарной шпоры;
- стертость рисунка хрящевых колец;
- рыхлая, отечная, с локальной гиперемией, легко кровоточащая слизистая оболочка;
- ограниченное расширение сосудов петлеобразного характера.
- Эти признаки бывают при центральном раке с перибронхиаль-ным ростом, при периферическом - с подрастанием к стенкам
бронхов и метастазах во внутригрудных лимфатических узлах. • Косвенные функциональные признаки рака выражаются в неподвижности одной из половин гортани, стенок трахеи и бронхов; локальном выпячивании мембраноз-ной части крупных бронхов; отсутствии ограниченной или респираторной подвижности устьев сегментарных бронхов; отсутствии передаточной пульсации сердца и крупных сосудов. Перспективны высокоинформативные специальные бронхо-
логические методики в диагностике рака легкого: хромобронхоско-пия, флюоресцентная бронхоскопия с использованием дериватов гематопорфирина и криптонового лазера, бронхорадиометрия с помощью кремниевых датчиков. Эти методики позволяют выявить рентгенонегативный и самые начальные, доклинические формы центрального рака - прединвазивный (carcinoma in situ) и микроинвазив-ный, т.е. повышают результативность истинно ранней диагностики рака легкого.

Рис. 31-5. Центральный рак верхней доли левого легкого на уровне деления верхнезонального бронха на сегментарные (эндофото)
Трансторакальная пункция опухоли
Трансторакальную (чрескожную) пункцию опухоли под ультразвуковым, рентгенологическим или КТ-контролем с цитологическим исследованием пунктата применяют при периферическом раке легкого и отсутствии морфологического подтверждения другими методами. С помощью этого метода диагноз рака удается установить в 80% случаев (при локализации опухоли в прикорневой зоне - у 60%, в средней - у 80%, плащевой - почти у 90% больных). При диаметре новообразования до 3 см (Т1) результативность метода составляет около 70%, более 3 см (Т2-Т3) - 90%. Цитологическое исследование пунктата позволяет определить гистологическую структуру опухоли примерно у 65% больных, причем у 40% из них удается установить степень
ее дифференцировки. Возможны осложнения метода: пневмоторакс, гидроторакс, кровохарканье. Описаны крайне редкие осложнения: гемоторакс, воздушная эмболия, имплантационное метастазирова-ние. Метод не применяют при патологической тени в единственном легком, подозрении на эхинококковую кисту, геморрагических диатезах, выраженной сердечно-сосудистой недостаточности и легочной гипертензии.
Медиастиноскопия
Диагностическая медиастиноскопия остается «золотым стандартом» в определении характера лимфаденопатии средостения при невозможности использования менее инвазивных методов диагностики. Ее чаще используют для биопсии претрахеальных, паратрахеальных лимфатических узлов, реже - узлов субаортальной и бифуркационной зон. Чувствительность метода составляет 70-80%. Необходимость верификации ипсилатеральных средостенных лимфатических узлов нередко обусловлена целесообразностью применения неоадъювантно-го лечения при местнораспространенном (IIIA стадии) раке легкого, а также в целях исключения метастатического поражения правых конт-ралатеральных паратрахеальных лимфатических узлов (до 1 см) при раке нижней доли левого легкого (IIIB стадии), особенно при наличии бифуркационных узлов более 3 см, что существенно влияет на прогноз и выбор метода лечения.
Парастернальная медиастинотомия
Парастернальная медиастинотомия по сравнению с медиастино-скопией обеспечивает более широкий доступ к лимфатическим узлам средостения, возможность исследования пространства впереди от верхней полой вены и дуги аорты, а также под дугой аорты и корней легких. Визуальный контроль более свободный. Возможны пальпа-торное исследование средостения и биопсия лимфатических узлов разных групп.
Видеоторакоскопия
В онкологической клинической практике видеоторакоскопия - один из завершающих этапов диагностики. Ее обычно применяют при отсутствии возможности установить характер заболевания и степень распространения опухолевого процесса стандартными методами.
Благодаря малой травматичности и широким диагностическим возможностям, видеоторакоскопию можно использовать для прицельной биопсии плевры, средостенных и корневых лимфатических узлов, ткани и узлов легкого, опухолей средостения. Гистологическое и цитологическое изучение полученного материала позволяет сделать окончательное заключение о характере и распространенности патологического процесса. Показания к диагностической видеоторакоскопии: экссудативный плеврит неясной этиологии, первичные опухоли плевры, необходимость определения стадии рака, метастазы опухоли в легком и плевре, диссеминированные заболевания легких, злокачественные опухоли средостения, лимфаденопатия средостения, необходимость уточнения природы перикардита.
Диагностическая торакотомия
Диагностическая торакотомия показана больным с очаговым поражением легкого, когда совокупность результатов перечисленных выше методов не позволяет исключить рак. Удельный вес этой операции среди всех торакотомий по поводу рака легкого составляет 10%. У каждого второго пациента выявляют относительно ранние (I-II) стадии заболевания, что дает возможность у 90% больных выполнить органосохра-няющую операцию. В целях морфологической верификации характера процесса во время операции выполняют пункцию или тотальную биопсию (плоскостную, клиновидную, сегментарную резекции). Срочное интраоперационное гистологическое исследование более информативно, чем цитологическое. В последние годы эту операцию заменяет видеоторакоскопия с аналогичными результатами. Следует отметить, что длительное динамическое наблюдение в сомнительных случаях нецелесообразно, поскольку диагностическая видеоторакоскопия или торако-томия менее опасны, чем угроза пропустить ранний рак легкого.
В целях уточняющей диагностики, т.е. определения символов N и М, применяют по показаниям дополнительные методы исследования в зависимости от поставленной задачи. Последовательность их применения следует планировать по принципу «от простых методик к более сложным». В задачу клинициста входит составление правильного индивидуального плана обследования, который включал бы минимальное количество диагностических процедур и одновременно обеспечивал бы необходимой информацией для верификации диагноза рака легкого, стадирования (включая систему TNM) и выработки оптимальной лечебной тактики.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику рака легкого необходимо проводить с большим количеством заболеваний легких, средостения, плевры и грудной стенки. Наиболее часто его дифференцируют от хронической неспецифической пневмонии, нагноительных процессов в легких, туберкулеза, доброкачественных опухолей, паразитарных кист, очагового пневмосклероза и метастазов опухолей другой локализации. Большое значение имеет сопоставление клинической симптоматики с результатами рентгенологического, бронхологического и цитологического исследований. При сомнении в доброкачественности опухоли больному показаны диагностическая видеоторакоскопия или торакотомия.
ЛЕЧЕНИЕ
Лечебная тактика при раке легкого в силу биологических особенностей заболевания и многообразия морфологических типов неоднозначна. Для правильного выбора метода лечения следует знать основные факторы прогноза: стадию заболевания в соответствии с Международной классификацией по системе TNM, гистологическую структуру опухоли и степень анаплазии, характер и тяжесть сопутствующих заболеваний, функциональные показатели жизненно важных органов и систем. Метод лечения сам по себе является одним из решающих прогностических факторов, значение которого тем больше, чем ближе вариант к радикальному.
При лечении больных немелкоклеточным раком легкого применяют следующие методы: хирургическое лечение, лучевую терапию, химиотерапию, комбинированное лечение (операцию и лучевую терапию или химиотерапию), химио- и лучевое лечение.
Хирургическое лечение
Хирургическое лечение больных с резектабельными формами рака легкого представляется наиболее радикальным методом, дающим реальные перспективы полного излечения. Основные условия радикализма операции: удаление единым блоком легкого или доли и регионарно-зависимых лимфатических узлов с окружающей клетчаткой в пределах здоровых тканей; отстояние линии пересечения бронха на 1 см от видимого края опухоли; отсутствие опухолевых клеток в краях пересеченных бронха, сосудов и дополнительно резецированных органов и тканей.
При резектабельных формах немелкоклеточного рака легкого (I, II*, IIIA* стадии) хирургическое лечение - метод выбора. Под уточнением показаний к операции при раке легкого имеют в виду не столько определение целесообразности, сколько установление принципиальной возможности выполнения хирургического пособия, чего достигают путем оценки противопоказаний.
Абсолютные онкологические противопоказания к операции на легком при раке: морфологически потвержденные метастазы в отдаленных органах (IV стадия) и лимфатических узлах надключичной (IIIB стадия), аксиллярной областей, шеи (IV стадия); обширное прорастание опухоли или метастазов в аорту, верхнюю полую вену, пищевод и противоположный главный бронх (IIIB стадия), не позволяющее выполнить их резекцию; метастатическое поражение париетальной плевры (IV стадия) со специфическим канцероматозным плевритом. Нередко в плане комбинированного лечения удается выполнить радикальную комбинированную операцию с резекцией бифуркации трахеи, предсердия, пищевода, аорты, верхней полой вены в пределах здоровых тканей.
Среди относительных противопоказаний к оперативному вмешательству наибольшее значение придают функциональной недостаточности жизненно важных органов и систем больного, т.е. функциональной неоперабельности: декомпенсированной сердечной недостаточности II и III степени; выраженным органическим изменениям в сердце, гипертонической болезни III степени, почечной или печеночной недостаточности. Перечисленные противопоказания имеют относительный характер, поскольку необоснованный отказ от операции может лишить больного перспектив выздоровления. Современные возможности анестезиологии и интенсивной терапии позволяют предотвратить нарушения функций органов и систем, особенно при адекватной предоперационной подготовке. Отказ от операции с онкологических позиций также должен быть серьезно мотивирован. Этот вопрос необходимо решать коллегиально, с обязательным участием торакального хирурга, имеющего опыт хирургического лечения рака легкого.
Основные операции при раке и других первичных злокачественных опухолях легкого - пневмонэктомия и лобэктомия, а также их варианты (расширенная и комбинированная операции). Бронхопластические операции, например лобэктомия с циркулярной резекцией бронхов, расширяют возможности хирургического метода. Выбор объема и характера операции зависит от локализации и распространенности пер* Этап комбинированного лечения.
вичной опухоли, ее отношения к окружающим органам и структурам, состояния внутригрудных лимфатических узлов.
При ранних формах центрального рака легкого (carcinoma in situ, микроинвазивном раке) в последние годы проводят фотодинамическую терапию. После введения фотосенсибилизатора (гидроксиалюминия трисульфофталоцианина и др.), который накапливается в раковых клетках, с помощью бронхоскопа осуществляют облучение опухоли лучом лазера определенной длины волны. Полученные удовлетворительные отдаленные 5-летние результаты свидетельствуют о перспективности такого метода радикального лечения без торакотомии.
У больных с низкими кардиореспираторными резервами при периферическом раке легкого и размерах опухоли до 3 см допустима классическая сегментэктомия с раздельной обработкой элементов корня сегмента, в крайнем случае - экономная резекция легочной ткани с обязательной ревизией лимфатических узлов и их срочным морфологическим исследованием. При выявлении в них метастазов минимальным радикальным объемом операции должна быть лобэктомия. В последние годы операции, включая лобэктомию, выполняют видео-торакоскопически и видеоассистированно с мини-торакотомией.
При карциноидах и саркомах легкого необходимость в пневмон-эктомии возникает в 3 раза реже, их удельный вес составляет 7-16%. Пневмонэктомия при центральном карциноиде обычно обусловлена вторичными необратимыми гнойно-воспалительными изменениями в легочной паренхиме в результате длительной обтурации главного бронха. Основные оперативные вмешательства при этих морфологических формах злокачественной опухоли легкого - органосохраня-ющие вмешательства. При высокодифференцированных карциноидах, локализованных в промежуточном или главном бронхе, возможна изолированная резекция бронха(ов) с последующем полибронхиальным анастомозом и тем самым сохранением всей легочной паренхимы. Подобные операции оправданы в случае сохранения функциональных свойств легочной ткани.
Операции на легких таят много опасностей, что иногда приводит к интра- и/или послеоперационным осложнениям, а также послеоперационной летальности. Совершенствование оперативной техники и анастезиологического пособия, а также проведение комплексной интенсивной терапии до и в раннем периоде после операции способствовали в последние годы снижению частоты послеоперационных осложнений: в ведущих торакальных клиниках она не превышает 20% при уровне летальности около 3%.
Лучевое лечение
Лучевое лечение немелкоклеточного рака легкого осуществляют по радикальной программе или с паллиативной целью. Радикальная лучевая терапия предусматривает получение длительного и стойкого эффекта в результате гибели всех клеток первичной опухоли и внутригрудных метастазов. При малодифференцированных формах рака в поле облучения включают и надключичные зоны.
Лучевую терапию проводят с помощью дистанционных у-установок, бетатрона и линейных ускорителей, генерирующих тормозное и электронное излучение. В целях увеличения радиочувствительности опухоли применяют так называемые радиомодификаторы: гипербарическую оксигенацию, искусственную гипертермию, метронидазол и др. В целях повышения устойчивости нормальных тканей облучение проводят в условиях гипоксии.
Лучевая терапия по радикальной программе (суммарная очаговая доза - не менее 60-80 Гр) возможна у больных раком легкого I-II стадии, которым хирургическое лечение противопоказано или которые отказались от него. Лучевую терапию по паллиативной программе (суммарная очаговая доза - не более 45 Гр) планируют при раке легкого III стадии.
Обычные противопоказания к лучевому лечению: обильное кровохарканье или кровотечение, опухолевый плеврит, множественные отдаленные метастазы, обширное прорастание первичной опухоли или метастазов в сосуды средостения, пищевод, трахею, лейкопения (менее 3х109/л), тромбоцитопения (ниже 10х109/л), тяжелая стенокардия, инфаркт миокарда, декомпенсированные формы легочно-сердечной, сердечно-сосудистой, печеночной и почечной патологии.
Лучевая терапия сопровождается общими и местными лучевыми реакциями и осложнениями. При лучевом пневмоните лечение прекращают и проводят активную терапию антибиотиками, сульфаниламидными препаратами, глюкокортикоидами, витаминами и др. Развитие эзофагита становится поводом для коррекции полей облучения и назначения соответствующей терапии. Симптомы общей лучевой реакции (общая слабость, снижение аппетита, нарушение сна, лейко- и тромбоцитопения, анемия, нарушения со стороны сердечно-сосудистой системы) обычно носят временный характер и требуют соответствующего лечения. Для их профилактики применяют витамины A, группы В, С, антигистаминные препараты, бронхолитические средства.
Непосредственный эффект лучевого лечения зависит от распространенности процесса, гистологической структуры опухоли, величины суммарной очаговой дозы, т.е. облучения по радикальной или паллиативной программе. У половины больных удается добиться резорбции опухоли, у 40% - уменьшения первичной опухоли и регионарных метастазов.
Химиотерапия
Химиотерапию при немелкоклеточном раке легкого проводят при противопоказаниях к хирургическому и лучевому лечению. Полихимиотерапию проводят следующими препаратами в различных сочетаниях: доксорубицином, цисплатином, винкристином, этопозидом, цикло-фосфамидом, метотрексатом, блеомицином, винорелбином, паклитак-селом, доцетакселом, гемцитабином и др. Обычно проводят до 6 курсов химиотерапии с интервалом 3-4 нед.
Объективное улучшение (частичная резорбция первичной опухоли, регионарных и отдаленных метастазов) наступает у 6-30% больных, однако полная резорбция наступает редко. Химиотерапия малоэффективна при метастазах в костях, головном мозге и печени.
Лучших результатов достигают при сочетании химиотерапии с лучевым лечением, при этом возможно одновременное или последовательное их применение. Химио- и лучевое лечение основано на возможности получения как аддитивного эффекта, так и синергизма, без суммации побочного токсического действия.
К возможным ранним токсическим реакциям при химиотерапии относятся тошнота, рвота, энтерит, диарея, флебит, цистит, дерматит и др. Наиболее частое позднее осложнение - угнетение кроветворения. Именно поэтому анализы крови повторяют не реже 2 раз в неделю и в течение 2 нед после завершения химиотерапии.
Комбинированное лечение
Повышение эффективности хирургического лечения больных не-мелкоклеточным раком легкого II-III стадии связано с разработкой методов комбинированного лечения, предусматривающего сочетание радикальной операции с лучевой терапией либо с лекарственным противоопухолевым лечением. Дополнительные методы применяют до или после операции, в редких случаях - во время нее.
Убедительных статистических данных об эффективности комбинированного лечения карциноидных опухолей легкого не получено.
Сочетание операции с химиотерапией при различных вариантах саркомы легкого оправдано. Назначение дополнительного лекарственного лечения рассматривают строго индвидуально, с учетом морфологической структуры новообразования, степени его дифференцировки и резистентности к терапии.
ПРОГНОЗ
Прогноз результатов лечения больных немелкоклеточным раком легкого весьма сложен. Лечебная тактика вследствие биологических особенностей заболевания и многообразия гистологических структур неоднозначна. Хирургическое лечение дает возможность излечить больного. Среди оперированных больных средний показатель 5-летней выживаемости составляет около 35% (рис. 31-6). Основные факторы прогноза: стадия заболевания, гистологическая структура опухоли, степень ее дифференцировки и радикальность лечения.

Рис. 31-6. Отдаленные результаты хирургического лечения больных с первичными злокачественными опухолями легкого
При IA стадии (T1N0M0) хирургический метод позволяет добиться 5-летней выживаемости у 60-80% больных, IB (T2N0M0) - у 45-65%. Предпочтительны органосохраняющие, функционально щадящие операции - лобэктомия, нередко с резекцией и пластикой бронхов с обязательным удалением клетчатки и лимфатических узлов регионарных зон. При микро- и прединвазивном раке (carcinoma in situ) более 5 лет живут до 90% больных. При этих формах допустима эндоскопическая хирургия в виде лазерной или фотодинамической терапии.
При IIA (T1N1M0) и IIB (T2N1M0, T3N0M0) стадиях комбинированное лечение (операция с лучевой терапией) позволяет продлить жизнь на 5 лет у 50-65% больных. При невозможности хирургического лечения применяют лучевую терапию по радикальной программе или химио-и лучевое лечение, добиваясь удовлетворительных результатов: 5-летняя выживаемость в среднем составляет 45%. При периферическом раке допустимы лобили билобэктомия, а при центральном раке - с резекцией и пластикой бронхов. Медиастинальная лимфаденэкто-мия - обязательный элемент операции.
При IIIA или ШБ стадии прогноз после хирургического (комбинированного) лечения неудовлетворительный, более 5 лет живут 8-30% больных. Распространенность процесса требует обширных операций типа расширенной, комбинированной пневмонэктомии с резекцией бифуркации трахеи, перикарда, предсердия, грудной стенки, пищевода, верхней полой вены, аорты и др. Лучшие результаты отмечают при плоскоклеточном раке, чем при железистом или крупноклеточном. Выживаемость больных выше при высокодифференцированных формах рака, свыше 5 лет живут около 30% больных.
Методы консервативной противоопухолевой терапии уступают хирургическому. Отдаленные результаты колеблются в значительных пределах и зависят от методики облучения, контингента больных с разной распространенностью процесса. Более 3 лет после лучевой терапии живут 4-28%, более 5 - не свыше 1-14,5%. Существенные факторы прогноза - гистологическая структура опухоли, непосредственный эффект и величина суммарной очаговой дозы. После химиотерапии все больные погибают в сроки до 3 лет.
При немелкоклеточном раке легкого IV стадии возможны лишь лекарственная противоопухолевая или симптоматическая терапия.
Мелкоклеточный рак легкого характеризуется быстрым развитием, ранним интенсивным лимфогенным и гематогенным метастазиро-
ванием и плохим прогнозом. У 80-90% больных диагностируют распространенный опухолевый процесс. Именно поэтому многие годы мелкоклеточный рак считали терапевтическим и противопоказанием к хирургическому лечению.
В настоящее время при I-II стадии возможно хирургическое лечение как этап коплексного воздействия с обязательной полихимиотерапией (до 6 курсов) в адъювантном и неоадъювантном режимах. При мелкоклеточном раке III стадии с поражением средостенных лимфатических узлов (N2) проводят консервативное лечение, сочетая химио- и лучевую терапию. Современные методики такого лечения позволяют у 80-90% больных получить непосредственный объективно регистрируемый эффект, а у 20-50% из них - полную регрессию опухоли. Достижение полной клинической ремиссии после основного курса лечения увеличивает выживаемость больных и открывает перспективу излечения.
По сводным данным отечественных и зарубежных публикаций, при мелкоклеточном раке I стадии 5-летние благоприятные исходы после комбинированного и комплексного лечения с применением хирургического составляют 42-60%, при II стадии - 20-31%, III стадии - до 20%. При IV стадии этого вида рака легкого оправдана полихимиотерапия, но прогноз неудовлетворителен.
Карциноиды - наиболее благоприятно протекающие злокачественные опухоли легкого. Значительному кличеству больных удается продлить жизнь на 15 лет и более.
В отдаленные сроки после операции по поводу саркомы легкого основной причиной смерти (75%) становится метастазирование в отдаленные органы, а у 25% - внутригрудной локорегионарный рецидив без поражения отдаленных органов. Прогностическими факторами в хирургическом лечении неэпителиальных опухолей легкого многие ученые считают размер первичной опухоли, состояние внутригрудных лимфатических узлов, гистологический тип и степень дифференци-ровки саркомы. Больные с опухолью диаметром до 3 см, независимо от степени ее дифференцировки, живут в 2 с лишним раза дольше, чем при опухоли размером 3,1-6 см, и в 3 с лишним раза дольше, чем при опухоли 6 см и более - соответственно 86, 37 и 24%. В группе низко-дифференцированных сарком, особенно диаметром более 6 см, прогноз неблагоприятен (ни один больной не доживает до 5 лет), а при высоко-дифференцированных опухолях этот срок переживают около половины больных. Существует также прямая зависимость отдаленных результа-
тов хирургического лечения больных с саркомой легкого от состояния внутригрудных лимфатических узлов. При их интактности 3-летняя выживаемость в 2 раза (62 и 29%), а 5-летняя - в 4 раза (59 и 14% соответственно) выше, чем при их метастатическом поражении. Лучшие отдаленные результаты в целом достигаются в группах ангиогенных сарком (60,2%), злокачественной фиброзной гистиоцитомы (62,5%) и нейросаркомы (55,5%), менее благоприятен прогноз при миогенных саркомах (35,2%).
Удовлетворителен прогноз при комбинированном лечении больных с первичной злокачественной неходжкинской лимфомой легкого. Пятилетняя выживаемость в целом составила 64%: при мелкоклеточной форме (низкой степени злокачественности) - 79,8% и крупноклеточной (высокой степени злокачественности) - 40%.
ПРОФИЛАКТИКА
Согласно терминологии ВОЗ, профилактические мероприятия предусматривают первичную и вторичную профилактику.
• Первичная (онкогигиеническая, иммунобиологическая, законада-тельно-правовая) профилактика - система государственных и медицинских мероприятий, направленных на устранение или резкое уменьшение воздействия на организм веществ и факторов, признаваемых в настоящее время канцерогенными и играющие значительную роль в возникновении и развитии злокачественного процесса. Основная цель гигиенической профилактики рака легкого - борьба с загрязнением вдыхаемого воздуха или уменьшение степени его загрязнения, борьба с производственными (профессиональными) вредностями и крайне вредной привычкой - курением табака.
• Вторичная, или медицинская, профилактика предусматривает планово-организационную систему обследования (диспансеризацию) населения в целях выявления, учета и лечения фоновых процессов и предопухолевых заболеваний легких - факторов повышенного риска рака легкого. К категории повышенного риска относят пациентов с хроническим бронхитом, пневмонией или туберкулезом, длительно курящих мужчин в возрасте 50 лет и старше, а также излеченных от злокачественного заболевания. Диспансерное наблюдение с периодическим обследованием этого контингента больных направлено одновременно на выявление истинно ранних форм рака легкого, лечение которых дает хорошие отдаленные результаты.
Рак верхушки легкого (опухоль Панкоста), благодаря преимущественному распространению опухолевого инфильтрата через купол плевры на задние отрезки I-II ребер, иногда на дужки нижних шейных позвонков и на ствол симпатического нерва, приводит к своеобразной клинической симптоматике, в которой превалируют боли в области плечевого сустава, плеча и синдром Горнера.
Клиническая картина атипических форм рака легкого обусловлена MTS, а первичный очаг в легком доступными диагностическими методами выявить не удается. Медиастинальная форма рака легкого выделяется в связи с особенностями, обусловленными преимущественным ростом метастатических опухолевых узлов в средостении. Она характеризуется выраженным компрессионным синдромом, степень которого зависит от локализации и размера соответствующих групп лимфатических узлов. При поражении лимфатических узлов, расположенных вокруг верхней полой вены, безымянной и непарной вен превалируют симптомы сдавления (одутловатость лица, шеи, одышка, цианоз, расширение подкожной венозной сети на грудной стенке). Преимущественно левостороннее расположение опухолевых узлов в средостении обусловливает компрессионный парез возвратной ветви блуждающего нерва с клинической картиной охриплости голоса вплоть до развития афонии. При поражении задней группы медиастинальных лимфатических узлов возможны симптомы сдавления симпатического нерва (болевой синдром) и сдавление пищевода (дисфагия).
Атипический первичный карциноз легких характеризуется множественными очаговыми MTS в легких, на фоне которых первичный очаг обычно не обнаруживается. Клинически это проявляется одышкой вследствие поражения большой дыхательной поверхности легких.
ОЖОГИ И РУБЦОВЫЕ СУЖЕНИЯ ПИЩЕВОДА
Чаще всего приходится сталкиваться с химическими ожогами пищевода, гораздо реже наблюдают термические его повреждения. Химические ожоги возникают при случайном или преднамеренном (суицидальная попытка) приеме различных химических веществ, чаще всего концентрированных кислот или щелочей. Ожоги пищевода могут вызывать и некоторые другие соединения (соли тяжелых металлов, пер-манганат калия, фенол, ацетон и т.д.).
Тяжесть химического ожога, а также его общее токсическое воздействие на организм зависят от концентрации принятого вещества, его количества, химической природы, времени воздействия на слизистые оболочки пищеварительной системы, сроков оказания первой помощи, реактивности организма.
• Щелочи вызывают глубокий и обширный колликвационный некроз (мягкое омертвение) тканей пищеварительной системы, сопровождаемый растворением белков и омылением жиров, что приводит к диффузии принятого вещества в глубоколежащие ткани.
• Кислоты обладают прижигающим и денатурирующим действием и ведут к менее глубокому коагуляционному некрозу. В связи с длительной задержкой химических веществ наиболее выраженные изменения обычно отмечают в местах физиологических сужений пищевода.
В зависимости от глубины поражения тканей различают три степени химического ожога пищевода:
• I (легкую) - повреждение поверхностных слоев эпителия слизистой оболочки;
• II (средней тяжести) - поражение слизистой оболочки на всю глубину с распространением процесса на подслизистый слой;
• III (тяжелую) - распространение повреждения на все слои пищевода, нередко с вовлечением околопищеводной клетчатки и соседних структур (плевры, перикарда, трахеи).
В клиническом течении ожогов пищевода различают четыре периода:
1) острый, который длится до 2 нед и характеризуется выраженными воспалительными и дегенеративно-дистрофическими изменениями в стенке пищевода;
2) мнимого благополучия продолжительностью 2-3 нед, в течение которого происходят отторжение некротических масс и образование грануляционной ткани, что приводит к уменьшению или полному исчезновению дисфагии;
3) формирования рубцовой стриктуры (начиная с 4-5-й недели), когда происходит замещение грануляций плотной фиброзной соединительной тканью, вновь возникает дисфагия (при химических ожогах I степени заживление происходит без формирования рубца);
4) поздних осложнений (облитерация просвета пищевода, развитие рака и др.).
Клиническая картина
Сразу после проглатывания химического вещества (острый период) развивается многократная рвота, часто с примесью крови, возникает сильная боль в полости рта, за грудиной, в надчревье, появляется рефлекторная дисфагия. Во время рвоты возможна аспирация, в результате развивается ожог гортани, трахеи, бронхов, что может привести к тяжелой пневмонии. У пострадавшего возникают страх, возбуждение, характерны бледность кожи, обильное слюноотделение, часто наблюдают осиплость голоса (вследствие распространения отека с глотки на гортань), появляются одышка, тахикардия, артериальная гипотензия. При тяжелых ожогах пищевода общее состояние больного быстро ухудшается, возбуждение сменяется адинамией, появляются холодный пот, акроцианоз, нарастают тахикардия, одышка, могут возникнуть спутанное сознание, бред. К концу первого дня температура тела повышается до 38-39 °С, уменьшается количество мочи, гемолитическое действие некоторых химических веществ может привести к почечной недостаточности. При глубоких некрозах возможна перфорация пищевода с развитием медиастинита. В наиболее тяжелых случаях пострадавшие погибают в первые часы или дни вследствие
шока или полиорганной недостаточности (летальность в остром периоде достигает 10%).
Через 7-14 дней после ожога дисфагия и боль при глотании уменьшаются (период мнимого благополучия), начинается отторжение некро-тизированных тканей пищевода. В случае глубокого некроза возможны кровотечение или перфорация пищевода. Этот опасный для жизни больного период обычно длится 2-3 нед, после чего острое воспаление стихает и начинается процесс регенерации за счет развития грануляционной ткани. Общее состояние больного стабилизируется, дисфагия уменьшается или даже исчезает вовсе, больной начинает осторожно принимать пищу через рот, что может ввести в заблуждение врачей, которые ошибочно прекращают лечение в этой стадии патологического процесса.
Через 4-5 нед после ожога пищевода грануляции начинают замещаться плотной фиброзной соединительной тканью, которая постепенно превращается в рубец (период формирования рубцовой стриктуры). Стриктуры пищевода чаще всего локализуются в области физиологических сужений. Выше рубцового сужения стенка пищевода со временем расширяется, истончается и склеротически изменяется в результате длительной задержки пищи, поддерживающей воспалительный процесс. Рубцовые сужения могут быть полными и неполными, короткими (до 3-5 см) и протяженными.
Длительно существующая стриктура пищевода может привести к развитию рака (период поздних осложнений), распространенность которого в обожженном пищеводе превышает таковую у здоровых людей.
Клинические проявления рубцовой стриктуры зависят от степени нарушения проходимости пищевода. Основной симптом - дисфагия, которая обычно сопровождается гиперсаливацией и регургитацией. Если пациент своевременно не обращается за медицинской помощью, рубцовая стриктура пищевода приводит к алиментарному истощению. Указание в анамнезе на прием химического вещества, появление через некоторое время дисфагии позволяют заподозрить образование рубцо-вого сужения пищевода.
Диагностика
Для определения локализации, протяженности и выраженности стриктуры проводят рентгеноконтрастное исследование пищевода и желудка с использованием жидкой взвеси сульфата бария или во-

Рис. 26-13. Протяженная рубцовая стриктура средней и нижней трети пищевода (рентгенограмма в боковой проекции)
дорастворимого контрастного вещества. Основные рентгенологические признаки рубцовой стриктуры пищевода: неравномерное сужение его просвета вплоть до полной облитерации, неровный, зазубренный контур на протяжении стриктуры, деформация рельефа слизистой оболочки, ригидность стенок, наличие супрастенотического расширения (рис. 26-13). Рентгенологическое исследование также позволяет выявить сопутствующие ожоговые деформации желудка. При полной облитерации пищевода желудок и отрезок пищевода ниже сужения заполняют контрастным веществом через гастростому.
Эзофагоскопия дает возможность определить степень и форму сужения, характер расширения пищевода над участком стеноза, локализацию рубцов, границы неизмененной слизистой оболочки. Ретроградная эзофагоскопия (через гастростому) позволяет уточнить нижнюю границу сужения, состояние постстенотического отдела пищевода и желудка.
Лечение
Неотложная помощь заключается в обезболивании, удалении остатков химических веществ, попавших в пищевод и желудок, и их нейтрализации. Этого достигают путем введения анальгетиков, вплоть до наркотических, а также промыванием пищевода и желудка большим количеством (не менее 10 л) теплой воды.
Лечение химических ожогов пищевода должно быть комплексным, его проводят в специализированных отделениях. Необходимо применение инфузионно-трансфузионной, противошоковой терапии, парентерального питания, антибактериальных средств. Назначают глю-кокортикоиды (гидрокортизон, преднизолон), обеспечивающие противовоспалительный эффект и лучшую регенерацию тканей. Значительно улучшают репаративные процессы сеансы гипербарической оксигена-
ции, местное облучение через эндоскоп ожоговой поверхности гелие-во-неоновым лазером. При сопутствующем ожоге дыхательных путей необходимы аспирация слизи из трахеи и бронхов и поддержание проходимости дыхательных путей, при необходимости проводят трахео-стомию. Развитие печеночно-почечной недостаточности диктует необходимость применения эфферентных методов лечения (гемодиализа, плазмафереза).
С первых дней после ожога рекомендуют прием жидких масел (подсолнечного, оливкового, облепихового, рыбьего жира). Если в течение 5-7 дней после ожога пациент не в состоянии принимать хотя бы жидкую пищу и отсутствуют условия для длительного парентерального питания, необходимо выполнить гастростомию (рис. 26-14).
Спустя 8-10 дней с момента ожога начинают бужирование пищевода, которое проводят на протяжении 1-1,5 мес. Использование раннего бужирования в 90% случаев предупреждает образование рубцового стеноза. Существует несколько методик проведения этой процедуры. Бужирование вслепую через рот представляется самой опасной из них,

Рис. 26-14. Схема различных видов гастростомии: а - по Кадеру; б - по Витце-лю; в, г - по Топроверу
так как наиболее часто осложняется перфорацией пищевода. В современных условиях его обычно проводят полыми рентгеноконтрастны-ми бужами по металлической струне-проводнику, который проводят под рентгенологическим или фиброэзофагоскопическим контролем. Бужирование показано всем больным, которым удается провести через сужение в желудок металлическую струну-проводник, и абсолютно противопоказано при стриктурах, осложнившихся образованием свищей пищевода.
В результате заживления образовавшихся во время бужирования надрывов в зоне рубцового поражения у большинства больных в последующем в различные сроки развивается рестеноз, поэтому после первичного курса подобного лечения требуются поддерживающие курсы бужирования в течение 1-1,5 лет для получения стойкого длительного расширения просвета в зоне сужения. При неэффективности поддерживающего лечения в течение этого времени необходимо решать вопрос о хирургической операции.
Хирургическое лечение
Оперативное лечение показано при полной облитерации просвета пищевода, невозможности провести буж из-за плотных рубцов, быстро возникающих после повторных курсов бужирования, рецидивах стриктуры (через 3-6 мес), сочетании ожоговой стриктуры пищевода, глотки и желудка; ожоговых стриктурах, осложненных пищеводными свищами, перфорации пищевода во время бужирования.
Выбор метода операции зависит от локализации, протяженности и степени стриктуры, наличия осложнений, сопутствующих поражений глотки и желудка, предыдущих операций, общего состояния больного. Оперативное вмешательство проводят в один или несколько этапов. У ослабленных пациентов первым этапом накладывают гастростому для полноценного питания. При постожоговом стенозе выходного отдела желудка вначале выполняют пилоропластику, гастроэнтеростомию или резекцию желудка в сочетании с гастростомией.
В зависимости от локализации и протяженности стриктуры, длины выкраиваемого трансплантата проводят местную, сегментарную, субтотальную и тотальную пластику пищевода. Местная пластика может быть выполнена при коротких (протяженностью до 3 см) стриктурах. Проводят циркулярную резекцию суженного отдела пищевода с эзофа-гоанастомозом «конец в конец» или продольное рассечение стриктуры с ушиванием разреза пищевода в поперечном направлении.
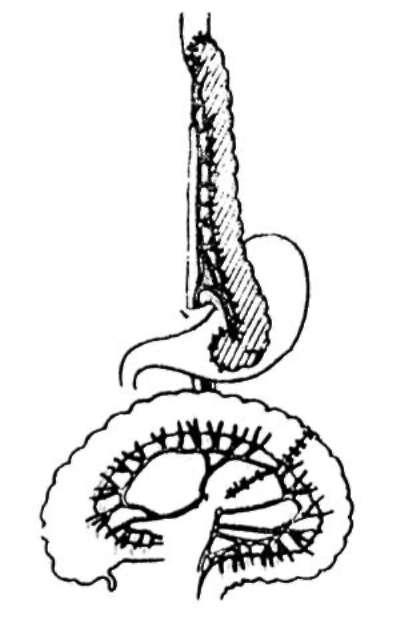
Рис. 26-15. Схема пластики пищевода толстой кишкой
При ограниченном рубцо-вом поражении пищевода может быть выполнена так называемая сегментарная пластика, для которой используют короткие трансплантаты из тонкой или толстой кишки. При протяженных сужениях пищевода показана субтотальная или тотальная пластика пищевода трансплантатом из толстой кишки, желудка или тонкой кишки. В зависимости от локализации и протяженности стриктуры анастомоз между пищеводом и трансплантатом может быть сформирован или в грудной полости, или на шее.
Для субтотальной и тотальной пластики пищевода часто используют трансплантат из толстой кишки (рис. 26-15). Он может быть сформирован как из правой, так и из левой половины толстой кишки, располагаться либо
в изоперистальтическом, либо в антиперистальтическом направлении. Трансплантат из толстой кишки проводят позади желудка, а затем на шею, чаще всего в загрудинном туннеле в переднем средостении. Нижний конец трансплантата соединяют с желудком (в некоторых случаях с двенадцатиперстной или тощей кишкой), верхний конец - с пищеводом или глоткой. Соединение трансплантата с пищеводом или глоткой чаще всего осуществляют одномоментно, но оно может быть отложено на второй этап при сомнении в адекватности кровоснабжения трансплантата или при недостаточной его длине. Непрерывность кишечника восстанавливают путем наложения анастомоза.
В настоящее время для пластики пищевода широко применяют желудок (рис. 25-16), используя как трубчатые трансплантаты, располо-женые изоперистальтически, так и целый желудок. Пассаж пищи после желудочной пластики считают более физиологичным, т.к. он обеспечивает участие в акте пищеварения всех отделов ЖКТ. Кроме того,
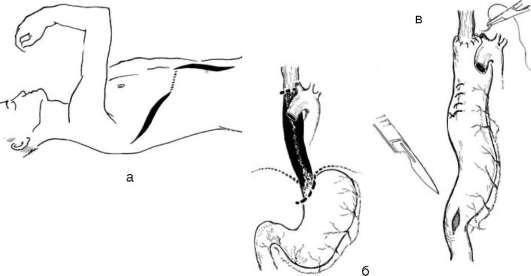
Рис. 26-16. Схема формирования искусственного пищевода из большой кривизны желудка: а - используемые доступы; б - объем удаления измененного пищевода; в - желудок перемещен в плевральную полость и анастомозирован с проксимальной порцией пищевода. Выполнена внеслизистая пилоротомия для предотвращения гастростаза
при желудочной пластике формируют лишь один анастомоз (между пищеводом или глоткой и желудком), что позволяет избежать многих осложнений. К сожалению, для пластики пищевода желудок удается использовать не всегда из-за выполненных ранее операций (резекции, гастроэнтеростомии, гастростомии).
В последние годы достаточно широко применяют метод удаления рубцово измененного пищевода. Данная операция - наиболее радикальная, но к выполнению этого вмешательства необходимо подходить индивидуально, т.к. оно достаточно травматично и значительно отягощает течение послеоперационного периода. Трансплантат проводят в заднем средостении, в ложе удаленного пищевода.
При стриктурах нижней трети пищевода может быть выполнена резекция пораженного участка с наложением анастомоза между пищеводом и желудком в грудной полости. Несостоятельность анастомоза в грудной полости приводит к медиастиниту, сопровождаемому высокой летальностью, поэтому большинство хирургов предпочитают тотальную и субтотальную пластику пищевода, при которых форми-
рование анастомоза между пищеводом и трансплантатом проводят на шее. Несостоятельность анастомоза на шее обычно не приводит к тяжелым осложнениям.
Важно знать клинические проявления особой формы острой эмпиемы плевры - пиопневмоторакса, возникающего при прорыве гнойного или гангренозного абсцесса. При этом происходит не только инфицирование плевральной полости содержимым гнойника, но и сдавление легкого воздухом и гноем, а также развитие инфекционно-токсического шока. Клиническая картина пиопневмоторакса зависит от распространенности и характера гнойного процесса в легком и плевральной полости, а также от бронхоплевральных сообщений. Тяжесть состояния больных усугубляется при напряженном пневмотораксе вследствие нарастания внутриплеврального давления, сдавления и коллапса легкого и резкого смещения средостения (рис. 143). Прорыв абсцессов легкого нередко происходит во время кашля: возникают сильные боли, одышка, бледность кожных покровов, липкий пот, цианоз. Развивается острая сердечно-сосудистая и дыхательная недостаточность: падает АД, нарастают тахикардия, одышка, удушье, цианоз. Больной принимает вынужденное положение: сидит, опираясь руками о край кровати. Грудная клетка на стороне процесса ограничена в акте дыхания, межреберные промежутки расширены, голосовое дрожание ослаблено, при перкуссии выявляется коробочный звук, аускультативно - бронхиальное дыхание с амфорическим оттенком. Требуются плевральная пункция и дренирование плевральной полости, противошоковые мероприятия, ингаляция кислорода в палате интенсивной терапии. Без оказания немедленной врачебной помощи больной умирает.
