
- •Міністество освіти і науки, молоді та спорту україни
- •4. Опис експериментальної установки.
- •5. Методика проведення дослідження.
- •6. Завдання на самостійну роботу.
- •7. Контрольні питання.
- •Література
- •4. Опис експериментальної установки.
- •5. Методика проведення досліджень.
- •6. Завдання на самостійну роботу.
- •7. Контрольні запитання.
- •Література
- •4. Опис експериментальної установки.
- •5. Методика проведення досліджень
- •6. Завдання на самостійну роботу.
- •7. Контрольні запитання.
- •Література.
- •4. Опис експериментальної установки.
- •5. Методика проведення досліджень.
- •6. Завдання на самостійну роботу.
- •7. Контрольні питання.
- •Література.
- •1S22s22p63s24s23d104p65s24d105p66s2 4s0
- •4. Опис експериментальної установки.
- •5. Методика проведення досліджень.
- •6. Завдання на самостійну роботу.
- •7.Контрольні питання.
- •Література.
- •Додатки
- •Обробка результатів лабораторної роботи :
5. Методика проведення досліджень.
Встановити на лаві ртутну лампу і ввімкнути її. Для яскравого освітлення вхідної щілини конденсор переміщати вздовж лави, намагаючись отримати на щілині зображення джерела світла.
Ввімкнути лампочки освітлювачів шкал і покажчика спектральних ліній.
Ширину вхідної щілини спектрометра встановити по можливості малою (0.030.05) мм.
Провести фокусування приладу з тим, щоб покажчик і спектральні лінії мали чіткі межі. Для цього, переміщуючи окуляр, отримати різке зображення вістря покажчика. Обертаючи барабан, знайти спектральні лінії ртуті і отримати їх ясне зображення за допомогою мікрометричного гвинта 8.
Проградуювати спектрометр по спектру ртуті (див.додаток 1) Для відліку положення спектральної лінії її центр сумістити з вістрям покажчика. Для кожної лінії відбувається її відлік по поділкам барабана.
Побудувати градуйовану криву, тобто залежність градусних ліній барабана (вісь Х) від довжини хвиль відповідних ліній. Градуйовану криву слід будувати в крупному масштабі на листі міліметрового паперу.
Встановити на лаві водневу трубку і ввімкнути її. Обертаючи барабан, зафіксувати відлік по його поділкам для водневих ліній H, H, H, і H.
За градуйованим графіком визначити довжини хвиль вказаних ліній.
Переконатися в тому, що ці довжини хвиль задовольняють формулі Бальмера.
Для кожної з ліній водню, що спостерігаються, обчислити значення постійної Рідберга R за формулою
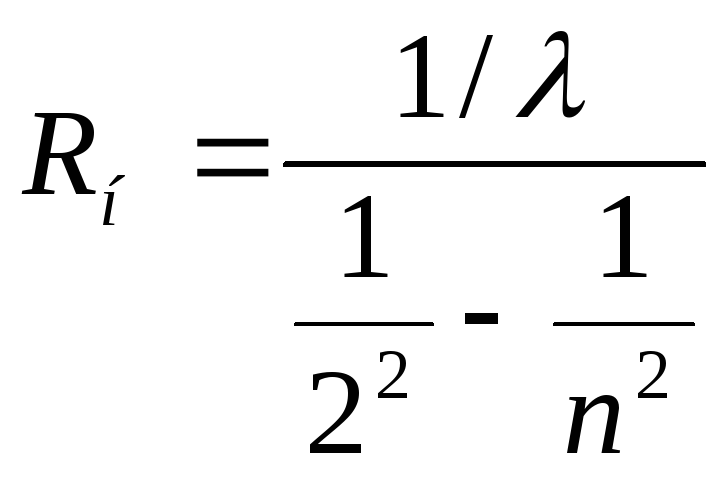
По всім вимірам визначити середнє значення Rн і визначити похибку вимірювань. Порівняти отриманий результат з табличним значенням Rн.
6. Завдання на самостійну роботу.
Виходячи з принципу відповідності Бора, отримати формулу для енергії стаціонарних станів атомів водню.
Розрахувати величину ізотопічного зсуву між лініями водню й дейтерію.
Атом водню з точки зори квантової механіки.
Характеристика термів атомів з одним зовнішнім електроном. Спін-орбітальна взаємодія.
Побудувати діаграму енергетичних рівнів атома водню з врахування спін-орбітальної взаємодії й указанням спектроскопічних позначень термів.
7. Контрольні питання.
Сформулюйте умову частот Бора.
Що називається спектральним термом? Який його фізичний зміст?
В чому полягає комбінаційний принцип Рітца-Рідберга?
Що означає узагальнена формула Бальмера?
Назовіть всі відомі спектральні лінії серій атома водню. Як вони виникають? В якому спектральному інтервалі вони розташовані?
Як фізичний зміст сталої Рідберга?
Чим відрізняються постійні Рідберга R і Rн?
Що таке ізотопічний зсув?
Запишіть формулу для стаціонарних станів атома водню. Як її можна отримати?
Що називається головним квантовим числом? Який його фізичний зміст?
Література.
Э.В.Шпольский. Атомная физика. Т.1. – М., Изд. «Наука», 1974. Гл. VIII, §§103-109 (стр. 329-347).
М.І.Білий. Атомна фізика. – Київ, “Вища школа”, 1973. Розд. III, §§3-4 (ст. 109-121); Розд. ІV, §1 (ст. 135-141); Розд. V, §1 (ст. 161-162).
Лабораторна робота №5
РІВНІ ЕНЕРГІЇ І СПЕКТРИ АТОМІВ ІНЕРТНИХ ГАЗІВ І РТУТІ.
1. Мета і задачі роботи.
Ознайомитись з теорією атомів з замкненими зовнішніми оболонками. Отримати спектри атомів одного з інертних газів (гелій, неон) і ртуті, провести їх ототожнення, побудувати діаграми рівнів енергії і нанести на них з врахуванням правил відбору відповідні переходи, що спостерігаються. Переконатися в одночасному існуванні синглетних і триплетних термів і переходів.
2. Необхідні прилади й обладнання.
Джерела збудження спектрів і блоки їх живлення, спектральний прилад (монохроматор), фотоелектрична система реєстрації випромінювання (ФЕП разом з підсилювачем постійного струму), самопишучий прилад, блок живлення фотопомножувача.
3. Теоретичні відомості.
Якщо в атомі два і більше оптичних електронів, то внаслідок їх взаємодії між собою схема енергетичних рівнів ускладнюється. Строго кажучи, стани системи електронів і ядра, що утворюють атомну частинку, можна розглядати тільки в цілому. Однак в якості наближеної і найбільш уживаної моделі реального атома звичайно використовується так зване наближення центрального або самоузгоджуваного поля. У цьому наближенні приймається, що кожний з електронів атома рухається в деякому ефективному потенційному полі, що створюється ядром та іншими електронами. Причому це поле носить центральносиметричний характер і однакове для всіх електронів (в силу їх тотожності).
Згідно сказаному, ми можемо навіть при наявності декількох електронів приписати кожному електрону ті ж самі квантові числа, які ми приписуємо одному електрону, що рухається в полі атомного ядра (атом водню і воднеподібні іони). Це наступні квантові числа:
Головне квантове число n, яке приймає цілі значення n=1,2,3,…, визначає енергію стаціонарного стану і служить мірою довжини відповідного “електронної хмари”.
Азимутальне або орбітальне квантове число ℓ, що визначає значення орбітального механічного моменту кількості руху
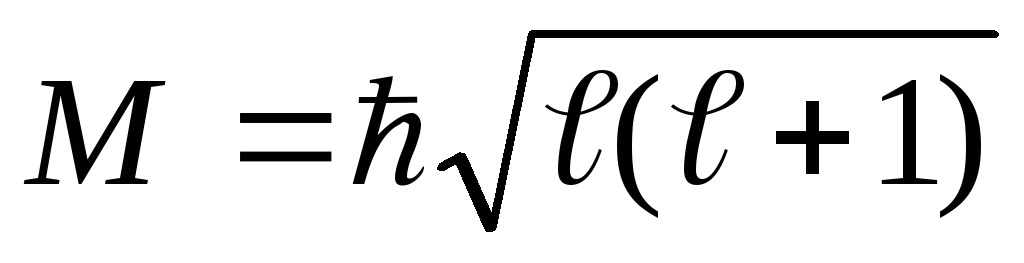 .
Приймає (при заданомуn)
значення ℓ=0,1,2,3,…,n-1.
Стани електронів з ℓ=0
називаються s-станами,
з ℓ=1
– p-станами,
з ℓ=2
– d-станами,
з ℓ=3
– f-станами
тощо. Значення головного квантового
числа n
звичайно ставиться перед символом ℓ,
наприклад говорять про 2p-
електрон (n=2,
ℓ=1).
.
Приймає (при заданомуn)
значення ℓ=0,1,2,3,…,n-1.
Стани електронів з ℓ=0
називаються s-станами,
з ℓ=1
– p-станами,
з ℓ=2
– d-станами,
з ℓ=3
– f-станами
тощо. Значення головного квантового
числа n
звичайно ставиться перед символом ℓ,
наприклад говорять про 2p-
електрон (n=2,
ℓ=1).Орбітальне магнітне квантове число me, яке дає значення проекції механічного моменту на виділений напрямок (напрямок магнітного поля, що співпадає з віссю Z)
![]()
При заданому ℓ це число приймає наступні значення: me=ℓ, ℓ-1…ℓ-1, тобто всього 2ℓ+1 значень.
Спінове квантове число ms, що визначає значення проекції спінового моменту електрона Ms на виділений напрямок згідно співвідношення
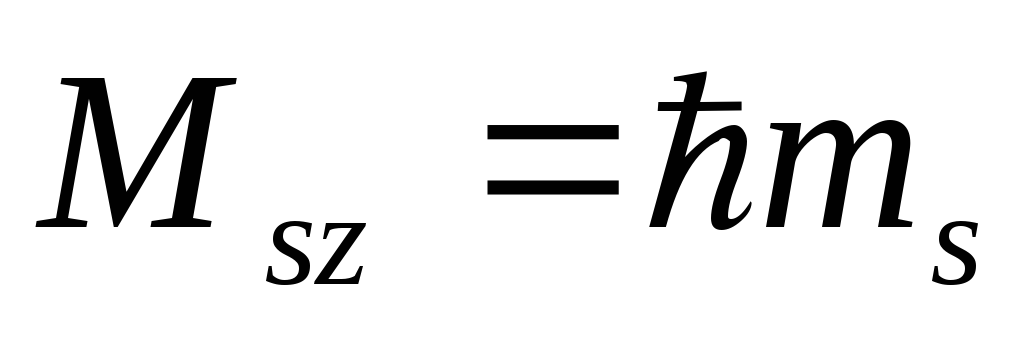 і
приймає два значення.ms=
+½
або
ms=
-½
і
приймає два значення.ms=
+½
або
ms=
-½
У таблиці наведені всі можливі стани електрона до n=4 з врахуванням обмежень для квантових чисел ℓ, me і ms. Величина ms позначено стрілкою, направленою вгору ms= +½ або вниз ms= -½
За відсутності магнітного поля стани електронів з однаковими n і ℓ (такі електрони називаються еквівалентними), але відмінними me і ms мають однакову енергію, тобто є виродженими. Для того щоб врахувати всі можливі стани електронів, будемо вважати, що атом знаходиться в магнітному полі. Крім того, що дати правильне пояснення спектрам атомів, що спостерігаються, необхідно припустити, що має місце так званий принцип Паулі, який можна сформулювати наступним чином: в атомі може існувати тільки один електрон в стані, що характеризується однаковим значенням чотирьох квантових чисел n, ℓ, me і ms, тобто два електрона, зв’язані в одному і тому ж атомі мають розрізнятись значенням принаймні одного квантового числа.
Принцип Паулі жорстко обмежує кількість електронів, зв’язаних в атомі і що мають три, два або одне визначене квантове число. Насамперед встановимо, скільки може бути в атомі електронів з трьома однаковим квантовими числами n, ℓ і me. Такі електрони мають відрізнятись значенням четвертого квантового числа ms, але ms може мати лише два значення +½ або -½. Отже, в атомі можуть бути тільки два електрона з однаковими трьома квантовими числами n, ℓ і me. Зафіксуємо тепер квантові числа n і ℓ. При даному значенні ℓ квантове число me може мати 2ℓ+1 різних значень, а для кожної трійки чисел n, ℓ і me ще ms може мати два різних значення. Отже в атомі може бути одночасно 2(2ℓ+1) електронів з двома однаковим числами n і ℓ, тобто s-електронів (ℓ=0) може бути тільки 2, p- електронів (ℓ=1) – 6, d-електронів (ℓ=2) – 10, f –електронів (ℓ=3) – 14 і т.д. Якщо в атомі є декілька електронів з однаковими значенням n і ℓ, то їх кількість позначається у вигляді відповідного показника ступені. Наприклад, сукупність електронів в основному стані в атомі магнію (їх число рівне 12) в позначається таким чином Mg (1s22s22p63s2). Сукупність електронів, що мають при заданому n однакові значення ℓ, утворюють підоболонку або підгрупу (заповнену або незаповнену). Таким чином можна говорити, наприклад, про підоболонки 1s2, 2p6, 3d10 тощо. Про розподіл електронів в атомі по станам з різними значеннями n і ℓ говорять як про електронну конфігурацію.
Нарешті, розглянемо, скільки може бути в атомі елетронів, що мають одне й те саме значення n. Враховуючи вищесказане, а також те, що при заданому n квантове число ℓ приймає значення ℓ=0,1,2,3,…(n-1), для визначення максимального числа електронів з однаковим n, необхідно знайти суму арифметичної прогресії з різницею 2:
![]()
Енергія електронних “орбіт” або їх станів з різними n, відрізняються один від одного в широких межах. Такі групи “орбіт” називаються K, L, M, N…оболонками (або шарами) у відповідності з значеннями n=1,2,3,4,…Таким чином, в K-оболонці (n=1) можуть знаходитись 2 електрона (2*12=2) в стані 1s2, в L-оболонці (n=2) – 8 електронів (2*22=8), з них 2 електрона в стані 2s2 і 6 електронів в стані 2p6. В M-оболонці (n=3) можуть знаходитись 18 електронів (2*32=18), з них 2 електрона в стані 3s2, 6 електронів в стані 3p6 і 10 електронів в стані 3d10 (див. таблицю 1).
Таблиця 1.
|
оболонка |
K |
L |
M |
N | ||||||||||||||||||||||||||
|
n |
1 |
2 |
3 |
4 | ||||||||||||||||||||||||||
|
ℓ символ |
0 1s |
0 2s |
1 2p |
0 3s |
1 3p |
2 3d |
0 4s |
1 4p |
2 4d |
3 4f | ||||||||||||||||||||
|
me |
0 |
0 |
-1 |
0 |
1 |
0 |
-1 |
0 |
1 |
-2 |
-1 |
0 |
1 |
2 |
0 |
-1 |
0 |
1 |
-2 |
-1 |
0 |
1 |
2 |
-3 |
-2 |
-1 |
0 |
1 |
2 |
3 |
|
ms |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
підоболонка |
1s2 |
2s2 |
2p6 |
3s2 |
3p6 |
3d10 |
4s2 |
4p6 |
4d10 |
4f18 | ||||||||||||||||||||
|
число електронів |
2 |
8 |
18 |
32 | ||||||||||||||||||||||||||
До цих пір були розглянуті стани окремих електронів в атомі. Тепер розглянемо квантові числа і моменти кількості руху всього атома і дамо систематику його енергетичних рівнів.
У наближенні центрального поля енергія атому в цілому, рівна сумі енергій окремих електронів, повністю визначається якщо задані квантові числа niℓi всіх N електронів (i=1,2,3,…N), тобто задана електронна конфігурація атома. Електронна конфігурація охоплює в загальному випадку декілька станів атома, що відрізняються взаємною орієнтацією орбітальних і спінових моментів електронів. У центральному полі енергія електронів не залежить від орієнтації їх моментів. Тому в наближенні центрального поля всі стани конфігурації мають однакову енергію, тобто є виродженими. У реальному атомі завдяки нецентральній електростатичній міжелектронної взаємодії й спін-орбітальної взаємодії електронів, кожний рівень енергії n1ℓ1, n2ℓ2…розщепляється на цілий ряд підрівнів (виродження знімається). Практично виявилось достатнім будувати систематику цих підрівнів на основі двох граничних підходів, коли одна з вказаних вище взаємодій вважається малою порівняно з іншою.
З точки зори наочної векторної системи атома взаємодію електронів розглядають як процесію векторів їх моментів кількості руху навколо векторів деяких сумарних моментів. Величини сумарних моментів, що характеризують визначену взаємну орієнтацію моментів електронів, а отже й енергії їх взаємодії, служать для класифікації станів атома в цілому. Різні схеми додавання моментів електронів в ті чи інші сумарні моменти відповідають, як прийнято казати, різним типам зв’язку електронів в атомі.
Для
більшості елементів основну роль грає
електростатична взаємодія, яке зумовлює
так званий нормальний
тип зв’язку.
Її також називають L-S-зв’язком
або зв’язком Рассела-Саундерса. При
нормальному типу зв’язку вектори
орбітальних моментів
![]() і
вектори їх спінових моментів
і
вектори їх спінових моментів![]() окремо додаються в сумарні вектори
окремо додаються в сумарні вектори![]() і
і![]() :
:
![]()
Терми
нормального зв’язку характеризуються
квантовими числами L
і
S,
які
визначають довжини векторів
![]() і
і![]() згідно зі співвідношенням
згідно зі співвідношенням
![]()
![]()
Спін-орбітальна
взаємодія моментів електронів, яка у
випадку нормального зв’язку є слабою,
приводить до прецесії векторів
![]() і
і![]() навколо вектора
навколо вектора![]() повного моменту кількості руху атома
повного моменту кількості руху атома![]() .
.
Величина
повного моменту кількості руху
визначається співвідношенням
![]() ,
деj
– ціле або напівціле число у відповідності
з тим, чи є S
цілим чи напівцілим. Квантове число j
називається внутрішнім квантовим
числом. Воно приймає слідуючи значення:
,
деj
– ціле або напівціле число у відповідності
з тим, чи є S
цілим чи напівцілим. Квантове число j
називається внутрішнім квантовим
числом. Воно приймає слідуючи значення:
J=(L+S), (L+S-1), (L+S-2)…|L-S|.
У
результаті терм з даними L
і S
розщепляється на ряд мультиплетних
рівнів з різними значеннями квантового
числа j.
Мультиплетність
термів ǽ
=2S+1
може приймати різні цілочислені значення.
Терми з мультиплетністю Х=1
(при S=0)
називаються синглетними, терми з ǽ
=2
(S=![]() )
– дублетними, з ǽ
=3
(при S=1)
– триплетними
тощо. Мультиплетність атомного терму
буде непарною для парного числа електронів
і парною для непарної кількості
електронів.
)
– дублетними, з ǽ
=3
(при S=1)
– триплетними
тощо. Мультиплетність атомного терму
буде непарною для парного числа електронів
і парною для непарної кількості
електронів.
Позначення термів атома відбуваються у відповідності зі значеннями квантового числа орбітального моменту L. При L=0,1,2,3,… терми називаються відповідно S, P, D, F… - термами (символи термів).
Розрізняють парні й непарні терми атома у відповідності з тим чи є сума ℓі парною чи непарною.
У
підсумку рівні енергії атома характеризують
заданими значеннями L,
S,
j
і парністю за допомогою прийнятого
позначення 2S+1Lj(0),
де зверху зліва біля символу терму
ставиться мультиплетність терму ǽ
=2S+1,
а справа знизу вказується значення
повного моменту електрона j.
Парність станів відмічають індексом
справа зверху від L
(0-непарний стан, парні стани ніяк не
позначають). Наприклад, 2P3/20
позначає
непарний дублетний рівень, для якого
L=1,
S=![]() і
j=
і
j=![]() .
Іноді до символу терму додається вся
електронна конфігурація в цілому,
наприклад, 1s22s22p6
3P1.
.
Іноді до символу терму додається вся
електронна конфігурація в цілому,
наприклад, 1s22s22p6
3P1.
Оптичні переходи між мультиплетними термами у випадку нормального зв’язку підкоряються правилам відбору, які дозволяють переходи тальки при певних змінах квантових чисел. Для дипольного випромінювання існують дів строгих правила відбору: j=0, 1 з обмеженням j=0 / j=0 (/ означає “не комбінує з”) і правило Лапорта, що говорить, що парні терми комбінують тільки з непарними і непарні терми комбінують тільки з парними. Крім того, з добрим ступенем наближення (особливо для легких елементів) виконуються наступні правила відбору:
L=1, S=0
Друге з цих правил носить назву інтеркомбінаційної заборони. Воно забороняє переходи між термами різної мультиплетності. Згідно першому з цих правил (L=1) терми S комбінують тільки з термами P, терми P – тільки з термами S і D, терми D – тільки з термами P і F. Рівні, з яких по тим чи інших правилам відбору оптичні переходи забороняються називаються метастабільними. Час життя таких рівнів великий.
Розглянемо тепер більш детально діаграми енергетичних рівнів атомів гелію, неону і ртуті, які вивчаються в даній роботі.
Атом гелію. Атом гелію, як відомо, має тільки два електрона і тому є двохелектронною системою в чистому вигляді. Основний стан атома He – 1s2 1S0. З-за малості спін-орбітальної взаємодії тут особливо чітко проявляється розподіл переходів на синглетні й триплетні.
Схема рівнів атома гелію з указівкою їх енергій (в електрон-вольтах) представлена на рис.3.
Перевищення першого збудженого синглетного рівня 1s2s 1S0 над більш низьким триплетним рівнем 1s2s 3S1 (в дійсності він є одиночним внаслідок L=0) складає 0.8 еВ. Синглетні терми комбінують один з одним, даючи серії аналогічно серіям лужних металів. При цьому головна серія 1S2 – n1P1 лежить в вакуумному ультрафіолеті.
Триплетні терми комбінують між собою і також дають серії, що лежать у близькій до ультрафіолетовій, видимої в інфрачервоної області спектра. Серії складаються з триплетів. Триплетна структура для гелію є дуже вузькою – порядку 1 см-1.
Інтеркомбінаційні переходи між синглетними і триплетними термами дуже слабі. Однак при певних умовах вдається спостерігати інтеркомбінаційну лінію =591,4 Å, що відповідає переходу 1s2p 3P1 – 1s2 1S0. Внаслідок слабкості інтеркомбінаційних ліній спектр гелію розкладається на дві практично незалежні системи ліній: синглетну – парагелій і триплетну – ортогелій. Така будова спектру гелію призвела до припущення про наявність двох різних хімічних елементів. Лише через декілька років з’ясувалось, що це зв’язано з двома типами станів атому гелію, переходи між якими заборонені правилом . Фізично це означає, що перехід ортогелію в парагелій зв’язаний з переорієнтацію спіна.
Нормальним термом атома гелію є синглетний 1S0 – терм. Оскільки наступним по висоті є триплетний терм, не комбінуючий з нормальним, то попадаючи яким-небудь чином (наприклад, шляхом зіткнень) в стан 1s2s 3S4, атом гелію лишається в метастабільному стані. Подвійна заборона оптичного переходу 3S → 1S (S0 і L=0) робить можливими лише неоптичні шляхи переходу атома з метастабільного стану в нормальний. Типовий час життя атома в метасбільному стані порядку мілісекунд, а для звичайних (дозволених) рівнів він має величини порядку 10-8-10-9 сек. Ряд важливіших явищ, зокрема стимульоване випромінювання, зв’язані як раз з властивістю атомів накопичувати енергію в метастабільних станах.
Статична вага (G=2j+1) ортогелію втричі більше статистичної ваги відповідних термів перигелію. Тому лінії ортогелію втричі інтенсивніше ліній парагелію.
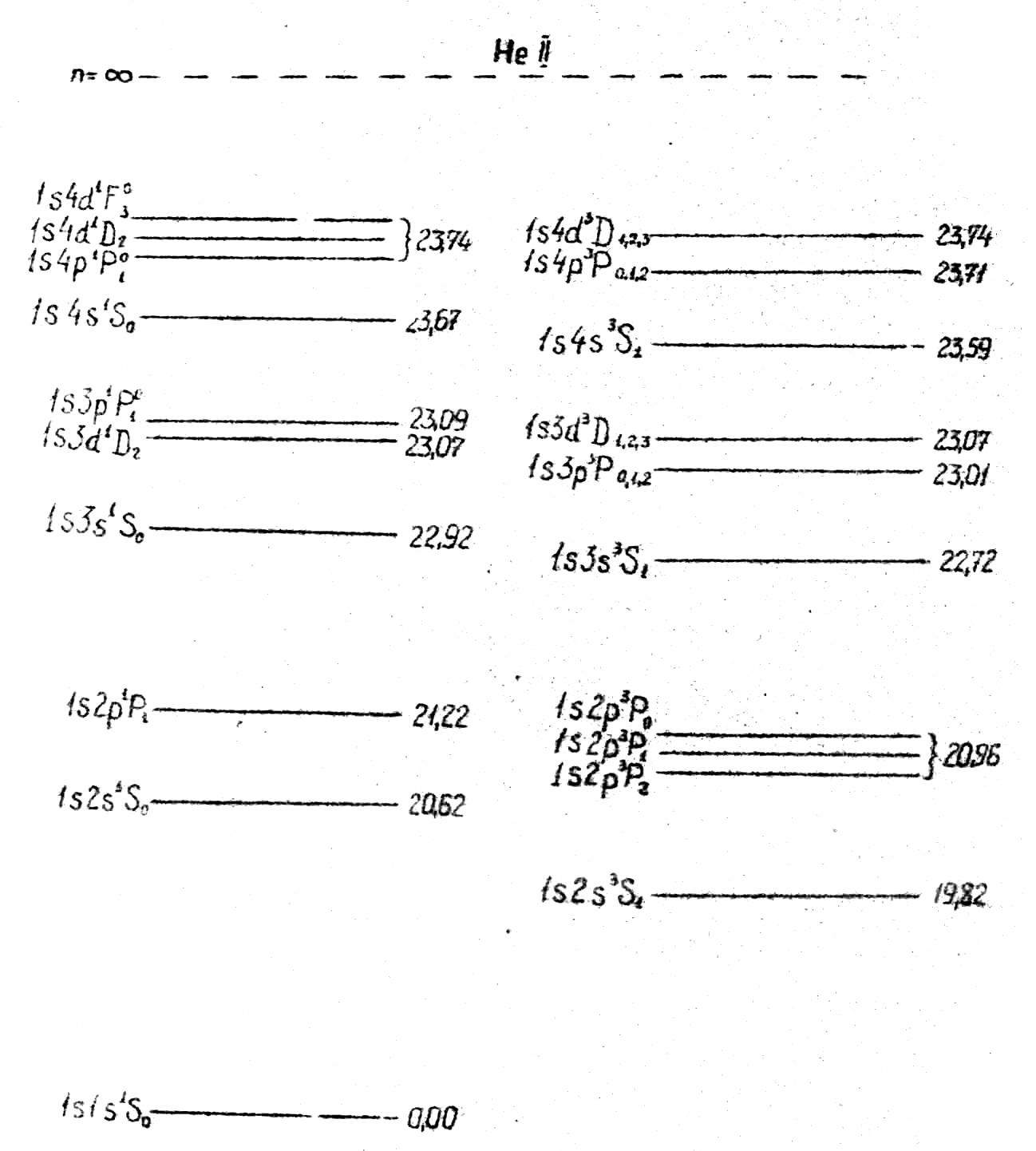
Рис.2. Діаграма енергетичних рівнів атома гелію.
Атом ртуті. Атом ртуті відноситься до лужноземельних елементів. Спектр атома ртуті є надзвичайно важливим з точки зору лабораторних досліджень, тому легко отримується за допомогою такого поширеного джерела світла, як ртутна лампи.
Атоми ртуті так само як і атом гелію має два зовнішніх електрона. Електрона конфігурація атома Hg така:
