
- •Міністество освіти і науки, молоді та спорту україни
- •4. Опис експериментальної установки.
- •5. Методика проведення дослідження.
- •6. Завдання на самостійну роботу.
- •7. Контрольні питання.
- •Література
- •4. Опис експериментальної установки.
- •5. Методика проведення досліджень.
- •6. Завдання на самостійну роботу.
- •7. Контрольні запитання.
- •Література
- •4. Опис експериментальної установки.
- •5. Методика проведення досліджень
- •6. Завдання на самостійну роботу.
- •7. Контрольні запитання.
- •Література.
- •4. Опис експериментальної установки.
- •5. Методика проведення досліджень.
- •6. Завдання на самостійну роботу.
- •7. Контрольні питання.
- •Література.
- •1S22s22p63s24s23d104p65s24d105p66s2 4s0
- •4. Опис експериментальної установки.
- •5. Методика проведення досліджень.
- •6. Завдання на самостійну роботу.
- •7.Контрольні питання.
- •Література.
- •Додатки
- •Обробка результатів лабораторної роботи :
1S22s22p63s24s23d104p65s24d105p66s2 4s0
Схема термів атома ртуті представлена на рис.3. На схемі показані терми, що отримуються тільки при збудженні одного з 6s2-електронів, так звані нормальні терми. Стан ж другого електронна залишається при цьому незмінним – 6s.
Розглянемо резонансні лінії =2537 Å і =1850 Å. Під резонансними розуміють лінії, що виникають при переходах маж станами, один з яких є нормальним (основним).
Як вказувалось вище, для атомів важких елементів зв’язок Рессела-Саундерса справджується тільки формально. Тому у випадку атома ртуті, зокрема, резонансна лінія 2537 Å дуже інтенсивна, не дивлячись на те, що відповідає інтеркомбінаційному переходу 6s 1S0 → 6p 3P10. Однак умови збудження на вихідний рівень 6p 3P10 досить сприятливі. Справа в тому, що цей рівень заповняється не тільки за рахунок прямого збудження з основного стану (енергія переходу 4,87 еВ), але і за рахунок інших каналів збудження. При зіткненнях атомів, що знаходяться в близьких метастабільних станах 6p 3P00 і 6p 3P20 відбувається безвипромінюване заповнення рівня 6p 3P10. Крім того цей рівень заселяється каскадними переходами з більш високих збуджених рівнів. У результаті число процесів, що закінчуються висвічуванням лінії 2537 Å, виявляється досить значним.
З дуже великою ймовірністю порядку 109сек-1 відбувається резонансне випромінювання і лінії 1850 Å, що відповідає переходу 6p 1P1→ 6s 1S0. ЇЇ інтенсивність досить значна, але практично вона послаблена в результаті її сильного поглинання кварцом, з якого виготовляються балони ртутних ламп, і атмосферним повітрям.
Найбільшою інтенсивністю у видимій області володіють три лінії ртутного спектра з довжинами хвиль 5461 Å (зелена), 4358 Å (синя) і 4046 Å (фіолетова). Вказані лінії широко використовуються в лабораторній практиці, наприклад, для збудження спектрів комбінаційного розсіяння світла, для градуювання спектральних приладів і ряду інших задач.
Природно, що поряд з випадком збудження тільки одного з 6s2- електронів можливе одночасне збудження і двох електронів. При цьому виникають так звані зміщенні терми, у яких різниця проявляється не тільки в розташуванні рівнів, але й в правилах відбору. Згідно правилам відбору зміщенні терми можуть комбінувати як між собою, так і з незміщеними. При цьому найбільш інтенсивними як правило виявляються спектральні лінії, у яких ℓ1=1, a ℓ2=0.
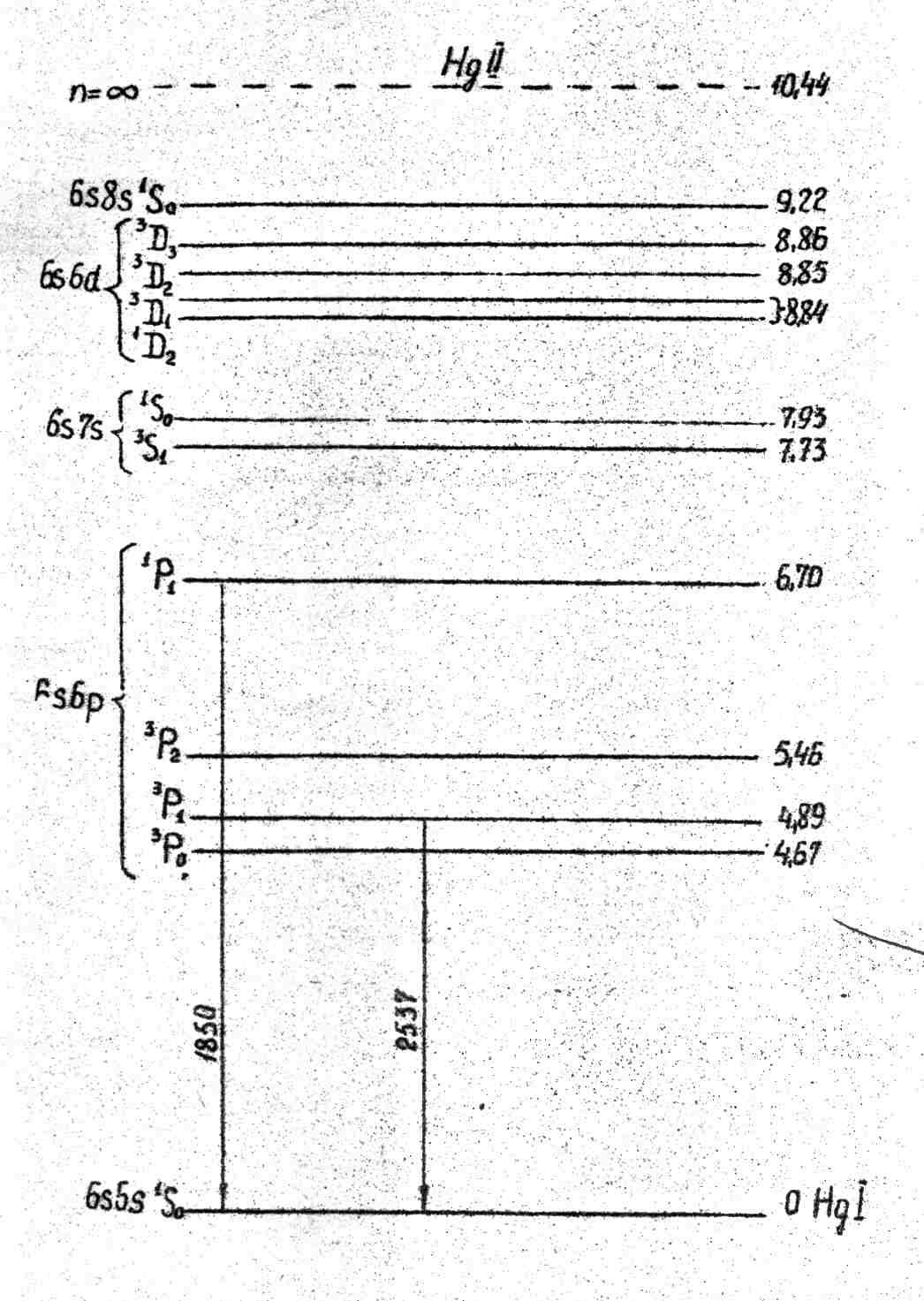
Рис.3. Діаграма енергетичних рівнів атома ртуті.
Атом неону. Атом неону, як й атоми інших інертних газів (Ar, Kr, Xe, Rn), характеризується замкнутою оболонкою, що складається з двох s- і шести p – електронів. Цій замкненій оболонці s2p6 відповідає рівність нулю всіх трьох квантових чисел L, S, j. Таким чином, єдиний стан, що відповідає електронній конфігурації s2p6 – це стан 1S00, який і є нормальним для інертних газів. На відміну від атомів з заповненою ns2-оболонкою, електрони якої порівняно легко збуджуються, для збудження одного з p- електронів, заповненої оболонки np6, вимагається значна витрата – від 21.56 еВ для неону, до 10.74 еВ для радону, тобто оболонка np6 володіє особливою стійкістю, що і зумовлює хімічну неактивність елементів, що розглядаються, при звичайних температурах. Інертний газ при цьому складається не з двохатомних молекул, як наприклад, водень, кисень, азот, а з атомів.
При збудженні одного з p- електронів виникають конфігурації типу s2p5nℓ. Наприклад, для неону це будуть конфігурації 1s22p52s, 1s22p53s…, 1s22p53p, 1s22p54p…, 1s22p53d… . Зовнішній електрон nℓ зв’язаний набагато слабше, ніж p- електрони “остова” nℓ5. З наглядної точки зору ми маємо розташовані у внутрішній оболонці еквівалентні p5-електрони і збуджений електрон, що знаходиться на периферії атома.
Спектр неону по своєму характеру не є двохелектронним спектром, оскільки оболонка nℓ5, в якій не вистачає одного p-електрона до повного заповнення дає дублетний терм 2Р0, як і один p- електрон. Однак розташування рівнів різко відрізняється від розташування рівнів для двох електронної системи при наявності нормального зв’язку. Спін-орбітальна взаємодія спінового моменту S’ і орбітального моменту L’ остова настільки значна, що їх додавання в повний момент остова j’ не порушується взаємодією з зовнішнім електроном. Тому немає змісту додавати момент L згідно схеми нормального зв’язку. Тут має місце так званий j-j – зв’язок.
Завдяки дуже значним енергіям збудження спектр атомів інертного газу розпадається на спектр, що лежить в вакуумній ультрафіолетовій області і отримується при переходах з високих збуджених рівнів на основний рівень, в спектр, що лежить в інфрачервоній, видимій і ультрафіолетовій області і що отримується при переходах між збудженими рівнями. Завдяки великій кількості таких рівнів цей спектр досить складний. Відмітимо, що в видимій області для неону характерна наявність інтенсивних ліній в червоній області, а для аргону – в синезеленій області. Це використовується в неонових і аргонових розрядних трубках, що застосовуються для світних рекламних надписів.
Загальна схема рівнів неону, що дають спектральні переходи в видимій області спектру, наведена на рис.4. Чотири терми 3P0,1,20 і 4P10, що відповідають електронній конфігурації 2s22p53s розташовані на 16.54-16.77 еВ вище нормального рівня. Терми 3P00 і 3P20 метастабільні. Вище лежить група з 10 термів, що відповідають електронній конфігурації 2s22p53p і ще вище – з 12 термів, що відповідають конфігурації 2s22p53d.
За загальними правилами переходів в спектрі неону комбінують між собою парні і непарні терми. Так, з 10 термів, що відвідають конфігурації 2p53p (парні), комбінують з термами, що відповідають конфігурації 2p53S (непарні). При цьому виконується правило відбору j=0+1 (крім випадку j1=0j2=0). При переходах між цими термами випромінюється характерна для неону група червоних ліній.

Рис.4. Діаграма енергетичних рівнів атома неону.
