
- •Розділ I літературний огляд
- •1.1. Основні характеристики клімату Закарпатської області
- •1.1.1. Клімат міста Ужгород
- •1.1.2. Ужгород – заручник власного розташування.
- •1.2. Характеристика снігового покрову Закарпатської області
- •1.3. Характеристика та особливості снігового покрову як об’єкта хімічного аналізу
- •Розділ II експерементальна частина
- •2. Техніка безпеки та охорона праці при виконанні дипломної роботи
- •2.1. Вибір ділянок пробовідбору та та обґрунтування критеріїв оцінки якості проб талого снігу
- •2.3. Пробовідбір
- •Опис проб
- •2.4. Визначення параметрів якості розтоплених проб снігу
- •2.4.1. Визначення жорсткості води
- •2.4.4. Визначення загальної лужності
- •2.4.5. Визначення hco
- •2.4.7. Визначення загальної мінералізації
- •2.4.8. Аргентометричне визначення Хлору
- •2.4.9. Турбідиметричне визначення сульфатів
- •Розділ III результати та їх обговорення
2.4.4. Визначення загальної лужності
В звичайних природних водах лужність залежить в основному від присутності гідрокарбонатів лужноземельних металів, в меншій мірі – лужних.
Хід визначення.
В конічну колбу відбираємо 100 мл проби води, додаємо 2-4 краплі (0,1 мл) індикатора метилоранжа. Продуваємо повітрям 2-3 хвилини. Титруємо 0,1 н розчином HCl до переходу забарвлення проби з жовтого в оранжеве. Якщо аналіз виконувати без продувки проби повітрям в розрахункову формулу вводять коефіцієнт 1,04 (тобто збільшують лужність на 4%).
Лужність(мг-екв/дм3)=![]()
де: А – кількість мл розчину HCl, яким титрують пробу;
N – нормальність розчину HCl;
V – об’єм досліджуваної води, мл;
К – поправка до нормальності розчину HCl (40).
2.4.5. Визначення hco
Якщо відсутні CO![]() ,
то HCO
,
то HCO![]() можна
визначити розрахунковим методом (через
лужність) в мг/дм3.
можна
визначити розрахунковим методом (через
лужність) в мг/дм3.
HCO![]() =61
.
лужність(мг-екв/дм3)
=61
.
лужність(мг-екв/дм3)
61 – екв. маса HCO![]() .
.
При рН води менше
8,3 визначають присутні HCO![]() (40).
(40).
2.4.6. Розрахунковий метод визначення Na+ та К +
Розрахунковий метод (40):
(Na++К+)(мг-екв/дм3)=![]() мг-екв/дм3(
мг-екв/дм3(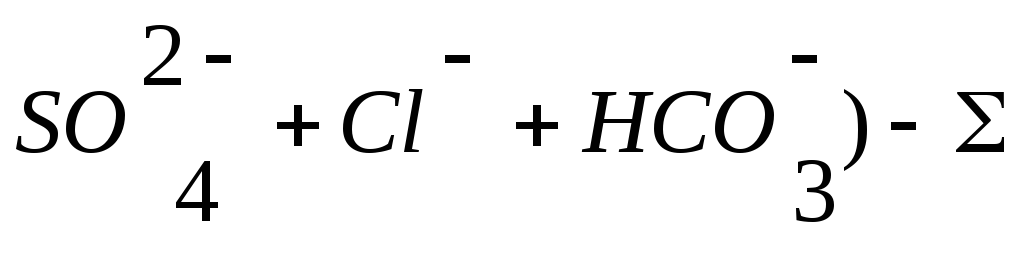 мгекв/дм3
мгекв/дм3
2.4.7. Визначення загальної мінералізації
Мінералізація
(мг/дм3)
=
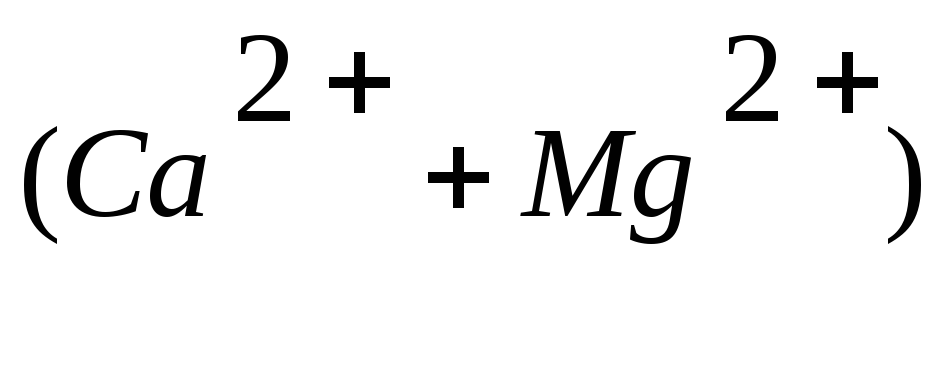 +(Na++К+)
+ HCO
+(Na++К+)
+ HCO![]() +
+
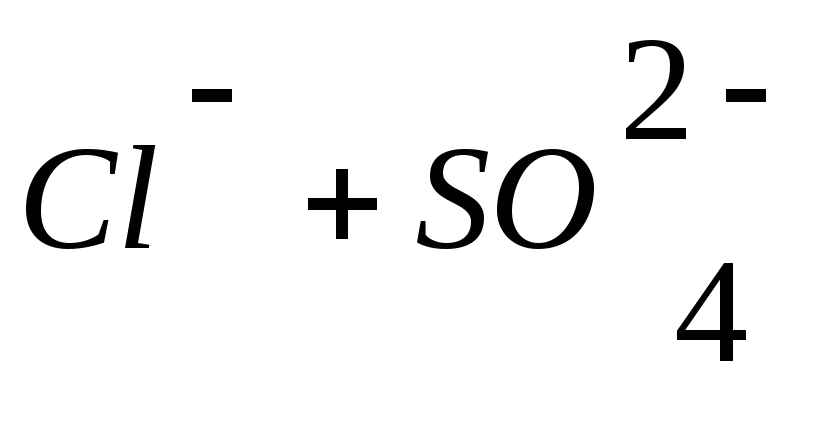 (40)
(40)
2.4.8. Аргентометричне визначення Хлору
Методика визначення.
В конічну колбу ємністю 250 мл наливають 100 мл досліджуваної води і додаємо невелику кількість (декілька крапель) водного розчину калію хромату (5%) титруємо 0,5 н розчином AgNO3 до переходу лимонно-жовтого забарвлення в оранжево-жовте:
Cl- + Ag+ = AgCl
Хлорид срібла менш розчинний, ніж хромат срібла, тому осад хромату срібла не утворюється до тих пір, поки в розчині є хлорид-іони. В т.е. всі хлорид-іони теоретично відтитровані. Додавання першої надлишкової порції титр анту – розчину нітрату срібла приводить до виникнення червоного осаду срібла хромату:
2AgNO3 + K2CrO4 = Ag2CrO4 + 2KNO3
При отриманні червоного осаду титрування закінчують. Визначення проводять при рН 6,5-10,3, тому що в сильно кислому середовищі осад срібла хромату розчиняється з утворенням дихромат-іонів:
Ag
CrO4
+ 2Н+
= 4 Ag+
+
![]() + Н2О
+ Н2О
В сильно лужних розчинах аргентометричне титрування не проводять, оскільки в лужних розчинах солі срібла дають коричневий осад Ag2О.
Вміст Cl- визначають за формулою:
![]()
де: а – об’єм AgNO3, який пішов на титрування;
n – нормальність AgNO3;
k – поправковий коефіцієнт, який рівний 1;
35,45 – еквівалент Cl-;
V – об’єм досліджуваної проби взятої на титрування, мл.
2.4.9. Турбідиметричне визначення сульфатів
Готуємо серію розчинів, яка складається з холостої проби та 8 проб досліджуваного талого снігу. У колбу на 25 мл наливаємо по 10 мл проби, підкислюємо HCl 3-4 краплі (1:1), додаємо по 10 мл гліколієвого реагенту. Проби залишають на 30 хв. Порівняння інтенсивності забарвлення досліджуваних проб проводять фотометричним методом (42), вимірюючи оптичну густину розчину при довжині хвилі 360+20 нм в кюветах з товщиною стінки 5 мм, будують градуювальник графік. Вміст сульфатів знаходять за градуювальник графіком(43).
