
- •4.Равновесное состояние – нулевое начало термодинамики.
- •18. Растворы: классификация растворов.
- •19. Давление насыщенного пара над раствором, эбулиоскопия, криоскопия, осмос и осмотическое давление.
- •20. Неидеальные растворы, активность.
- •21. Законы Гиббса-Коновалова.
- •22. Термодинамическое обоснование законов Гиббса-Коновалова. Перегонка и ректификация.
- •23. Твердые растворы.
- •24. Растворы с эвтектикой.
- •25. Растворы газов в жидкостях.
- •26. Трехкомпонентные системы. Экстракция.
- •27. Особенности водных растворов электролитов.
- •29. Подвижность ионов и числа переноса.
- •30. Сильные и слабые электролиты.
- •31. Активность электролитов и ионная сила растворов.
- •32. Механизм возникновения электрического потенциала.
- •33. Термодинамическая теория эдс, уравнение Нернста.
- •34. Стандартные электродные потенциалы, электрохимические цепи и химические источники тока.
- •35. Формальная кинетика, основные представления. Скорость химической реакции.
- •36. Молекулярность и порядок химической реакции.
- •37. Кинетические уравнения реакции различного порядка, определение порядка реакции.
- •38. Механизм химических реакций: энергия активации и зависимость её от различных факторов.
- •39. Обратимые, последовательные параллельные и сопряженные реакции.
- •40. Цепные и фотохимические реакции.
- •42. Скорость каталитических реакций, основные положения теорий каталитических реакций, ферментативный катализ.
- •43. Коллоидная химия как наука. Признаки, классификация и значение коллоидных систем и коллоидных процессов в природе и технике.
- •45. Адгезия, смачивание и растекание жидкости.
- •46. Адсорбция, адсрбция на границе раствор-газ. Уравнение Гиббса.
- •47. Поверхностно-активные вещества. Поверхностная активность. Правило Дюкло-траубе. Строение монослоев пав.
- •48. Изотермы адсорбции Фрейндлиха и Лэнгмюра. Работа адсорбции
- •49. Адсорбция на границе жидкость-жидкость.
- •50. Адсорбция газов на поверхности твердых тел.
- •51. Адсорбция из растворов. Ионный обмен.
- •52. Методы получения и очистки дисперсных систем.
- •54. Электрокинетические свойства дисперсных систем.
- •55. Коагуляция дисперсных систем, свойства тонких пленок. Расклинивающее давление. Дальнодействующее межмолекулярное взаимодействие. Электростатическое составляющая расклинивающего давления.
- •56. Кинетика коагуляции. Коагуляция под действием электролитов. Теория устойчивости длфо.
- •57.Микрогетерогенные системы. Пены. Эмульсии. Суспензии.
- •58. Свойства мицеллярных пав. Мицеллообразование. Солюбилизация. Микроэмульсии.
- •59. Растворы высокомалекулярных соединений.
- •60. Аэрозоли.
- •61. Структурообразование в дисперсных системах. Способы описания структурно-механических свойств. Основы реологии.
- •62. Элементы управления структурно-миханическими свойствами дисперсных систем.
35. Формальная кинетика, основные представления. Скорость химической реакции.
Формальная кинетика – это кинетика, где скорость химической реакции представляется в зависимости только от концентрации реагирующих веществ. Полученные в формальной кинетике закономерности позволяют:
во-первых, определить кинетические параметры химической реакции (константу скорости,..);
во-вторых, распространить полученные закономерности на сложные многостадийные химические реакции, характерные для технологических процессов;
в-третьих, дают возможность классифицировать химические реакции.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Количество вещества выражают в МОЛЯХ, а объем в ЛИТРАХ. В этом случае мы получаем удобную для работы величину - КОНЦЕНТРАЦИЮ вещества в моль/л, которая ИЗМЕНЯЕТСЯ в ходе реакции.
Таким образом, скоростью реакции называют изменение концентрации какого-нибудь вещества, участвующего в реакции, за единицу времени (например, за секунду или за минуту). Отсюда другое определение скорости реакции:
Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
Например
для реакции:
![]()
выражение
для скорости будет выглядеть так:
![]()
36. Молекулярность и порядок химической реакции.
При изучении реакций выделяют молекулярность и порядок реакции.
Молекулярность реакции - это число молекул исходных веществ, принимающих участие в одном (единичном) химическом превращении. При этом число молекул образующихся продуктов не имеет значения.
В соответствии с приведенным определением различают реакции:
1) мономолекулярные, в которых только один вид молекул участвует в превращении, причем стехиометрический коэффициент в уравнении равен единице, например, запись А → С означает, что молекула вещества А превращается в молекулу вещества С;
2) бимолекулярные, в которых участвуют два различных вида молекул или две молекулы одного вида (стехиометрический коэффициент во втором случае равен двум), например, А + В→С или 2А → С;
3) тримолекулярные, в которых участвуют три молекулы одного или разного видов, например,
А + В + D → С или 2 А + В → С, или 3А→С.
Реакции более высокой молекулярности маловероятны. Связано это с причиной, о которой говорилось ранее.
Выше было сказано, что порядок химической реакции выражается
суммой:
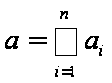
где аi - показатели степени концентрации исходных веществ в уравнении действующих масс.
Они приравнивались стехиометрическим коэффициентам компонентов химической реакции. Исходя из этого можно сделать заключение, что молекулярность и порядок реакции это одинаковые величины. Однако, это не всегда так. Порядок реакции или равен молекулярности или, в большинстве случаев, меньше её. Расхождение между порядком реакции и её молеклярностью может быть вызвано разными причинами.
1. Молекулярность реакции величина теоретическая, а порядок реакции - экспериментальная. Между теоретическими и экспериментальными величинами почти всегда есть различия.
2. Если, например, в реакции
bB + dD = P, скорость которой W = КСBbCD d
один из компонентов, например, компонент B, находится в избытке, то в ходе данной реакции его концентрация будет изменяться незначительно и в уравнении скорости реакции можно принять СB = const. Но в таком случае скорость реакции практически зависит от концентрации только компонента D, то есть W = К1CD d тогда порядок реакции равен d, а молекулярность реакции (b + d).
3. Если данная реакция является гетерогенной, то в зависимости от условий протекания порядок такой реакции может быть различным.
4. Порядок каталитической реакции также может отличаться от молекулярности, причина - сложный механизм таких реакций.
5. Для сложной реакции, протекающей в несколько стадий, порядок реакции и её молекулярность не совпадают. В данном случае порядок реакции определяет какая-либо промежуточная (лимитирующая) стадия. Как правило порядок этой стадии отличается от молекулярности сложной реакции.
