
Основные положения МКТ
.pdf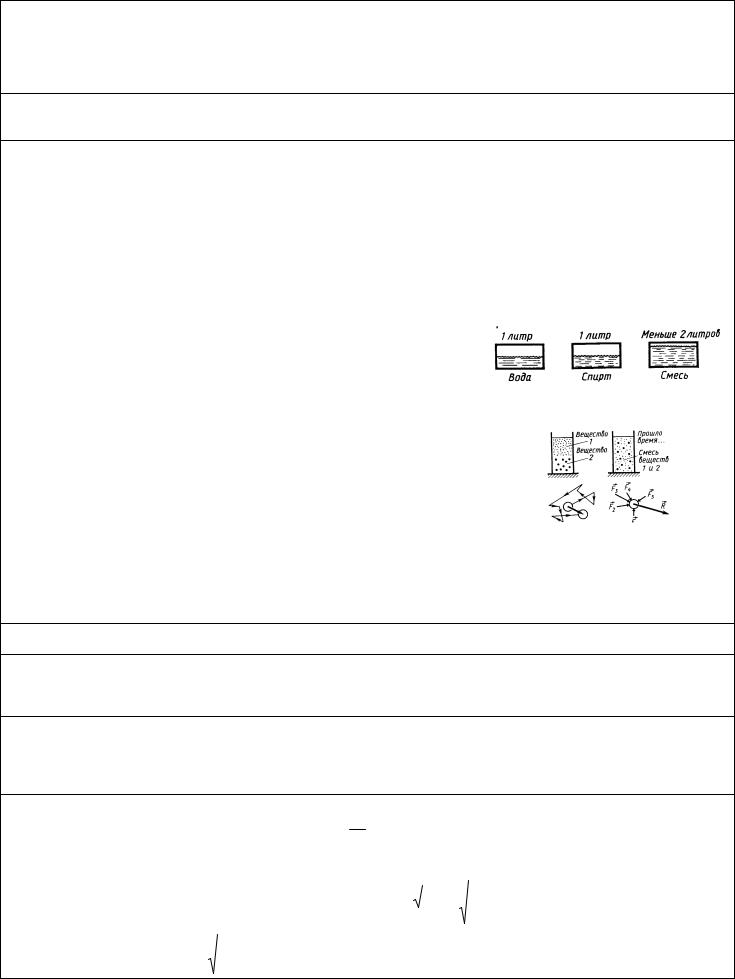
1
Основные положения МКТ
Левкипп и Демокрит — 400 лет до н.э.
М. В. Ломоносов — XVIII в. «0 причине теплоты и холода», «О коловратном движении корпускул».
1.Все вещества состоят из мельчайших частиц (молекул и атомов). Молекулы разделены промежутками.
2.Молекулы находятся в беспрерывном хаотическом движении.
3.Между молекулами существуют силы взаимодействия (притяжение и отталкивание).
АТОМ - наименьшая частица химического элемента, которая является носителем его химических свойств. А. состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в кулоновском поле ядра по законам квантовой механики. Размеры А. порядка 10-10 м.
МОЛЕКУЛА - наименьшая устойчивая частица вещества, обладающая всеми химическими свойствами и состоящая из |
|||
одинаковых (простое вещество) или разных (сложное вещество) атомов, объединенных химическими связями. |
|||
|
|
Опытные обоснования МКТ |
|
Существование |
1. |
Делимость вещества |
|
молекул |
2. |
Закон кратных отношений: при образовании из двух |
|
|
элементов различных веществ массы одного из элементов |
|
|
|
в разных соединениях находятся в кратных отношениях – |
|
|
|
N2O : N2O2 : N2O3 - 1:2:3. (1803, Дж. Дальтон; 1808, Ж.Л. |
|
|
|
Гей-Люссак). |
|
|
|
3. |
Наблюдение молекул с помощью ионного проектора, |
|
|
электронного микроскопа, туннельного микроскопа. |
|
|
|
4. |
Явление диффузии. |
|
Наличие |
1. |
При смешивании различных жидкостей объем смеси |
|
промежутков |
меньше суммы объемов отдельных жидкостей. |
|
|
|
2. |
Диффузия. |
|
|
3. Деформация |
|
|
|
|
|
|
Хаотическое |
1. |
Броуновское движение. |
|
движение |
2. Диффузия. |
|
|
молекул |
3. |
Давление газа на стенки сосуда. |
|
|
4. |
Стремление газа занять любой объем. |
|
|
5. |
Опыты по измерению скоростей атомов и молекул |
|
|
методом молекулярных пучков: И. Штерн, 1920. |
|
|
|
|
|
|
Силы |
1. |
Деформация тела. |
|
взаимодействия |
2. |
Сохранение формы твердого тела. |
|
|
3. |
Поверхностное натяжение жидкости. |
|
|
4. |
Свойства прочности, упругости, твердости и т.п. |
|
|
5. |
Опыт со свинцовыми цилиндрами. |
|
Диффузия. Броуновское движение.
Диффузия - явление проникновения частиц одного вещества в промежутки между частицами другого. Скорость диффузии зависит от температуры и состояния вещества (быстрее в газах).
Броуновское движение - беспорядочное движение мелких частиц, взвешенных в жидкости или газе, происходящее под влиянием теплового движения молекул.
Р. Броун (1827) наблюдал. Создание теории - А. Эйнштейн и М. Смолуховский (1905). Ж.Б. Перрен (1908—1911) — опыты. Движение не прекращается
Роль в природе, технике
1.Питание растений из почвы.
2.В организмах человека и животных всасывание питательных веществ происходит через стенки органов пищеварения.
3.Работа органов обоняния.
4.Цементация.
Скорость теплового движения молекул
МКТ газов основана на том, что газы состоят из беспорядочно движущихся молекул. Понятие температуры связано со
|
|
|
|
|
|
|
|
|
m |
|
2 |
|
|
3kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
скоростью хаотического движения молекул формулой 2 |
|
|
2 |
, |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
ср.кв |
|
2 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
m0 |
|
|||||||||
где - 2 среднее значение квадрата скорости. Следовательно |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ср.кв. |
|
3RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Так как NА.k=const=R, то |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2
При t0=0°С средние скорости для азота – 500 м/с, для водорода – 1800 м/с.
Экспериментальное определение скорости движения молекул
Сущность опыта О. Штерна (1920)
1.Если цилиндры неподвижны, то атомы попадают в точку М.
2.При вращении цилиндров со скоростью ω атомы попадают в точку К. Так как
скорости |
атомов |
неодинаковы, |
то |
полоска |
размыта. |
Распределение молекул по скоростям
График распределения молекул по скоростям. Английский физик Дж. Максвелл и австрийский физик Л. Больцман. Кривая распределения Максвелла соответствует результатам, полученным в опыте Штерна. Количество частиц, имеющих скорости в интервале υ1, равно N, υ - одна из скоростей этого интервала. Из графика видно, что количество частиц, имеющих скорости в равных интервалах υ1 и υ2, различно. Скорость, около которой расположены наиболее «населенные» интервалы,— наиболее вероятная скорость теплового движения молекул.
Основные выводы
1.Распределение по скоростям имеет определенную закономерность.
2.Среди молекул газа имеются как очень быстрые, так и очень медленные молекулы.
3.Распределение молекул по скоростям зависит от температуры.
4.Чем больше Т, тем больше максимум кривой распределения смещается в сторону больших скоростей.
|
|
|
|
РАЗМЕРЫ И МАССЫ МОЛЕКУЛ |
|
|
|
|
|
|
|
|
Атомная единица массы (а.е.м.) - 1,6.10-27кг - единица массы, равная 1/12 массы |
|
|
|
|
|
|
|
|||||
изотопа углерода с массовым числом 12. |
|
|
|
|
m0 |
|||||||
|
|
|
|
, где m0 - масса молекулы (атома); |
|
Mr |
|
|
||||
|
|
|
|
|
|
|
||||||
m0С - масса атома углерода (изотоп 12С) |
|
|
|
|
1 |
m0c |
||||||
|
|
|
|
|
||||||||
Mr |
|
m0 |
|
|
|
12 |
|
|||||
|
|
|
|
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
||||
|
|
|
m0c |
- относительная атомная масса |
Пример: |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||
12 |
Для H2 : Mr |
1 1 2 |
||||||||||
- определяется по таблице Менделеева! |
||||||||||||
Для О2: |
Mr 16 16 32 |
|||||||||||
Относительная молекулярная масса сложного вещества определяется как сумма |
|
|
|
|
|
|
||||||
относительных атомных масс всех атомов, входящих в состав данного вещества. |
Для Н2О: Mr |
1 1 16 18 |
||||||||||
|
|
|
|
|
|
Для воздуха Mr=29 |
||||||
3
- количество вещества; |
[ ]=моль; |
|
|
|
|
|
NA=6,02.1024 моль-1 |
||||||||||||||||||||||||||||||
1 моль углерода имеет массу 0,012 кг |
|
|
|
|
|
||||||||||||||||||||||||||||||||
NA=6,02.1024 моль-1 - число (постоянная) Авогадро - количество структурных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
элементов (атомов, молекул) в 1 моле вещества (в 12 г углерода 12С). |
|
|
|
N |
|
m |
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
N |
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NA |
|
|
M |
|||||||||||||
|
NA |
M , |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
M m0 NA Mr |
|
10 3 |
кг |
||||||||||||||||||||||
где М - молярная масса (масса 1 моля); |
|
|
|
|
|
|
моль |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
N |
NА . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|||||||||||||
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
кг |
|
|
|
|
|
кг |
|
|
|
m |
|
|
|
|
|
|
|
||||
M m |
|
|
N |
|
|
0,012 |
M |
|
M |
|
10 3 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
||||||||||||||||||
0 |
A |
|
моль |
r |
r |
моль |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
г |
|
|
|
|
|
|
|
|
|
кг |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
1000 |
|
||||||||||||
n |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
см3 |
|
|
м3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
V - концентрация - количество частиц в единице объема вещества. [n]=м-3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
m |
m0n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
- плотность - масса единицы объема вещества. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
[ ]= кг/м3.
2.Оценим размеры молекулы, считая, что молекулы шарики.
Vшара |
|
4 |
R 3 , |
|||||||
|
|
|
||||||||
|
|
3 |
|
|
|
|
|
|||
следовательно, |
используя понятия плотности и молярной массы получим: |
|||||||||
|
|
|
|
|
|
|
|
|||
R 3 |
3V |
|
3 |
3M |
|
|||||
|
4 NA |
|||||||||
|
|
4 |
||||||||
Например, для воды R 10-10м.
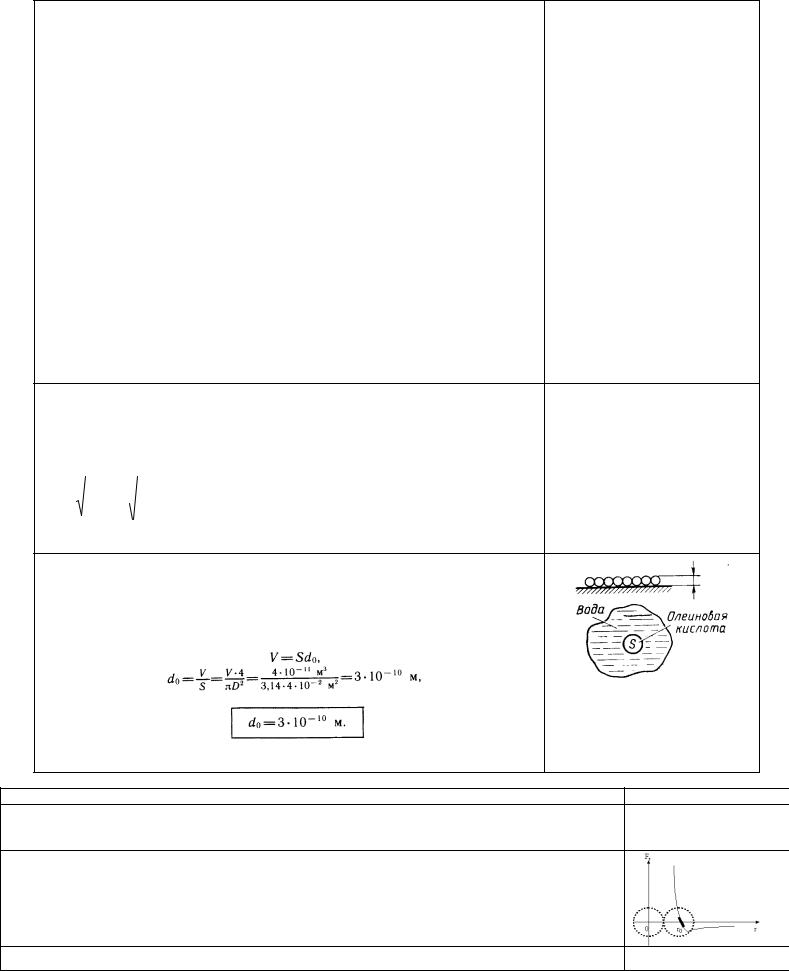
Другой способ оценки размеров молекул. Известно, что некоторые несмешивающиеся с водой жидкости (масло, нефть, олеиновая кислота и др.), растекаясь по поверхности воды, могут образовывать очень тонкие пленки (толщиной до одного молекулярного ряда). Можно провести опыт, в котором, зная объем жидкости и измерив площадь, которую она заняла на поверхности воды, можно оценить размер молекулы. Например:
Олеиновая кислота - одноосновная насыщенная карбоновая кислота
CH 3(CH 2 )7 CH CH (CH 2 )7 COOH
ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ.
Впервые подробно - Я.Д. Ван-дер-Ваальс (Голландия).
Природа сил - электромагнитная. Силы короткодействующие
Зависимость от расстояния: F |
~ |
1 |
; |
F |
~ |
1 |
|
r7 |
r13 |
||||||
прит |
|
|
от |
|
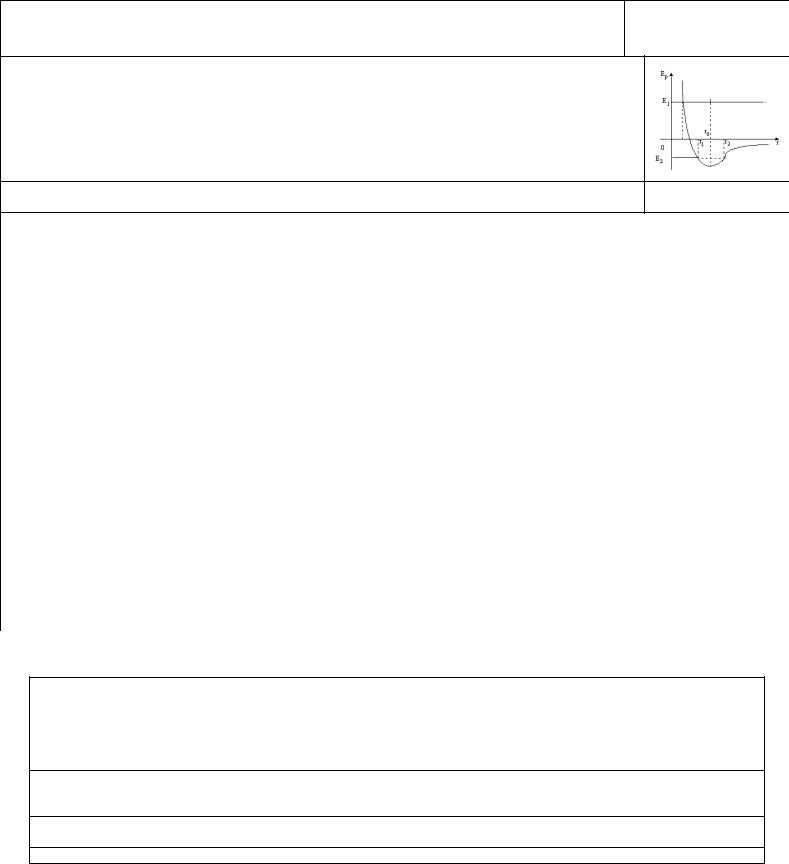
Проекции Fприт <0, ` Fот >0. График суммы - рис.
4
На расстоянии r0 , примерно равном сумме радиусов молекул, F=0, т.к. Fприт = Fот . При r<r0 -
отталкивание, при r>r0 - притяжение. Утолщенный участок - выполнение закона Гука (малые деформации).
На рисунке - график зависимости потенциальной энергии от расстояния.
При Eполн=E1: если частица движется справа налево из бесконечности, то в точке r0 потенциальная энергия минимальна. В точке r1 полная энергия равна потенциальной энергии отталкивания, а кинетическая энергия равна нулю - точка поворота. Дальше молекула движется в положительном направлении оси r и уходит в бесконечность
При Eполн=E2<0 молекула находится в потенциальной яме между точками поворота r2 и r3. Молекулы совершают колебания около друг друга.
СВОЙСТВА ТВЕРДЫХ, ЖИДКИХ И ГАЗООБРАЗНЫХ ТЕЛ.
|
|
|
Соотношение между |
|
|
|
|
|
кинетической энергией |
|
|
Состояние |
Расположение частиц. |
Характер движения |
молекул и потенциальной |
Некоторые свойства. |
|
вещества. |
частиц. |
энергией |
|||
|
|
||||
|
|
|
межмолекулярного |
|
|
|
|
|
взаимодействия. |
|
|
Твердое. |
Расстояния сравнимы с |
Колебания около |
Потенциальная много больше |
Сохраняют форму и объем. |
|
|
размерами частиц. |
положения равновесия. |
кинетической. Силы |
Упругость. Прочность. |
|
|
Истинно твердые тела |
|
взаимодействия большие. |
Твердость. Имеют |
|
|
имеют кристаллическую |
|
|
определенную точку |
|
|
структуру (дальний |
|
|
плавления и кристаллизации. |
|
|
порядок |
|
|
|
|
|
упорядоченности). |
|
|
|
|
Жидкое |
Расположены почти |
В основном колеблются |
Кинетическая энергия лишь |
Сохраняют объем, но не |
|
|
вплотную друг к другу. |
около положения |
незначительно меньше по |
сохраняют форму. Мало |
|
|
Наблюдается ближний |
равновесия, изредка |
модулю потенциальной |
сжимаемы. Текучи. |
|
|
порядок упорядоченности. |
перескакивая в другое. С |
энергии. |
|
|
|
|
повышением |
|
|
|
|
|
температуры время |
|
|
|
|
|
оседлой жизни |
|
|
|
|
|
уменьшается. |
|
|
|
Газообраз- |
Расстояния много больше |
Хаотическое движение с |
Кинетическая энергия много |
Не сохраняют ни форму, ни |
|
ное. |
размеров частиц. |
многочисленными |
больше потенциальной по |
объем. Легко сжимаемы. |
|
|
Расположение |
столкновениями. |
модулю. |
Заполняют весь |
|
|
совершенно хаотическое. |
Скорости сравнительно |
|
предоставленный им объем. |
|
|
|
большие. |
|
|
Основные положения МКТ
Левкипп и Демокрит — 400 лет до н.э.
М. В. Ломоносов — XVIII в. «0 причине теплоты и холода», «О коловратном движении корпускул».
1.Все вещества состоят из мельчайших частиц (молекул и атомов). Молекулы разделены промежутками.
2.Молекулы находятся в беспрерывном хаотическом движении.
3.Между молекулами существуют силы взаимодействия (притяжение и отталкивание).
АТОМ - наименьшая частица химического элемента, которая является носителем его химических свойств. А. состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в кулоновском поле ядра по законам квантовой механики. Размеры А. порядка 10-10 м.
МОЛЕКУЛА - наименьшая устойчивая частица вещества, обладающая всеми химическими свойствами и состоящая из одинаковых (простое вещество) или разных (сложное вещество) атомов, объединенных химическими связями.
Опытные обоснования МКТ

|
|
5 |
|
Существование |
1. |
Делимость вещества |
|
молекул |
2. |
Закон кратных отношений: при образовании из двух |
|
|
элементов различных веществ массы одного из элементов |
|
|
|
в разных соединениях находятся в кратных отношениях – |
|
|
|
N2O : N2O2 : N2O3 - 1:2:3. (1803, Дж. Дальтон; 1808, Ж.Л. |
|
|
|
Гей-Люссак). |
|
|
|
3. |
Наблюдение молекул с помощью ионного проектора, |
|
|
электронного микроскопа, туннельного микроскопа. |
|
|
|
4. |
Явление диффузии. |
|
Наличие |
1. |
При смешивании различных жидкостей объем смеси |
|
промежутков |
меньше суммы объемов отдельных жидкостей. |
|
|
|
2. |
Диффузия. |
|
|
3. Деформация |
|
|
|
|
|
|
Хаотическое |
1. |
Броуновское движение. |
|
движение |
2. Диффузия. |
|
|
молекул |
3. |
Давление газа на стенки сосуда. |
|
|
4. |
Стремление газа занять любой объем. |
|
|
5. |
Опыты по измерению скоростей атомов и молекул |
|
|
методом молекулярных пучков: И. Штерн, 1920. |
|
|
|
|
|
|
Силы |
1. |
Деформация тела. |
|
взаимодействия |
2. |
Сохранение формы твердого тела. |
|
|
3. |
Поверхностное натяжение жидкости. |
|
|
4. |
Свойства прочности, упругости, твердости и т.п. |
|
|
5. |
Опыт со свинцовыми цилиндрами. |
|
Диффузия. Броуновское движение.
Диффузия - явление проникновения частиц одного вещества в промежутки между частицами другого. Скорость диффузии зависит от температуры и состояния вещества (быстрее в газах).
Броуновское движение - беспорядочное движение мелких частиц, взвешенных в жидкости или газе, происходящее под влиянием теплового движения молекул.
Р. Броун (1827) наблюдал. Создание теории - А. Эйнштейн и М. Смолуховский (1905). Ж.Б. Перрен (1908—1911) — опыты. Движение не прекращается
Роль в природе, технике
1.Питание растений из почвы.
2.В организмах человека и животных всасывание питательных веществ происходит через стенки органов пищеварения.
3.Работа органов обоняния.
4.Цементация.
Скорость теплового движения молекул
МКТ газов основана на том, что газы состоят из беспорядочно движущихся молекул. Понятие температуры связано со
|
|
|
|
|
|
|
|
|
m |
|
2 |
|
|
3kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
скоростью хаотического движения молекул формулой 2 |
|
|
2 |
, |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
ср.кв |
|
2 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
m0 |
|
|||||||||
где - 2 среднее значение квадрата скорости. Следовательно |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ср.кв. |
|
3RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Так как NА.k=const=R, то |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
При t0=0°С средние скорости для азота – 500 м/с, для водорода – 1800 м/с.
6
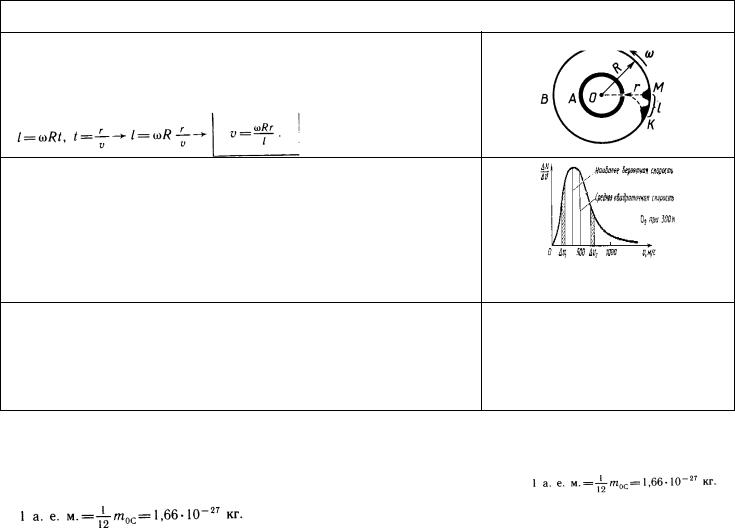
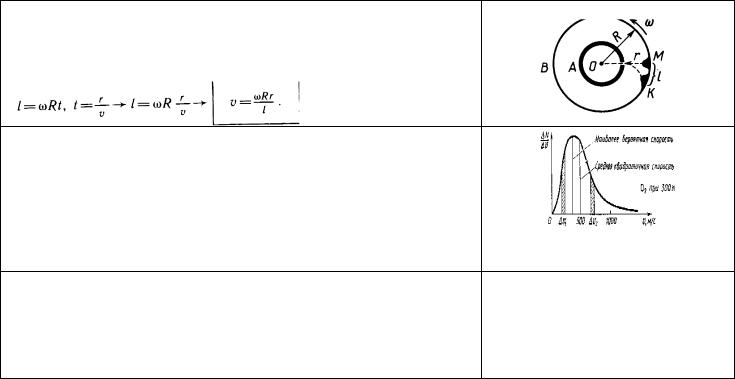
Экспериментальное определение скорости движения молекул
Сущность опыта О. Штерна (1920)
1.Если цилиндры неподвижны, то атомы попадают в точку М.
2.При вращении цилиндров со скоростью ω атомы попадают в точку К. Так как
скорости |
атомов |
неодинаковы, |
то |
полоска |
размыта. |
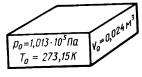
Распределение молекул по скоростям
График распределения молекул по скоростям. Английский физик Дж. Максвелл и австрийский физик Л. Больцман. Кривая распределения Максвелла соответствует результатам, полученным в опыте Штерна. Количество частиц, имеющих скорости в интервале υ1, равно N, υ - одна из скоростей этого интервала. Из графика видно, что количество частиц, имеющих скорости в равных интервалах υ1 и υ2, различно. Скорость, около которой расположены наиболее «населенные» интервалы,— наиболее вероятная скорость теплового движения молекул.
Основные выводы
1.Распределение по скоростям имеет определенную закономерность.
2.Среди молекул газа имеются как очень быстрые, так и очень медленные молекулы.
3.Распределение молекул по скоростям зависит от температуры.
4.Чем больше Т, тем больше максимум кривой распределения смещается в сторону больших скоростей.
|
|
|
|
|
|
|
Уравнение состояния идеального газа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
(уравнение Менделеева – Клапейрона). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Уравнением состояния называется уравнение, связывающее параметры физической системы и |
|
|
|
|
|
|
|
|||||||||||||||||||
однозначно определяющее ее состояние. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел |
|
|
|
|
|
|
|
|||||||||||||||||||
уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел |
|
|
|
|
|
|
|
|||||||||||||||||||
уравнение для произвольного числа молекул. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Мы знаем, что |
p nkT |
NkT |
. Следовательно, |
pV NkT. Учитывая, что N |
m |
N |
A |
N |
A |
, |
|
|
|
|
|
|
|
|
|
|||||||
получим: pV NAkT. |
V |
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Произведение |
|
постоянных |
|
величин |
есть |
величина |
постоянная, |
следовательно: |
|
|
|
|
|
|
|
|||||||||||
|
|
Дж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
NAk R 8,31 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R 8,31 |
|
|
Дж |
|
|
||||||
К моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К моль |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
- универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Таким образом, имеем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
pV |
m |
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
M |
- уравнение состояния (уравнение Менделеева – Клапейрона). |
|
|
|
|
|
|
pV |
RT |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
pV RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pV RT |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
Другие формы записи уравнения состояния идеального газа. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
7
1. Уравнение для 1 моля вещества. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
Если =1 моль, то, обозначив объем одного моля Vм, получим: pVM RT. |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
Для нормальных условий получим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
RT |
8,31 |
|
Дж |
|
273К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
Кмоль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
V |
|
|
|
|
|
|
|
|
|
|
|
0,0224м3 22,4л |
|
|
|
|
|
|
|
|
||||||||||||||||||
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
м |
|
|
1,013 105 Па |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
2. Запись уравнения через плотность: p |
|
RT - плотность зависит от температуры и давления! |
|
p |
|
RT |
||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
M |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
3. Уравнение Клапейрона. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
(m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества =const. |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
Тогда: |
|
|
|
pV |
|
|
m |
R const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
T |
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
Эта запись означает, что для данной массы данного газа справедливо равенство: |
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1V1 |
|
|
p2V2 |
|
|
p3V3 |
... const |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
T2 |
|
T3 |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
температуре в данном состоянии есть величина постоянная: |
|
pV |
const |
. |
|
pV |
const |
|||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
приν const |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Газовые законы. |
|
|
|
|
|
|
|
|
|||||||
1. |
Закон Авогадро. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
молекул (атомов). |
|
Условие: V1=V2=…=Vn; p1=p2=…=pn; T1=T2=…=Tn |
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
p nkT p |
N |
kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Доказательство: |
|
|
|
pV |
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
природы газа и одинаково. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
2. |
Закон Дальтона. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Давление смеси газов равно сумме парциальных (частных) давлений каждого газа. |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
Доказать: p=p1+p2+…+pn |
|
|
|
|
N |
|
|
|
|
|
N1 |
N2 |
N3 ... |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
p nkT |
kT |
kT (n1 n2 n3 ...)kT |
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
Доказательство: |
|
|
|
|
|
|
|
|
|
V |
|
|
V |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
p1 p2 p3 ... |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
3. |
Закон Паскаля. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Давление, производимое на жидкость или газ, передается во все стороны без изменения. |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
8
|
|
|
|
|
|
|
|
|
Температура |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Важнейшим внутренним параметром газа является температура, чувствительность к |
|
|
|
|
|
||||||||||||||||||||||
которой заложена в живых системах, однако она субъективна («степень нагретости тела»). |
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Основные свойства температуры |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Тепловое (термодинамическое) равновесие – состояние тела или системы тел, при |
|
|
|
|
|
||||||||||||||||||||||
котором его термодинамические параметры (p, V, m |
и др.) остаются неизменными сколь |
|
|
|
|
|
|||||||||||||||||||||
угодно долго. Температура - характеристика внутреннего состояния макроскопической |
|
|
|
|
|
||||||||||||||||||||||
системы – состояния теплового равновесия. Температура – термодинамический |
|
|
|
|
|
||||||||||||||||||||||
параметр, одинаковый во всех частях термодинамической системы, находящейся в |
|
|
|
|
|
||||||||||||||||||||||
тепловом равновесии. Температуры тел, находящихся в тепловом контакте, выравнива- |
|
|
|
|
|
||||||||||||||||||||||
ются. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Измерение температуры. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
1. Тело необходимо привести в тепловой контакт с термометром. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
2. Термометр должен иметь массу значительно меньше массы тела. |
|
|
|
|
|
|
|
||||||||||||||||||||
3. Показание термометра следует отсчитывать после наступления теплового равновесия. |
|
|
|
|
|
||||||||||||||||||||||
Термометры. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
1. Жидкостный термометр (ртуть: температура от -38 до 2600С; глицерин: от – 50 до |
|
|
|
|
|
|||||||||||||||||||
1000С) – тепловое расширение. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
2. Термопара (температура от -269 до 23000 С). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
3. Термисторы (зависимость сопротивления от температуры). |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
4. Манометрические (зависимость давления от температуры). |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
5. |
|
Газовые термометры – тепловое расширение. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
6. |
|
Акустические, магнитные и др. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
Температурные шкалы: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
1. Шкала Цельсия. 00С – таяние люда, 1000С – кипение воды (изначально – наоборот). |
|
|
|
|
|
||||||||||||||||||||||
2. |
|
Шкала Реомюра. 00С - 00R, 1000С - 800R. 10R=1,250С. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
3. |
|
Шкала Фаренгейта. 00С=320F, 1000С=2120F t0C=5/9(t0F-32). |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
Недостаток этих шкал – произвольность выбора реперных точек (точек отсчета), их |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
зависимость от внешних условий. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
Физический смысл температуры |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Опыт: давление газа зависит от температуры - p f (T) и |
|
|
к |
f (T) . |
|
|
|
|
|
|
|||||||||||||||||
E |
|
|
|
|
|
|
|||||||||||||||||||||
Из |
|
|
основного уравнения МКТ идеального |
газа: p |
2 |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
nE |
к |
. Следовательно |
Физическая величина, |
||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
3p |
3pV |
|
|
|
|
|
|
3 |
|
|
|
одинаковая у любых |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тел при тепловом |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Eк |
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
равновесии. |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
2n |
2N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Если мы установим, как меняется это выражение при переходе от одного состояния теплового |
|
|
|
|
|
||||||||||||||||||||||
равновесия к другому, то можно будет ввести понятие температуры и изучить ее свойства. |
|
|
|
|
|
||||||||||||||||||||||
Опыт показывает, что для любых веществ |
pV |
~ T. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
pV |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pV |
|
|
|
|
kT |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|||||||||
Заменяя знак пропорциональности на знак равенства, получим: |
|
|
|
kT , |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|||||
где k – коэффициент пропорциональности, называемый постоянная Больцмана, а Т – |
|
|
|
|
|
||||||||||||||||||||||
абсолютная термодинамическая температура. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
pV |
|
|
|
|
|
Абсолютная температура. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
kT 0 - абсолютная температура неотрицательна! |
|
|
|
|
|
|
|
|
pV |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kT 0 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Т.к. объем газа равен нулю быть не может, то температура равна нулю, если давление равно |
|
|
|
T 0 |
|||||||||||||||||||||||
нулю, а значит, равна нулю скорость поступательного теплового движения (сохраняются |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||
т.н. нулевые колебания). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Единица температуры – Кельвин (К). Кельвин равен 1/273,16 |
части термодинамической |
|
|
КЕЛЬВИН |
|||||||||||||||||||||||

9
|
температуры тройной точки воды. Шкала строится так, что t0C T К. |
|
|
|
|
|
|
|
1К |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Температура |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
абсолютного нуля |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
не зависит от |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
внешних условий и |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
одинакова для всех |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
веществ. |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Связь температуры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
и средней кинетической энергии поступательного движения молекул. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
Сравнивая два выражения |
|
|
|
|
|
3p |
|
3pV |
и |
pV |
kT, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
E |
к |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2n |
2N |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
kT |
|
|
|
|
||||||||||||||||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
к |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||||
|
получим: Eк |
kT. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Т.о. средняя кинетическая энергия прямо пропорциональна абсолютной температуре. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
Температура - мера средней кинетической энергии молекул. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
Постоянная Больцмана |
|
k 1,38 10 |
-23 Дж |
|
|
|
k 1,38 10 |
-23 Дж |
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
К |
|
|
|
|
|
|
К |
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
Температуру можно измерять в энергетических единицах – Джоулях. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
При Т=0 средняя кинетическая энергия поступательного движения молекул равна нулю. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
При комнатной температуре |
|
(300К) |
энергия |
|
примерно |
6.10-21Дж – очень |
маленькая |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
(барабанные перепонки – шум в ушах; движение частиц мозга – передача сигналов). |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3p |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
Т.к. Eк |
|
и Eк |
kT, то p nkT |
|
|
|
p nkT |
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
2n |
|
|
2 |
|
|
|
|
||||||||||||||||||||||||||||||||||
|
- связь давления итемпературы (еще одна форма основного уравнения МКТ идеального |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
газа). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПРОЦЕССЫ В ИДЕАЛЬНОМ ГАЗЕ |
|
|
|
|
|
|
||||||||||
|
Название |
|
|
Постоянные |
|
|
|
|
|
|
|
|
Зависимость |
|
|
|
|
Направление |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
величины |
|
|
|
|
|
|
|
|
между другими |
|
|
|
|
процесса |
|
|
|
|
|
|
|
|
|
|
|
|
Графики |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
параметрами |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Закон Бойля- |
|
T=const |
|
|
|
|
|
|
pV |
|
|
|
|
|
|
Изотермическое |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
Мариотта |
|
M=const |
|
|
|
|
|
|
|
|
|
|
|
|
расширение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
m=const |
|
|
|
|
|
|
|
|
|
|
const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
изотермический |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
процесс |
|
|
|
|
|
pV const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1V1 p2V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Словесная |
|
|
Изотермическое сжатие |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
формулировка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
|
10 |
|
|
|
||||
|
|
Для данной массы данного газа |
|
|
|
|||||||
|
|
при постоянной температуре |
|
|
|
|||||||
|
|
произведение давления на объем |
|
|
|
|||||||
|
|
есть величина постоянная |
|
|
|
|||||||
|
|
(давление обратно |
|
|
|
|||||||
|
|
пропорционально объему). |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Закон Гей-Люссака |
|
|
pV |
|
|
|
const |
Изобарное расширение |
|
|
||
|
p=const |
|
|
|
|
(нагревание) |
|
|
||||
|
M=const |
|
T |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
m=const |
V |
|
|
|
|
|
|
|
|
||
|
изобарный процесс |
|
|
|
|
|
|
|
|
|||
|
|
|
|
const |
|
|
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
V V0 T |
|
|
|
|||||||
|
|
V V0 (1 t0 ) |
|
|
|
|||||||
|
|
=1/273 К-1 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
Словесная |
Изобарное сжатие |
|
|
|
|
|
|
|
|
|
|
формулировка |
(охлаждение) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Для данной массы данного газа |
|
|
|
|||||||
|
|
при постоянном давлении |
|
|
|
|||||||
|
|
отношение объема к абсолютной |
|
|
|
|||||||
|
|
температуре есть величина |
|
|
|
|||||||
|
|
постоянная (объем прямо |
|
|
|
|||||||
|
|
пропорционален температуре). |
|
|
|
|||||||
Закон Шарля |
|
|
pV |
|
|
|
const |
Изохорное |
|
|
||
|
V=const |
|
|
|
|
нагревание |
|
|
||||
|
M=const |
|
T |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
m=const |
|
p |
|
|
|
|
|
|
|
|
|
|
изохорный |
|
|
|
|
|
|
|
|
|
||
|
процесс |
|
|
const |
|
|
|
|||||
|
|
|
|
|
|
|||||||
|
|
T |
|
|
|
|
|
|
|
|
||
|
|
|
p p0 T |
|
|
|
||||||
|
|
|
p p (1 t0 ) |
|
|
|
||||||
|
|
|
|
|
0 |
|
|
|
|
|||
|
|
=1/273 К-1 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Словесная |
Изохорное охлаждение |
|
|
|
|
|
|
|
|
|
|
формулировка |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Для данной массы данного газа |
|
|
|
|||||||
|
|
при постоянном объеме |
|
|
|
|||||||
|
|
отношение давления к |
|
|
|
|||||||
|
|
абсолютной температуре есть |
|
|
|
|||||||
|
|
величина постоянная (давление |
|
|
|
|||||||
|
|
прямо пропорционально |
|
|
|
|||||||
|
|
температуре). |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||
|
M=const |
pV |
|
Адиабатное расширение |
|
|
||||||
|
m=const |
|
|
|
=const |
|
|
|
||||
|
|
S= const |
|
|
|
|||||||
|
|
(изоэнтропийный процесс) |
|
|
|
|||||||
|
|
|
cp |
|
|
|
|
|||||
Адиабатный |
|
|
|
|
|
|||||||
|
|
|
|
|
|
cV |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
M=const |
|
|
|
|
Адиабатное сжатие |
|
|
|||||
процесс |
|
|
|
|
|
|||||||
m=const |
pV =const |
|
|
|
||||||||
|
|
|
|
|||||||||
|
|
S= const |
|
|
|
|||||||
|
|
(изоэнтропийный процесс) |
|
|
|
|||||||
|
|
|
cp |
|
|
|
|
|||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
cV |
|
|
|
||
ДОПОЛНИТЕЛЬНЫЕ ГРАФИКИ. (температура измеряется по шкале Цельсия).
