
Основные положения МКТ
.pdf
11
1. Закон Гей-Люссака. |
2. Закон Шарля |
|
|
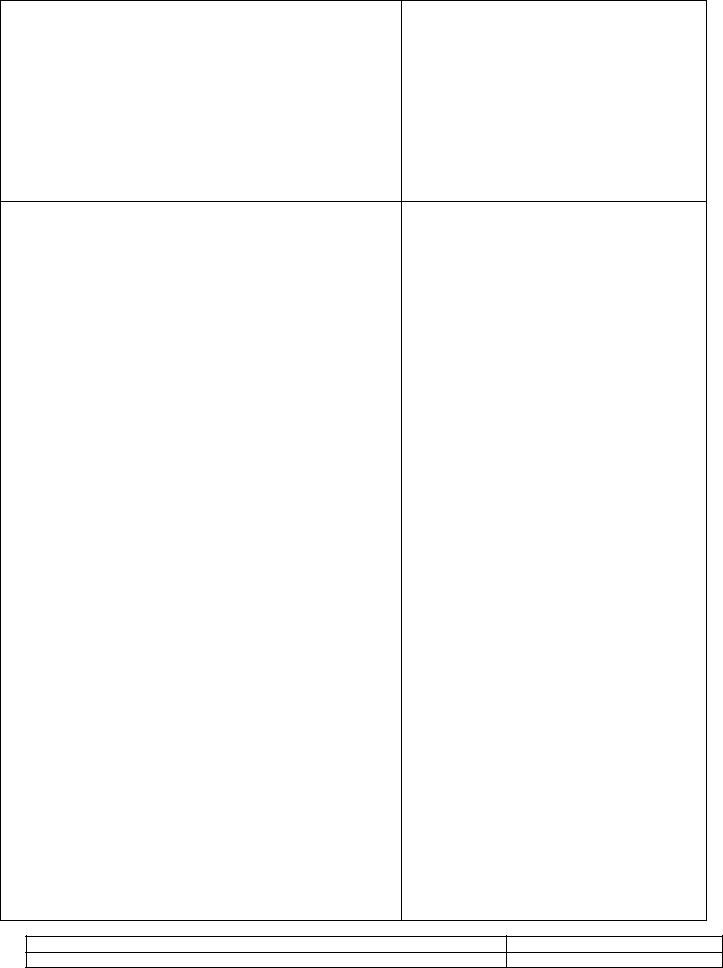
СРАВНЕНИЕ ПАРАМЕТРОВ ПО ГРАФИКУ
Т.к. p1>p2 (по графику), а по закону Шарля (АВ - изохора)
p1 |
|
T1 |
|
|
p2 |
T2 |
, то Т1>T2. |
||
|
Чем выше лежит изотерма, тем выше температура.
p1 T1
Т.к. T1 < T2 , а по закону Шарля (АВ - изохора) p2 T2 , то р1<р2.
Чем ниже лежит изобара, тем больше давление.
Т.к. T1 < T2 , а по закону Гей-Люссака (АВ - изобара)
V1 T1
V2 T2 , то V1<V2.
Чем ниже лежит изохора, тем больше объем.
КОЭФФИЦИЕНТЫ
|
|
|
|
|
|
|
V |
|
|
V0 |
|
V0 |
|
|||
|
|
|
|
|
|
|
|
|
|
T |
273 |
|
||||
|
|
0 |
|
|
|
|
T |
|
|
. |
||||||
1. Температурный коэффициент объемного расширения. Обозначим V0 - объем газа при 0 С = 273 К. Тогда: |
|
|
|
|
0 |
|
|
|||||||||
Обозначим =1/273 К-1. Следовательно: V=V0 T или V=V0 (t0+273)= V0(1+ t0). |
p |
|
p0 |
|
|
p0 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
2. Температурный коэффициент давления. Обозначим p0 - давление газа при 0 |
0 |
С = 273 К. Тогда: |
T |
T |
273 |
. Обозначим |
||||||||||
|
|
|||||||||||||||
|
|
0 |
|
|
|
|
|
|||||||||
=1/273 К-1. Следовательно: p=p0 T или p=p0 (t0+273)= p0(1+ t0).
АДИАБАТНЫЙ ПРОЦЕСС |
|
|
|
|
|
- процесс, происходящий без теплопередачи (Q=0). |
|
|
|||
Запись первого з-на термодинамики для А.п. - |
|
|
|||
U=A, где А - работа внешних сил. |
|
|
|||
Для идеального газа U=U(T). Либо работа внешних сил идет на увеличение |
внутренней |
|
|||
энергии, темп-ра возрастает. |
Либо газ совершает работу за счет уменьшения собственной внутренней |
|
|||
энергии (темп-ра убывает). |
|
cp |
|
|
|
pV const, г де = |
|
|
|
||
cv , |
|
|
|||
Уравнение адиабаты: |
|
|
|
||

|
|
|
|
|
|
|
|
|
|
|
Внутренняя энергия |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
1-й закон термодинамики. |
|
|
|
|
||||||
|
Сумма кинетических энергий хаотического движения всех |
|
|
U Wk |
Wp |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|||
|
частиц тела относительно центра масс тела (молекул, |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где сp - теплоемкость при постоянном давлении, |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
сv - теплоемкость при постоянном объеме. |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для идеального одноатомного газа: |
pV |
3 |
|
const |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
pV |
V1-γ |
|
|
-1 |
|
|
1-γ |
|
γ |
|
|
|
|
|
|
||||
|
|
|
const, |
|
const |
илиV |
|
|
|
T const или |
p |
|
T |
|
const |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
Т.к. T |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Адиабатный процесс может быть осуществлен либо в теплоизолированной системе, либо очень быстро |
Облако мощного |
|||||||||||||||||||
|
(чтобы не успеть передать тепло - взрыв). |
|
|
|
|
|
|
|
|
|
(ядерного) взрыва, |
||||||||||
|
Используется для получения жидких газов. |
|
|
|
|
|
|
|
|
облака |
|||||||||||
Атмосферное давление.
Атмосфера - слой воздуха, который окружает нашу планету. Она представляет собой смесь газов. Атмосфера удерживается притяжением Земли. На нее действует сила тяжести.
Исследования показали, что плотность атмосферы на разных высотах от поверхности Земли различна: она увеличивается по мере приближения к поверхности Земли.
Если последовательно выделять разные уровни, то можно показать, что каждый вышележащий слой атмосферы вследствие притяжения Земли давит на слой, лежащий ниже. Но газы, согласно закону Паскаля, передают производимое на них давление без изменения во все точки. Значит, на разных расстояниях от поверхности Земли состояние атмосферы можно характеризовать своим давлением. Самое большое давление будет наблюдаться вблизи поверхности Земли.
Атмосфера давит на поверхность Земли. Это действие называют атмосферным давлением. Атмосферное давление действует на все тела, находящиеся в атмосфере.
Впервые установил существование атмосферного давления, изобрел прибор для измерения атмосферного давления и измерил его ученик Галилея Эванджелиста Торричелли.
Его опыт состоял в следующем. Узкую трубку длиной 1 м, запаянную с одного конца, Торричелли заполнил ртутью. Закрыв отверстие пальце, он перевернул ее и погрузил в чашку с ртутью. Когда Торричелли отпустил палец, часть ртути вылилась из трубки в чашку. Высота столбика оставшейся ртути в трубке оказалась равной примерно 76 см.
Это явление можно объяснить, если предположить, что давление образовавшегося столба ртути уравновешивает давление атмосферы на уровне свободной поверхности ртути в чашке.
Поместив рядом с трубкой шкалу, Торричелли наблюдал изменение высоты столба ртути в трубке в связи с изменениями в атмосфере и измерял атмосферное давление в единицах "высоты ртутного столба". Этот прибор называется ртутным барометром. За величину нормального атмосферного давления, измеренного таким способом, принято давление столба ртути высотой 760 мм.
В единицах СИ pатм |
13600 |
кг |
10 |
Н |
0,76м 105 |
Н |
105 Па . |
м3 |
|
м2 |
|||||
|
|
|
кг |
|
|||
Соответственно 1 мм ртутного столба 133,(3) Па.
Если использовать жидкостные приборы, то давления разреженных газов удобнее измерять в единицах "высоты водяного столба", поскольку плотность ртути в 13,6 раза больше плотности воды.
pатм 105 Па
13
атомов) и потенциальных энергий их взаимодействия друг |
|
|
с другом называется внутренней энергией. |
|
|
Внимание! 1. Энергия упорядоченного движения частиц тела |
|
|
представляет собой механическую кинетическую энергию тела. |
|
|
2. Вообще говоря, во внутреннюю энергию входят |
|
|
энергии внутриатомных частиц, но при не очень больших |
|
|
температурах эта энергия остается неизменной. |
U=U(T,V) |
|
Кинетическая энергия частиц определяется скоростью, а значит |
|
|
- температурой тела. |
|
|
Потенциальная - расстоянием между частицами, а значит - |
|
|
объемом. |
|
|
Следовательно: |
U=U(T,V) - внутренняя энергия зависит от |
|
объема и температуры. |
|
|
Для идеального газа: U=U(T), т.к. взаимодействием на |
|
Идеальный газ: |
|||||||||||||||||||||||
расстоянии |
|
|
|
|
|
|
|
пренебрегаем. |
|
U |
3 |
RT |
|
|
|||||||||||
|
|
3 |
|
3m |
3m |
3 |
|
3 |
|
|
|
|
|
||||||||||||
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
U NE N |
2 |
kT |
2M |
NA kT |
2M |
RT |
2 |
RT |
2 |
pV |
|
2 |
|
|
|
|
|
||||||||
- внутренняя энергия идеального одноатомного газа. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
3 |
|
|
|
|
||||||||||||||
Внутренняя энергия - однозначная функция состояния (с |
|
|
U |
pV |
|
|
|||||||||||||||||||
|
|
||||||||||||||||||||||||
точностью до произвольной постоянной) и в замкнутой системе |
|
2 |
|
|
|
|
|||||||||||||||||||
сохраняется. Обратное неверно(!) - одной и той же энергии |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
могут соответствовать разные состояния. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Опыты Джоуля доказали эквивалентность работы и количества |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
теплоты, т.е. и та и другая величины являются мерой изменения |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
энергии, их можно измерять в одинаковых единицах: 1 кал = |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
4,1868 Дж 4,2 Дж. Эта величина наз. механическим |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
эквивалентом теплоты. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Р.Майер, Д.Джоуль, Г.Гельмгольц - закон сохранения энергии |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
для тепловых процессов - 1-й закон термодинамики. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Изменение внутренней энергии системы при переходе ее из |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
U Q A |
|
|
||||||||||||||||||||||
одного состояния в другое равно сумме работы |
внешних сил и |
|
|
|
|
||||||||||||||||||||
количества теплоты, переданного системе: |
U Q A |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Изменений внутренней энергии не зависит от способа, которым |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
осуществляется этот переход. Т.о. существует два способа |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
изменения внутренней энергии: совершение механической |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
работы и теплопередача (теплообмен). Работа и количество |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
теплоты характеризуют процесс изменения внутренней энергии, |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
но не саму внутреннюю энергию. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Если А - работа внешних сил, а А' - работа газа, то А = - А' |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
(в соответствии с 3-м законом Ньютона). Тогда: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q U A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q U A |
|
||||||||
- другая форма записи первого закона термодинамики. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Количество теплоты, переданное системе, идет на |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
изменение ее внутренней энергии и на совершение системой |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
работы над внешними телами. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Невозможность создания вечного двигателя 1-го рода. |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Вечный двигатель первого рода - устройство, которое |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
могло бы совершать неограниченное количество работы без |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
затраты энергии. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Тогда Q=0. Следовательно: A'= - U. Т.е. такой двигатель |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
должен совершать работу за счет убыли внутренней энергии. Но |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
ее запасы конечны. После того, как запас энергии будет |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
исчерпан, двигатель остановится. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Работа в термодинамике.
В термодинамике движение тела как целого не рассматривается и речь идет о
14
перемещении частей макроскопического тела относительно друг друга. При совершении работы меняется объем тела, а его скорость остается раной нулю. Но скорости молекул тела меняются! Поэтому меняется температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется - поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура.
F- сила, действующая на газ со стороны поршня.
А- работа внешних сил по сжатию газа.
F'- сила, действующая на поршень со стороны газа. А' - работа газа по расширению.
F = -F' - по 3-ему з-ну Ньютона. Следовательно: А= - А'
F'= pS, где p- давление, S - площадь поршня. Если газ расширяется:
h=h2 - h1 - перемещение поршня. V1=Sh1; V2=Sh2.
Тогда: A'=F' h=pS(h2 - h1)=p(Sh2 - Sh1)=p(V2-V1)=p V
При расширении работа газа положительна. При сжатии - отрицательна. Таким образом: A' = p V - работа газа
A= - p V - работа внешних сил.
Используя уравнение Менделеева-Клапейрона, получим:
A pΔ V p νRΔT νRΔT p
Эти выражения справедливы при очень малых (!) изменениях объема или при постоянном давлении (т.е. в изобарном процессе)
Физический смысл универсальной газовой постоянной.
R A - универсальная газовая постоянная численно равна работе 1
νΔT
моля идеального газа при изобарном нагревании на 1 К.
Геометрическое истолкование работы.
Визобарном процессе площадь под графиком в координатах p,V численно равна работе (вспомните - перемещение на графике скорости!).
Вобщем случае надо процесс разбить на малые части и сосчитать
элементарные |
работы, |
а |
затем |
их |
сложить |
(процесс |
N V2
интегрирования):A pn V pdVНапример, в изотермическом процессе
n 1 V1
A RT ln V2 . V1
Визохорном процессе объем не меняется, следовательно, в изохорном процессе работа не совершается!
Вадиабатном процессе A cV (T2 T1).
ТЕПЛОПЕРЕДАЧА
Теплопередача (теплообмен) - процесс изменения внутренней энергии без совершения
15
|
|
работы. |
|
|
|
|
|
|
||
Количественная характеристика - количество теплоты - часть изменения внутренней |
1 кал = 4,19 Дж |
|
||||||||
энергии, происходящего в процессе теплопередачи. Обозначается Q. Единицы измерения: |
|
|
|
|
|
|
||||
Дж, кал (калория). 1 кал = 4,19 Дж. |
|
|
|
|
|
|
||||
|
|
Виды теплопередачи: |
|
|
|
|
|
|
||
1. Теплопроводность - вид теплопередачи, при котором энергия передается от более |
|
|
|
|
|
|
||||
нагретого участка тела к менее нагретому, благодаря движению и взаимодействию частиц |
|
|
|
|
|
|
||||
тела. Характерна для твердых тел. |
|
|
|
|
|
|
||||
2. Конвекция - вид теплопередачи, при котором энергия передается потоками (струями) |
|
|
|
|
|
|
||||
вещества. Характерна для жидкостей и газов. |
|
|
|
|
|
|
||||
3. Излучение - вид теплопередачи, при котором энергия передается с помощью |
|
|
|
|
|
|
||||
электромагнитных волн (преимущественно инфракрасного диапазона). Может |
|
|
|
|
|
|
||||
происходить в вакууме. |
|
|
|
|
|
|
|
|
||
|
|
Расчет количества теплоты. |
|
|
|
|
|
|
||
1. Изменение температуры. Q = cm(Т2-Т1) = cm Т. |
|
|
|
|
|
|
||||
Величина с наз. удельной теплоемкостью. Она характеризует тепловые свойства вещества |
|
|
|
|
|
|
||||
по его способности к изменению температуры. Удельная теплоемкость показывает на |
Изменение температуры: |
|||||||||
сколько изменяется внутренняя энергия 1 кг данного вещества при изменении его |
|
|
|
|
|
|
||||
температуры на 1 К. Единица измерения Дж/кг.К. |
Q = cm(t02-t01) |
|
||||||||
Q=C T. Величина С называется теплоемкостью тела. С=сm. |
Q = cm t0. |
|
||||||||
Q = c T. |
Величина c |
называется молярной теплоемкостью (теплоемкость 1 моля |
|
|
|
|
|
|
||
вещества). |
|
|
|
|
|
|
|
|
|
|
2. Плавление и отвердевание вещества. Q= m. - удельная теплота плавления. Удельная |
Плавление и отвердевание |
|||||||||
теплота плавления показывает на сколько изменяется внутренняя энергия 1 кг данного |
вещества |
|
||||||||
вещества при его полном переходе из твердого состояния в жидкое (при температуре |
Q= m |
|
||||||||
плавления). Зависит от внешних условий. Единица Дж/кг. При плавлении и отвердевании |
|
|
Дж |
|
|
|
||||
(кристаллизации) температура остается неизменной пока вещество не перейдет в одну |
|
|
|
|
||||||
|
кл |
|
||||||||
фазу. Энергия при плавлении тратится на разрушение кристаллической решетки. При |
|
|
|
|||||||
|
|
|
|
|
|
|||||
отвердевании Q = - m. |
|
|
|
|
|
|
|
|
||
|
|
|
|
|||||||
3. Парообразование и конденсация вещества. Q = Lm = rm. L ( r ) - удельная теплота |
Q = Lm = rm |
|
||||||||
парообразования. Удельная теплота парообразования показывает, на сколько изменяется |
L |
Дж |
|
|
||||||
внутренняя энергия 1 кг данного вещества при полном превращении жидкости в пар (при |
|
|
||||||||
кл |
|
|||||||||
температуре кипения). Зависит от внешних условий. Единица L ( r ) Дж/кг. При кипении |
|
|
|
|||||||
температура остается постоянной. Энергия тратится на разрыв связей между |
|
|
|
|
|
|
||||
молекулами. При конденсации Q = -Lm = -rm. |
|
|
|
|
|
|
||||
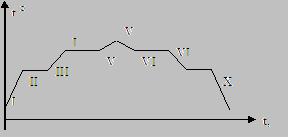
I – нагревание твердого тела; |
|
|
|
|
|
|
|
|||
II – плавление твердого тела; |
|
|
|
|
|
|
|
|||
III – нагревание жидкости; |
|
|
|
|
|
|
|
|
||
IV – кипение; |
|
|
|
|
|
|
|
|
|
|
V – нагревание газа; |
|
|
|
|
|
|
|
|
||
VI – охлаждение газа; |
|
|
|
|
|
|
|
|
||
VII – конденсация; |
|
|
|
|
|
|
|
|
||
VIII – охлаждение жидкости; |
|
|
|
|
|
|
|
|||
IX – кристаллизация (отвердевание); |
|
|
|
|
|
|
|
|||
X – охлаждение твердого тела. |
|
|
|
|
|
|
|
|||
|
|
|
|
|||||||
4. Сгорание топлива. Q = qm. q - удельная теплота сгорания топлива. Дельная теплота |
Q = qm |
|
||||||||
сгорания топлива показывает сколько энергии выделяется при полном сгорании 1 кг данного |
q |
Дж |
|
|
|
|||||
вещества. Единица q Дж/кг. Сгорание - соединение с кислородом. При горении изменяется |
|
|
||||||||
|
|
|||||||||
взаимное расположение частиц вещества, следовательно, меняется их потенциальная энергия, |
|
|
кл |
|
||||||
а значит, внутренняя энергия вещества. Вещества, при горении которых выделяется энергия, |
|
|
|
|
|
|
||||
являются топливом. |
|
|
|
|
|
|
|
|
||
Qполученное>0, Qвыделенное<0 |
|
|
|
|
|
|
||||
Согласно закону сохранения энергии алгебраическая сумма всех количеств теплоты |
|
|
|
|
|
|
||||
равна нулю (все переданное количество теплоты равно по модулю всему полученному): |
|
|
|
|
|
|
||||
Q1 + Q2 + Q3 +...= 0 |
- |
|||||||||
Q1 + Q2 + Q3 +...= 0 |
- уравнение теплового баланса. |
|||||||||
уравнение теплового |
|
|||||||||
С учетом потерь на нагревание окружающей среды: |
|
|||||||||
баланса. |
|
|||||||||
|
Qпереданное = Qполученное, где - кпд нагревательного прибора. |
|
||||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
16
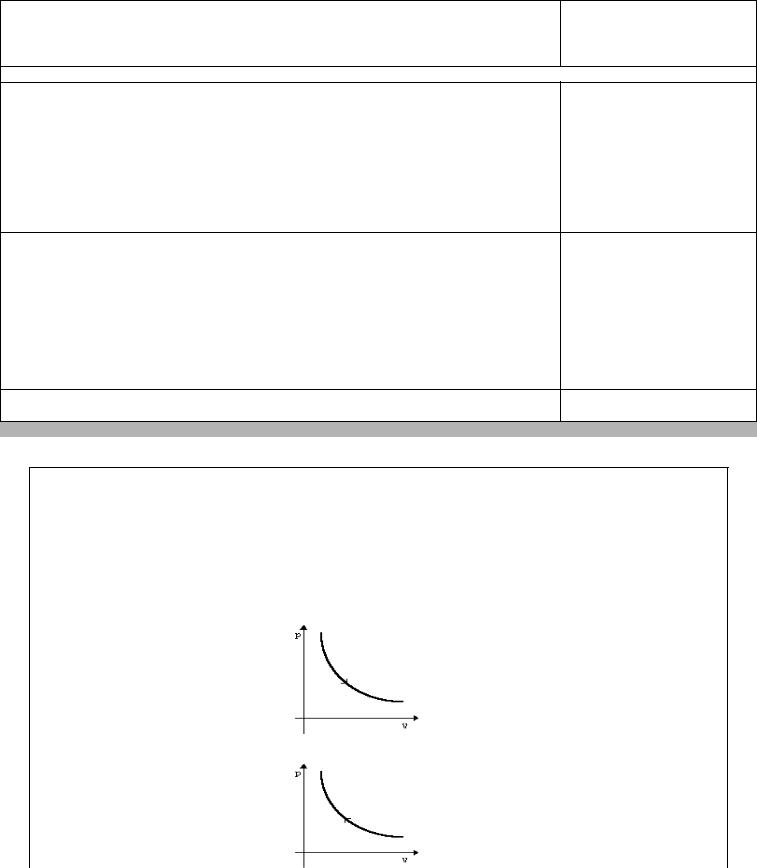
Qпереданное = Qполученное
Теплоемкости газа при постоянном объеме и постоянном давлении.
1. Молярная теплоемкость при постоянном объеме: с |
|
|
QV |
|
U A' |
|
|
|
|
|
|||||
V |
|
|
|
|
|
|
. |
|
|
|
|
|
|||
T |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
T |
|
|
|
3 |
|
||||||
|
|
|
|
|
|
3 |
|
|
|
|
cV |
R |
|||
|
|
|
|
|
|
R T |
3 |
2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Но при изохорном процессе работа не совершается, следовательно: cV |
|
2 |
|
|
R . |
|
|
||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
T |
2 |
|
|
|
||
2.Молярная теплоемкость при постоянном давлении:
|
|
Qp |
U A' |
|
|
3 |
R T R T |
|
5 |
|
cp |
5 |
R |
|
|
|
|
2 |
|
||||||||||
|
|
|
|
|
|
|||||||||
|
сp |
|
|
|
|
|
|
|
R . |
2 |
|
|||
|
T |
T |
|
T |
2 |
|||||||||
|
|
|||||||||||||
3. Связь между теплоемкостями при постоянном давлении и постоянном объеме: |
сp cV R |
|||||||||||||
сp cV |
R - уравнение Майера для идеального одноатомного газа. |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
уравнекние Майера |
||
4. Теплоемкость при изотермическом процессе: т.к. температура не меняется, то теплоемкость бесконечна.
ПРИМЕНЕНИЕ 1 ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ.
|
Процесс |
Постоянные |
График |
Изменение внутренней энергии |
Запись 1-го закона |
термодинамики |
|
|
Физический смысл |
|
|
|
|
|
|
|
|
||
|
|
m=const |
|
U=const |
Q=A' |
|
Изотермический процесс |
||
Изотермическое |
|
M=const |
|
U=0 |
|
|
не |
может |
происходить |
расширение |
T=const |
|
|
|
|
без |
теплопередачи. Все |
||
pV=const |
|
|
|
|
количество |
теплоты, |
|||
|
|
|
|
|
переданное |
системе, |
|||
|
|
|
|
|
расходуется |
на |
|||
|
|
|
|
|
совершение |
этой |
|||
|
|
|
|
|
системой |
механической |
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
работы. |
|
|
Изотермическо |
|
m=const |
|
U=const |
A=-Q |
|
Изотермический процесс |
||
е сжатие |
M=const |
|
U=0 |
|
|
не |
может |
происходить |
|
T=const |
|
|
|
|
без теплопередачи. |
||||
pV=const |
|
|
|
|
Вся работа внешних сил |
||||
|
|
|
|
|
выделяется в виде тепла. |
||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
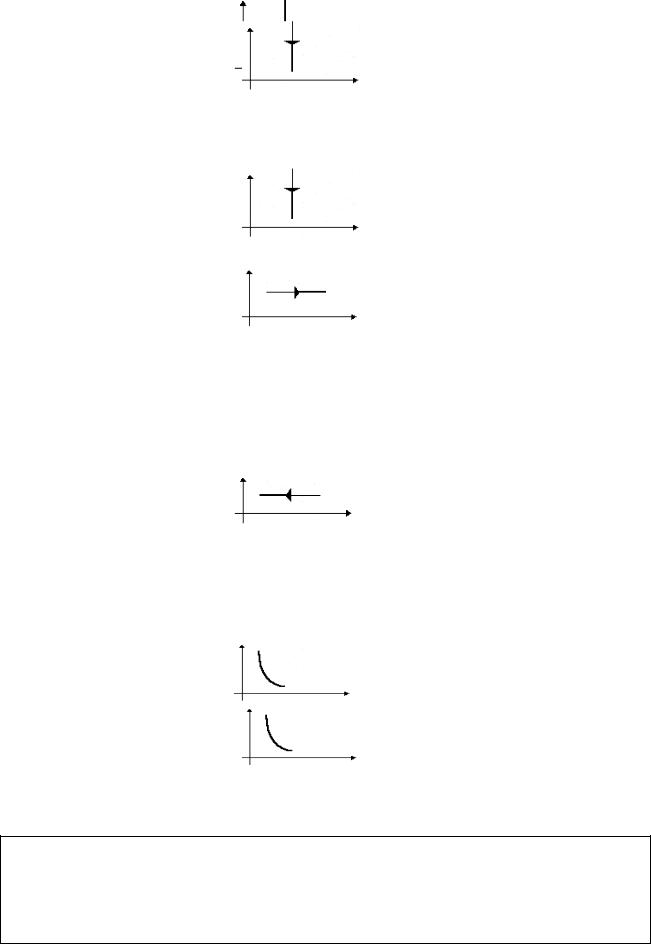
17
|
|
m=const |
p |
|
p |
A=0 |
Все количество теплоты, |
||||||||
|
|
M=const |
|
|
T |
Q= U |
переданное |
|
системе, |
||||||
|
|
V=const |
|
|
U |
|
расходуется |
|
|
на |
|||||
Изохорное |
нагревание |
|
p |
|
const |
|
|
U>0 |
|
увеличение |
|
|
ее |
||
|
|
|
|
|
внутренней энергии. |
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
T |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
m=const |
p |
|
p |
A=0 |
Система уменьшает свою |
||||||||
Изохорное |
охлаждение |
M=const |
|
|
T |
Q= U<0 |
внутреннюю |
энергию, |
|||||||
V=const |
|
|
U |
|
отдавая |
|
|
тепло |
|||||||
|
|
|
p |
|
const |
|
|
U<0 |
|
окружающим телам. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
T |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
m=const |
p |
|
V |
Q= U+A' |
Количество |
|
теплоты, |
||||||
Изобарное |
) |
M=const |
|
|
T |
U=Q-А'>0 |
переданное |
|
системе, |
||||||
нагревание(расширение |
p=const |
|
|
U |
|
превышает |
совершенную |
||||||||
|
|
|
|
V |
|
|
U>0 |
|
ею механическую работу. |
||||||
|
|
|
|
|
|
const |
|
|
|
|
Часть |
тепла |
расходуется |
||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
T |
|
V |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
на совершение работы, а |
|||||
|
|
|
|
|
|
|
|
|
|
|
часть |
– на |
увеличение |
||
|
|
|
|
|
|
|
|
|
|
|
внутр. энергии. |
|
|||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
m=const |
P |
|
V |
U=Q+A<0 |
Количество |
|
теплоты, |
||||||
Изобарное |
охлаждение(сжатие) |
M=const |
|
|
T |
Q<0 |
отдаваемое |
|
системой, |
||||||
p=const |
|
|
U |
|
превышает |
сил. |
работу |
||||||||
|
|
|
|
V |
|
|
U<0 |
|
внешних |
Часть |
|||||
|
|
|
|
|
|
const |
|
V |
|
|
тепла |
система отдает за |
|||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
T |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
счет |
уменьшения |
внутр. |
||
|
|
|
|
|
|
|
|
|
|
|
энергии. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Адиабатное |
Расширение |
m=const |
P |
|
U<0 |
Q=0 |
Система |
|
совершает |
||||||
M=const |
|
|
U |
A' > 0 |
механическую |
работу |
|||||||||
|
|
|
pV =const |
|
|
T |
U=-A' < 0 |
только |
|
за |
счет |
||||
|
|
|
|
|
|
|
|
V |
|
A'=- U |
уменьшения |
|
|
своей |
|
|
|
|
|
|
|
|
|
|
|
внутренней энергии. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
m=const |
|
|
U>0 |
Q=0 |
Внутренняя |
|
|
энергия |
|||||
Адиабатное |
сжатие |
M=const |
|
|
U |
A>0 |
системы увеличивается за |
||||||||
|
pV =const |
P |
|
T |
U=A |
счет работы внешних сил. |
|||||||||
|
|
|
|
||||||||||||
|
|
|
V |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Второй закон термодинамики. Необратимость тепловых процессов.
Закон сохранения энергии утверждает, что количество энергии при любых процессах остается неизменным. Но он ничего не говорит о том, какие энергетические превращения возможны.
З-н сохранения энергии не запрещает, процессы, которые на опыте не происходят:
-нагревание более нагретого тела более холодным;
-самопроизвольное раскачивание маятника из состояния покоя;

18
- собирание песка в камень и т.д.
Процессы в природе имеют определенную направленность. В обратном направлении самопроизвольно они протекать не могут. Все процессы в природе необратимы (старение и смерть организмов).
Необратимым процессом может быть назван такой процесс, обратный которому может протекать только как одно из звеньев более сложного процесса. Самопроизвольными называются такие процессы, которые происходят без воздействия внешних тел, а значит, без изменений в этих телах).
Процессы перехода системы из одного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний, называются обратимыми. При этом сама система и окружающие тела полностью возвращаются к исходному состоянию.
Второй з-н термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость процессов в природе. Он установлен путем непосредственного обобщения опытных фактов.
Формулировка Р. Клаузиуса: невозможно перевести тепло от более холодной системы к более
горячей при отсутствии одновременных изменений в обеих системах или окружающих телах. Формулировка У. Кельвина: невозможно осуществить такой периодический процесс,
единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Невозможнен тепловой вечный двигатель второго рода, т.е. двигатель, совершающий механическую работу за счет охлаждения какого-либо одного тела.
Объяснение необратимости процессов в природе имеет статистическое (вероятностное) истолкование. Чисто механические процессы (без учета трения) обратимы, т.е. инвариантны (не изменяются) при
замене t -t. Уравнения движения каждой отдельно взятой молекулы также инвариантны относительно преобразования времени, т.к. содержат только силы, зависящие от расстояния. Значит причина необратимости процессов в природе в том, что макроскопические тела содержат очень большое количество частиц.
Макроскопическое состояние характеризуется несколькими термодинамическими параметрами (давление, объем, температура и т.д.). Микроскопическое состояние характеризуется заданием координат и скоростей (импульсов) всех частиц, составляющих систему. Одно макроскопическое состояние может быть реализовано огромным числом микросостояний.
Обозначим: N- полное число состояний системы, N1 - число микросостояний, которые реализуют данное состояние, w - вероятность данного состояния.
Тогда : w N1 .
N
Чем больше N1, тем больше вероятность данного макросостояния, т.е. тем большее время система будет находиться в этом состоянии. Эволюция системы происходит в направлении от маловероятных состояний к более вероятным. Т.к. механическое движение - это упорядоченное движение, а тепловое - хаотическое, то механическая энергия переходит в тепловую. При теплообмене состояние, в котором одно тело имеет более высокую температуру (молекулы имеют более высокую среднюю кинетическую энергию), менее вероятно, чем состояние, в котором температуры равны. Поэтому процесс теплообмена происходит в сторону выравнивания температур.
Энтропия - мера беспорядка. S - энтропия.
Уравнение Больцмана: S k lnw
где k - постоянная Больцмана. Это уравнение раскрывает статистический смысл законов термодинамики. Величина энтропии во всех необратимых процессах увеличивается. С этой точки зрения жизнь - это постоянная борьба за уменьшение энтропии. Энтропия связана с информацией, т.к. информация приводит к порядку (много будешь знать - скоро состаришься).
Энтропия - функция состояния системы. В термодинамике - это величина, определяемая |
|
|
|
|||||||
соотношением: ΔS |
Q |
, |
|
|
|
|||||
|
|
|
|
|||||||
|
|
|
|
|
T |
S k lnw |
||||
где S- энтропия. Т.е. изменение энтропии равно количеству теплоты, переданному в процессе, к |
||||||||||
|
Q |
|
||||||||
температуре, при которой происходил этот процесс. |
ΔS |
|
||||||||
В этом смысле адиабатный процесс - это изоэнтропийный процесс. |
|
|||||||||
T |
||||||||||
Из первого закона термодинамики: |
|
|||||||||
|
|
|
||||||||
|
Q |
U A' |
|
|
|
|||||
S |
|
|
|
|
|
|
|
|||
T |
T |
|
|
|
||||||
- основное уравнение термодинамики. |
|
|
|
|||||||
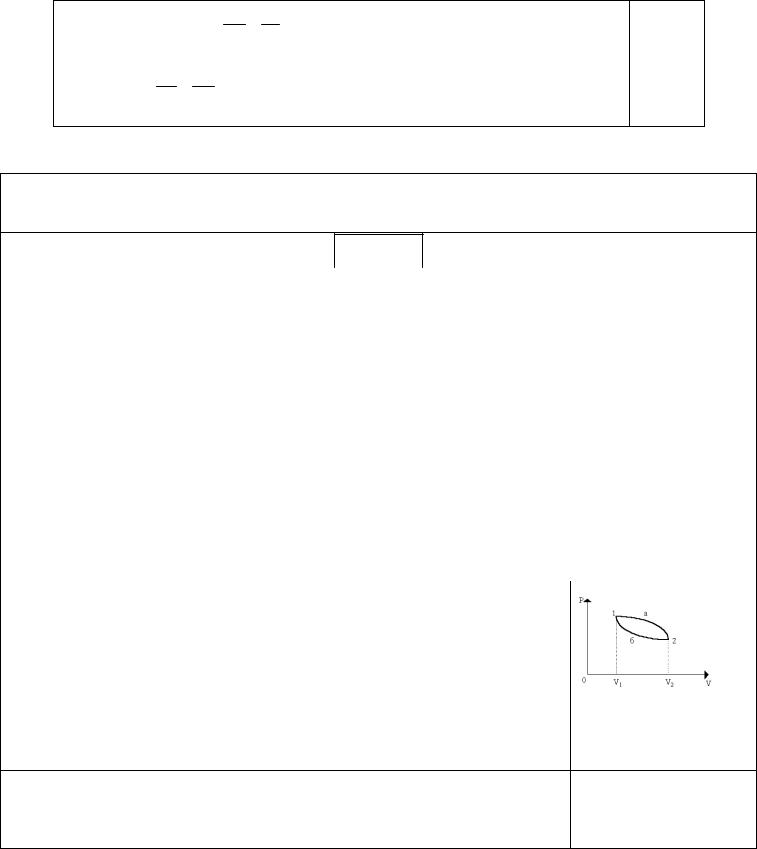
19
Из теоремы Карно следует: Q1 T1 .
Q2 T2
Следовательно: Q1 Q2 или S 0
T1 T2
Тепловые двигатели.
Машины, преобразующие внутреннюю энергию механическую работу называют тепловыми двигателями
Тепловые
двигатели
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Двигатели |
|
|
Паровые |
|
|
|
|
Имя |
|
|
|
|||||||||||||
|
|
|
|
|
|
внутреннего |
|
|
двигатели |
|
|
|
|
Турбины |
|
|
|
|||||||||||||
|
|
|
|
|
|
сгорания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Карбюраторные |
|
Дизельные |
|
|
|
Паровые |
|
|
|
Газовые |
|
|
|
|||||||||||||
|
|
|
|
(внешнее |
|
(внешнее |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
смесе- |
|
смесе- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
образование) |
|
образование) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Хронология изобретений: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
1690 |
- пароатмосферная машина Д.Папена (Франция) - теоретически |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
1698 |
- пароатмосферная машина Т.Севери (Англия) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
1705 |
- пароатмосферная машина Т.Ньюкомена (Англия) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
1763 |
- паровая машина И.Ползунова (Россия) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
1774 |
- паровая машина Д.Уатта (Англия) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
1860 |
- двигатель внутреннего сгорания Ленуара (Франция) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
1865 |
- двигатель внутреннего сгорания Н.Отто (Германия) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
1871 |
- холодильная машина К.Линде (Германия) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
1887 |
- паровая турбина К.Лаваля (Швеция) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
1897 |
- двигатель внутреннего сгорания Р.Дизеля (Германия) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
Круговой (циклический) процесс - если в результате изменений система вернулась в |
|
|
|||||||||||||||||||||||||
исходное состояние, то говорят, что она совершила круговой процесс или цикл. |
|
|
||||||||||||||||||||||||||||
|
|
|
А1а2>А1б2 - по модулю (из сравнения площадей). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
А1а2>0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
А1б2<0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
Суммарная работа за циклический процесс численно равна площади, ограниченной |
|
|
|||||||||||||||||||||||||
линией процесса. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
Из второго з-на термодинамики: ни один тепловой двигатель не может иметь кпд равный |
Aза цикл |
|
|||||||||||||||||||||||||
единице (100%). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Qза цикл |
||||
|
, где А - работа двигателя за цикл, Q - количество теплоты, полученное двигателем за |
|||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
Q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
цикл.
Принцип работы теплового двигателя:
Q = A' + U - количество теплоты, переданное системе расходуется на совершение этой Q = A' + U системой механической работы и на увеличение ее внутренней энергии (т.е. система должно отдать тепло в окружающее пространство) - 1-й з-н термодинамики.
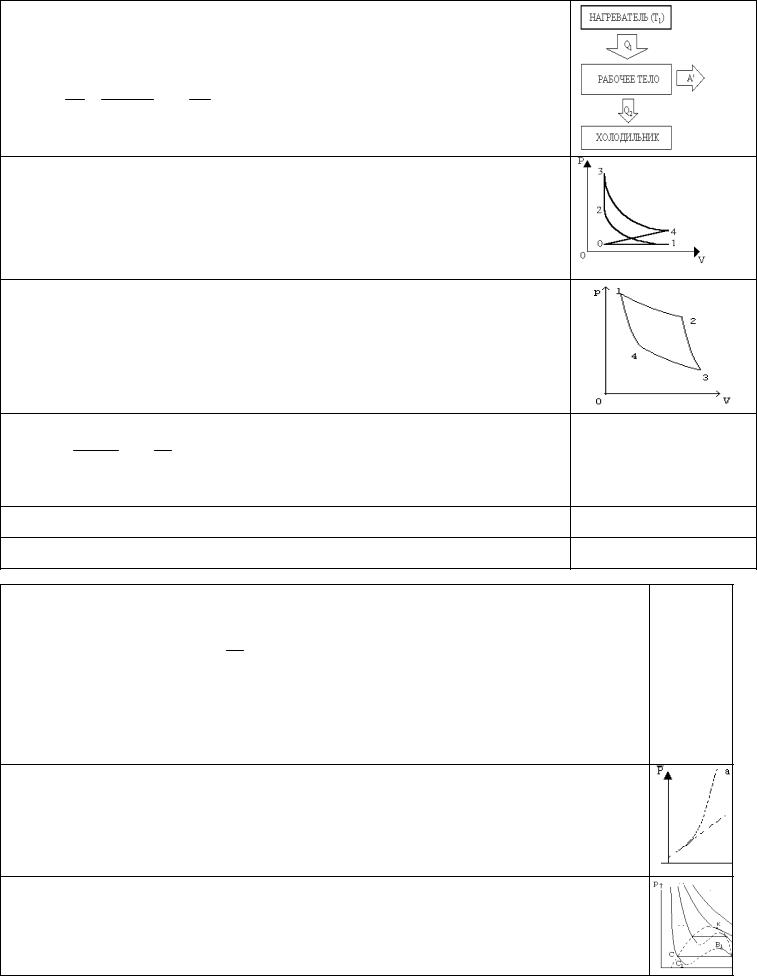
20
Нагреватель передает тепло рабочему телу при температуре Т1. Рабочее тело совершает полезную механическую работу A'.
Холодильник (охладитель) получает часть тепла, обеспечивая циклический процесс. A' = Q1 - Q2
Коэффициент полезного действия теплового двигателя:
A' Q1 Q2 1 Q2 1
Q1 Q1 Q1
Кпд реальных двигателей:
турбореактивный - 20 -30%; карбюраторный - 25 -30%, дизельный - 35-45%. 0 - 1 - впуск горючей смеси (изобара)
1- 2 - сжатие (адиабата)
2- загорание горючей смеси
2-3 -резкое возрастание давления (изохора)
3-4 - рабочий ход (адиабата)
4- 0 - выпуск
Идеальная тепловая машина - машина Карно (Сади Карно, Франция, 1815). Машина работает на идеальном газе.
1 - 2 - при тепловом контакте с нагревателем газ расширяется изотермически. 2 -3 - газ расширяется адиабатно.
После контакта с холодильником: 3 -4 - изотермическое сжатие; 4 -1 - адиабатное сжатие.
КПД идеальной машины:
T1 T2 1 T2
T1 T1
является функцией только двух температур, не зависит от устройства машины и вида топлива.
Теорема Карно: кпд реальной тепловой машины не может быть больше кпд идеальной машины, работающей в том же интервале температур.
Цикл Карно обратим. Машина, работающая по обратному циклу наз. холодильной машиной.
ИСПАРЕНИЕ И КОНДЕНСАЦИЯ.
Парообразование - процесс превращения жидкости в пар. Конденсация - процесс превращения пара в жидкость.
ИСПАРЕНИЕ - процесс парообразования с поверхности жидкости или твердого тела. Заключается в
вылетании частиц (молекул, атомов), Ек которых превышает потенциальную энергию их связи с остальными частицами вещества. Скорость испарения зависит от:
1.площади поверхности жидкости,
2.температуры (увеличивается), хотя происходит при любой температуре и не требует постоянного притока тепла. Температура жидкости уменьшается.
3.движения молекул над поверхностью жидкости или газа,
4.рода вещества.
НАСЫЩЕННЫЙ И НЕНАСЫЩЕННЫЙ ПАР.
Вещество в газообразном состоянии, находящееся в динамическом равновесии со своей жидкостью, наз. насыщенным паром. Динамическое равновесие заключается в том, что процессы испарения и конденсации уравновешены. Давление насыщенного пара в зависимости от температуры (кривая а) растет быстрее, чем идеального газа (график b), т.к. с ростом температуры увеличивается концентрация, а p=nkT.
Основное свойство насыщенного пара - давление пара при постоянной температуре не зависит от объема (см. изотерму).Участок ВС соответствует насыщенному пару.
