
- •ВВЕДЕНИЕ
- •НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •Вводная часть
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •ПРАВИЛА ОФОРМЛЕНИЯ ОТЧЕТА ПО ЛАБОРАТОРНЫМ РАБОТАМ
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •ЭКВИВАЛЕНТ
- •Вопросы к семинару
- •СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
- •ЛАБОРАТОРНАЯ РАБОТА «Приготовление растворов»
- •Вопросы к семинару
- •ТЕРМОХИМИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Определение тепловых эффектов»
- •Вопросы к семинару
- •ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •ЛАБОРАТОРНАЯ РАБОТА «Равновесие»
- •Вопросы к семинару
- •СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ЛАБОРАТОРНАЯ РАБОТА «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •РАСТВОРИМОСТЬ ЭЛЕКТРОЛИТОВ
- •ЛАБОРАТОРНАЯ РАБОТА «Растворимость и ПР»
- •Вопросы к семинару
- •ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •ГИДРОЛИЗ СОЛЕЙ
- •ЛАБОРАТОРНАЯ РАБОТА «Гидролиз солей»
- •Вопросы к семинару
- •КОЛЛОИДНЫЕ РАСТВОРЫ
- •ЛАБОРАТОРНАЯ РАБОТА «Коллоидные растворы»
- •Вопросы к семинару
- •РЕДОКС-ПРОЦЕССЫ
- •ЛАБОРАТОРНАЯ РАБОТА «ОВР»
- •Вопросы к семинару
- •ЭЛЕКТРОХИМИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Электрохимия»
- •Вопросы к семинару
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Получение и свойства КС»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •ЛАБОРАТОРНАЯ РАБОТА «Очистка веществ»
- •Вопросы к семинару
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ОГЛАВЛЕНИЕ

ЛАБОРАТОРНАЯ РАБОТА «Очистка веществ»
1. Очистка воды от растворенных в ней веществ перегонкой. Со-
брать прибор (рис. 15). В колбу Вюрца (1) на 0,5 л налить 250 мл сульфата меди (предварительно измерив его плотность ареометром) и опустить в раствор несколько кусочков пемзы. (Зачем?)
Закрыть отверстие колбы Вюрца пробкой с термометром (2), присоединить холодильник (3), аллонж (4), по-
следний опустить в приемник (5). На охладитель плите (6) через асбестовую сетку на-
греть раствор в колбе до кипения. При
Рис.15. Прибор для очистки |
какой Т он закипит? Изменяется ли температура ки- |
воды от растворенных в ней |
пения в процессе упаривания жидкости? |
нелетучих веществ. |
Нагревание закончить, когда в приемнике соберется |
|
100–120 мл жидкости. Измерить ее плотность. Есть ли в ней сульфат меди? Как это установить?
2.Очистка иода возгонкой. В стакан для возгонки поместите 0,3 г кри-
сталлического иода и 0,1 г иодида калия (для удаления примесей Cl2 и Br2, содержащихся в иоде), и перемешайте стеклянной палочкой. Круглодонной колбой с холодной водой накройте стакан и осторожно нагрейте его через асбестовую сетку (табл. 6). После прекращения выделения паров (какого цвета?) отделите кристаллы от колбы, взвесьте их и определите процент выхода иода.
3.Очистка пятиводного сульфата меди перекристаллизацией. Рас-
считать количество воды и CuSO4  5H2 O , нужное для приготовления раствора,
5H2 O , нужное для приготовления раствора,
насыщенного при 600С, чтобы при последующем его охлаждении до 00С выделилось 7 г кристаллогидрата, используя следующие данные:
T0C |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
80 |
100 |
|
S, г/100 г |
12.9 |
14.8 |
17.2 |
20.0 |
22.8 |
25.1 |
28.1 |
34.9 |
42.4 |
|
H2O |
||||||||||
|
|
|
|
|
|
|
|
|
Обычно пентагидрат содержит примеси хлорида калия, а также песок и кусочки угля. Поэтому для очистки отвесьте исходной соли на 10% больше рассчитанной массы. Отмерьте цилиндром нужный объем воды, вылейте в стакан на 50 мл, вскипятите воду и растворите в ней при перемешивании навеску очищаемой соли.
Убедитесь, что хлорид-ионы есть в приготовленном растворе. Для этого к 3 каплям его добавьте каплю раствора AgNO3 и две капли азотной кислоты. Что наблюдается? Почему? Затем нагретый до кипения раствор сульфата меди отфильтруйте через складчатый фильтр, приготовленный заранее.
98
Помешивая фильтрат стеклянной палочкой, охладите его до комнатной температуры, а потом до 00С в кристаллизаторе с водой и льдом. Выпавшие кристаллы отделите от маточного раствора фильтрованием и промойте их (зачем?) 5-10 мл холодной дистиллированной воды. Раствор очищенной соли, маточный раствор, и промывные воды испытайте на хлорид-ионы и сделайте выводы.
Затем снимите кристаллы соли с воронки и отжимайте их между листами фильтровальной бумаги до тех пор, пока они не перестанут прилипать к сухой стеклянной палочке. Взвесьте на технохимических весах полученную соль. Оцените массу соли в процентах по отношению к исходной навеске. Чем объясняется сравнительно низкий выход продукта, очищенного методом перекристаллизации?
4. Очистка углекислого газа. Колбу Вюрца наполнить на 1/5 объема кусочками мрамора, присоединить к ней газоотводную трубку, добавить 30 мл 20%-го раствора HCl и сразу закрыть колбу пробкой. Что наблюдается? Чем может быть загрязнен получающийся при этом углекислый газ?
Пропускать выделяющийся газ в течение 10–15 мин через склянку Дрекселя с дистиллированной водой и последовательно с ней соединенную хлоркальциевую трубку, наполненную обезвоженным сульфатом меди. (Как изменяется его цвет? Почему?). Испытать содержимое промывной склянки на присутствие ионов Cl– и H+, используя раствор AgNO3 и индикаторную бумагу соответственно. Сделать выводы.
Вопросы к семинару
1.Какие применяются специальные наименования («марки») для продуктов, вырабатываемых химической промышленностью? В чем их различие? Какие существуют методы контроля чистоты веществ?
2.Какими способами производят очистку реактивов: газообразных, жидких, твердых? Дать краткую характеристику этих способов.
3.Кривые растворимости солей. Суть метода перекристаллизации. Ма-
точный раствор, его состав. Почему для проведения перекристаллизации рекомендуется готовить растворы, насыщенные при 60–70, а не при 20–300С или 90–950С? С какой целью раствор, насыщенный при определенной температуре, нагревают почти до кипения и лишь потом фильтруют? Как величина кристаллов влияет на чистоту препарата? Для чего проводят вторичную перекристаллизацию?
4.Диаграмма состояния вещества в координатах p–T. Суть метода возгонки. Условия осуществления интенсивной возгонки.
5.Какую воду называют дистиллированной и как ее получают? Что называется бидистиллятом? Как отличить дистиллированную воду от водопроводной?
99
6. Очистка воды с помощью ионитов? Как очистить жидкость от: а) твердого вещества нерастворимого в ней? б) растворенных твердых веществ?
7. Изложить суть методов очистки газов. (На чем они основаны?)
100

ПРИЛОЖЕНИЕ 1
НАЗВАНИЯ, УСЛОВНЫЕ ОБОЗНАЧЕНИЯ И ЕДИНИЦЫ ИЗМЕРЕНИЯ ФИЗИЧЕСКИХ ВЕЛИЧИН В СИ
|
|
|
Условные |
Произношен |
Единицы |
|
Название |
обозначени |
ие |
||
|
измерения |
||||
|
|
|
я |
обозначения |
|
|
|
|
|
||
|
Время |
|
тау |
с |
|
|
|
|
|
|
|
|
Выход продукта (массовая доля вы- |
|
эта |
– |
|
|
хода) |
|
|
|
|
|
Давление |
р |
пэ |
Па |
|
|
|
|
|
|
|
|
Заряд ядра атома |
Z |
зет |
– |
|
|
|
|
|
|
|
|
Изменение энтальпии |
H |
дельта аш |
Дж, кДж |
|
|
|
|
|
|
|
|
Количество вещества |
n |
эн |
моль |
|
|
|
|
|
|
|
|
Коэффициент активности |
|
гамма |
– |
|
|
|
|
|
|
|
|
Масса |
m |
эм |
кг, г, т |
|
|
|
|
|
|
|
|
Массовая доля |
|
омега |
– |
|
|
|
|
|
|
|
|
Молярная доля |
|
хи |
– |
|
|
|
|
|
|
|
|
Молярная концентрация |
С |
цэ |
моль/л |
|
|
|
|
|
|
|
|
Мольная масса |
M |
эм |
г/моль |
|
|
|
|
|
|
|
|
Мольный объем газа |
Vm |
вэ эм |
л/моль |
|
|
|
|
|
|
|
|
Объем |
V |
вэ |
мл, л, м3 |
|
|
|
|
|
|
|
|
Объемная доля |
|
фи |
– |
|
|
|
|
|
|
|
|
Орбитальный радиус атома |
r |
эр |
нм |
|
|
|
|
|
|
|
|
Относительная атомная масса |
Ar |
а эр |
– |
|
|
|
|
|
|
|
|
Относительная молекулярная масса |
Mr |
эм эр |
– |
|
|
Относительная плотность по |
D(Н2) |
дэ аш два |
– |
|
|
водороду |
|
|
|
|
|
Относительная плотность по воздуху |
Dв |
дэ вэ |
– |
|
|
Плотность |
|
ро |
г/мл |
|
|
|
|
|
|
|
|
Потениал ионизации атома |
I |
и |
эВ |
|
|
|
|
|
|
|
|
Скорость реакции |
|
вэ |
моль/(л∙с) 1 |
|
|
|
|
|
|
|
|
Степень диссоциации |
|
альфа |
– |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 Единица измерения скорости гетерогенных процессов – моль/(м2∙с).
101

Температура по шкале Кельвина |
T |
тэ |
|
К |
|
|
|
|
|
Температура по шкале Цельсия |
t |
тэ |
|
0С |
|
|
|
|
|
Число Авогадро |
Na |
эн а |
|
моль–1 |
|
|
|
|
|
Эффективный заряд атома в соедине- |
|
дельта |
|
– |
нии |
|
|
|
|
|
|
|
ПРИЛОЖЕНИЕ 2 |
|
ПРИБЛИЖЕННЫЕ ЗНАЧЕНИЯ СРЕДНИХ КОЭФФИЦИЕНТОВ АКТИВНОСТИ В ЗАВИСИМОСТИ ОТ ИОННОЙ СИЛЫ РАСТВОРА ( )
И ЗАРЯДА ИОНА (Z)
Z |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
0,05 |
0,1 |
0,2 |
|
|
|
|
|
|
|
|
|
1 |
0,97 |
0,95 |
0,93 |
0,90 |
0,87 |
0,81 |
0,76 |
0,70 |
|
|
|
|
|
|
|
|
|
2 |
0,87 |
0,82 |
0,74 |
0,66 |
0,57 |
0,44 |
0,33 |
0,24 |
|
|
|
|
|
|
|
|
|
3 |
0,73, |
0,64 |
0,51 |
0,39 |
0,28 |
0,15 |
0,08 |
0,04 |
|
|
|
|
|
|
|
|
|
4 |
0,56 |
0,45 |
0,30 |
0,19 |
0,10 |
0,04 |
0,01 |
0,003 |
|
|
|
|
|
|
|
|
|
|
|
ПРИЛОЖЕНИЕ 3 |
|
ЗНАЧЕНИЯ K d ЭЛЕКТРОЛИТОВ (t=250C) |
|||
|
|
|
|
Название и формула |
|
|
|
кислоты |
K d |
рK d |
|
или основания |
|
|
|
Иодоводородная HI |
1,0 . 10 11 |
–11,0 |
|
Азотная HNO3 |
43,6 |
–1,64 |
|
Фтороводородная (плавико- |
|
|
|
вая) Н2F2 |
6,6 .10 –4 |
3,18 |
|
Уксусная СН3СООН |
1,76 .10 –5 |
4,75 |
|
Циановодородная |
|
|
|
(синильная) НСN |
7,9 . 10 –10 |
9,10 |
|
|
|
|
|
102
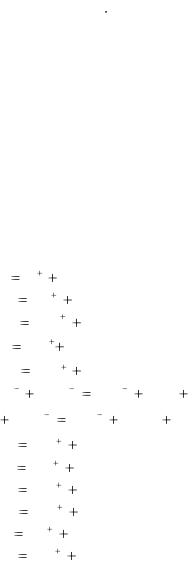
Серная H2SO4 |
|
|
|
|
|
1,0 . 10 3 |
|
|
||
I ступень |
|
|
|
|
|
|
–3,00 |
|
||
II ступень |
|
|
|
|
|
|
|
1,2 . 10 –2 |
1,90 |
|
Сернистая H2SO3 |
|
|
|
|
|
1,6 . 10 –2 |
|
|
||
I ступень |
|
|
|
|
|
|
|
1,8 |
|
|
II ступень |
|
|
|
|
|
|
|
6,3 . 10 –8 |
7,2 |
|
Угольная Н2СО3 |
|
|
|
|
|
4,4 . 10 –7 |
|
|
||
I ступень |
|
|
|
|
|
|
|
6,36 |
|
|
II ступень |
|
|
|
|
|
|
|
4,7 . 10 –11 |
10,33 |
|
Сероводородная H2S |
|
|
|
|
|
6,0 . 10 –8 |
|
|
||
I ступень |
|
|
|
|
|
|
|
7,2 |
|
|
II ступень |
|
|
|
|
|
|
|
1,3 . 10 –13 |
12,89 |
|
Ортофосфорная Н3РО4 |
|
|
|
|
7,5 . 10 –3 |
|
|
|||
I ступень |
|
|
|
|
|
|
|
2,12 |
|
|
II ступень |
|
|
|
|
|
|
|
6,3 . 10 –8 |
7,20 |
|
III ступень |
|
|
|
|
|
|
|
1,3 . 10 –12 |
11,89 |
|
Гидрат аммиака NH3 H2 O |
|
|
|
|
1,8 . 10 –5 |
4,75 |
|
|||
Гидроксид кальция Ca(OH)2 |
|
|
4,3 . 10 –2 |
1,37 |
|
|||||
II ступень |
|
|
|
|
|
|
|
|
||
Гидроксид бария Вa(OH)2 |
|
|
|
2,3 . 10 –1 |
0,64 |
|
||||
II ступень |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
ПРИЛОЖЕНИЕ 4 |
|
ЗНАЧЕНИЯ СТАНДАРТНЫХ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ |
||||||||||
|
|
|
||||||||
Полуреакции окисления |
|
E0 , В |
|
|||||||
Li0 |
Li |
e |
|
|
|
|
|
|
–3,04 |
|
Na0 |
Na |
e |
|
|
|
|
|
|
–2,71 |
|
Mg0 |
Mg2 |
2e |
|
|
|
|
|
|
–2,36 |
|
Al 0 |
Al 3 |
3e |
|
|
|
|
|
|
–1,66 |
|
Mn0 |
Mn2 |
2e |
|
|
|
|
|
|
–1,18 |
|
SO2 |
2OH SO2 |
|
H |
O |
2e |
|
–0,98 |
|
||
3 |
|
|
4 |
|
2 |
|
|
|
|
|
S 6OH |
SO2 |
3H |
2 |
O |
|
4e |
|
–0,90 |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
Zn0 |
Zn2 |
2e |
|
|
|
|
|
|
–0,76 |
|
Fe0 |
Fe2 |
2e |
|
|
|
|
|
|
–0,44 |
|
Cd0 |
Cd2 |
2e |
|
|
|
|
|
|
–0,40 |
|
Co0 |
Co2 |
2e |
|
|
|
|
|
|
–0,28 |
|
Ni0 |
Ni2 |
2e |
|
|
|
|
|
|
–0,25 |
|
Sn0 |
Sn2 |
2e |
|
|
|
|
|
|
–0,14 |
|
|
|
|
|
|
|
|
103 |
|
|
|
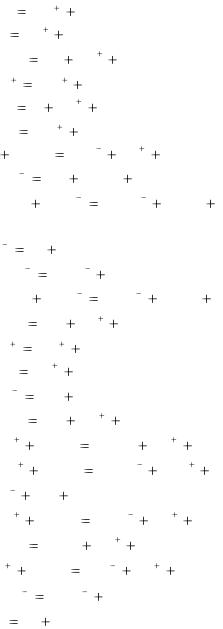
Pb0 |
|
Pb2 |
|
|
2e |
|
|
|
|
|
–0,13 |
|
H20 |
2H |
|
|
2e |
|
|
|
|
|
0,00 |
||
2NH3 |
|
N2 |
|
|
6H |
|
6e |
|
|
|
0,06 |
|
|
|
|
|
|
|
|
|
|
|
|
||
Sn2 |
|
Sn4 |
|
|
2e |
|
|
|
|
0,15 |
||
H2S |
|
S |
2H |
|
2e |
|
|
|
|
0,17 |
||
Cu0 |
|
Cu2 |
|
|
2e |
|
|
|
|
0,34 |
||
S 4H2 O SO24 |
|
8H |
6e |
|
0,36 |
|||||||
4OH |
|
O2 |
|
2H2 O |
4e |
|
|
0,40 |
||||
MnO2 |
4OH |
|
MnO24 |
2H2 O |
2e |
0,51 |
||||||
|
|
|
|
|
|
|
|
|
|
|||
2I |
|
I2 |
2e |
|
|
|
|
|
0,54 |
|||
MnO24 |
MnO4 |
e |
|
|
|
|
0,56 |
|||||
MnO2 |
4OH |
|
MnO4 |
2H2 O |
2e |
0,60 |
||||||
H2 O2 |
|
O2 |
|
|
2H |
|
2e |
|
|
|
0,68 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe2 |
|
Fe3 |
|
|
e |
|
|
|
|
|
0,77 |
|
Ag0 |
|
Ag |
|
|
|
e |
|
|
|
|
|
0,80 |
2Br |
|
Br2 |
|
|
2e |
|
|
|
|
|
1,07 |
|
2H2 O |
O2 |
|
|
4H |
4e |
|
|
|
1,23 |
|||
Mn2 |
|
2H2 O |
MnO2 |
4H |
2e |
|
1,23 |
|||||
2Cr3 |
|
7H |
2 |
O |
Cr O2 |
14H |
6e |
1,34 |
||||
|
|
|
|
|
|
2 |
7 |
|
|
|
|
|
2Cl |
|
Cl2 |
|
|
2e |
|
|
|
|
|
1,36 |
|
Mn2 |
|
4H2 O |
MnO4 |
8H |
5e |
|
1,52 |
|||||
2H2 O |
H2 O2 |
2H |
2e |
|
|
1,78 |
||||||
|
|
|
|
|
|
|
|
|
||||
Bi3 |
|
3H2 O |
|
BiO 3 |
6H |
2e |
|
1,80 |
||||
2SO24 |
S2 O28 |
2e |
|
|
|
2,01 |
||||||
2F |
F2 |
2e |
|
|
|
|
|
|
2,87 |
|||
104
