
- •ВВЕДЕНИЕ
- •НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •Вводная часть
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •ПРАВИЛА ОФОРМЛЕНИЯ ОТЧЕТА ПО ЛАБОРАТОРНЫМ РАБОТАМ
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •ЭКВИВАЛЕНТ
- •Вопросы к семинару
- •СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
- •ЛАБОРАТОРНАЯ РАБОТА «Приготовление растворов»
- •Вопросы к семинару
- •ТЕРМОХИМИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Определение тепловых эффектов»
- •Вопросы к семинару
- •ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •ЛАБОРАТОРНАЯ РАБОТА «Равновесие»
- •Вопросы к семинару
- •СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ЛАБОРАТОРНАЯ РАБОТА «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •РАСТВОРИМОСТЬ ЭЛЕКТРОЛИТОВ
- •ЛАБОРАТОРНАЯ РАБОТА «Растворимость и ПР»
- •Вопросы к семинару
- •ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •ГИДРОЛИЗ СОЛЕЙ
- •ЛАБОРАТОРНАЯ РАБОТА «Гидролиз солей»
- •Вопросы к семинару
- •КОЛЛОИДНЫЕ РАСТВОРЫ
- •ЛАБОРАТОРНАЯ РАБОТА «Коллоидные растворы»
- •Вопросы к семинару
- •РЕДОКС-ПРОЦЕССЫ
- •ЛАБОРАТОРНАЯ РАБОТА «ОВР»
- •Вопросы к семинару
- •ЭЛЕКТРОХИМИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Электрохимия»
- •Вопросы к семинару
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Получение и свойства КС»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •ЛАБОРАТОРНАЯ РАБОТА «Очистка веществ»
- •Вопросы к семинару
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ОГЛАВЛЕНИЕ

Вопросы к семинару
1.Какие процессы происходят при растворении соли в воде? Что называется растворимостью вещества?
2.Как зависит растворимость соединений от температуры? Почему?
3.Классификация солей по величине растворимости. ПР.
4.Влияет ли на ПР температура, состав раствора, степень дисперсности, структура или количество осадка, находящегося в равновесии с раствором? а на растворимость осадка? Солевой эффект.
5.Какие расчеты можно проводить, исходя из ПР?
6.Составить каждому студенту задачу по теме «ПР» и привести ее ре-
шение.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Степень диссоциации электролитов (обозначается ), т.е. распад их при растворении на ионы, определяется отношением:
количество диссоцииро ванных молекул . общее количество молекул
И если электролит диссоциирован в растворе лишь частично ( 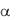 1), то он относится к слабым. А поскольку электропроводность растворов обеспечивают свободные гидратированные ионы, то, очевидно, высокую проводимость имеют достаточно концентрированные растворы именно тех веществ, которые полностью диссоциированы на ионы, т.е. относятся к сильным электролитам. Для них
1), то он относится к слабым. А поскольку электропроводность растворов обеспечивают свободные гидратированные ионы, то, очевидно, высокую проводимость имеют достаточно концентрированные растворы именно тех веществ, которые полностью диссоциированы на ионы, т.е. относятся к сильным электролитам. Для них 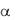 1 – это имеет место, например, в 0,1М НСl. Однако значение проводимости этого раствора указывает на то, что лишь 80% ионов реально обеспечивают проводимость, а 20% находятся в неактивном состоянии, что объясняется ассоциацией частиц, в частности, образованием ионных пар:
1 – это имеет место, например, в 0,1М НСl. Однако значение проводимости этого раствора указывает на то, что лишь 80% ионов реально обеспечивают проводимость, а 20% находятся в неактивном состоянии, что объясняется ассоциацией частиц, в частности, образованием ионных пар:
H Cl [8].
[8].
При повышении концентрации раствора (до определенного 1 предела) доля ассоциатов будет расти и, значит, активность растворенного вещества
( a |
C ) падать, ибо увеличивается ионная сила ( |
) раствора. |
||
|
Значение |
рассчитывается по формуле: |
1 / 2 CiZi2 , где Z i – заряды |
|
ионов. Например, в случае 0,1М НCl и 0,1н H2SO4: |
|
|||
|
(HCl) 1 / 2 (0,1 12 0,1 |
12 ) 0,10 , |
|
|
|
(H2SO4 ) |
1 / 2 (0,1 12 |
0,05 22 ) 0,15. |
|
По значениям , используя справочную таблицу (приложение 2), находим значения коэффициентов активности ( ) для H : 0,76 и 0,73 соответственно. И, следовательно, активности H
: 0,76 и 0,73 соответственно. И, следовательно, активности H в данных растворах: 7,6
в данных растворах: 7,6  10 2 и
10 2 и
1 Выше этой концентрации по мере ее роста увеличиваются значения коэффициентов активности ионов из-за снижения степени их гидратации и становятся даже больше 1.
57

7,3  10 2 моль/л. Из их сравнения видно, что серная кислота должна хуже проводить ток, чем хлороводородная.
10 2 моль/л. Из их сравнения видно, что серная кислота должна хуже проводить ток, чем хлороводородная.
Рассмотрим как влияет повышение ионной силы раствора на диссоциа-
цию сильных |
кислот. Если |
к 1 л |
0,1н H2SO4 (его |
рН= –lg[H+]= – |
lg 7,3 10 2 =1,14) добавить 0,1 моль NaCl, то хотя при этом |
увеличивается с |
|||
0,15 до 0,25 ( |
1 / 2 (0,1 . 12 |
+ 0,05 . 22 |
+ 0,1 . 12 + 0,1 . 12)), а поэтому (H ) |
|
снижается (до 0,67), но рН изменится мало (до 1,18), т.е. раствор останется почти таким же кислым, как и исходный.
Практически тот же результат получается и при добавлении соли, содержащей анион, одноименный с кислотным остатком, например, Na2SO4 .
Однако если добавить к серной кислоте такое же количество соли, образованной слабой кислотой (например, KCN), то ионы водорода свяжутся в молекулы слабой кислоты HCN. И тогда именно диссоциация последней станет определять [H ] в растворе; рассчитаем эту концентрацию. Состав раствора слабых электролитов строго характеризуется термодинамической константой равновесия диссоциации [8]. Мы же для расчета [H ] возьмем концентрационную константу. Так, для диссоциации синильной кислоты: HCN H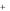 CN
CN , она будет иметь вид:
, она будет иметь вид:
К d [H ]  [CN ] . [HCN]
[CN ] . [HCN]
Обозначим [H ] за Х моль/л, тогда и [CN ] X моль/л, т.к. при диссоциации HCN эти ионы образуются в одинаковых количествах (если пренебречь ионами H , образующимися при диссоциации воды). Очевидно, концентрация молекул кислоты, например, в 0,1М растворе, будет равна:
, образующимися при диссоциации воды). Очевидно, концентрация молекул кислоты, например, в 0,1М растворе, будет равна:
[HCN] (0,1 X) моль/л.
Подставляя эти обозначения в выражение K d (значение K d берем из справочника), получим: 7,2  10 10 X
10 10 X  X /(0,1 X) X2 / 0,1 1, откуда:
X /(0,1 X) X2 / 0,1 1, откуда:
X 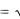
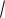 72
72  10 12 8,5
10 12 8,5  10 6 (моль/л).
10 6 (моль/л).
Эта концентрация водорода почти в 10 тыс. раз меньше, чем в случае сильных кислот той же концентрации, т.е. значение рН 2 ( lg 8,5  10 6 5,07 ) гораздо ближе к рН нейтрального раствора (равного 7).
10 6 5,07 ) гораздо ближе к рН нейтрального раствора (равного 7).
При добавлении соли, содержащей анион одноименный с анионом слабой кислоты, равновесие диссоциации этой кислоты сместится влево (по принципу Ле Шателье), и значение pH раствора еще более приблизится к 7 3.
Можно так же значительно уменьшить щелочность раствора, добавляя к нему соль слабого основания, например, NH4Cl. На подобной нейтрализую-
1В данной задаче величина Х по сравнению с 0,1 незначительна, поэтому ею (как слагаемым) можно пренебречь. Если же после решения задачи окажется, что значение Х сопоставимо с величинами других слагаемых, то решают задачу без упрощения формул.
2Напоминаем: отрицательный логарифм концентрации ионов водорода в растворе называется водородным показателем и обозначается pH .
3Расчет pH для подобного случая рассмотрен в разделе «Методика решения задач» (см. ниже).
58
