
Література
Боєчко Ф.Ф. Біологічна хімія. -К.: «Вища школа», 1995.- С. 169-207.
О.В.Стеценко, Виноградова Г.П. Біоорганічна хімія.-К.: «Вища щкола»,1992.
Додатки
Розбавлений розчин слини. Споліскують рот водою для видалання залишків їжі. Набирають в рот приблизно 20 -25 мл води і, продержавши її кілька хвилин, виливають розчин в пробірку.
Реактив Люголя (розчин йоду в йодиді калію). Розчиняють 1 г. йоду і 2,5 г йодиду калію в 20 мл води. Доводять водою об᾿єм розчину до 100 мл.
Екстрат сахарази. Старанно розтирають в ступці 20 г сухих дріжджів, поступово добавляють 100 мл води. Суміш переносять в колбу і струшують її в шутель апараті протягом 1 -2 год, після чого фільтрують. Фільтрат використовують як розчин сахарози.
Реактив Фелінга. Складається з розчинів А і Б. Розчин А: 3,5 г CuSO4 ·H2О розчиняють в 50 мл води. Розчин Б: 17,3 г сегнетової солі і 6 г гідроксиду натрію розчиняють в 50 мл води. Розчини А і Б перемішують в рівних об᾿ємах.
Методична розробка теми: «Кількісне визначення активності ферментів»
Мета: Вивчення кінетики ферментативних реакцій, умов оптимальної дії ферментів, впливу активаторів і інгібіторів на ферментативну активність, регуляцію активності ферментів в організмі людини.
Активність ферментів часто змінюється під дією різних хімічних сполук, що знаходяться в середовищі.
Речовини, які підвищують активність ферментів, називаються активаторами, а ті, що знижують їх активність, - інгібіторами.
Активаторами є різні сполуки – мінеральні солі і кислоти, органічні речовини, ферменти, іони металів і т.д.
Інгібітори викликають гальмування ферментативних процесів. Гальмування може бути оборотним і необоротним. При оборотньому гальмуванні інгібітор утворює з ферментом слабкий комплекс, який має здатність розпадатися, в результаті чого фермент вивільняється і набуває знов каталітичну активність. Необоротне гальмування характеризується тим, що інгібітор міцно зв᾿язується з ферментом, а комплекс, який утворився за цих умов, не розкладається. Отже, відбувається поступове зв᾿язування ферменту і вилучення його із середовища.
Рівняння Міхаеліса — Ме́нтен—рівняння ферментативної кінетики, яке описує залежність швидкості реакції, яка каталізується ферментом, від концентрації субстрата і фермента. Найпростіша кінетична схема, для якої справедливо рівняння Міхаеліса:
![]()
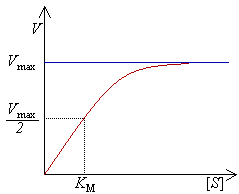
Рівняння має вид: Диаграмvа скорости реакции V как функции от концентрации [S].
 ,
де
,
де
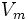 —
максимальнашвидкістьреакціі, рівна
—
максимальнашвидкістьреакціі, рівна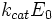 ;
; —
константа Міхаеліса,
рівна концентраціісубстрата, приякій швидкість
реакцііскладаєполовинувід максимальної;
—
константа Міхаеліса,
рівна концентраціісубстрата, приякій швидкість
реакцііскладаєполовинувід максимальної;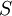 —
концентрація субстрата.
—
концентрація субстрата.
Одиниці ферментативної активності. Кількості ферментів зазвичай виражаються або в одиницях кількості речовини (молях) або в одиницях їх активності. Ферментативна активність дорівнює кількості молей субстрату, що перероблюються ферментом в одиницю часу. Ферментативна активність є мірою кількості активного ферменту, присутнього в системі, і залежить від умов проведення реакції, які повинні окремо вказуватися в кожному випадку. Одиницею системи СІ є катал, 1 катал = 1 моль с-1, проте це дуже велика одиниця. Більш практичною позасистемною одиницею, що і використовується в більшості випадків, є «ферментативна одиниця» або «міжнародна ферментативна одиниця», що позначається літерою U, 1 U = 1 μмоль хв-1 (μ = мікро, x 10-6). 1 U дорівнює 16,67 нанокатал. Також звичайною пов'язаною величиною є питома ферментативна активність. Вона вимірюється як активність ферменту на одиницю маси (зазвичай міліграм) повної маси білків та виражається в μмоль хв-1мг-1. Питома ферментативна активність є мірою чистоти ферменту.
Регуляція ферментативних процесів. Дія Ф. у організмі здійснюється шляхом регуляції їх синтезу і активності. Властивий даному організму набір Ф. визначається його генетичною природою. Проте він може змінюватися під впливом різних внутрішніх і зовнішніх чинників – мутацій, дії іонізуючої радіації, складу газового середовища, умов живлення і т.д. Так, в результаті мутацій виникають т.з. «молекулярні хвороби» (наприклад, алкаптонурія). При цьому спадковому захворюванні у хворих з сечею виділяється гомогентізіновая кислота, що утворюється в результаті перетворень амінокислоти Тирозину. Гомогентізіновая кислота накопичується в організмі і виділяється з сечею унаслідок того, що у хворих алкаптонурією загублена здібність до синтезу два Ф., що каталізують її подальше окислення, – параоксифенілпіруватоксидази і оксидаза гомогентізінової кислоти. Вплив умов живлення організму на його ферментний апарат особливо наочно просліджується у мікроорганізмів. Наприклад, кишкова паличка при зростанні на живильному середовищі, що містить глюкозу, синтезує лише сліди b-галактозідази. У присутності ж різних b-галактозідів утворюються значні кількості цього Ф. – до 6–7% від всіх білків, що містяться в клітці. Ф., новоутворення або посилення синтезу яких відбувається під впливом якого-небудь з'єднання, називаються індукованими ферментами. Під впливом ін. з'єднань може відбуватися придушення синтезу Ф., зване репресією. У тваринному організмі індукція і репресія синтезу Ф. здійснюється не лише під впливом відповідних субстратів і метаболітов, але і під впливом гормонів. Так, синтез глюкозо-6-фосфатазы, що бере участь в синтезі глюкози в печінці, індукується гормонами тіроксином і кортизоном, але репресується інсуліном. Загальна теорія індукції і репресії біосинтезу на генетичному рівні дана французькими вченими Ф. Жакобом і Ж. Моно (див. Оперон ). У одному організмі один і той же Ф. може бути представлений різними молекулярними формами. Такі всілякі форми Ф., що каталізують одну і ту ж реакцію, але що розрізняються по фізичних, хімічних і імунологічних властивостях, називаються ізоферментами. Синтез ізоферментів визначається генетичними чинниками, але може змінюватися під впливом умов існування організму. Т. о., чинники, від яких залежать концентрація і активність Ф. у організмі, так само всілякі, як і умови його існування. Це перш за все водний, газовий, температурний, кислотний і світловий режим середовища, а також концентрація субстратів і різних кофакторів, необхідних для дії Ф., наявність активаторів і інгібіторів, концентрації метаболітов і, нарешті, у вищих багатоклітинних організмів це нервова і гормональна регуляція ферментативної активності. Прикладом впливу умов існування організму на активність Ф. може служити Пастера ефект – припинення бродіння під дією кисню. Активність багатьох Ф. регулюється за аллостерічеському принципом. В таких Ф. є т.з. аллостерічеський центр, приєднуючись до якого певний метаболіт – еффектор викликає зміну структури активного центру, унаслідок чого активність Ф. знижується або підвищується. Деякі Ф. знаходяться в клітці у вигляді багатоферментних комплексів. У таких багатоферментних ансамблях активність кожного окремого Ф. строго координована і регулюється ін. Ф., що входять до складу даного комплексу. Прикладом багатоферментного комплексу може служити піруватдегидрогеназа, що складається з 16 молекул піруватдекарбоксилази, 8 молекул дігидроліпоїлдегидрогенази і 4 агрегатів ліпоатацетілтрансферази, кожна з яких складається з 16 субодиниць. Вирішальну роль в регуляції активності Ф. у клітці грають різні субклітинні структури – мітохондрії, мікросоми, лізосоми і т.д., і белковоліпідниє мембрани, що відокремлюють їх від цитоплазми. Багато Ф. вмонтовані в цих мембранах у вигляді багатоферментних ансамблів.
Лабораторна робота
«Кількісне визначення амілазної активності слини і впливу на неї активаторів і інгібіторів.»
Мета: Вивчення кінетики ферментативних реакцій, умов оптимальної дії ферментів, впливу активаторів і інгібіторів на ферментативну активність, регуляцію активності ферментів в організмі людини.
Кінетика ферментативної реакції. Крива насичення хімічної реакції (рівняння Міхаеліса-Ментен), що ілюструє співвідношення між концентрацією субстрата [S] і швидкістю реакції V. Найпростішим і найпоширенішим описом кінетики односубстратних ферментатівних реакцій є рівняння Міхаеліса-Ментен.
На сьогоднішній момент описано і кілька складніших типів кінетики ферментів. Наприклад, якщо реакція вимагає кількох молекул субстрата або різних субстратів, часто реакція протікає через утворення третинного комплексу. Для дії багатьох ферментів також типове утвореня перехідних комплексів (станів), що описується «механізмом пінг-понг».
Виконати лабораторні досліди.
Ємельяненко С.М., Каданер Л.І., Комарова О.А. Хімія і біологічна хімія. К. «Вища школа», 1988. Досліди № 1. С. 107.
Кількісне визначення активності ферментів. Методи кількicнoгo визначення ферментів грунтуються на визначенні їхньої каталітичної дії. Як правило, активність ферментів визначають за зменшенням або збільшенням субстрату, на який діє фермент, в одиницю часу. Робота з ферментами проводиться в оптимальних для їхньої дії умовах (оптимальна концентрація субстрату, наявність коферментів, активаторів, оптимальні значения рН, температури). У досліджувані cyміші добавляють коферменти, активатори i стабілізатори, щоб запобігти денатурації ферментного білка.
Дослід 1. Кількісне визначення амілазної активності слини i вплив на неї активатора та інгібітора.
Амілаза міститься у слині, ceчi, сироватці кpoвi. Активність амілази слини залежить від характеру харчування, стану органів травления, змінюється при фізичному навантаженні.
Активатором амілази є іони С1ˉ , а інгібітором - іони Cu2+. Для кількісної оцінки впливу активатора та iнгібітора на активність амілази визначення ферменту проводять паралельно з визначенням хлориду натрію, сульфату міді i без добавляння цих речовин. Результати порівнюють між собою.
Обладнання. Штатив з пробірками, термостат, 4 бюретки по 50 мл, піпетки на 1 мл, циліндр на 10 мл, олівець по склу.
Реактиви і матеріали дослідження. Слина, 0,1 %-й розчин крохмалю, реактив Люголя, 0,04 %-й розчин хлориду натрію, 0,1 %-й розчин сульфату міді.
Таблиця 2. Визначення активності амілази
|
Номер |
Розбавлення |
Реакція з йодом |
Активність амілази А |
|
пробірки |
слини |
(забарвлення) |
(розрахунок) |
|
1 |
1:20 |
|
|
|
2 |
1:40 |
|
|
|
3 |
1 :80 |
|
|
|
4 |
1 : 160 |
|
|
|
5 |
1 :320 |
|
|
|
6 |
1 :640 |
|
|
|
7 |
1 : 1280 |
|
|
|
8 |
1 :2560 |
|
|
|
9 |
1 : 5120 |
|
|
|
10 |
1 : 10 240 |
|
|
Виконання досліду
1. Беруть три cepiї по 10 пpoбipoк i наливають у кожну пpoбipкy по 1 мл води.
Збирають у пpoбipкy слину i переносять 1 мл її до циліндра на 10 мл, добавляють 9 мл води i старанно перемішують вміст циліндра.
1 мл розведеної слини відмірюють у пробірку № 1 кожної cepii.
Bмicт пpoбipки № 1 кожної cepiї добре перемішують триразовим втягуванням піпеткою рідини з пpoбipки i послідовним випусканням її з пiпeтки. Після цього 1 мл слини з пpoбipки № 1 кожної cepiї переносять у пробірку № 2 відповідно.
Перемішують так само вміст пpoбipки № 2 i переносять 1 мл з пpoбipки № 2 у пpoбipкy № 3 (так роблять для Bcix трьох серій дослідних пpoбipoк). Дістають серію розчинів. Концентрація ферменту у кожній наступній пpoбipцi вдвоє менша, ніж у попередній. З пробірки № 10 кожної cepii 1 мл рідини виливають.
6. В 10 пpoipoк пepшої cepiї наливають по 1 мл води, другої cepiї — по 1 мл хлориду натрію, третьої cepiї — по 1 мл сульфату міді.
7. В yci пробірки трьох cepiї добавляють по 2 мл розчину крохмалю, перемішують вміст кожної пробірки. Добавляння треба починати з пробірки, яка містить найменшу концентрацію амілази. В ній розщеплення крохмалю на холоді відбувається дуже повільно i помилка при неодноразовому додаванні субстрату на результатах визначення практично не позначається.
Одночасно всі пpoбipки вміщують на 30 хв у термостат чи на водяну баню при температурі 37 °С.
Через 30 хв пробірки дістають з термостата, швидко охолоджують водою i в кожну добавляють по 1—2 краплі реактиву Люголя.
10. Відмічають найбільше розбавлення слини, при якому відбувається розщеплення крохмалю в кожній cepiї досліних пpoбipок.
Наприклад, якщо розщеплення кfрохмалю першої дослідної cepiї відбулося у пробірках №№ 1—5 (за характером забарвлення продуктів гідролізу крохмалю з йодом), активність амілази визначають, виходячи з розчину пробірки №5 (табл. 2).
Розрахунок. Амілазна активність А слини за даних умов (при темперaтypi 38°С протягом 30 хв):
ab
A= ——,
f
де а — об'єм розчину крохмалю у пpoбipцj № 5 (2 мл); b — розбавлення слини (320); f — об'ем нерозбавленої слини (1 мл), тобто
