
LR2-2
.1.pdfМіністерство освіти і науки України Одеська національна морська академія
Кафедра фізики і хімії
Лабораторна робота № 2-2
ВИЗНАЧЕННЯ ЗМІН ЕНТРОПІЇ В НЕОБОРОТНИХ ПРОЦЕСАХ ТЕПЛООБМІНУ
ВКАЗІВКИ ДО ЛАБОРАТОРНОГО ПРАКТИКУМУ
Склали: В.І. Михайленко, Ф.О.Птащенко
Посібник затверджено на засіданні кафедри, протокол № 4, від 16.02.2011
Одеса – 2011

1
Лабораторна робота № 2-2
ВИЗНАЧЕННЯ ЗМІН ЕНТРОПІЇ В НЕОБОРОТНИХ ПРОЦЕСАХ ТЕПЛООБМІНУ
1.Теоретична частина
1.1.Друге начало термодинаміки. Оборотні та необоротні процеси
Термодинаміка вивчає властивості термодинамічних систем*, розглядаючи перетворення енергії в них. Термодинаміка базується на двох основних законах (першому та другому началах термодинаміки). Перше начало термодинаміки** говорить про збереження і перетворення енергії в системі, але не визначає напрямку перебігу термодинамічних процесів. (Наприклад, перше начало термодинаміки не забороняє процес передачі тепла від холодного тіла до гарячого, хоча такий процес в природі не спостерігається). Друге начало термодинаміки (з яким тісно пов’язано поняття ентропії) говорить саме про напрямок перебігу процесів.
Друге начало термодинаміки має кілька еквівалентних формулювань. У цій лабораторній роботі буде наведено чотири формулювання, перші два з них такі:
1. Неможливий такий процес, єдиним результатом якого було б передавання теплоти від холодного тіла до гарячого (формулювання Клаузіуса).
У холодильній машині тепло від холодного тіла (морозильної камери) передається у більш нагріте навколишнє середовище. Але цей процес іде за рахунок зовнішнього джерела енергії.
2.Неможливо побудувати теплову машину, яка виконувала б роботу лише за рахунок охолодження деякого тіла (формулювання Кельвіна).
Така теплова машина була б еквівалентною вічному двигуну (це так званий вічний двигун другого роду). Якби така теплова машина виконала б роботу, наприклад, за
*) Термодинамічною системою називається сукупність макроскопічних фізичних тіл, які можуть обмінюватися енергією у формі виконання механічної роботи та передачі теплоти як між собою, так і з оточуючим середовищем.
Розрізняють відкриті термодинамічні системи, для яких немає ніяких обмежень в обміні енергією з оточуючим середовищем, та частково ізольовані системи:
а) механічно ізольовані, які не можуть обмінюватися енергією з навколишнім середовищем у формі виконання роботи; б) адіабатно ізольовані, які не можуть обмінюватися теплотою з оточуючим середовищем.
**) Перше начало термодинаміки формулюється так: Кількість теплоти dQ, яка була надана термодинамічній системі, витрачається на виконання системою роботи dA
проти зовнішніх сил та на зміну внутрішньої енергії системи dU: dQ dA dU
В термодинаміці кількість теплоти dQ – це енергія, якою обмінюються тіла при теплопередачі (передачі тепла від гарячого тіла до холодного); робота dA – це міра перетворення енергії хаотичного руху молекул у енергію направленого руху всього тіла (наприклад, при розширенні газу він виконує роботу, рухає поршень циліндру); внутрішня енергія dU – це сума кінетичної енергії усіх молекул системи та потенціальної енергії їхньої взаємодії (у ідеальному газі потенціальна енергія молекул дорівнює нулю, і, отже, внутрішня енергія дорівнює сумі тільки кінетичних енергій усіх молекул).
2
рахунок охолодження океану на 0,1K , то енергії, що вона виробила б, вистачило людству на 1500 років.
Друге начало термодинаміки тісно зв’язано з поняттям про оборотні та необоротні процеси. Наведемо визначення цих процесів.
Оборотними називаються процеси, які задовольняють двом таким умовам:
1.Процес може проходити як у прямому так і у зворотному напрямках.
2.Після проходження таких процесів і повернення у початковий стан у
навколишньому середовищі не повинно залишитися жодних змін. Прикладами оборотних процесів можуть бути адіабатний процес (який відбувається без обміну енергією з навколишнім середовищем), або ізотермічний процес (при якому внутрішня енергія системи не змінюється).
Необоротними називаються процеси, після перебігу яких система не може самочинно повернутися у початковий стан. Прикладом необоротного процесу є процес передавання тепла від гарячого тіла до холодного. Зворотний до цього процес не спостерігається.
Друге начало термодинаміки стверджує, що процес переходу впорядкованого руху тіла як цілого у невпорядкований тепловий рух його молекул є необоротним.
1.2.Статистичний зміст другого начала термодинаміки. Термодинамічна ймовірність
Краще зрозуміти зміст другого начала термодинаміки можна на основі статистичної фізики.
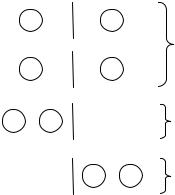
Стан термодинамічної системи (макростан) визначається сукупністю її термодинамічних параметрів (параметрів стану або макропараметрів). Параметри стану характеризують макроскопічні властивості системи – це об’єм, тиск, температура тощо. Мікростан системи визначається сукупністю усіх мікропараметрів системи – координат та швидкостей окремих молекул. Одному макростану системи може відповідати багато мікростанів. Наприклад, система в рівновазі весь час переходить із одного мікростану до іншого (молекули рухаються,
їхня швидкість змінюється), |
але при цьому макропараметри системи P , |
V , T (і, |
|||||||
отже, макростан) не змінюються. |
|
|
|
|
|||||
|
Розрахуємо, скільки мікростанів може відповідати певному макростану – ця |
||||||||
|
|
|
|
величина |
називається |
термодинамічною |
|||
1 |
1 |
2 |
|
||||||
І |
ймовірністю стану P. Для цього розглянемо |
||||||||
2 |
|
|
декілька найпростіших моделей термодинамічних |
||||||
|
|
||||||||
2 |
1 |
||||||||
|
систем. |
|
|
|
|
||||
|
|
|
|
Нехай термодинамічна система складається з |
|||||
|
|
|
|
||||||
3 |
|
|
|
двох молекул. Макростан системи буде |
|||||
1 2 |
|
ІІ |
|||||||
|
визначатися кількістю молекул у кожній половині |
||||||||
4 |
|
|
ІІІ |
посудини. Очевидно, що мікростани 1 і 2 (рис. 1) |
|||||
1 |
2 |
||||||||
еквівалентні і відповідають одному макростану І. |
|||||||||
|
|
|
|
Тобто |
макростан |
І |
реалізується |
двома |
|
|
|
|
|
||||||
|
Рис. 1 |
|
|
мікростанами, його |
термодинамічна ймовірність |
||||
|
|
|
PІ 2. Мікростанам |
3 і 4 відповідають |
два різні |
||||
|
|
|
|
||||||
макростани ІІ і ІІІ. Тобто термодинамічна ймовірність макростанів ІІ і ІІІ однакова і дорівнює PІІ PІІІ 1. Зазначимо, що ймовірність стану І з рівномірним розподілом
3
молекул по об’єму буде найбільшою.
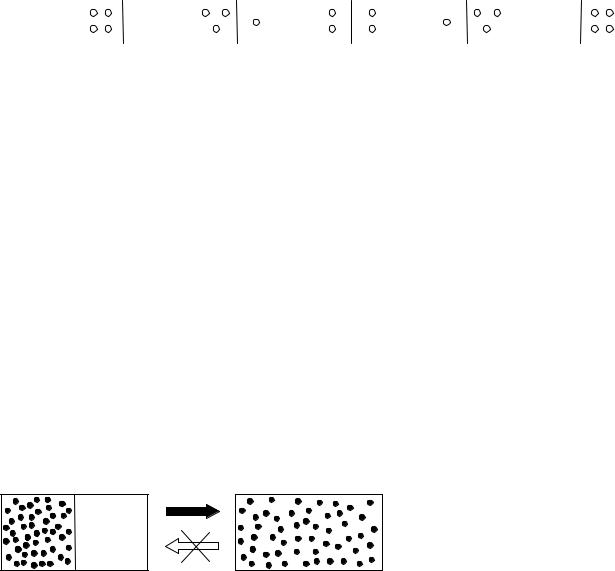
Розглянемо тепер систему, яка складається з чотирьох молекул. Знову знайдемо термодинамічну ймовірність різних макростанів (усього їх буде п’ять,
рис. 2).
І |
|
ІІ |
|
ІІІ |
|
ІV |
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PІ =1 |
PІI = 4 |
PІII = 6 |
PІV = 4 |
PV = 1 |
Рис. 2
Макростанам І і V, коли усі молекули знаходяться у одній половині посудини, відповідає по одному мікро стану, тобто їх термодинамічна ймовірність мінімальна і дорівнює одиниці. Макростанам ІІ і ІV (де в одній половині посудини буде одна молекула, а в іншій – три) відповідає чотири мікростани (кожна з чотирьох молекул може знаходитися окремо від інших). Можна легко показати, що макростану ІІІ, коли у обох половинах посудини буде по дві молекули, відповідає максимальна кількість мікростанів – шість. Тобто термодинамічна ймовірність макростану, у якому молекули розподілені рівномірно по об’єму буде максимальною. Всього
мікростанів у такій системі буде 1 4 6 4 1 16 24 . Якщо ж молекул буде N ,
то сумарна кількість мікростанів буде 2N . Можна показати, що коли макростан визначається не кількістю молекул у двох половинах посудини, а положенням
кожної молекули у об’ємі, термодинамічна ймовірність буде пропорційною до VN , тобто
|
|
P ~ VN . |
|
(1) |
Розглянемо тепер такий уявний експеримент: нехай спочатку газ із N молекул |
||||
|
|
|
знаходиться в стані І у одній |
|
|
|
|
половині |
посудини, |
|
|
|
відокремленій перегородкою від |
|
|
|
|
іншої. Цьому стану відповідає |
|
PІ =1 |
|
PІІ 2N |
термодинамічна |
ймовірність |
Рис. 3 |
PІ 1. Якщо перегородку убрати, то |
|||
|
|
через деякий час |
газ практично |
|
|
|
|
||
рівномірно розподілиться по всьому об’єму посудини, тобто перейде у стан ІІ з набагато більшою термодинамічною ймовірністю PІІ 2N. Можна зробити висновок, що у системі
відбувся такий процес, при якому термодинамічна ймовірність зросла. Зворотний процес (коли б усі молекули перейшли б у одну половину посудини) дуже мало ймовірний.
Розглянутий вище експеримент показує, що поведінка термодинамічної ймовірності тісно зв’язана з напрямком перебігу процесів. Про напрямок перебігу процесів говорить друге начало термодинаміки, отже його можна переформулювати, виходячи із поведінки термодинамічної ймовірності (це статистичне формулювання другого начала термодинаміки):
3. Усі процеси в ізольованій системі можуть протікати тільки у тих напрямках,
4
коли термодинамічна ймовірність зростає (не зменшується).
Наведемо тепер визначення оборотним і необоротним процесам, спираючись на поведінку термодинамічної ймовірності у цих процесах:
Оборотним називається процес, при якому термодинамічна ймовірність не змінюється.
При протіканні необоротного процесу термодинамічна ймовірність проміжних станів зростає. Процес, зворотний до необоротного дуже мало ймовірний.
1.3.Ентропія. Статистичне визначення ентропії
Термодинамічна ймовірність рівноважного стану системи, яка складається з багатьох молекул – це дуже велике число (наприклад, для одного моля речовини
P ~101023 ). Крім того, P термодинамічна ймовірність стану системи в цілому дорівнює не сумі, а добутку термодинамічних ймовірностей частин системи
P P1 P2 P3 (це виходить із теорії ймовірностей). Вищеназвані недоліки
роблять використання термодинамічної ймовірності незручним.
Для описання ймовірності стану системи Больцман запропонував увести іншу величину – ентропію, яка пропорційна до логарифма термодинамічної ймовірності:
|
S kБ ln P |
|
(2) |
де kБ 1,38 10 23 Дж/ К – стала Больцмана (ентропія вимірюється |
також у |
||
Дж/ К ). Визначена таким чином ентропія по-перше, не буде дуже великим
числом, а по-друге, ентропія системи в цілому буде дорівнювати сумі ентропій окремих частин системи (оскільки логарифм добутку дорівнює сумі логарифмів), тобто ентропія є адитивною величиною:
S n |
Si . |
(3) |
|
i 1 |
|
|
|
Зауважимо, що зміна ентропії також буде адитивною: |
|
||
S n |
Si . |
(4) |
|
i 1 |
|
|
|
Встановимо фізичний зміст поняття ентропії, визначеного Больцманом. Термодинамічна ймовірність стану системи тим більша, чим ближчий стан системи до рівноважного, коли усі молекули рівномірно (хаотично) розподілені по об’єму (їх розподіл за швидкостями в рівновазі також хаотичний). Тому і ентропія є мірою невпорядкованості, хаотичності системи.
Ентропія, як і термодинамічна ймовірність є параметром стану системи (тобто певному стану системи з певними об’ємом, температурою, тиском відповідає певна ентропія). Із виразу (2) видно, що коли термодинамічна ймовірність системи зростає – то зростає і ентропія (коли P не змінюється, то не змінюється і S ). Це дає змогу переформулювати друге начало термодинаміки, використовуючи поняття ентропії:
4.У замкнених системах можуть протікати лише такі процеси, при яких ентропія зростає (необоротні) або не змінюється (оборотні).
5
1.4.Термодинамічне визначення ентропії
Знайдемо зв'язок ентропії з термодинамічними параметрами системи. Для цього розглянемо зміну ентропії при оборотному (ізотермічному) процесі. Оскільки
P ~ VN (вираз (1)), то ентропія буде дорівнювати
S kБ ln P kБ lnV N C kБ N lnV C NAkБ lnV C RlnV C , |
(5) |
||||||
де R 8,31 Дж/(К моль) |
– |
універсальна |
газова стала, а C const . Тоді |
зміна |
|||
ентропії при розширенні газу буде |
|
|
|
|
|||
S S |
2 |
S RlnV RlnV Rln V2 . |
(6) |
||||
|
|
1 |
2 |
1 |
V1 |
|
|
|
|
|
|
|
|
|
|
Можна показати*, що при ізотермічному розширенні ідеальний газ отримує тепло
|
|
Q RT ln V2 . |
|
(7) |
|
|
|
|
V |
|
|
|
|
|
1 |
|
|
Тоді, порівнюючи вирази (6) і (7), знаходимо, що |
|
|
|||
|
|
|
|
|
|
|
S |
Q |
або dS dQ |
, |
(8) |
|
|
T |
T |
|
|
тобто зміна ентропії дорівнює відношенню тепла, наданого системі у оборотному процесі, до її температури. (Це співвідношення було отримано для окремого випадку ізотермічного розширення ідеального газу, але його можна довести для будь-якого оборотного процесу.)
Щоб проілюструвати справедливість другого начала термодинаміки у четвертому формулюванні, знайдемо зміну ентропії для оборотного процесу (адіабатного) та для необоротного (процесу теплообміну).
Для адіабатного процесу (який відбувається без обміну енергією з
навколишнім середовищем) Q 0 . Отже, |
S |
Q |
0 . Якщо розрахувати зміну |
|
|
T |
|
ентропії при циклічному ізотермічному процесі (розглянутому вище), то отримаємо, що за повний цикл зміна ентропії також дорівнює нулю. Узагальнюючі ці результати, можна зробити висновок, що при циклічних оборотних процесах ентропія не змінюється:
|
SОБОР 0 |
. |
(9) |
|
|
|
|
*) При ізотермічному (T const ) розширенні внутрішня енергія ідеального газу не змінюється. Усе надане системі тепло переходить у роботу, тобто dQ dA. Елементарна
робота в термодинаміці дорівнює dA PdV . Використовуючи рівняння стану ідеального
газу (Менделєєва-Клапейрона), |
PV RT , дістаємо P |
RT |
. Тоді dQ dA RT dV |
, |
||||
|
V |
|||||||
|
|
|
V2 |
|
|
V |
|
|
|
|
|
|
dV |
V |
|
|
|
а повна робота або отримане |
тепло буде Q A dA RT |
V |
2 |
, що |
||||
RT ln V |
||||||||
|
|
|
|
V |
|
1 |
|
|
|
|
|
|
1 |
|
|
|
|
співпадає із формулою (7).
6
В процесі теплообміну тепло передається від гарячого тіла до холодного, гаряче тіло віддає, а холодне отримує тепло dQ . При цьому, сумарна зміна ентропії
дорівнює сумі змін ентропій гарячого і холодного тіл: dS dSГАР dSХОЛ .
dSГАР |
dQ |
0 |
|
і |
dSХОЛ |
dQ |
0 . |
||||||
|
|
TХОЛ |
|||||||||||
|
TГАР |
|
|
|
|
|
|
|
|
||||
Оскільки ТГАР ТХОЛ , |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
dS dQ |
|
|
|
|
|
0 . |
(10) |
||||||
|
|
|
|
||||||||||
|
|
|
TХОЛ |
|
|
TГАР |
|
|
|
||||
Тобто при перебігу необоротних процесів ентропія зростає: |
|||||||||||||
|
|
|
|
. |
|
|
(11) |
||||||
|
|
|
SHEОБОР 0 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поєднуючи результати, отримані вище, знову підкреслимо, що у замкнених системах протікають лише процеси, при яких ентропія зростає (необоротні) або не змінюється (оборотні):
|
|
|
|
|
|
|
|
|
. |
|
|
(12) |
|
|
|
|
|
|
|
|
|
S 0 |
|
|
|||
|
Для того, щоб дістати ще одне термодинамічне визначення зміни ентропії |
||||||||||||
|
|
|
|
|
|
|
|
знову розглянемо систему, яка складається з |
|||||
|
|
|
|
|
|
|
|
гарячого та холодного тіл, рис.4. Нехай |
|||||
|
холодне T |
|
|
|
холодильник |
|
|||||||
|
|
|
|
|
замість просто процесу теплопередачі (рис. |
||||||||
|
тіло |
ХОЛ |
|
|
TХОЛ |
|
4а) відбувається перетворення енергії в |
||||||
|
|
|
|
|
|
dQ2 |
|||||||
|
|
|
|
|
|
ідеальній тепловій машині Карно (рис. 4б). |
|||||||
|
TГАР dS |
|
dA робоче |
Термодинаміка доводить, що коефіцієнт |
|||||||||
|
|
|
|
|
|
тіло |
корисної дії |
ідеальної |
теплової |
машини |
|||
|
dQ |
|
|
|
|
dQ |
(відношення |
виконаної |
роботи |
dA до |
|||
|
|
|
|
|
наданого тепла dQ ) залежить лише від |
||||||||
|
|
|
|
|
|
|
|
||||||
|
гаряче |
Т |
|
|
|
нагрівач T |
|
температур холодильника і нагрівача і |
|||||
|
тіло |
|
ГАР |
|
|
ГАР |
|
дорівнює |
dA 1 |
ТХОЛ . |
|
||
|
а) |
|
|
Рис. 4 |
б) |
|
|
|
(13) |
||||
|
|
|
|
|
|
|
|
|
dQ |
ТГАР |
|
||
Тобто робота, яку виконує ідеальна машина дорівнює |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(14) |
|
|
|
|
|
|
dA dQ 1 |
TХОЛ . |
|
|
||||
|
|
|
|
|
|
|
|
|
TГАР |
|
|
|
|
Помножимо вираз (10) для зміни ентропії системи на температуру холодильника:
|
1 |
|
1 |
|
|
|
|
|
dS TХОЛ dQ |
|
|
TХОЛ dQ 1 |
TХОЛ . |
(15) |
|||
|
|
|||||||
TХОЛ |
|
TГАР |
|
TГАР |
|
|||
Порівнюючи вирази (14) і (15), дістаємо висновок, що |
|
|
||||||
|
TХОЛ dS dA , |
|
(16) |
|||||
тобто зростання ентропії системи яка складається із гарячого і холодного тіл при теплопередачі (помножена на температуру холодного тіла) дорівнює роботі, яку
7
могла би виконати теплова машина, використовуючи холодне і гаряче тіла системи як холодильник і нагрівач. Отже, зростання ентропії системи тіл з різними температурами дорівнює втраті корисної механічної енергії, поділеній на температуру більш холодного тіла:
dS dWКОРИСНА |
. |
(17) |
T |
|
|
ХОЛ |
|
|
Іншими словами, коли замкнена система знаходиться у стані рівноваги
(температури та тиски всюди однакові) – ентропія максимальна. Така система не
може виконувати роботу (її частини не можуть бути нагрівачем та холодильником одної теплової машини). Якщо ж температури та тиски у різних частинах системи будуть різними, система не буде знаходиться у рівновазі, її ентропія буде низькою. При переході у стан рівноваги ентропія такої системи зросте, максимальна робота яку при цьому може виконати система пропорційна зміні ентропії і дається виразом
(16).
2.Експериментальна частина
2.1.Описання експериментальної установки та виведення розрахункової формули
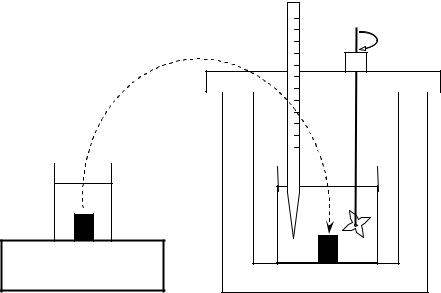
У даній роботі вивчається необоротний процес теплообміну між тілами, що |
|||||||
мають різні температури в адіабатно ізольованій термодинамічній системі. Стан |
|||||||
системи, в якому тіла мають різні температури, |
є нерівноважним. |
В такій системі |
|||||
здійснюється необоротний процес переносу теплоти від гарячого тіла до |
|||||||
холодного. Цей процес закінчується тоді, коли температури всіх тіл системи |
|||||||
зрівняються і настане стан термодинамічної рівноваги. |
В лабораторній |
роботі |
|||||
|
t0 |
|
|||||
|
адіабатно |
|
ізольованою |
||||
|
М |
системою |
є |
посудина |
з |
||
|
|
холодною |
|
|
водою |
||
|
|
(калориметричний стакан К, |
|||||
|
|
рис. 5), в яку поміщають |
|||||
|
|
нагріте |
|
тіло |
|
Т. |
|
|
O |
Калориметричний |
стакан |
||||
|
знаходиться |
|
|
|
в |
||
|
К |
|
|
|
|||
|
теплоізолюючій оболонці О, |
||||||
Т |
|
яка |
зменшує |
теплообмін |
|||
|
вимірювальної |
установки |
з |
||||
нагрівач |
Т |
навколишнім середовищем. В |
|||||
|
посудині |
|
з |
водою |
|||
|
|
знаходиться мішалка М, що |
|||||
|
Рис. 5 |
дозволяє швидше досягнути |
|||||
|
стану |
термодинамічної |
|||||
|
|
рівноваги та термометр t0, за |
|||||
допомогою якого вимірюють температуру системи. Тому в експерименті одночасно |
|||||||
нагріваються вода, посудина та мішалка, а остиває тіло Т. |
|
|
|
|
|
||
Наведемо параметри тіл, які входять до складу вимірювальної установки.
8
1)Калориметричний стакан К має масу mK , початковою температуру t0 і питому теплоємність* матеріалу cK .
2)Вода у калориметричному стакані має масу mB , питому теплоємність cB і
початкову температуру також t0 .
3)Мішалка М має масу mM , питому теплоємність cM і початкову температуру t0 .
4)Нагріте тіло Т має масу mH , питому теплоємність cH і початкову температуру
tH .
Таким чином, у запропонованому досліді відбуваються такі процеси: досліджуване тіло Т спочатку нагрівають до температури tH (на нагрівачу –
електроплитці) та опускають в калориметричний стакан з водою. В результаті теплообміну нагріте тіло віддає частину тепла холодним тілам (воді, стакану, мішалці). Після закінчення теплообміну система стає рівноважною з температурою t *, причому виконується наступне співвідношення: tH t* t0 .
Відповідно до закону збереження енергії, кількість теплоти, що віддає нагріте тіло cH mH (tH t*) , дорівнює кількості теплоти, яку отримують разом холодна вода,
cBmB (t * t0 ) , і холодний калориметричний стакан, cK mK (t * t0 ) . (Теплотою,
витраченою на нагрівання мішалки, нехтують). Таким чином, рівняння теплового балансу буде виглядати так:
|
|
cH mH (tH t*) cBmB (t * t0 ) cK mK (t * t0 ) . |
|
(18) |
||||||
При цьому зменшення ентропії нагрітого тіла буде дорівнювати |
|
|
||||||||
SТІЛА dS |
dQ |
T* c |
m dT |
|
T* dT |
|
T * |
|
||
T |
|
H TH |
cH mH T |
cH mH ln |
T |
0 , |
||||
|
|
|
|
T |
|
|
T |
|
H |
|
|
|
|
|
H |
|
|
H |
|
|
|
а збільшення ентропії води і калориметричного стакану відповідно |
|
|||||||||
S |
ВОДИ |
c m ln T * |
0 |
і |
S |
СТАКАНУ |
c m ln T * |
0 . |
||
|
В В |
T0 |
|
|
|
С С |
T0 |
|
||
|
|
|
|
|
|
|
|
|
||
Загальна зміна ентропії системи після теплообміну дорівнює сумі змін
ентропіїчастин системи:
|
S SТІЛА SВОДИ SСТАКАНУ |
|
|
|
||||||
або |
|
|
|
ln T * |
c m ln T * |
c m ln T * |
|
|
||
S c |
Н |
m |
Н |
, |
(19) |
|||||
|
|
TН |
В В |
T0 |
С С |
T0 |
|
|
||
|
|
|
|
|
|
|
|
|||
*) Питомою теплоємністю речовини с називають кількість теплоти, яку необхідно надати 1кг речовини, щоб її температура підвищилася на 1К . Іншими словами,
кількість теплоти dQ , необхідна для нагрівання тіла масою m з питомою теплоємністю c на температуру dT дорівнює
|
dQ cmdT . |
Якщо нагрівання (охолодження) відбувається від температури T1 до температури T2 , то |
|
тіло отримує (віддає) тепло |
Q cm(T2 T1 ) . |
9
де TH , T0 , T * – температури за шкалою Кельвіна, які відповідають температурам tH , t0 і t * за шкалою Цельсія (зв'язок між ними такий: T (K) t( C) 273).
2.2.Визначення рівноважного значення температури
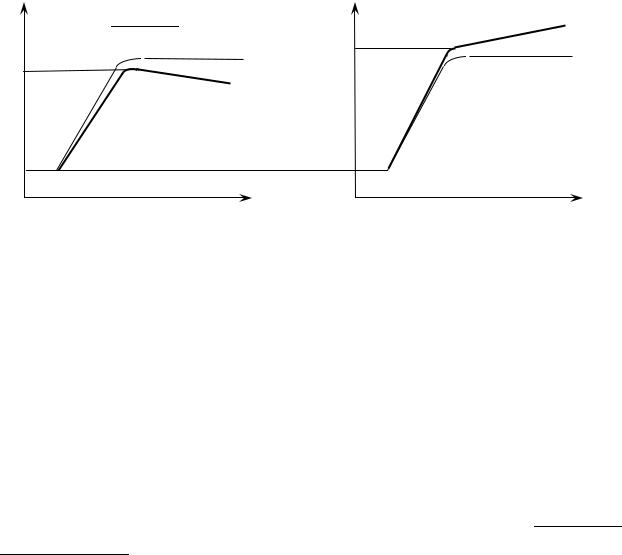
Якщо теплоізоляція є адіабатично ідеальною (тепло зовсім не виходить із системи), то після підйому температури в посудині до значення t *, температура системи буде зберігатися сталою в часі (див. рис.6 а, б пунктирні лінії ).
Якщо система неповністю адіабатна, то здійснюється теплообмін з навколишнім середовищем. У тому випадку, коли температура навколишнього середовища tCEP нижча, ніж рівноважна температура системи t * , температура
системи досягає максимального значення, а потім починає повільно спадати (суцільна крива, рис. 6а). А коли температура навколишнього середовища tCEP
вища, ніж рівноважна температура системи t *, то після досягнення рівноваги температура продовжує зростати, але значно повільніше (суцільна крива, рис. 6б).
Тому для |
визначення рівноважної |
температури |
системи t * будують графік |
||
t, C |
tCEP t * |
t, C |
|
tCEP t * |
|
t * |
|
t * |
|
|
|
|
|
|
|
|
|
t0 |
t0 |
|
|
, ceк |
, ceк |
а) |
б) |
|
Рис. 6 |
залежності температури від часу t f ( ) та фіксують на ньому t *, як максимальну температуру (при tCEP t * ) або температуру, що відповідає точці перегину
залежності t f ( ) (при tCEP t *).
2.3.Порядок проведення вимірювань та обробки даних
1.Вимірюють масу калориметричного стакану К та масу тіла Т. Потім це тіло
вміщують в технічний стакан з водою і за допомогою нагрівача (електричної плитки) воду доводять до кипіння ( tH 100 C ). Тіло витримують при цій
температурі 3–5 хв.
2. В калориметричний стакан наливають воду (приблизно 0,75 об`єму стакану).
Об`єм води V визначають мірним циліндром. Маса води дорівнює mB B V , де B 10 3 кг/ см3 – густина води.
3. Калориметричний стакан з водою розміщують в калориметрі з теплоізолюючою оболонкою. Вмикають мішалку М і через 2-3 хвилини визначають за допомогою термометра початкову температуру води в калориметрі t0 .
