- •Методическое пособие
- •Введение
- •Функциональная характеристика возбудимых тканей
- •Ультраструктура клеточной мембраны
- •Практические работы инструменты, приборы и аппараты, используемые для изучения физиологических функций
- •Тема 1. Биоэлектрические свойства возбудимых тканей. Вопросы для подготовки к занятию
- •Тема 2. Физиологические свойства возбудимых тканей Вопросы для подготовки к занятию
- •Определение хронаксии у лягушки
- •Определение хронаксии у кролика
- •Тема 3. Физиологические свойства мышц Вопросы для подготовки к занятию
- •Вопросы к экзамену
- •Список использованных терминов и сокращений
- •Бав - биологически активные вещества.
- •Список рекомендуемой литературы основная литература
- •Дополнительная литература
Функциональная характеристика возбудимых тканей
Отличительной особенностью ряда тканей является способность в ответ на раздражение переходить из покоя в состояние возбуждения, проявляющееся распространяющимися по ним импульсами. Такие ткани названы возбудимыми, а это свойство – возбудимостью.
Впервые связь электрической активности с возбуждением продемонстрирована в конце XVIII в. ученым Л. Гальвани. На поврежденный участок мышцы с помощью стеклянных крючков Гальвани помещал нерв так, чтобы одна его часть касалась поврежденного, а другая - целого участка мышцы. В момент накладывания нерва мышца сокращалась. На основании этого Гальвани предположил, что «животное электричество» имеется не только в специальных органах некоторых рыб (электрический сом, угорь, скат), но и в других тканях различных животных.
К.Маттеучи в своем опыте использовал два нервно-мышечных препарата. Нерв первого препарата соединялся с источником электрического тока, а нерв другого накладывался на мышцу первого. При раздражении нерва первого препарата электрическим током сокращались мышцы и второго препарата. На основании полученных результатов был сделаны выводы о том, что электрический ток, как от внешнего источника, так и возникающий во время возбуждения является раздражителем для тканей, а процесс возбуждения, происходящий при раздражения нервов и мышц, может распространяться на значительные расстояния от места возникновения.
В середине XIX в. Е. Дюбуа-Реймон с помощью гальванометра показал, что поврежденная область мышцы электроотрицательна по отношению к неповрежденной, а раздражение нерва сопровождается кратковременными уменьшением электрического тока.
В начале XX в. Ю. Бернштейн сформулировал мембранную теорию, согласно которой, клеточная мембрана поляризуется вследствие избирательной проницаемости для ионов. Бернштейн предположил, что мембрана клетки в покое проницаема только для К+, а при возбуждении она становится проницаема и для других ионов, что приводит к изменению потенциала. В середине XX в. рядом ученых (А. Ходжкиным, А. Хаксли и Б. Катцем) была развита мембранная теория Ю. Бернштейна на основе результатов регистрации потенциалов в одиночных живых клетках и сложившихся представлений о структуре клеточной мембраны.
Ультраструктура клеточной мембраны
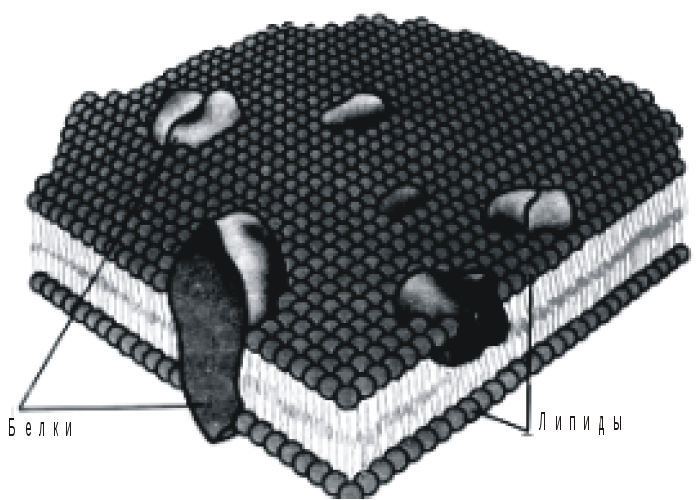
Клеточная мембрана (рис. 1) имеет трехслойную структуру.
|
|
Рис. 1. Мозаичная модель цитоплазматической мембраны (по Л.Бергельсону, 1975). |
Слои мембраны расположенные по краям преимущественно состоят из липидов и белков. Липиды на одном конце молекулы имеют полярные (гидрофильные) «головки» а другой их конец («хвост») является гидрофобным. «Головки» стремятся к контакту с водой, а хвостовые части отталкиваются от воды и притягиваются друг к другу. В результате образуются двухслойные липидные пленки, разделенные внутри неводной фазой и контактирующие снаружи с водой внутри- и внеклеточного пространств.
Белки расположены на поверхности (периферические) и внутри мембраны (интегральные).
Периферические белки выполняют регуляторно-сигнальную и структурно-каркасную (обеспечивают форму и подвижность клеточных структур) функции. Интегральные белки делят на транспортные, рецепторные и ферменты. Транспортные белки формируют каналы для транспорта веществ через мембрану и являются переносчиками веществ. Рецепторные - воспринимают действующие на клетку стимулы. Ферменты - обеспечивают биохимические реакции на поверхности клеточных мембран. Нередко один и тот же белок выполняет несколько функций.
В клеточных мембранах имеются каналы, обладающие избирательной проницаемостью, а ионы влияют на величину мембранного потенциала. Например, «калиевые» каналы проницаемы только для К+ и воды. Поскольку по обе стороны клеточной мембраны осмотическое давление растворов одинаково, осмотический ток воды через эти каналы не происходит, но могут проходить только К+. Однако, из-за электростатического взаимодействия (отрицательный заряд в клетках удерживает положительно заряженные К+) в покое диффузии К+ также нет.
Таким образом, по обе стороны мембраны, устанавливается электрохимическое равновесие, обусловленное равными по силе, но действующими в противоположных направлениях электрическим и концентрационным градиентами ионов. Такое равновесие в покое формирует относительно постоянный трансмембранный равновесный потенциал.
Мембрана живых клеток в той или иной степени проницаема для многих ионов. Например, под действием электрохимического и концентрационного градиентов Na+ через натриевые каналы проходит внутрь клетки, а К+ из нее. В результате этого внутри- и внеклеточные концентрации ионов через некоторое время могут выравняться. Но в живой клетке это не происходит, так как с помощью «насоса», Na+ удаляются из клетки, а К+ возвращается в нее.
Насосы могут работать против концентрационного и электрохимического градиентов, что требует затрат энергии, которая освобождается при гидролизе АТФ аденозинтрифосфатазой. Данный фермент-переносчик на внешней поверхности мембраны обладает высоким сродством к К+, а на внутренней - Na+. Насос является электронейтральным если транспортирует оба иона в соотношении 1:1 и электрогенным - когда транспортирует одних ионов больше чем других.
Поскольку проницаемость мембраны для К+ значительно выше, чем для других ионов, последние мало влияют на величину потенциала покоя (ПП), а К+ в покое является потенциалобразующим внутриклеточным ионом.
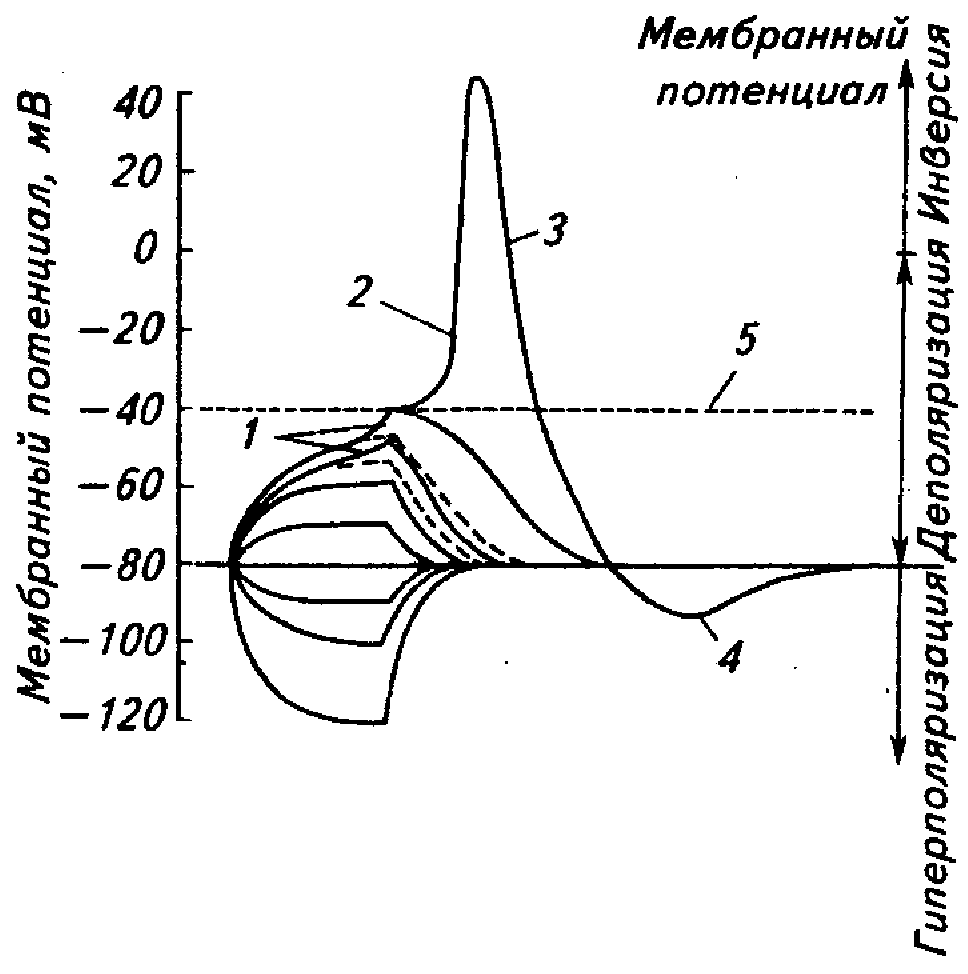
При слабом раздражении возбудимой клетки (рис. 2.) возникает локальный ответ (ЛО). Мембранный потенциал при этом временно снижается (деполяризация мембраны). При увеличении силы раздражения ЛО становится более выраженным и при раздражении пороговой силы возникает потенциал действия (ПД). Мембранный потенциал при развитии ПД стремительно достигает нулевого значения, а затем становится положительным. Достигнув определенной амплитуды, мембранный потенциал возвращается к исходному уровню и продолжает еще некоторое время падать. Затем ПП медленно восстанавливается.
Раздражение, превышающее пороговое значение, не изменяет амплитуду ПД, поскольку он подчиняется принципу «все или ничего».
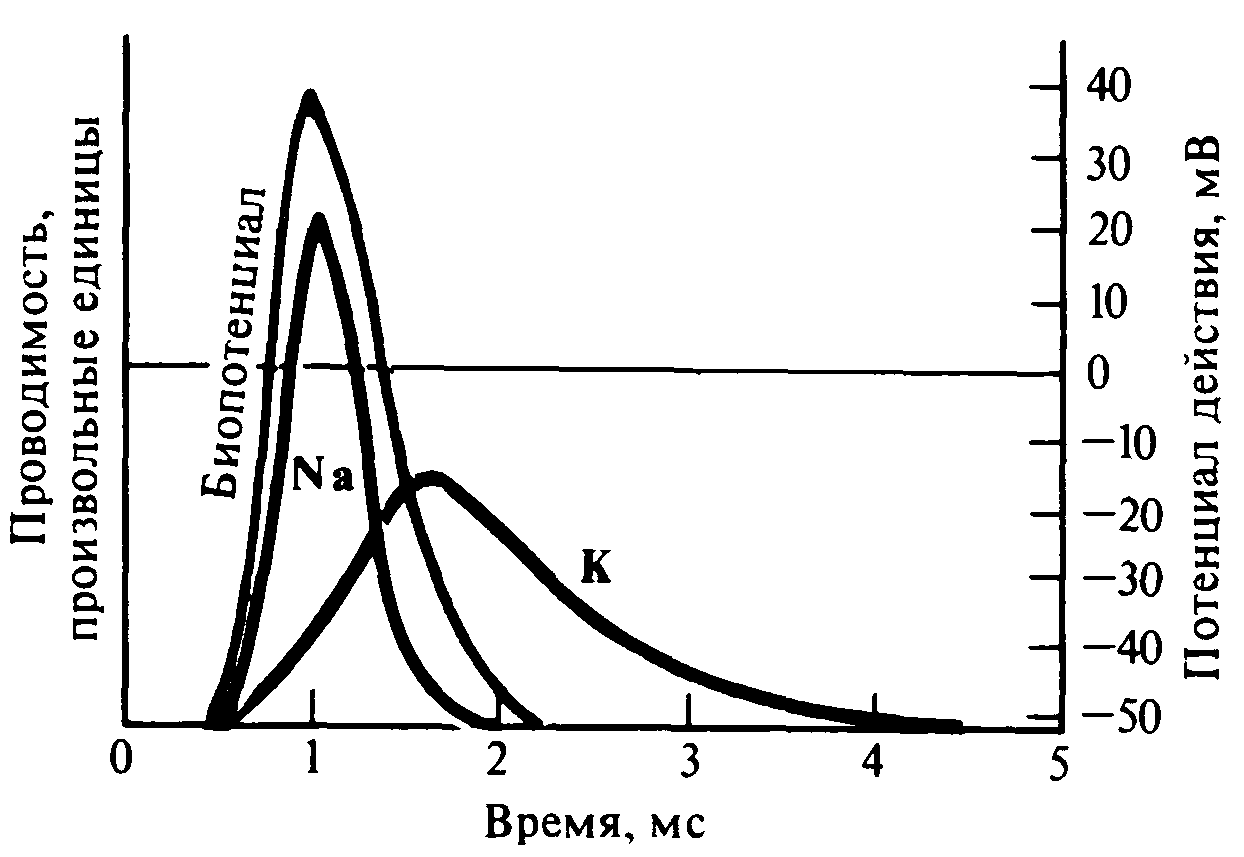
При возбуждении наблюдается высокая проницаемость мембран, как для К+, так и для других ионов, что способствует увеличению числа потенциалобразующих ионов (рис. 3.).
На первом этапе ПД (фаза ЛО) начинается деполяризация мембраны. По мере приближения мембранного потенциала к пороговому уровню, приоткрываются натриевые (потенциалзависимые или потенциалуправляемые) каналы. Если мембранный потенциал остается ниже критического (порогового) уровня, выход К+ из клетки компенсирует эффект натриевого тока, и ПД не возникает. При пороговом раздражении, вход Na+ уже преобладает над выходом К+ и открываются дополнительные натриевые каналы (фаза деполяризации). При этом, вход Na+ кратковременно (до 1 мс) усиливается и внутренняя поверхность клеточной мембраны становится положительной (инверсия). При активации одного «натриевого» канала через него проходит до 6000 ионов.
|
|
Рис. 2. Изменение мембранного потенциала возбудимой клетки при раздражении: 1 – локальные ответы на допороговые раздражения нарастающей силы; 2 – деполяризация; 3 – реполяризация; 4 – следовая гиперполяризация; 5 – критический уровень деполяризации. | |
|
|
Рис. 3. Интенсивность диффузии Na+ в клетку и К+ из клетки в сопоставлении с изменениями заряда на мембране. | |
При достижении максимального значения ПД начинается инактивация натриевых каналов и дополнительно открываются потенциалзависимые калиевые каналы. К+ быстро выходит из клетки, а мембранный потенциал возвращается к исходному уровню (фаза реполяризации). Повышенная проводимость для К+ сохраняется еще некоторое время, поэтому мембранный потенциал становится ниже, чем в исходном состоянии (следовая гиперполяризация). Затем Nа+-К+-насос восстанавливает исходную концентрацию ионов в клетках (фаза следовых потенциалов).
СВОЙСТВА ПОТЕНЦИАЛА ДЕЙСТВИЯ
Аккомодация проявляется отсутствием возбуждения при медленно нарастающей силе раздражения. Аккомодация связана с инактивацией натриевых каналов и активацией калиевых каналов при продолжительной деполяризации. При низкой скорости деполяризации, часть натриевых каналов успевает закрыться (ослабление входящего натриевого тока), а калиевых открыться (усиление выходящего калиевого тока) до прекращения нарастания силы раздражения. Зависимость порога от скорости нарастания силы раздражения названа законом раздражения. Согласно этому закону, сила раздражения необходимого для возбуждения ткани должна нарастать с определенной скоростью.
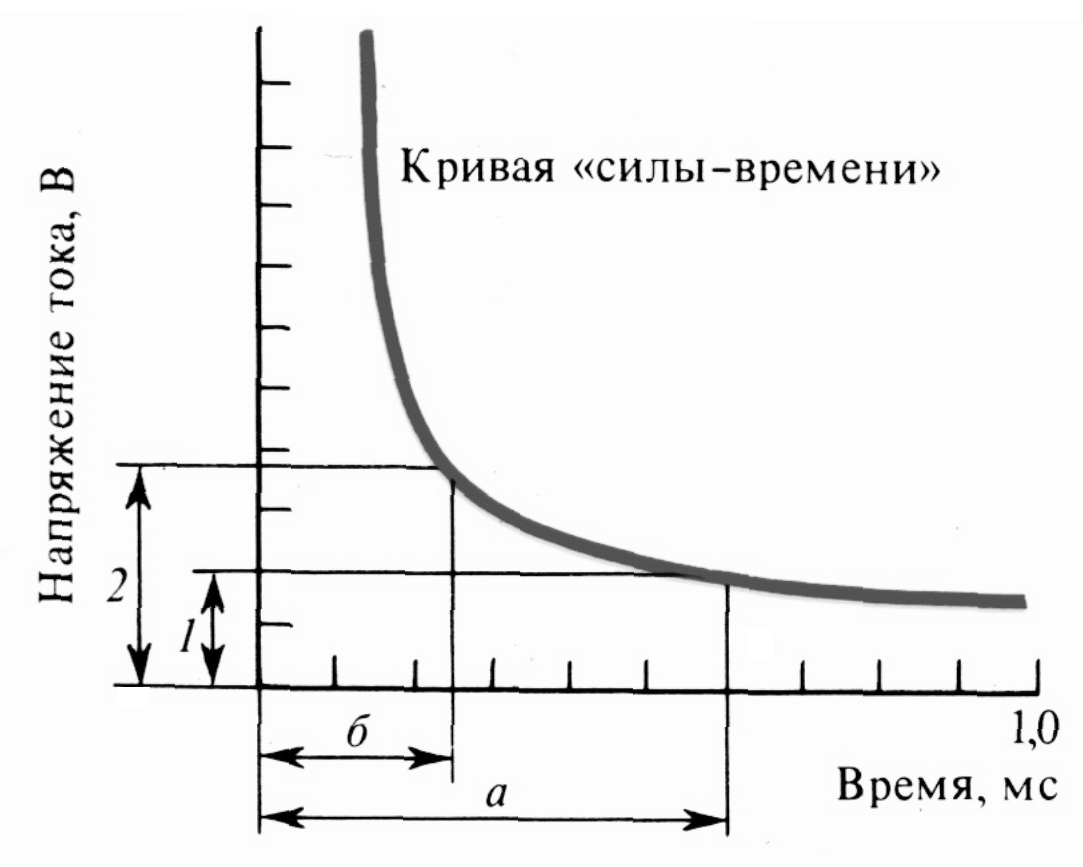
Закон длительности раздражения гласит, что возбуждения нет, если оно длится долго, но с малой силой, или если сила раздражения велика, но действует кратковременно. Кривая, отражающая взаимосвязь порога и времени раздражения, имеет вид гиперболы и не пересекает оси координат (рис. 4). Ось абсцисс (ось времени) не пересекается так как допороговая сила не вызывает возбуждения ни при какой длительности раздражения (время бесполезно). Начиная с пороговой силы, время становится значимым (полезным) для раздражения. «Полезное время» - минимальная длительность действия порогового раздражения (реобазы), достаточная для возбуждения.
«Полезное время» свидетельствует об уровне возбудимости ткани. Чем короче «полезное время», тем более возбудимой является ткань и быстрее реагирует на раздражитель. Точное измерение «полезного времени» затруднительно, поскольку в этой части кривой значительные изменения времени соответствуют малым изменениям порога. Поэтому предложено измерять хронаксию (минимальную длительность раздражителя при силе, равной двум реобазам). Хронаксия зависит от структуры ткани и ее функционального состояния. Например, в мотонейронах она равна 0,09-0,2 мс, в скелетных мышцах - 0,2-0,4 мс; а наибольшая хронаксия у гладких мышц (десятки и сотни мс).
|
|
Рис. 4. Кривая «силы-времени» (по Лапику и др., 1926): 1 - реобаза, 2 – удвоенная реобаза, а - полезное время, б – хронаксия. |
Рефрактерность - временное отсутствие возбудимости клеток при возникновении в них ПД.
При уменьшении интервала между раздражениями величина ПД в ответ на следующие стимулы становится все ниже и ниже. Если же частота наносимых раздражений так велика, что повторный стимул наносится во время генерации ПД или сразу после его окончания, следующий ПД не возникает. Период, в течение которого новый ПД не может возникнуть, называется абсолютным рефрактерным периодом и составляет в нервных клетках позвоночных животных 1,5-2 мс. После периода абсолютной рефрактерности наступает относительный рефрактерный период. Он характеризуется пониженной возбудимостью ткани и меньшей амплитудой ПД.
После периода относительной рефрактерности возбудимость восстанавливается.
Возникновение абсолютной рефрактерности объясняется тем, что в фазу реполяризации открываются дополнительные калиевые каналы и снижается натриевая проводимость. Поэтому активных натриевых каналов становится недостаточно для превышения эффекта калиевого тока и деполяризация невозможна. В период относительной рефрактерности открытых калиевых каналов становится меньше, и раздражитель очень большой силы может активировать достаточное для возбуждения число натриевых каналов. Однако, увеличенная проницаемость мембраны для К+ и остаточная натриевая инактивация уменьшают амплитуду ПД.
ПД распространяется по всей мембране клетки, а нервные (и некоторые мышечные) клетки способны передавать возбуждение другим клеткам на значительные расстояния. Возбуждение от тела нейронов распространяется по отросткам (аксонам или дендритам). Часть отростков (мякотные волокна) покрыты миелиновой оболочкой, являющейся электрическим изолятором. Оболочка периодически (через каждые 0,9-2 мм) прерывается и образуются перехваты Ранвье, через которые клеточная мембрана контактирует с межклеточной жидкостью.
В покое нервная клетка внутри заряжена отрицательно. При раздражении возбуждается определенный немиелинизированный участок нервного волокна. Na+ входит в клетку и внутренняя поверхность мембраны кратковременно становится положительной. Электрический ток распространяется от положительного полюса к отрицательному, а петли тока проходят вдоль нервного волокна по цитоплазме и через мембрану невозбужденных участков. В результате мембранный потенциал достигает пороговых значений и возникает ПД в ранее невозбужденном участке, который затем вызовет возбуждение следующих участков нерва.
В миелинизированном волокне из-за того, что участки мембраны между перехватами Ранвье изолированы, ток действует на мембрану только в области перехвата и очередной ПД возникает в следующем перехвате. Поэтому возбуждение в безмякотном нервном волокне охватывает всю поверхность нервного волокна, а в мякотном - распространяется скачкообразно (от перехвата к перехвату).
Ток от места возникновения ПД, распространяется и назад, но это не приводит к возбуждению, поскольку те участки, где только что возникал ПД, еще находятся в состоянии абсолютной рефрактерности.
Скорость проведения возбуждения зависит от диаметра нервного волокна (табл. 1) и наличия миелиновой оболочки. Причем миелинизированные нервные волокна даже при равных с немиелинизированными волокнами диаметрах имеют большую скорость проведения.
|
Таблица 1. Свойства нервных волокон млекопитающих | ||||
|
Тип волокон |
Диаметр волокна, мкм |
Скорость проведения, м/с |
Функции | |
|
Мякотные |
Аα
|
13-22 |
7-120 |
Эфферентные волокна проводят возбуждение к скелетным мышцам, а афферентные проводят возбуждение от мышечных рецепторов (веретен) |
|
Аβ
|
8-13 |
40-70 |
Афферентные волокна проводят возбуждение от рецепторов прикосновения и сухожильных рецепторов | |
|
Аγ |
4-8 |
15-40 |
Афферентные волокна проводят возбуждение от рецепторов прикосновения и давления, а эфферентные – к мышечным веретенам | |
|
В |
1-3 |
3-14 |
Преганглионарные волокна вегетативной нервной системы | |
|
Безмя-котные |
С |
0,5-1,0 |
0,5-2,0 |
Постганглионарные волокна вегетативной нервной системы, афферентные волокна проводят возбуждение от рецепторов боли, давления и тепла |
|
| ||||
ПЕРЕДАЧА ВОЗБУЖДЕНИЯ МЕЖДУ КЛЕТКАМИ
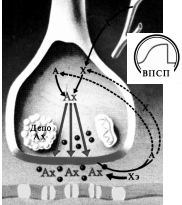
При возбуждении одной из возбудимых клеток в области контакта их мембран, происходит деполяризация мембраны и соседней клетки. При достижении порогового значения деполяризации в ней возникнет ПД и распространится по всей поверхности клетки. Такое соединение называется электрический синапс (эфапс). Эфапсы обнаружены в ЦНС, а также гладких и сердечных мышцах. Электрическая передача возбуждения обеспечивает быстрое распространение возбуждения по группам клеток. Но, для надежной работы эфапса, необходима значительная площадь соприкосновения двух мембран в области с низким электрическим сопротивлением. Кроме того, возбуждение в электрическом синапсе проводится в обе стороны и сигнал в клетках не может преобразовываться так как они являются лишь пассивными проводниками. Поэтому большинство синапсов являются химическими (рис. 5) и осуществляют передачу сигналов специальными веществами - медиаторами. Сигнал через химический синапс проводится относительно медленно (синаптическая задержка), но может обеспечивать как возбуждающие так и тормозные влияния.
|
|
Рис. 5. Механизм передачи возбуждения в синапсе: Ах - ацетилхолин, А - ацетат, Х - холин, Хэ – холинэстераза, ВПСП - возбуждающий постсинаптический потенциал. |
Передача сигнала через химический синапс сопровождается следующими процессами:
Деполяризация пресинаптической мембраны при возбуждении нервного окончания.
Активация Са++ каналов и проникновение Са++ в нервные окончания.
Выброс медиатора в синаптическую щель из нервного окончания.
Диффузия медиатора к постсинаптической мембране на другой клетке.
Активация рецепторов постсинаптических мембран в результате их взаимодействия с молекулами медиатора.
Передача сигнала с одной клетки на другую.
Инактивация рецепторов, из-за расщепления медиатора ферментами.
В нервно-мышечном синапсе медиатор (ацетилхолин) активирует натриевые каналы, что приводит к деполяризации постсинаптической мембраны мышечного волокна. При достижении порогового уровня деполяризации, возникает ПД. Открытие натриевых каналов на постсинаптических мембранах кратковременно (на несколько мс), поскольку ацетилхолин быстро гидролизуется холинэстеразой на холин и уксусную кислоту.
ФИЗИОЛОГИЧЕСКИЕ СВОЙСТВА МЫЩЦ
По морфологическим и функциональным характеристикам мышцы делят на гладкие и поперечнополосатые (скелетные и сердечные). Скелетные мышцы не могут работать без управляющих сигналов ЦНС и поэтому обеспечивают только произвольные движения. Гладкие (расположены в сосудах и внутренних органах) и сердечные мышцы контролируются ЦНС, но обладают автоматией и собственной нервной сетью (интрамуральные ганглии), часто обеспечивающей их самоуправление.
Мышцы состоят из цилиндрических многоядерных клеток (волокон). Поперечнополосатые мышцы, как правило, начинаются от сухожилия или от другой соединительной ткани на одной кости и заканчиваются в сухожилии или в соединительной ткани другой кости.
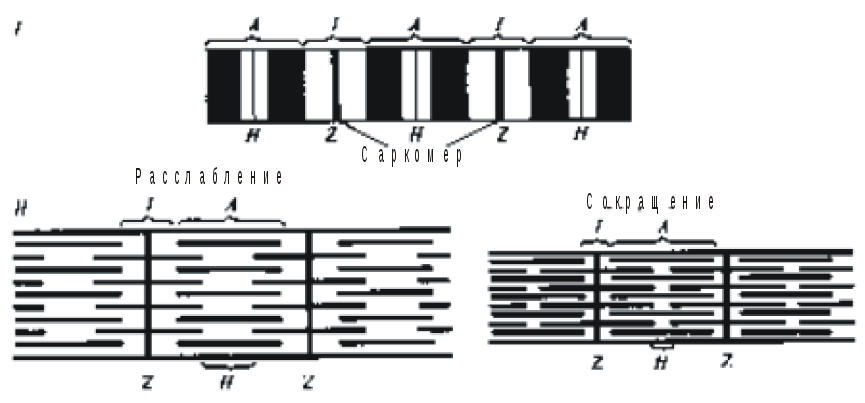
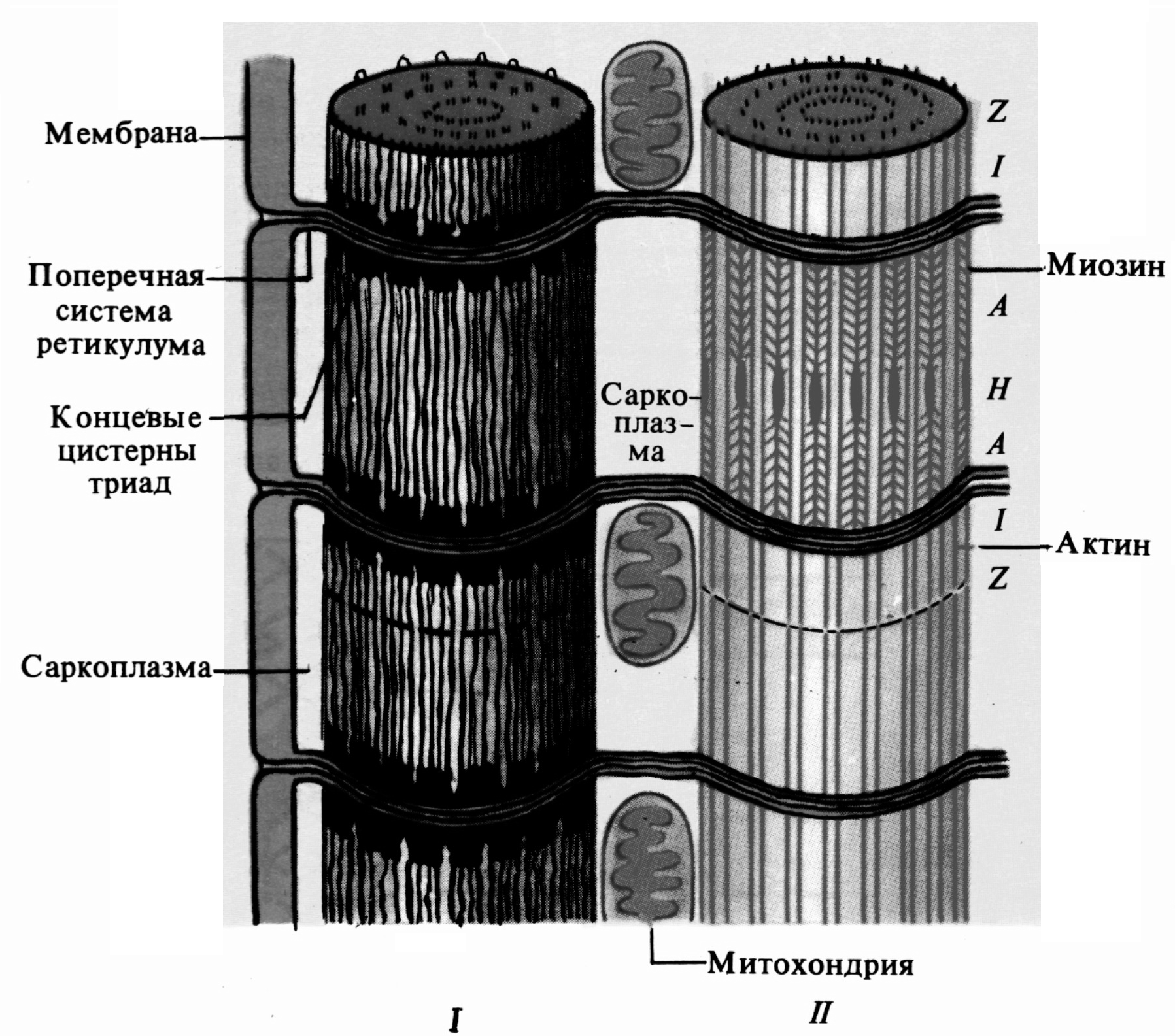
Функциональной единицей поперечнополосатой мышцы является саркомер (рис. 6). Саркомеры отделены друг от друга Z-пластинками и повторяются в мышечных волокнах в продольном направлении. Миофибриллы отдельного мышечного волокна поперечно-полосатой мышцы связаны таким образом, что положение их саркомеров совпадает, и это под световым микроскопом создает картину «исчерченности». В обоих направлениях от Z-пластинки тянутся тонкие нити (филаменты), состоящие преимущественно из актина. Они контактируют с толстыми нитями белка миозина. Миозиновые филаменты образуют наиболее темный диск саркомера (A-диск). Светлый участок в центре A-диска называют H-зоной. В середине H-зоны находится M-линия, в области которой находятся ферменты, участвующие в энергообмене. По периметру миофибриллы на уровне Z-пластинки идет окруженная мембраной Т-трубочка, которая соединяется с трубочками соседних миофибрилл.
|
|
|
Рис. 6. Строение мышечного волокна (I) миофибрилл (II): A – анизотропный диск, I – изотропный диск, H – Н-зона, Z – Z пластинка. |
Система трубочек достигает поверхности мышечного волокна и соединяется с его мембраной, а устье трубочки открывается во внеклеточное пространство. В дополнение к системе T-трубочек, в мышцах есть саркоплазматический ретикулум (рис. 7), обволакивающий каждый саркомер от одной Z-пластинки до другой. Ретикулум отделен мембранами от саркоплазмы и Т-трубочек, что обеспечивает хранение Са++, что в нем.
В области I-дисков имеются только актиновые филаменты, а в H-зоне - миозиновые. На участке взаимного перекрывания каждый миозиновый филамент окружен шестью актиновыми филаментами.
Актиновый филамент состоит из двух актиновых нитей и имеет форму прикрепленной одним концом к Z-линии двойной спирали. В бороздках актиновой спирали лежит комплекс белка тропомиозина с белками тропонинами, образующими выступы с интервалом около 40 нм.
|
|
|
Рис. 7. Расположение саркоплазматического ретикулума в миофибриллах (по Дж. Бендоллу, 1970 г): I – саркомеры, II – саркомеры без ретикулума, A – А -диск, I – I-диск, H – Н-зона, Z – Z пластинка. |
Филаменты миозина одним концом прикрепляются к Н-зоне, а свободный их конец имеет двойные головки. Длинная тонкая часть миозина состоит из двух закрученных относительно друг друга цепей, и подразделяется на шейку и хвост. Мономеры в филаменте собираются так, что их головки («мостики») выступают и располагаются вдоль оси филамента (на расстоянии друг от друга около 14 нм) в виде двухнитчатой спирали, а угол их смещения вокруг филамента составляет 120о.
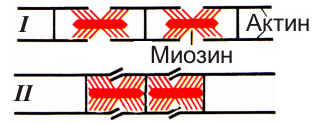
При сокращении саркомеры изменяют свою длину (рис. 8), ширина I-дисков и H-зон уменьшается, а длина самих филаменты не меняется.
|
|
|
Рис. 8. Схема скольжения нитей актина и миозина при сокращении и расслаблении (по Дж. Бендоллу, 1970 г): I – растянутая миофибрилла, II – сокращенная миофибрилла. |
Согласно «теории скольжения», саркомер укорачивается при скольжении актиновых нитей относительно миозиновых. Укорочение заканчивается, когда актиновые филаменты максимально втягиваются в A-диск. Филаменты скользят под действием силы последовательного связывания миозиновой головки с актином. Механизм сокращения заключается в перемещении актиновых нитей вдоль миозиновых к центру саркомера за счет «гребных» движений головок миозина, периодически прикрепляющихся к актиновым филаментам. Амплитуда одного движения составляет около 20 нм, а частота - 5-50 кол/с. Мостики соединяются и тянут нить, или отсоединяются и ждут «условий» для нового прикрепления. Поскольку мостиков много и работают они несинхронно, их общая «тяга» равномерна.
Этапы развития сокращения и расслабления:
При пороговом раздражении мышцы деполяризуется саркоплазматическая мембрана T-трубочки и с помощью посредника (инозитолтрифосфат), сигнал передается на мембраны ретикулума.
Са++ каналы на мембранах ретикулума открываются и быстро увеличивается концентрация Са++ в миоплазме.
Са++ соединяясь с тропонином, устраняет препятствия для взаимодействия сократительных белков (при отсутствии Са++ комплекс тропонина с тропомиозином препятствует взаимодействию головки фосфорилированного миозина с актином).
Головки миозина сгибаются, и актин перемещается на один шаг с последующим разрывом мостика (расходуется энергия фосфорилактомиозина).
При восстановлении ПП посредник разрушается, Са++ каналы закрываются, а Са++-насос (используя энергию АТФ) возвращает Са++ в ретикулум.
Тропомиозин снова блокирует актин, а миозин фосфорилируется за счет АТФ.
АТФ наряду со снабжением энергией будущей работы, способствует временному разобщению нитей сократительных белков и делает возможным их растяжение внешними силами. При отсутствии АТФ в миоплазме развивается непрерывное сокращение (контрактура).
Основным источником Са++ участвующего в сокращении скелетных мышц является ретикулум, в сердечной мышце - ретикулум и внеклеточная среда, а в гладких мышцах - преимущественно внеклеточная среда.
МЕХАНИКА МЫШЦЫ
Различают три режима сокращения мышц: изотонический, изометрический и смешанный. В изотоническом режиме мышца укорачивается при неизменном внутреннем напряжении (например, при небольшом поднимаемом грузе или сокращении мышцы без груза). При изометрическом режиме длина мышцы не меняется, а возрастает ее внутреннее напряжение (при нагрузке мышцы неподъемным грузом). В реальных условиях сокращение, как правило, является смешанным (возможно лишь преобладание одного из двух режимов).
Скорость скольжения между филаментами не зависит от длины саркомеров. Но скорость укорочения миофибриллы при стандартной нагрузке, линейно зависит от числа саркомеров. Следовательно, противоположные концы длинной мышцы сближаются с наибольшей скоростью. А в мышцах одинаковой длины сокращение происходит быстрее у мышцы, с более короткими саркомерами. Максимальная скорость сокращения и максимально развиваемая сила мышцы находятся в обратной зависимости от длины саркомера. Так, у мышцы с длинными саркомерами (благодаря большему перекрыванию филаментов) развивается большая сила и низкая предельная скорость укорочения. Усилие при сокращении ограничено числом параллельно работающих филаментов. Поэтому толстая мышца способна поднять больший груз.
При увеличении нагрузки на мышцу удлиняется время, затрачиваемое ей на отрыв груза от поверхности опоры (необходимо время для развития мостиками достаточного усилия). С активацией мостиков связана и обратная зависимость скорости укорочения мышцы от нагрузки.
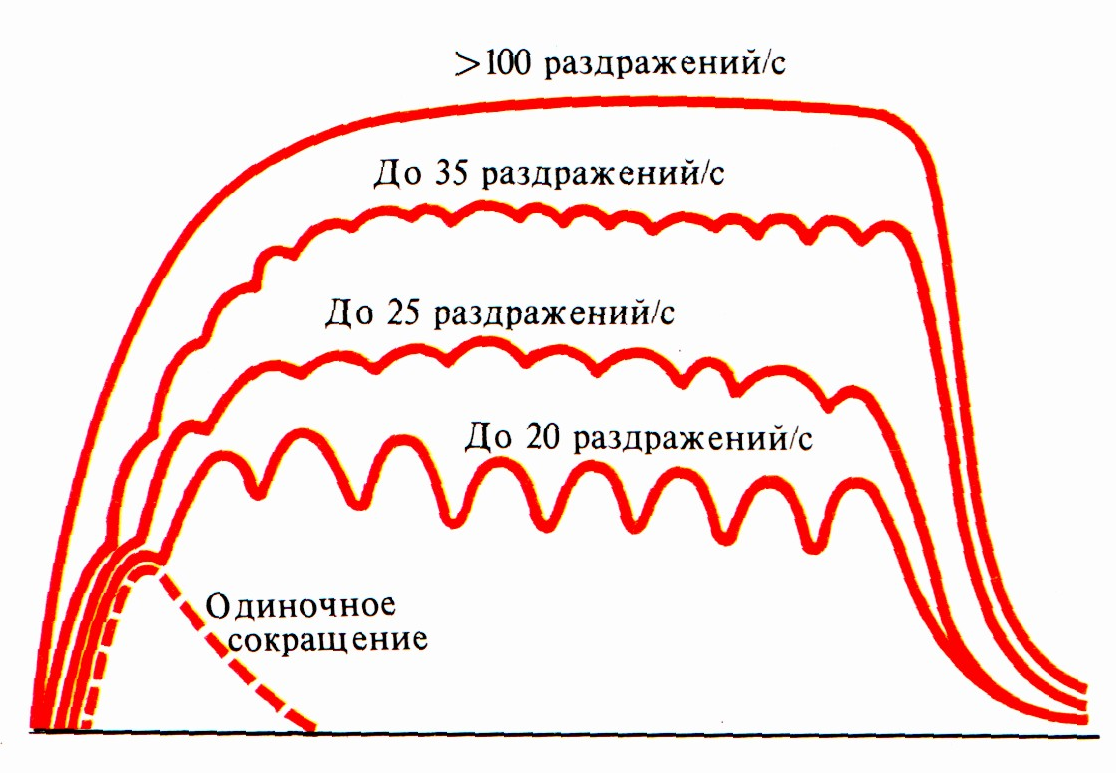
Различают два вида сокращений: одиночное и тетаническое (рис. 9). Одиночное сокращение возникает при возбуждении мышечных волокон одним ПД. При одиночном сокращении образование мостиков быстро устраняется вследствие того, что Са++ возвращаются в ретикулум, до того как филаменты успеют втянуться достаточно глубоко, и максимальное напряжение не развивается. Если второй ПД возникнет до возвращения Са++ в ретикулум, сокращение продляется (тетанус). При генерации серии ПД изометрическое напряжение мышцы нарастает до тех пор, пока внутреннее укорочение сократительных компонентов, не станет максимальным.
При длительном сокращении мышцы ранее накопленных запасов АТФ хватает ненадолго. АТФ может быстро регенерировать в результате фосфорилирования АДФ, за счет расщепления креатинфосфата.
Сокращение мышц сопровождается выделением части энергии в виде теплоты. Энергия, освобождающаяся из мышцы в виде теплоты, в 4-5 раз превышает энергию, затраченную на выполнение механической работы. Благодаря этому мышца не только выполняет механическую работу, но и является источником тепла для всего организма.
|
|
Рис. 9. Зависимость мышечных сокращений от частоты раздражения. |
При интенсивной мышечной работе кислорода не хватает, и в организме накапливаются недоокисленные продукты (молочная кислота и др.). Создается «кислородная задолженность», погашаемая после работы за счет усиления дыхания и кровообращения. Если же работа, при наличии «кислородного долга», продолжается, то наступает утомление мышцы.
В норме утомление развивается вследствие отказа структур ЦНС. Децентрализованные мышцы (при перерезке нерва) работают дольше, но, в конечном счете, также утомляются. По скорости развития утомления, сократительной активности и характеру энергообеспечения поперечно-полосатые мышечные волокна делят на четыре основные группы:
Быстрые фазические окислительные - реагируют быстрым одиночным сокращением и медленно утомляются (содержат много митохондрий; АТФ быстро образуется за счет окислительного фосфорилирования).
Быстрые фазические гликолитические - быстро сокращаются, но устают раньше волокон первой группы (АТФ образуется за счет гликолиза).
Медленные фазические - как все фазические волокна, сокращаются по закону «все или ничего», но медленнее первых двух групп. Утомляются медленно (митохондрий много, а АТФ используется медленно).
Тонические - сокращаются медленно и не способны к одиночным сокращениям (их мембрана не генерирует ПД по закону «все или ничего»). Одиночный импульс на постсинаптический потенциал вызывает слабое сокращение, а серия постсинаптических потенциалов приводит к плавному нарастанию деполяризации мембраны и амплитуды сокращения миофиламентов в саркомерах. Тонические волокна слабее фазических, тратят мало энергии и способны долго работать.
Гладкие мышцы находятся в стенках внутренних органов (пищевод, мочевой пузырь, артерии и др.), состоят из мелких одноядерных клеток диаметром 2-20 мкм (при сокращении он увеличивается в 10-100 раз). Клетки объединены друг с другом с помощью плотных контактов, обеспечивающих распространение электрического тока от клетки к клетке (функциональный синтиций).
Гладкие мышцы не имеют поперечной исчерченности так как филаменты в них не упорядочены. Гладкие мышцы сокращаются и расслабляются медленнее поперечнополосатых а саркоплазматический ретикулум в них представлен слабо. В покое с помощью Са++ насоса и благодаря инактивации Са++каналов постоянно поддерживается низкий уровень внутриклеточной концентрации Са++в цитоплазме гладкомышечных клеток. При возбуждении Са++каналы открываются, а Са++насос инактивируется. В результате концентрация Са++в гладкомышечной клетке возрастает.
Вместо тропонина в гладкой мышце Са++соединяется с белком кальмодулином и активирует протеинкиназу, что сопровождается фосфорилированием миозиновой головки и ее присоединением к актину. Затем сократительные белки скользят друг относительно друга и происходит сокращение гладкой мышцы.