
23.2-
.pdf
Жерносек А.К. |
Фармацевтическая химия |
АСКОРБИНОВАЯ КИСЛОТА
1. Химическое и пространственное строение молекулы
Аскорбиновую кислоту можно рассматривать как -лактон 2- оксогулоновой кислоты либо как гетероциклическое соединение – производное фурана.
O C |
OH |
|
|
|
|
O |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
C |
|
|
O |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
O HO |
OH |
|
|
|
|
|
||||||||||
HO |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H |
|
|
|
|
|
|
|
|
|
OH |
HO |
|
|
|
|
O |
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
HO |
|
|
|
H |
|
|
|
|
|
|
|||||
HO |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
HO |
|
OH |
|||||||||
|
|
|
|
CH OH |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2-оксогулоновая кислота |
енольная форма лактона |
|
|
|
|
|
||||||||||||||||||
HO |
|
|
|
|
|
|
|
O |
2-оксогулоновой кислоты |
|
|
|
|
|
||||||||||
3 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
O1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
HO |
|
4 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
HO |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH2OH
5-(1,2-дигидроксиэтил)-3,4-дигидрокси-5H-фуран-2-он
В молекуле аскорбиновой кислоты присутствуют 2 центра хиральности, поэтому данное вещество может существовать в виде 4 стереоизомеров. Все изомеры аскорбиновой кислоты синтезированы. Витаминной активностью обладает L-аскорбиновая кислота, её D-изомер такой активностью не обладает. Изоаскорбиновые кислоты в природе не встречаются.
HO |
O |
|
|
|
O |
HO |
L-аскорбиновая кислота |
HO |
H |
|
CH2OH |
2011/2012
Жерносек А.К.
O HO 
O
HO
H OH
CH2OH
D-аскорбиновая кислота
|
|
|
|
|
|
Фармацевтическая химия |
||||||
|
O |
|
O |
|||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|
OH |
O |
|
OH |
O |
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||
|
|
|||||||||||
HO |
|
|
|
H |
H |
|
|
|
|
OH |
||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH OH |
CH2OH |
|||||||||
2 |
|
D-изоаскорбиновая |
||||||||||
L-изоаскорбиновая |
|
|||||||||||
кислота |
|
кислота |
||||||||||
Название по R,S-номенклатуре 1) стереоцентр в лактонном цикле  старшинство заместителей
старшинство заместителей
O HO 
1O
HO 2 3 H
4
HO H CH2OH
 преобразование стандартной проекции Фишера
преобразование стандартной проекции Фишера
HO |
O |
O |
OH |
|
|
||
2 |
1 O |
O 1 |
2 |
H |
|
X OH |
|
HO 3 |
H |
||
HO |
4 |
3 |
|
H |
4 |
|
CH2OH
Старшинство заместителей убывает по часовой стрелке, следовательно, атом углерода имеет R-конфигурацию.
2) стереоцентр в боковой цепи
|
2 |
|
|
2 |
|
||
1 |
Y |
4 |
3 |
Y |
1 |
||
|
|
|
|
||||
HO |
|
|
H |
HOH2C |
|
|
OH |
|
|
|
|
||||
|
CH2OH |
|
H |
|
|||
|
3 |
|
|
4 |
|
||
Старшинство заместителей убывает против часовой стрелки, следовательно, атом углерода имеет R-конфигурацию.
Систематическое название L-аскорбиновой кислоты с учётом конфигурации имеет следующий вид: (R)-5-[(S)-1,2-дигидроксиэтил]-3,4- дигидрокси-5H-фуран-2-он
2011/2012
Жерносек А.К. |
Фармацевтическая химия |
2. Промышленный синтез аскорбиновой кислоты
Первый синтез аскорбиновой кислоты был осуществлён в 1933 году Т. Рейхштейном и Е. Хирстом. Из-за важного значения аскорбиновой кислоты как лекарственного средства в различных странах были созданы многотоннажные производства этого вещества.
Исходным веществом для промышленного получения аскорбиновой кислоты является D-глюкоза.
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CHO |
|
|
|
CH2OH |
|
|
CH OH |
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
H |
|
|
|
|
OH |
|
H |
|
|
|
OH |
|
|
|
2 |
|||
2 |
|
|
|
|
|
|
|
Acetobacter |
H |
|
|
|
|
OH |
||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
HO |
|
|
|
|
H |
H2 |
HO |
|
|
|
H |
HO |
|
|
|
|
H |
|
3 |
|
|
|
|
|
|
Suboxydans |
|
|
|
|
|||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
H |
|
|
|
|
OH |
|
H |
|
|
|
OH |
|
H |
|
|
|
|
OH |
|
|
|
|
Ni |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
4 |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
H |
|
|
|
|
OH |
|
H |
|
|
|
OH |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
C |
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
CH2OH |
|
|
|
CH2OH |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
CH OH |
||||||||||||
|
|
6 |
|
|
|
|
сорбит |
|
|
2 |
||||||||
D-глюкоза |
|
|
|
|
L-сорбоза |
|||||||||||||
Формулу L-сорбозы можно представить в другом виде
|
|
|
CH2OH |
|
|
|
|
CH2OH |
|
|
|
CH2OH |
|
|
|
|
|
|
|
|
|
||||||||||||
H |
|
|
|
|
|
OH |
|
|
|
C |
|
O |
|
|
C |
|
O |
|
|
|
|
O |
|
|
OH |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
HO |
|
|
|
|
H |
|
HO |
|
|
|
|
H |
|
HO |
|
|
|
|
|
H |
|
|
|
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
H |
|
|
|
|
|
OH |
|
H |
|
|
|
|
|
OH |
|
H |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
||||||||||
|
|
C |
|
|
|
O |
|
HO |
|
|
|
|
H |
|
H |
|
|
|
|
|
CH2OH |
HOCH2 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
CH2OH |
|
|
|
CH2OH |
|
|
OH |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
-L-сорбофураноза |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Для предотвращения окисления гидроксильных групп L-сорбозу превращают в диизопропилиденсорбозу.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
CH3 |
|||||||
|
|
|
|
O |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH3)2CO |
|
|
|
|
O |
O |
|||||||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
KMnO4 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
CH OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
HOCH |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
||||
|
-L-сорбофураноза |
H3C |
|
|
|
|
H3C |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
H |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||||
|
KMnO4 |
|
|
|
O |
|
|
O |
|
H2O |
|
|
|
|
|
|
O |
|
||||||||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
COOH HCl |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
O |
|
|
|
|
|
|
|
|
HOCH2 |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
H3C |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2011/2012
Жерносек А.К.
O C OH
C OH
C O
O
HO H
H OH HO H
CH2OH
2-оксогулоновая кислота
Фармацевтическая химия
|
|
|
O |
|
|
|
|
O |
|||
O |
HO |
||||||||||
|
|
|
O |
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
HO |
|
|
|
|||
|
|
||||||||||
HO |
|
|
|
H |
HO |
|
|
|
H |
||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
CH2OH |
||||||||||
|
|
|
|
|
|
L-аскорбиновая кислота |
|||||
3. Физико-химические свойства
По внешнему виду аскорбиновая кислота представляет собой белый порошок или бесцветные кристаллы, которые во влажном воздухе стано-
вятся discolored. Температура плавления около 190 С (с разложением).
Растворимость (при 20 ) в воде – 33 г/100 мл, в этаноле – 2 г/100 мл. Практически нерастворима в диэтиловом эфире, бензоле и хлороформе.
Аскорбиновая кислота является двухосновной кислотой (pKa1 = 4,17; pKa2 = 11,57). При рН 7,4 она находится в растворе в виде моноаниона.
|
OH |
|
|
|
|
CH2OH |
|
|
|
|
|
||||||||
HO |
|
|
|
|
CHOH |
|
|
|
|
|
|||||||||
|
|
O |
|
|
|
O + H O |
|
|
|
|
O |
|
|
|
O |
+ H O+ |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
OH |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
O |
OH |
|
||||||||||||||
|
|
|
|
||||||||||||||||
Отщепление второго протона происходит только в сильнощелочной среде и не имеет практического значения (например, для физиологической активности данного вещества либо для его количественного определения методом кислотно-основного титрования). Кроме того, в сильнощелочной среде аскорбиновая кислота быстро окисляется.
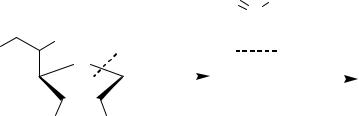
Аскорбиновая кислота обладает восстановительными свойствами и может обратимо окисляться до дегидроаскорбиновой кислоты. Данный процесс протекает в несколько стадий с образованием в качестве интермедиатов свободных радикалов. Суммарное уравнение имеет следующий вид
HO |
OH |
|
|
|
|
|
|
HO |
OH |
|
|
|
|
||||
|
O |
|
|
|
O + 2H+ + 2e |
|
|
|
|
O |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
||||
|
O |
|
|
|
|
|
|
OH |
|||||||||
|
|
|
HO |
||||||||||||||
|
дегидроаскорбиновая кислота |
|
|
|
|
|
|
|
|
|
|
||||||
Величина E0 для данной окислительно-восстановительной пары рав-
на +0,39 В.
2011/2012
Жерносек А.К. |
Фармацевтическая химия |
При гидролизе дегидроаскорбиновой кислоты образуется 2,3-диоксо- L-гулоновая кислота, которая далее необратимо окисляется до L- треоновой и щавелевой кислот.
|
|
|
|
|
|
|
|
|
|
O C OH |
|
|
|
|
|
|
|
|
|||||||
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
HO |
|
|
|
|
|
|
|
C |
|
O |
|
|
COOH |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
O |
|
|
|
|
H2O |
|
|
|
O [O] |
|
|
|
|
|
|
|
COOH |
||||||
|
|
|
|
|
O |
C |
|
H |
|
|
|
OH |
+ |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
OH |
HO |
|
|
H |
COOH |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
HO |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||||||
|
HO |
OH |
|
|
|
|
|
|
|
|
CH2OH |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
L-треоновая кислота |
|||||||||||
2,3-диоксо-L-гулоновая кислота
Водные растворы аскорбиновой кислоты неустойчивы. Их стабильность зависит от следующих факторов:
 наличия в воде растворённого кислорода;
наличия в воде растворённого кислорода;
 рН
рН
Аскорбиновая кислота более устойчива к окислению в кислой среде, чем в щелочной. Согласно уравнению Нернста при повышении рН величина восстановительного потенциала уменьшается, таким образом, восстановительные свойства аскорбиновой кислоты увеличиваются.
E 0,39 0,059 lg [DA][H ]2 2 [A]
При одинаковых концентрациях дегидроаскорбиновой и аскорбиновой ки-
слот E = 0,39 – 0,059 pH.
 присутствия катионов тяжёлых металлов, особенно Cu2+;
присутствия катионов тяжёлых металлов, особенно Cu2+;
 концентрации аскорбиновой кислоты в растворе – разбавлен-
концентрации аскорбиновой кислоты в растворе – разбавлен-
ные растворы данного вещества менее стабильны, чем концентрированные
 наличия стабилизаторов.
наличия стабилизаторов.
В кристаллическом состоянии аскорбиновая кислота устойчива к окислению. В отсутствии кислорода данное вещество не окисляется даже при высокой температуре. Дегидроаскорбиновая кислота менее устойчива к нагреванию и при повышении температуры разрушается. При нагревании в присутствии кислорода аскорбиновая кислота необратимо окисляется до биологически неактивных продуктов.
Аскорбиновая кислота способна поглощать электромагнитное излучение ближнего УФ-диапазона. В нейтральном растворе макс = 265 нм ( =
7000), в кислой среде макс = 245 нм ( = 7500).
Молекула аскорбиновой кислоты хиральна, поэтому данное вещество обладает оптической активностью. Величина [ ]20D = 21,0 ± 0,5 (водные растворы, 100 г/л).
2011/2012
Жерносек А.К. |
|
|
|
|
|
|
|
Фармацевтическая химия |
|||||||||
4. Химико-аналитические свойства |
|||||||||||||||||
|
|
CH2OH |
|
|
|
|
|
|
|
УФ- (идентификация, количественное |
|||||||
|
|
|
|
|
|
|
|
|
определение, детекция в ВЭЖХ) |
||||||||
|
|
CHOH |
|
|
|
|
|
|
|
ИК (идентификация) |
|||||||
|
|
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
поглощение ЭМИ |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
OH |
|
|
|
||||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислотные свойства |
восстановительные свойства |
|||||||||||||||
|
рН раствора |
|
|
|
|
|
|
|
идентификация по продуктам |
||||||||
|
|
|
|
|
|
|
|
восстановления реагентов-окислителей |
|||||||||
|
образование окрашенных |
||||||||||||||||
|
оксидиметрические определения |
||||||||||||||||
|
солей |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
кислотно-основное |
фотометрические реакции |
|||||||||||||||
|
титрование |
|
|
|
|
|
|
|
вольтамперометрия, кулонометрия |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Таблица.
Реагенты, используемые для идентификации аскорбиновой кислоты
|
|
|
|
|
Реагенты |
|
Сущность реакции |
Аналитический |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эффект |
|
|
|
|
|
|
|
FeSO4 |
|
образование окра- |
тёмно-фиолетовое ок- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
шенного аскорбината |
рашивание, исчезаю- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
железа (II) |
щее при действии сер- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ной кислоты |
|
|
|
|
|
|
|
AgNO3 |
|
восстановление |
тёмно-серый осадок |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag+1 до Ag |
|
|
|
щелочной раствор |
|
восстановление |
красный осадок |
|||||||||||||||
|
|
|
|
тартрата меди |
|
Cu+2 до Cu2O |
|
|||||||||||||
|
Cl |
|
восстановление |
исчезновение синей |
||||||||||||||||
|
|
|
окраски раствора |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
||||||||||||||||
2,6-дихлорфенолиндофенол |
|
|||||||||||||||||||
|
|
(окисленная форма) |
|
|
|
|||||||||||||||
|
E0 =+0,668 В при рН 1 |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
восстановление |
исчезновение синей |
(H3C)2N |
|
|
|
|
|
|
|
S |
N(CH3)2 |
окраски раствора |
||||||||||
 N
N 
метиленовый синий (окисленная форма) E0 =+0,532 В при рН 1
2011/2012

Жерносек А.К. |
Фармацевтическая химия |
5. Контроль качества
1. Аскорбиновая кислота
|
Идентификация |
|
|
Чистота |
Количественное |
|
|
|
|
|
определение |
МФ III |
химические реак- |
|
[ ]D20 = 20,5 - 21,5 |
иодометрическое |
|
|
ции |
|
(100 мг/мл); |
титрование |
|
|
- AgNO3, |
|
|
||
|
|
тяжёлые металлы |
|
||
|
- FeSO4. |
|
|
||
|
|
(колориметрия, 20 г/rг); |
|
||
|
температура плав- |
|
|
||
|
ления (около 190 |
|
прозрачность и окраска; |
|
|
|
С, с разл) |
|
легко обугливаемые вещест- |
|
|
|
|
ва; |
|
|
|
|
|
|
|
|
|
|
|
|
сульфатная зола ( 20 г/кг) |
|
|
ГФ РБ, |
спектроскопия |
|
прозрачность и цветность; |
иодометрическое |
|
PhEur, BP |
- УФ (при 245 нм |
|
[ ]20 = 20,5-21,5 (100 г/л); |
титрование |
|
|
A11 = 545 – 585); |
|
|
D |
|
|
|
щавелевая кислота ( 20 %) |
|
||
|
- ИК; |
|
медь, 5 ppm (ААС; 324,8 |
|
|
|
потенциометрия |
|
нм, воздушно-ацетиленовое |
|
|
|
(рН = 2,1 – 2,6 – |
|
пламя); |
|
|
|
раствор 50 г/л); |
|
железо, 2 ppm (ААС; 248,3 |
|
|
|
химические реак- |
|
нм, воздушно-ацетиленовое |
|
|
|
ции |
|
пламя); |
|
|
|
- AgNO3 |
|
тяжёлые металлы (10 ppm); |
|
|
|
|
|
сульфатная зола ( 0,1%) |
|
|
USP 24 |
спектроскопия |
|
[ ]D20 = 20,5-21,5 (100 г/л); |
иодометрическое |
|
|
- ИК; |
|
остаток при прокаливании |
титрование |
|
|
химические реак- |
|
( 0,1%); |
|
|
|
ции |
|
тяжёлые металлы (0,002%); |
|
|
|
- щелочной раствор |
|
|
||
|
тартрата меди |
|
летучие органические при- |
|
|
|
|
меси (ГЖХ). |
|
||
|
|
|
|
||
2. Раствор для инъекций |
|
|
|
||
|
|
|
|
|
|
|
Идентификация |
|
Чистота |
Количественное |
|
|
|
|
|
|
определение |
BP |
ТСХ |
|
рН (5,0 – 6,5); |
иодометрическое |
|
|
НФ: силикагель 60 F254 |
щавелевая кислота. |
титрование |
||
|
ПФ: 96% этанол – вода |
|
|
||
|
(120:20); |
|
|
|
|
|
детекция – 254 нм. |
|
|
|
|
|
химические реакции |
|
|
||
|
- AgNO3 |
|
|
|
|
USP 24 |
химические реакции |
бактериальные эндо- |
ВЭЖХ |
||
|
- метиленовый синий; |
|
токсины ( 1,2 ед); |
ПФ: полигидро- |
|
|
- окраска пламени (Na) |
рН (5,5 – 7,0); |
ксиметакрилатный |
||
|
ВЭЖХ |
|
оксалаты |
гель |
|
|
|
|
|
|
НФ: ФБР (рН 2,5) |
|
|
|
|
|
детекция – 245 нм |
2011/2012

Жерносек А.К. |
Фармацевтическая химия |
|||
|
3. Таблетки |
|
|
|
|
|
|
|
|
|
|
Идентификация |
Количественное |
|
|
|
|
определение |
|
BP |
|
ТСХ |
цериметрическое титрование |
|
|
|
НФ: силикагель 60 F254 |
|
|
|
|
ПФ: 96% этанол – вода |
|
|
|
|
(120:20); |
|
|
|
|
детекция – 254 нм. |
|
|
|
|
химические реакции |
|
|
|
|
- AgNO3, |
|
|
|
|
- 2,6-дхфиф. |
|
|
USP |
|
ВЭЖХ |
титрование раствором |
|
|
|
химические реакции |
2,6-дихлорфенолиндофенола |
|
|
|
- метиленовый синий |
|
|
|
|
- трихлоруксусная кислота и |
|
|
|
|
пиррол |
|
|
2011/2012
Жерносек А.К. |
Фармацевтическая химия |
АСКОРБИНОВАЯ КИСЛОТА
(ASCORBIC ACID)
HO
OH Витамин C
O
 O
O
HO OH
(5R)-5-[(1S)-1,2-дигидроксиэтил]-3,4-дигидроксифуран-2(5H)-он
Таблетки по 25, 50, 75, 100 мг; таблетки жевательные по 25, 100, 500 мг; таблетки шипучие по 1000 мг; таблетки вагинальные по 250 мг; порошок для приготовления раствора для приёма внутрь по 500 и 1000 мг; капли для приёма внутрь 100 мг/мл; раствор для инъекций 5%; сироп Асковит, таблетки Аскорутин и др.
ПРОИЗВОДНЫЕ ФЕНИЛХРОМАНА
ФЛАВОНОИДЫ
O
Группа природных полифенольных соединений, в молекулах которых содержатся 2 бензольных кольца, связанных трёхуглеродной цепью
3 |
шестичленный гетероцикл |
|
|
O 1 |
1,3-дифенилпропаноиды |
|
Витамин P («permeability») – 1936 (Albert Szent-Gyorgyi).
Биофлавоноиды – флавоноидные соединения с выявленной и подтверждённой биологической активностью.
Флавоны, флавонолы Флаваноны, флаванонолы
|
5 |
O |
|
|
|
|
O |
|
4 |
|
R |
|
|
||
|
3 |
|
|
3 R |
|||
6 |
|
|
|
||||
|
|
|
|
|
|
||
7 |
|
O |
2 |
1' |
2' |
3' |
2 |
|
8 |
|
|
|
O |
||
|
1 |
|
|
|
|
||
|
|
6' |
|
4' |
|
||
|
|
|
|
|
|||
|
|
|
|
|
5' |
|
|
кверцетин, рутозид дигидрокверцетин
РУТОЗИДА ТРИГИДРАТ
(RUTOSIDE TRIHYDRATE)
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
OH |
РУТИН |
||
HO |
|
O O |
|
|
|
O |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
3-[[6-O-(6-дезокси-α-L- |
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
маннопиранозил)-β-D- |
|
CH3 |
|
|
|
|
O O |
O |
глюкопиранозил]окси]-2- |
|||||||||||
|
|
|
|
OH |
|
|
|
|
|
|
3H2O |
(3,4-дигидроксифенил)- |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
5,7-дигидрокси-4H-1- |
|||||
OH OH |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
бензопиран-4-он |
|||||
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
||
|
|
|
|
|
|
OH |
|
|
|
|
|
|||||||
OH
Таблетки по 20 мг; АСКОРУТИН – таблетки, содержащие по 50 мг Р и АК; ТРОКСЕРУТИН – гель для НП 20 мг/г; капсулы по 200 мг.
|
|
OH |
O |
|
|
|
Кверцетин |
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
OH |
|
2H2O |
||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
HO |
O |
|
|
|
||||||||
|
|
|
|
OH |
||||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-(3,4-дигидроксифенил)-5,7-дигидрокси-4H-1-бензопиран-4-он |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
КОНТРОЛЬ КАЧЕСТВА РУТОЗИДА
2011/2012 |
1 |
Жерносек А.К. |
Фармацевтическая химия |
Характеристика вещества
Жёлтый или зеленовато-жёлтый кристаллический порошок. Практически нерастворим в воде, растворим в метаноле, мало растворим в этаноле (Ph.Eur – умеренно растворим), практически нерастворим в метиленхлориде. Растворяется в растворах гидроксидов щелочных металлов.
Идентификация |
ВТОРАЯ |
|
|
o УФ (210-450 нм) |
ПЕРВАЯ |
o ТСХ |
|
ИК |
o ХР |
|
Химическая реакция
10 мг вещества растворяют в 5 мл 96% этанола, добавляют 1 г порошка цинка и 2 мл HCl. Появляется красное окрашивание.
OH
OH
HO

 O
O
 OH
OH

 OH
OH
Количественное определение
Алкалиметрия в среде ДМФА. Титрант тетрабутиламмония гидроксид.Потенциометрическое обнаружение КТТ. Фактор эквивалентности 1/2.
*Спектрофотометрия (безводный этанол)
ИК-спектр
УФ-спектр
Метанольный раствор. Максимумы 257 нм и
358 нм (УПП = 305–330).
ТСХ
HФ – силикагель G. ПФ – бутанол, безводная уксусная кислота, вода, метилэтилкетон, этилацетат (5:10:10:30:50).Проявитель – смесь растворов K3[Fe(CN)6] и FeCl3.
Испытания на чистоту
Светопоглощающие примеси (в диапазоне
450–800 нм максимальная оптическая плотность 0,1)
Вещества нерастворимые в метаноле (не более 3%)
Сопутствующие примеси
ВЭЖХ: НФ – С8-СГ; ПФ – ТГФ-ФБР (рН 3), градиент; 280 нм
Вода (7,5–9,5%) |
|
Сульфатная зола |
ОКОР, МЧ |
(не более 0,1%) |
|
МАКРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРРОЛА
ТЕТРАПИРРОЛЫ
СОТКРЫТОЙ ЦИКЛИЧЕСКИЕ ЦЕПЬЮ
билирубин ПРОИЗВОДНЫЕ ПОРФИНА
ПРОИЗВОДНЫЕ
КОРРИНА
2011/2012 |
2 |
