
24
.pdf
Жерносек А.К. Лекции по фармацевтической химии (ст)
ЛЕКЦИЯ 24-26
АНТИБИОТИКИ
ХИМИОТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА
АНТИБИОТИКИ 
 СИНТЕТИЧЕСКИЕ ХТС
СИНТЕТИЧЕСКИЕ ХТС
ОБЩАЯ ХАРАКТЕРИСТИКА И КЛАССИФИКАЦИЯ АНТИБИОТИКОВ
Химиотерапия – лечение инфекционных заболеваний и злокачественных НО с
помощью ЛС, обладающих специфическим этиотропным действием.
ХТ средства действуют не на макроорганизм, а на микроорганизм – возбудитель соответствующего заболевания (либо на клетки злокачественных опухолей).
КЛАССИФИКАЦИЯ АТХ
JАнтиинфекционные средства для системного применения
J01 |
Антибактериальные средства для СП |
J02 |
Противогрибковые средства для СП |
J04 |
Средства, активные в отношении микобактерий |
J05 |
Противовирусные средства прямого действия |
J06 |
Иммунные сыворотки и иммуноглобулины |
J07 |
Вакцины |
LПротивоопухолевые и иммуномодулирующие средства
…L01D Цитотоксичные антибиотики и родственные им соединения
J01
J01А Тетрациклины
J01B Амфениколы
J01С Бета-лактамные антибиотики - пенициллины J01D Прочие бета-лактамные антибиотики
J01E Сульфаниламиды и триметоприм
J01F Макролиды, линкозамиды и стрептограмины J01G Аминогликозидные АБ
J01M АБС, производные хинолона J01R Комбинации АБС
J01X Прочие антибактериальные средства Гликопептиды; стероидные АБС; производные имидазола, нитрофурана; прочие АБС.
Антибиотики - вещества, синтезируемые микроорганизмами и продукты модификации
этих веществ, избирательно подавляющие рост патогенных микроорганизмов, низших грибов, а также некоторых вирусов и клеток злокачественных новообразований.
В широком смысле слова АБ - низкомолекулярные эффекторы изначально природного происхождения, способные подавлять рост живых клеток.
«Антибиоз» - Л.Пастер, «антибиотик» - З.Ваксман
(1942)
2011/2012
1

Жерносек А.К. Лекции по фармацевтической химии (ст)
МЕТАБОЛИТЫ ЖИВЫХ КЛЕТОК
ПЕРВИЧНЫЕ |
|
ВТОРИЧНЫЕ |
аминокислоты, |
|
антибиотики, |
моносахариды, |
|
алкалоиды, |
нуклеотиды и др. |
|
пигменты и др. |
Функции АБ в продуцирующих их живых клетках:
 средства нападения и защиты;
средства нападения и защиты;
 детоксикация вредных метаболитов;
детоксикация вредных метаболитов;
 контроль некоторых реакций при обмене веществ;
контроль некоторых реакций при обмене веществ;  участие в процессе дифференцировки клеток;
участие в процессе дифференцировки клеток;
 запасные питательные вещества.
запасные питательные вещества.
КЛАССИФИКАЦИЯ |
|
|
АНТИБИОТИКИ |
Тип |
|
действия |
||
|
||
Химическое |
Механизм |
|
строение |
||
действия |
||
Спектр |
||
|
||
действия |
|
Химическое строение
Группа АБ |
Химическая |
Представители |
|
структура |
|
Бета-лактамиды |
Содержат в молекуле - |
Пенициллины |
|
лактамный цикл |
Цефалоспорины |
|
|
Карбапенемы |
|
|
Монобактамы |
Макролиды и |
Содержат в молекуле |
Эритромицин |
азалиды |
лактонное кольцо, в |
Кларитромицин |
|
состав которого входят |
Рокситромицин |
|
14–16 атомов, у азалидов |
Азитромицин и др. |
|
в цикле присутствует N |
|
Аминогликозиды |
Гликозиды циклических |
Стрептомицин |
|
аминоспиртов (2- |
Канамицин |
|
дезоксистрептамина и |
Гентамицин |
|
др.) |
Амикацин и др. |
Тетрациклины |
АБ, в молекулах которых |
Тетрациклин |
ТИП ДЕЙСТВИЯ |
Бактерицидные |
|
|
присутствует частично |
Доксициклин |
|
|
|
|
гидрированное ядро |
|
|
|
|
Амфениколы |
нафтацена |
|
Бактериостатические |
|
|
АБ, относящиеся к |
Хлорамфеникол |
|
|
||
|
фенилалкиламинам; |
|
|
|
|
|
хлорамфеникол - |
|
|
|
|
|
нитрофенилалкиламин |
|
|
|
|
Линкозамиды |
Амид 1-метил-4- |
Линкомицин |
|
|
|
|
пропилпролина и |
Клиндамицин |
|
Нарушение синтеза КС |
|
|
метилтиолинкозаминида |
|
|
||
|
|
|
|
|
|
|
(линкомицин) и его п/с |
|
|
Повреждение КМ |
|
|
производное (клиндамицин) |
|
МЕХАНИЗМ |
Нарушение синтеза НК |
|
АБ другой |
Гликопептиды |
Ванкомицин |
|||
структуры |
Антрациклиновые АБ |
Доксорубицин |
ДЕЙСТВИЯ |
Нарушение отдельных |
|
|
Анзамицины |
Рифампицин |
|
||
|
|
процессов трансляции |
|||
|
Полиеновые АБ |
Нистатин |
|
||
|
Влияние на энергетический обмен |
||||
|
|
|
|||
|
|
|
2011/2012 |
|
|
2
Жерносек А.К. Лекции по фармацевтической химии (ст)
СПЕКТР ДЕЙСТВИЯ |
Набор микроорганизмов, на |
|
которые влияет данный АБ |
||
|
||
Влияющие |
Противотуберкулёзные |
|
преимущественно |
|
|
на Гр+ |
|
|
|
Противогрибковые |
|
Влияющие |
|
|
преимущественно |
Противоопухолевые |
|
на Гр- |
||
Широкого спектра |
Влияющие на |
|
действия |
простейших |
СПОСОБЫ ПОЛУЧЕНИЯ |
|
|
АНТИБИОТИКОВ |
|
|
СПОСОБЫ ПОЛУЧЕНИЯ |
||
БИОСИНТЕЗ |
ХИМИЧЕСКАЯ |
ПОЛНЫЙ |
|
ИЛИ БТ |
ХИМИЧЕСКИЙ |
|
МОДИФИКАЦИЯ |
СИНТЕЗ |
|
ПРИРОДНЫХ |
|
|
АНТИБИОТИКОВ |
|
Антибиотики продуцируются плесневыми грибами, актиномицетами, эубактериями и другими микроорганизмами.
Антибиотик Продуцент
Пенициллин Penicillium chrysogenum, P. notatum
Цефалоспорин Cephalosporum acremonium
Стрептомицин Streptomyces globisporus streptomycini
Эритромицин S. erythreus
Тетрациклин S. aureofaciens, S. rimosus
Один и тот же вид МО может синтезировать несколько АБ. Например, Streptomyces griseus синтезирует более 50 антибиотиков.
Варианты биотехнологического получения природных и полусинтетических антибиотиков:
Прямая ферментация микроорганизма-продуцента с веществом, являющимся метаболическим предшественником получаемого антибиотика и стимулирующим процесс его биосинтеза.
БП – фенилуксусная кислота; макролиды, макролиды – пропионовая кислота и пропиловый спирт.
Использование для биосинтеза антибиотиков микроорганизмов-мутантов, у которых блокированы определённые ферменты, участвующие в синтезе антибиотика
Стадии биотехнологического получения АБ |
МЕТОДЫ ОЦЕНКИ КАЧЕСТВА |
|||
|
|
|
||
Накопление |
Ферментер для |
|
АНТИБИОТИКОВ |
|
биомассы |
роста культуры |
|
МЕТОДЫ |
СПЕКТРОМЕТРИЧЕСКИЕ |
|
|
|
||
|
|
|
|
|
Активный |
Биореактор |
|
КОНТРОЛЯ |
|
биосинтез |
|
КАЧЕСТВА |
ХРОМАТОГРАФИЧЕСКИЕ |
|
|
|
|||
Выделение |
Экстракция |
|
|
|
Сорбция |
|
|
|
|
и очистка |
|
|
БИОЛОГИЧЕСКИЕ |
|
Осаждение и ПК |
|
|
||
антибиотика |
|
|
||
ИОХ |
|
|
|
|
|
|
|
|
|
Лиофильная |
|
|
ДРУГИЕ |
ХИМИЧЕСКИЕ |
сушка |
|
|
|
|
|
|
2011/2012 |
|
|
3

Жерносек А.К. Лекции по фармацевтической химии (ст)
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ |
|
|
АНТИБИОТИКОВ МИКРОБИОЛОГИЧЕСКИМ |
||
МЕТОДОМ |
|
|
Активность АБ определяют путем |
Т 1. |
|
сравнения степени угнетения роста |
||
чувствительных МО под действием |
2.7.2 |
|
испытуемого АБ и стандартного |
|
|
образца в известных концентрациях. |
|
|
МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ КО АБ |
|
|
МЕТОД ДИФФУЗИИ |
МЕТОД ТУРБИДИМЕТРИИ |
|
Метод диффузии
 Проводят на твёрдых средах.
Проводят на твёрдых средах.
 Среды засевают определённым количеством указанных в НД тест-МО.
Среды засевают определённым количеством указанных в НД тест-МО.  На поверхность среды наносится раствор исследуемого АБ и стандартного образца.
На поверхность среды наносится раствор исследуемого АБ и стандартного образца.
 После инкубирования в течение определённого времени измеряют диаметр зон угнетения роста тест-МО, вызванного исследуемым антибиотиком и ГСО.
После инкубирования в течение определённого времени измеряют диаметр зон угнетения роста тест-МО, вызванного исследуемым антибиотиком и ГСО.
Турбидиметрический метод
 С помощью растворителя и буферного раствора,
С помощью растворителя и буферного раствора,
указанных в ГФ РБ, готовят растворы стандартного образца и испытуемого АБ, имеющие известные концентрации и предположительно равные активности.
 Помещают равные объемы каждого из растворов в
Помещают равные объемы каждого из растворов в
идентичные пробирки и добавляют в каждую пробирку равные объемы инокулированной среды (например, 1 мл раствора и 9 мл среды).
 По окончании инкубации рост микроорганизмов
По окончании инкубации рост микроорганизмов
останавливают добавлением 0,5 мл раствора формальдегида в каждую пробирку или тепловой обработкой и измеряют степень мутности.
БЕТА-ЛАКТАМНЫЕ АНТИБИОТИКИ
ОБЩАЯ ХАРАКТЕРИСТИКА
Бета-лактамиды – антибиотики, содержащие в молекуле -лактамный цикл
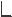 NH азетидин-2-он
NH азетидин-2-он
O
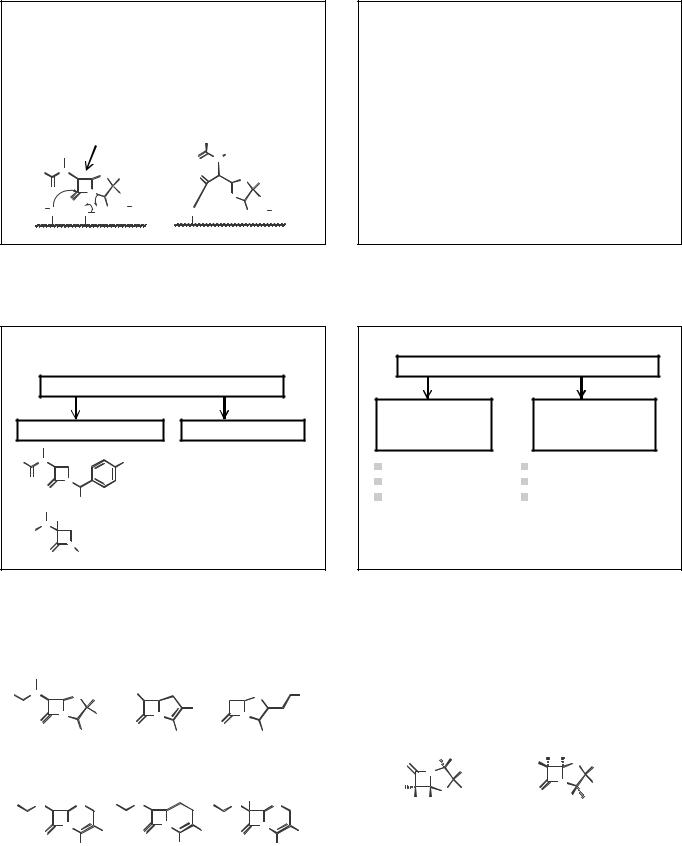
Все бета-лактамные АБ являются гидрофильными веществами. Они проникают в клетки бактерий через пориновые каналы внешней мембраны и связываются с ПСБ, расположенными на внутренней мембране бактериальной клетки.
Для характеристики количественного содержания действующего вещества в образце АБ, кроме обычных параметров используют единицы действия (ЕД).
Единицей действия называется минимальная масса АБ, которая подавляет развитие тест-
микроорганизма в определённом объёме питательной среды.
Обычно 1 ЕД соответствует 1 мкг чистого АБ (стрептомицин, тетрациклин), но 1 ЕД натриевой соли бензилпенициллина соответствует 0,5958 мкг данного вещества
внутренняя внешняя
мембрана мембрана
|
клеточная |
ПСБ |
стенка |
|
|
ПСБ |
-лактамный |
|
цитоплазма АБ
 ПСБ
ПСБ 
периплазма
2011/2012
4
Жерносек А.К. Лекции по фармацевтической химии (ст)
Связывание АБ с ПСБ происходит вследствие сродства беталактамной структуры к активному центру ПСБ. В процессе связывания происходит раскрытие БЛК. Для проявления антибактериальной активности в молекуле АБ должен присутствовать БЛК, способный раскрываться в процессе связывания вещества с ПСБ.
|
Похож на |
|
|
|
||
|
D-Ala-D-Ala |
|
R |
|
||
H |
|
|
|
O |
N H |
|
R N |
|
S |
CH3 |
O |
S |
CH3 |
|
|
|||||
O |
N |
|
|
|||
|
CH3 |
|
N |
CH3 |
||
O |
|
|
|
|||
O |
B H COO |
O |
COO |
|||
Ингибирование транспептидазы приводит к нарушению образования клеточной стенки и разрушению бактерий вследствие высокого осмотического давления внутри бактериальной клетки.
Бета-лактамные антибиотики обладают бактерицидным действием.
КЛАССИФИКАЦИЯ |
|
||
|
БЕТА-ЛАКТАМНЫЕ АНТИБИОТИКИ |
||
МОНОЦИКЛИЧЕСКИЕ |
БИЦИКЛИЧЕСКИЕ |
||
|
H |
|
|
R |
N |
OH |
|
O O |
N |
|
|
|
H |
COOH |
|
|
R2 |
|
|
R1 |
N |
N SO3H |
|
|
O |
|
|
БИЦИКЛИЧЕСКИЕ БЕТА-ЛАКТАМИДЫ |
|
СОДЕРЖАЩИЕ |
СОДЕРЖАЩИЕ |
ПЯТИЧЛЕННЫЙ |
ШЕСТИЧЛЕННЫЙ |
ЦИКЛ |
ЦИКЛ |
тиазолидиновый |
дигидротиазиновый |
пиразолидиновый |
дигидропиридиновый |
оксазолидиновый |
дигидрооксазиновый |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПЕНИЦИЛЛИНЫ |
|
|
|
|
|
|
|
||||||||||
R |
|
|
|
N |
|
|
|
|
S |
CH3 |
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
|
|
|
|
O |
|
OH |
|
Пенициллины (пенамы) – бета-лактамные |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
O |
|
|
N |
CH3 |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
антибиотики, являющиеся производными 6- |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
O |
|
|
|
|
COOH |
|
|
O |
|
|
|
|
COOH |
O |
|
COOH |
|
|
|
аминопенициллановой кислоты. |
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
H |
COOH |
H2N |
H H |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
1 |
2 |
CH3 |
|
|
|
S |
CH |
3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
N |
|
|||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H2N |
|
6 |
|
5 S4 |
CH3 или |
O |
|
|
CH3 |
||||||||||
R1 |
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OCH3 O |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
H |
COOH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
N |
|
|
|
|
S |
|
|
N |
|
|
|
|
|
|
R1 |
|
|
|
|
N |
|
|
|
|
H H |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
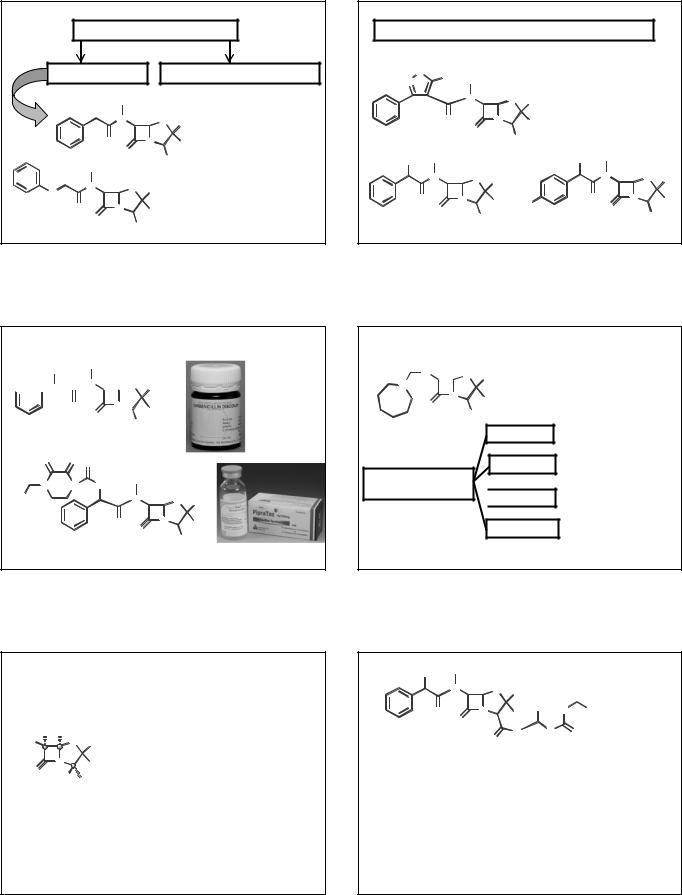
(2S, 5R, 6R)-6-амино-3,3-диметил-7-оксо-4-тиа-1- |
|
||||||||||||
|
|
O O |
|
|
|
N |
R2 |
O O |
|
|
N |
|
|
R2 |
O O |
|
N |
R2 |
|
азабицикло[3.2.0]гептан-2-карбоновая кислота |
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
В современных фармакопеях принята нумерация, |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
начинающаяся от атома азота! |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2011/2012
5
Жерносек А.К. Лекции по фармацевтической химии (ст)
|
|
ПЕНИЦИЛЛИНЫ |
||
ПРИРОДНЫЕ |
ПОЛУСИНТЕТИЧЕСКИЕ |
|||
|
|
H |
|
|
|
|
N |
S |
CH3 |
|
|
O O |
N |
CH3 |
|
H |
|
COOH |
|
|
|
|
|
|
O |
N |
S |
CH3 |
|
|
|
|||
|
O O |
N |
CH3 |
|
|
|
COOH |
|
|
ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЛИНЫ |
|
||||||
Изоксазолпенициллины |
|
|
|
|
|
||
N O |
CH3 H |
|
|
|
|
|
|
|
N |
S |
CH3 |
|
|
|
|
|
O |
N |
CH3 |
|
|
|
|
|
O |
|
|
|
|
|
|
Аминопенициллины COOH |
NH2 |
H |
|
|
|||
NH2 H |
|
|
|
|
|
||
N |
S |
CH3 |
|
|
N |
S |
CH3 |
|
|
|
|||||
O O |
N |
CH3 HO |
O |
O |
N |
CH3 |
|
|
COOH |
|
|
|
COOH |
||
Карбоксипенициллины
COOH H


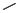 N
N

 S CH3
S CH3
O O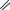
 N
N COOHCH3
COOHCH3
Уреидопенициллины
O |
O O |
|
|
|
N |
N NH H |
|
|
|
H3C |
|
N |
|
S CH3 |
|
O |
O |
N |
CH3 |
|
|
|
||
|
|
|
|
COOH |
Связь структуры и действия |
||||||
6-АПК можно рассматривать как дипептид, |
||||||
образованный ЦИС и СЕР или ЦИС и ВАЛ. |
||||||
H2N H H S4 |
CH |
В молекуле 3 центра хиральности. |
||||
|
6 |
5 |
|
3 |
3 |
|
O |
7 |
N |
2 |
CH |
3 |
Атом С обязательно R. |
|
1 |
|
|
5 |
||
|
|
H |
COOH |
|
||
Положение С2
Удаление или модификация -COOH резко снижает антибактериальную активность. Сложные эфиры могут быть использованы в качестве «пролекарств». Они не обладают фармакологической активностью, но хорошо всасываются в кровь из ЖКТ, где затем гидролизуются с образованием активного АБ.
Амидинопенициллины
N
 N
N

 S CH3
S CH3
O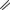
 N CH3
N CH3
COOH
ПЕРВОЕ
ВТОРОЕ
ПОКОЛЕНИЯ ПЕНИЦИЛЛИНОВ  ТРЕТЬЕ
ТРЕТЬЕ
ЧЕТВЁРТОЕ
NH2 |
H |
|
|
|
|
|
N |
S |
CH3 |
CH3 O |
|
O |
O |
N |
CH3 |
CH3 |
|
|
|
O |
|
||
|
|
O |
O |
O |
|
|
|
|
|
|
Положение С3
Удаление метильных групп снижает активность в отношении Гр+ и не влияет на активность в отношении Гр-. Образование ацетоксиметильных производных значительно уменьшает антибактериальную активность
2011/2012
6
Жерносек А.К. Лекции по фармацевтической химии (ст)
Положение S4 |
|
Положение С |
|
|
6 |
Образование сульфоксидов уменьшает |
|
Модификация приводит к образованию ПС |
антибактериальную активность. Диоксиды (например, |
|
пенициллинов. Получено более 20 тысяч таких |
сульбактам) являются необратимыми ингибиторами - |
|
соединений, из которых около 40 используются |
лактамаз. |
|
(…лись) в качестве ЛС. ПС пенициллины превосходят |
Положение С5 |
|
природные по различным характеристикам |
|
карбоксипенициллины и изоксазолпенициллины |
|
Любые модификации данного положения приводят к |
|
более устойчивы к действию -лактамаз, так как |
полной утрате антибактериальной активности. Это |
|
являются их конкурентными ингибиторами; |
связано с увеличением прочности амидной связи в |
|
аминопенициллины – обладают повышенной |
-лактамном кольце и стерическими препятствиями |
|
кислотоустойчивостью и могут применяться per os; |
взаимодействию молекулы пенициллина с ПСБ. |
|
уреидопенициллины – активны в отношении СГП; |
|
|
амидинопенициллины – действуют на Гркишечной |
|
|
группы. |
|
|
|
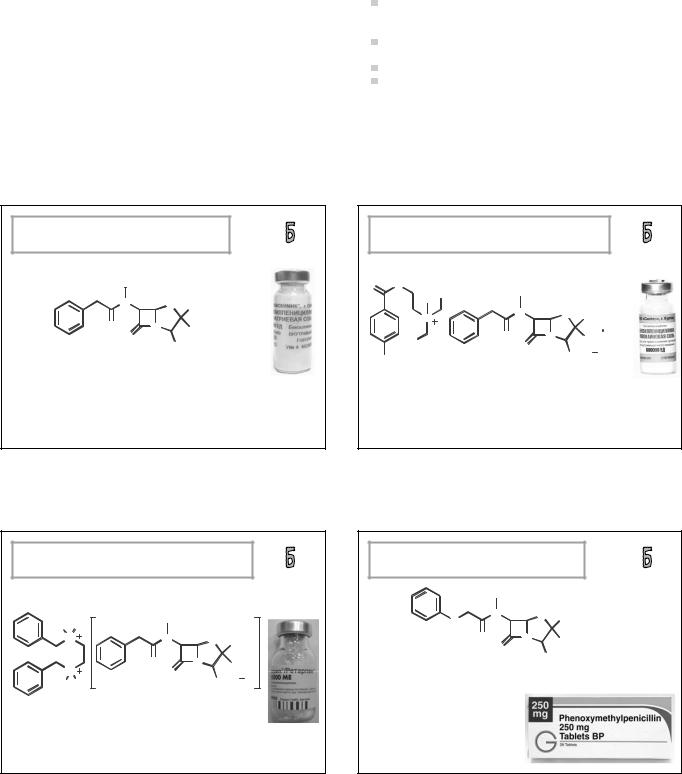
БЕНЗИЛПЕНИЦИЛЛИН НАТРИЯ |
ПРОКАИНА БЕНЗИЛПЕНИЦИЛЛИН |
(BENZYLPENICILLIN SODIUM) |
(PROCAINE BENZYLPENICILLIN) |
Бензилпенициллина натриевая соль |
|
Бензилпенициллина новокаиновая соль |
||||||||||||
H |
|
|
|
|
|
O |
O |
|
CH3 |
|
H |
|
|
|
N |
S |
CH3 |
|
|
|
|
|
H |
|
|
|
|
||
|
|
|
|
|
|
|
N |
|
S |
CH3 |
||||
O |
N |
CH3 |
|
|
|
|
|
N |
|
|
|
|||
|
|
|
|
H3C |
|
|
O |
|
N |
|
H2O |
|||
O |
COONa |
|
|
|
|
|
O |
|
CH3 |
|||||
натрия (2S,5R,6R)-3,3-диметил-7-оксо-6- |
|
|
|
|
NH2 |
|
|
|
|
|
COO |
|||
[(фенилацетил)амино] -4-тиа-1-азабицикло[3.2.0] |
|
2-(диэтиламино)этил 4-аминобензоата (2S,5R,6R)-3,3- |
||||||||||||
гептан-2-карбоксилат |
|
|
|
|
|
диметил-7-оксо-6-[(фенилацетил)амино] -4-тиа-1- |
||||||||
Порошок для приготовления раствора для |
азабицикло[3.2.0]гептан-2-карбоксилат |
|
|
|||||||||||
инъекций по 500000 и 1000000 ЕД. |
|
Порошок для приготовления раствора для |
||||||||||||
|
|
|
|
|
|
инъекций по 600000 ЕД. |
|
|
|
|||||
БЕНЗАТИНА БЕНЗИЛПЕНИЦИЛЛИН |
|
ФЕНОКСИМЕТИЛПЕНИЦИЛЛИН |
|
|||||||||||
(BENZATHINE BENZYLPENICILLIN) |
|
(PHENOXYMETHYLPENICILLIN) |
|
|||||||||||
Бензилпенициллина |
|
|
|
РЕТАРПЕН |
|
|
|
|
H |
|
|
|
|
|
бензатиновая соль |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
N |
|
S |
|
|
|
H H |
H |
|
|
|
|
|
|
|
O |
|
CH3 |
|
||
|
|
|
|
|
|
|
|
|
|
|
||||
N |
N |
|
S |
CH3 |
|
|
|
|
O |
O |
N |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
N |
O O |
N |
|
CH3 |
|
|
|
|
|
|
|
COOH |
|
|
|
|
(2S,5R,6R)-3,3-диметил-7-оксо-6-[(феноксиацетил)амино]- |
||||||||||||
H H |
|
|
COO |
2 |
4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновая кислота |
|||||||||
Соединение (1:2) N,N’-дибензилэтан-1,2-диамина с |
|
Таблетки по 100 и |
|
|
|
|
|
|||||||
(2S,5R,6R)-3,3-диметил-7-оксо-6-[(фенилацетил)амино] |
250 мг; порошок для |
|
|
|
|
|||||||||
-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислотой |
приготовления |
|
|
|
|
|
||||||||
Порошок для приготовления суспензии |
|
|
|
|
|
|||||||||
суспензии. |
|
|
|
|
|
|||||||||
для в/м введения по 2400000 ЕД. |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
2011/2012 |
|
|
|
|
|
|
|
|
7
Жерносек А.К. Лекции по фармацевтической химии (ст)
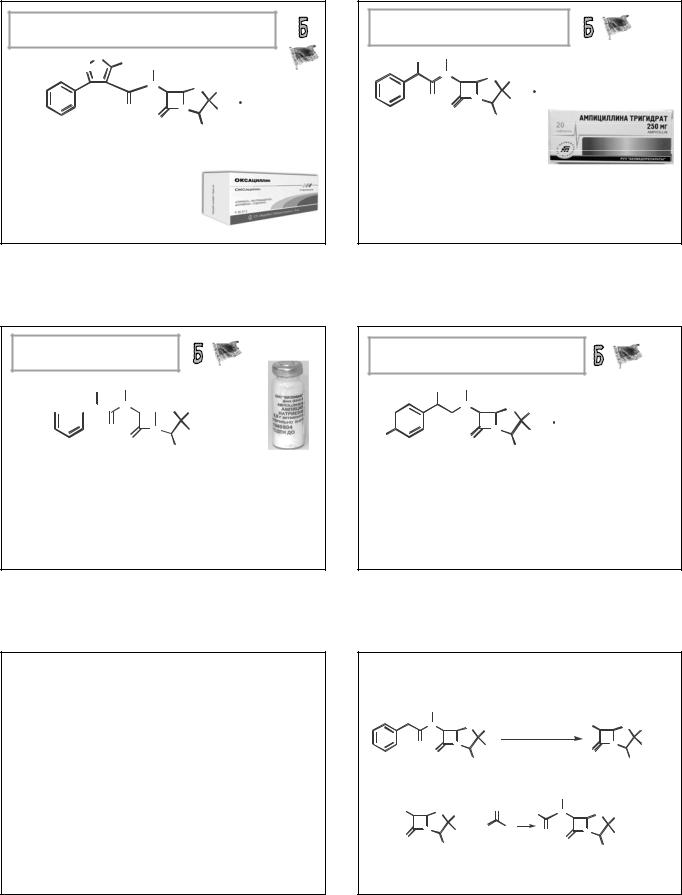
ОКСАЦИЛЛИНА НАТРИЯ МОНОГИДРАТ |
|||||
(OXACILLIN SODIUM MONOHYDRATE) |
|||||
N O |
CH3 H |
|
|
|
|
|
N |
|
S |
CH3 |
H2O |
|
O |
N |
|
CH3 |
|
|
O |
|
|
|
|
|
|
|
COONa |
|
|
натрия (2S,5R,6R)-3,3-диметил-7-оксо-6-[[(5-метил-3-фенил-4- |
|||||
изоксазолил)карбонил]амино]-4-тиа-1-азабицикло[3.2.0]гептан-2- |
|||||
карбоксилат |
|
|
|
|
|
Порошок для приготовления |
|
|
|
||
раствора для инъекций по |
|
|
|
|
|
250, 500 и 1000 мг; ЛС с |
|
|
|
|
|
ампициллином. |
|
|
|
|
|
АМПИЦИЛЛИНА ТРИГИДРАТ
(AMPICILLIN TRIHYDRATE)
NH2 H |
|
|
|
|
N |
S |
CH3 |
3H2O |
|
O O |
N |
CH3 |
||
|
||||
|
COOH |
|
||
(2S,5R,6R)-6-[[(2R)-2-амино-2-
фенилацетил]амино]-3,3-диметил-7- оксо-4-тиа-1-азабицикло[3.2.0]гептан- 2-карбоновой кислоты тригидрат
Таблетки по 250 мг; капсулы, содержащие по 125 мг ампициллина ТГ и оксациллина.
АМПИЦИЛЛИН НАТРИЯ
(AMPICILLIN SODIUM)
NH2 H


 N
N

 S CH3
S CH3
O O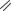
 N
N
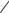
 CH3 COONa
CH3 COONa
натрия (2S,5R,6R)-6-[[(2R)-2-амино-2-фенилацетил]амино]-3,3-
диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоксилат
Порошок для приготовления раствора для инъекций по 1000 и 2000 мг; вместе с оксациллином натрия – ОКСАМП-НАТРИЙ; вместе с сульбактамом натрия –
АМПИСУЛЬБИН-КМП, СУЛЬТАСИН.
АМОКСИЦИЛЛИНА ТРИГИДРАТ
(AMOXICILLIN TRIHYDRATE)
|
|
|
NH2 |
H |
|
|
|
|
АМОКСИКАР |
|||||
|
|
|
|
|
|
N |
S CH3 |
|
|
|
АМОСИН |
|||
|
|
|
|
|
|
|
|
|
|
|
3H |
2 |
O |
АМОКСИЛ |
HO |
|
|
O |
|
|
|
N |
CH3 |
|
|
ОСПАМОКС |
|||
|
|
|
|
|
O |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
(2S,5R,6R)-6-[[(2R)-2-амино-2-(4-гидроксифенил)ацетилl]амино]- 3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты тригидрат
Таблетки ПО по 250, 500 и 1000 мг; капсулы по 250 и 500 мг; порошок для приготовления суспензии для приёма внутрь по 125 мг/5 мл и 250 мг/5 мл; таблетки и порошок для приготовления суспензии для приёма внутрь с клавулановой кислотой (см. далее)
Природные пенициллины получают путём |
|
||||||||
биосинтеза. Бóльшая часть бензилпенициллина |
|
||||||||
используется для получения ПС пенициллинов. |
|||||||||
|
H |
|
|
|
|
|
|
|
|
CПОСОБЫ ПОЛУЧЕНИЯ |
N |
S |
CH |
|
-C6H5CH2COOH |
H2N |
S |
CH |
|
O |
N |
|
|
N |
|||||
ПЕНИЦИЛЛИНОВ |
|
|
CH3 |
амидаза E.coli |
|
|
CH3 |
||
|
COOH |
|
|
|
COOH |
||||
|
O |
|
|
3 |
|
|
O |
|
3 |
ПС пенициллины получают взаимодействием 6-АПК и |
|||||||||
хлорангидридов соответствующих кислот |
|
|
|||||||
H2N |
|
|
O |
|
H |
|
|
|
|
S |
CH3 |
R |
N |
|
S CH3 |
|
|||
+ R |
|
|
|
||||||
O |
N |
CH3 |
|
Cl |
O O |
N |
CH3 |
+ HCl |
|
|
COOH |
|
|
|
|
|
COOH |
|
|
Некоторые ПС пенициллины (АМП,АМО) получают |
|||||||||
БТ способом без выделения 6-АПК из культуральной |
|||||||||
жидкости |
|
|
|
|
|
|
|
|
|
2011/2012 |
|
|
|
|
|
|
|
|
|
8
Жерносек А.К. Лекции по фармацевтической химии (ст)
Физико-химические и химико-аналитические свойства
1. Внешний вид и растворимость
Пенициллины представляют собой твёрдые вещества белого цвета (табл. 1). Растворимость в воде и других растворителях зависит от того, в какой форме (кислотной или солевой) находится вещество и от природы катиона, входящего в состав солевой формы.
Таблица 1
Физические свойства лекарственных веществ группы пенициллинов
Вещество |
Внешний |
|
Растворимость |
|
|||
вода |
этанол |
другие |
|||||
|
|
вид |
|||||
|
|
|
|
|
|
||
БП |
натрие- |
белый или |
очень |
растворим |
практически нерастворим в |
||
вая соль |
почти белый |
легко |
|
хлороформе, эфире, жирных |
|||
|
|
КП |
|
|
маслах и жидком парафине |
||
БП |
новокаи- |
белый КП |
1:250 |
1:30 |
хлороформ 1:60 |
|
|
новая соль |
|
|
|
|
|
||
Бензатина |
белый поро- |
1:5000 |
1:65 |
легко в формамиде и диме- |
|||
БП |
|
шок |
|
|
тилформамиде, |
практически |
|
|
|
|
|
|
нерастворим в хлороформе |
||
ФМП |
белый КП, |
1:1700 |
1:7 |
растворим в хлороформе, |
|||
|
|
слегка гиг- |
|
|
практически нерастворим в |
||
|
|
роскопичен |
|
|
эфире и бензоле |
||
АМП |
белый КП |
1:150 |
практиче- |
практически нерастворим в |
|||
тригидрат |
|
|
ски нерас- |
хлороформе, эфире и жир- |
|||
|
|
|
|
творим |
ных маслах, растворим в |
||
|
|
|
|
|
растворах кислот и щелочей |
||
АМП |
Белый поро- |
1:2 |
образует |
умеренно в ацетоне, мало в |
|||
натриевая |
шок, гигро- |
|
гель |
хлороформе, |
практически |
||
соль |
|
скопичен |
|
|
нерастворим в эфире, жир- |
||
|
|
|
|
|
ных маслах и жидком пара- |
||
|
|
|
|
|
фине, |
|
|
АМО |
белый или |
1:400 |
1:1000 |
в метаноле 1:200, практиче- |
|||
тригидрат |
почти белый |
|
|
ски нерастворим в хлоро- |
|||
|
|
КП |
|
|
форме и эфире, растворим в |
||
|
|
|
|
|
растворах кислот и щелочей |
||
АМО |
белый или |
> 1:1 |
умеренно |
очень мало в ацетоне |
|||
натриевая |
почти белый |
|
|
|
|
||
соль |
|
порошок, |
|
|
|
|
|
|
|
очень гигро- |
|
|
|
|
|
|
|
скопичен |
|
|
|
|
|
ОЦ |
|
белый КП |
легко |
умеренно |
мало в хлороформе, практи- |
||
натриевая |
|
|
|
чески нерастворим в ацето- |
|||
соль |
|
|
|
|
не, бензоле и эфире |
||
9
2011/2012
Жерносек А.К. Лекции по фармацевтической химии (ст)
Кислотные формы пенициллинов незначительно растворимы в воде и применяются в виде таблеток или суспензий. Солевые формы (за исключением новокаиновой и бензатиновой солей пенициллина) легко или очень легко растворимы в воде и выпускаются в виде порошков для приготовления растворов для инъекций. Бензатиновая соль пенициллина очень мало растворима в воде и вводится внутримышечно в виде суспензии. Она медленно всасывается из места введения, что обеспечивает пролонгированное действие лекарственного вещества (вводится 1 раз в неделю).
2. Спектральные свойства
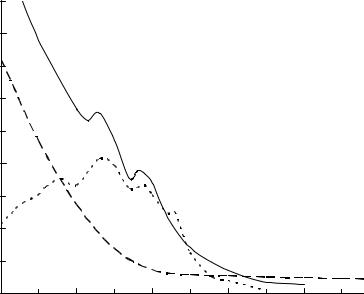
Поглощение УФ-излучения. Пенициллины поглощают, хотя и не слишком интенсивно электромагнитное излучение ближнего УФдиапазона. Спектры поглощения пенициллинов в УФ-области можно рассматривать как сумму спектров поглощения 6-АПК и ацильного остатка. На рис. 1 показаны спектры поглощения натриевой соли бензилпенициллина, 6-АПК и фенилуксусной кислоты. 6-АПК не имеет максимумов в рассматриваемом диапазоне длин волн, в то время как фенилуксусная кислота имеют несколько максимумов, связанных с поглощением бензольного кольца.
|
|
|
|
|
|
400 |
1 |
|
|
|
|
|
|
|
|
|
|
200 |
2 |
3 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
0 |
|
|
|
|
|
245 |
255 |
265 |
275 |
285 |
, нм |
Рис. 1. Спектры поглощения водных растворов натриевой соли БП (1), |
|||||
6-АПК (2) и раствора фенилуксусной кислоты в 5% растворе NaHCO3 (3) |
|||||
10
2011/2012
