
Лекции
.docВ 1822 г. было обнаружено, что электрон обладает собственным механическим моментом импульса, который не связан с орбитальным движением. Этот собственный момент назвали спином. Спин электрона и всех других микрочастиц квантуется. s (ms) – спиновое квантовое число.
![]() (27)
(27)
По аналогии с орбитальным моментом
проекция спина квантуется так, что![]() может принимать 2s+1
положение в атоме. Впоследствии выяснили,
что
может принимать 2s+1
положение в атоме. Впоследствии выяснили,
что
![]() в атоме может иметь только два положения,
т.е. 2s+1=2, тогда s = + ½
и определяет возможные значения
проекции спина на направление Z.
в атоме может иметь только два положения,
т.е. 2s+1=2, тогда s = + ½
и определяет возможные значения
проекции спина на направление Z.
Ls,z= ħs (28)
Т.о. всего оказалось четыре квантовых числа, что увеличивает число состояний электрона с одним и тем же значением En до 2n2.
Сравнение показывает, что квантовая механика приводит к тем же результатам и выводам, что и теория Бора. Но в теории Бора эти результаты просто постулировались. В квантовой механике они получены логическим путем из основного управления.
Согласно квантовой механике, каждому энергетическому состоянию соответствуют волновые функции, квадрат модуля которых определяет вероятность нахождения электрона в объеме ∆V, а произведение е|ψ|2 среднее значение плотности заряда в этом элементе объема. Т. к. вероятность обнаружения электрона в различных частях атома разная, то и электронная плотность распределяется вокруг ядра атома неравномерно, т. е. электрон как бы размазывается по всему объему атома, образуя электронное облако. Причем, размер и форма электронного облака определяется квантовыми числами n и l, а его ориентацию в пространстве характеризует квантовое число – ml.
ОПТИЧЕСКИЕ АТОМНЫЕ СПЕКТРЫ. МОЛЕКУЛЯРНЫЕ СПЕКТРЫ.
Атомы и молекулы находятся в общем случае в стационарных энергетических состояния, когда они не излучают и не поглощают энергию. Состояние соответствующее самому низкому энергетическому уровню называется основным, все остальные возбужденными. Переходы атомов и молекул из одного состояния в другое совершаются скачком , причем, при переходе с более высокого уровня на нижний энергия излучается, а при обратном – поглощается. Атом в основном состоянии способен только поглощать.
Различают два типа квантовых переходов:
-
без излучения или поглощения электромагнитного излучения. Это происходит при взаимодействии частиц. При этом, либо изменяется внутреннее состояние (новые l и ml), либо изменяется кинетическая энергия частиц (упругое сталкновение), но сохраняется внутреннее состояние.
-
С излучением или с поглощением фотона. Энергия фотона определяется как разность энергий начального (i) и конечного (k) стационарных состояний атомов или молекул
ε = hv = E2 – Ek (1)
В зависимости от причин, вызывающих излучающий квантовый переход, различают спонтанное (самопроизвольное) и индуцированное (вынужденное) излучение.
Спонтанное излучение имеет место при переходе частицы из возбужденного состояния на более низкий уровень без каких либо внешних воздействий. Оно случайно и хаотично по времени, частоте, направлению и поляризации.
Индуцированное излучение возникает при взаимодействии фотона hvn c возбужденной частицей, если для нее существует возможность квантового перехода между уровнями, разность энергий которых Ев- Ен = hv равна энергии пролетающего фотона hvn = hv . Т.о. появляется другой фотон с такой же частотой, направлением распространения и поляризацией.
Если энергетические изменения в квантовой системе невелики, то это связано с переходами валентных электронов. Частоты излучения при этом соответствуют оптическому диапазону, т.е. области видимого, инфракрасного или ультрафиолетового излучения. Переходы между уровнями внутренних слоев соответствуют более высоким частотам, т.е. дальнему ультрафиолету и рентгеновскому излучению.
Квантовые переходы происходят не между любыми энергетическими уровнями. В квантовой механике вводятся правила отбора, которые определяют возможные переходы. Так для водородоподобных атомов правила отбора гласят: осуществляются только такие переходы, для которых:
-
изменение орбитального квантового числа Δl = ±1
-
изменение магнитного квантового числа Δme = 0,±1
Для примера рассмотрим оптические спектры атома водорода:
 серия Лаймана np
1s n = 2,3,4…
серия Лаймана np
1s n = 2,3,4…
 cерия Бальмера np
2s n
= 3,4.5…
cерия Бальмера np
2s n
= 3,4.5…
 ns
2p
ns
2p
 nd
2p
nd
2p
 серия Пашена nf
3d n = 4, 5,
6…
серия Пашена nf
3d n = 4, 5,
6…
 серия Брекета ng
4f n = 5,
6, 7…
серия Брекета ng
4f n = 5,
6, 7…
Для поглощения это 1s → np. n = 5, 6, 7…
Структура энергетических уровней, а значит и спектров многоэлектронных атомов и молекул достаточно сложна. Она зависит не только от строения одиночных атомов и молекул но и от внешних условий. Особенно сложными являются спектры молекул. При соединении атомов в молекулы изменяется конфигурация оболочки с валентными электронами, а в твердых телах образуются энергетические зоны. Это приводит к возрастанию числа возможных переходов и соответствующих им спектральных линий.
Кроме уровней (Ее) связанных с переходами электронов у молекул появляются уровни обусловленные колебаниями ядер атомов, образующих молекулу, около положения равновесия (Еклб) и уровни вращательного движения молекулы как целого (Евр). Энергия этих видов движения тоже квантуется, т.е. принимает только определенные значения. Т.к.
Емол = Ее + Еколб + Евр , (2)
то молекулярные спектры состоят из трех компонентов. Энергетические расстояния между электронными уровнями составляют несколько электрон-вольт; между соседними колебательными уровнями ~ 10-2 - 10-1эВ и для вращательных эта разность составляет всего 10-5-10-3 эВ, т.е. Евр << Eклб << Ee . Все это приводит к тому, что молекулярные спектры:
-
состоят из полос, каждая из которых представляет собой совокупность большого числа тесно расположенных близких по длине волны линий.
-
занимают широкий диапазон электромагнитного излучения, причем переходы между вращательными и колебательными уровнями относятся к инфракрасному излучению, а электронные к видимому и ультрафиолетовому.
Рассмотренное нами ранее комбинационное рассеяние связано с переходами молекул между различными колебательными и вращательными уровнями.
Различают три основных типа спектров:
-
линейчатые – состоят из ряда резко очерченных цветных линий на черном фоне, каждой из которых соответствует определенная длина волны, источник – невзаимодействующие друг с другом атомы (разреженные одноатомные газы, инертные газы, пары металлов).
-
полосатые – состоят из групп очень близко расположенных одноцветных линий на темном фоне, источник – отдельные молекулы (разреженные многоатомные газы).
-
сплошные – представляют собой радужную полоску или часть ее, в которой цвета плавно переходят друг в друга, т.е. сплошной спектр образован непрерывным интервалом длин волн, источник – совокупность многих взаимодействующих молекулярных или атомных ионов (твердые и жидкие тела, сжатые газы).
Спектры являются источником различной информации о веществе. По виду спектра можно идентифицировать атомы и молекулы – качественный анализ. По интенсивности спектральных линий определяют количество излучающих или поглощающих атомов – количественный анализ. При этом обнаруживаются примеси в концентрациях 10-5 –10-6 % . Для проведения спектрального анализа требуется всего несколько десятков микрограммов вещества.
По спектрам можно судить о строении атомов и молекул, структуре их энергетических уровней, подвижности отдельных частей больших молекул и многое другое.
Изучение спектров движущихся тел позволяет на основании оптического эффекта Доплера определить относительные скорости излучателя и приемника.
В зависимости от энергии (частоты) фотонов, испускаемых или поглощаемых атомами или молекулами, классифицируют следующие виды спектроскопии: радио, инфракрасная, видимого излучения, ультрафиолетовая и рентгеновская.
5.2. Понятие об индуцированном излучении света. Оптические квантовые генераторы (лазеры) и их применение. Люминесценция. Фотолюминесценция. Закон Стокса. Закон Вавилова. Люминесценция биологических систем. Люминесцентный анализ. Спектрофотометр, применение в фармации. Люминесцентные метки и зонды, их применение. Фотоэффект. Законы фотоэффекта. Полупроводниковые фотосопротивления и фотоэлементы. Фотоумножители.
Л Ю М И Н Е С Ц Е Н Ц И Я.
Тела испускают электромагнитное излучение не только в результате нагревания. Это может происходить и по другим причинам, например, при электрическом разряде в газах; некоторых кинетических процессах (гниение органических веществ, окислении фосфора); свечение светлячков и т.д. Если при этом испускаются волны оптического диапазона - то это явление люминесценции.
Люминесценция происходит одновременно с тепловым излучением и независимо от него. С.И. Вавилов определил явление люминесценции следующим образом: люминесценция есть излучение телом электромагнитных волн в оптическом диапазоне, представляющее собой избыток над тепловым излучением при данной температуре тела и имеющее длительность, значительно превышающую период колебаний световых волн (10-15с).
Последняя часть этого определения позволяет отделить люминесцентное излучение от других видов неравновесных избыточных над тепловым излучений.
Люминесценция, как и тепловое излучение, происходит в результате сообщения атому дополнительной энергии, из-за чего он переходит в возбужденное состояние. При возвращении атома в основное состояние испускается фотон. Однако люминесцентное излучение в отличие от теплового не может стать равновесным и прекращается, как только будет исчерпан запас энергии процесса, породившего люминесценцию.
Люминесценцию классифицируют:
А) по виду процессов, которые вызывают возбуждение атомов и молекул.
По этому признаку различают:
-
биолюминесценция – свечение в живых организмах (светлячки, бактерии, грибы);
-
электролюминесценция – свечение газов при электрическом разряде;
3. радиолюминесценция – возбуждение вызывается радиоактивным излучением;
4. хемилюминесценция – свечение при экзотермических химических реакциях;
5. фотолюминесценция - возбуждение вызывается коротковолновой частью оптического спектра и др. виды.
В) по длительности свечения
люминесценция делится на флуоресценцию, когда послесвечение длится до 10-3с, и фосфоресценцию, время послесвечения составляет от 10-3с до нескольких минут и даже часов.
С) по механизму элементарных процессов, протекающих в люминесцирующих атомах и молекулах.
1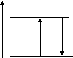 )
)
S*
E
hνпог hνизл
S0
При возбуждении атом или молекула, поглощая энергию, переходят с основного уровня S0, на возбужденный уровень S*, обратный переход с S* на S0 вызывает появление кванта люминесцентного излучения hνизл = hνпог , т.е. λизл= λ.пог Такой механизм имеет место в парах некоторых простых молекул (Hg, Na, Ca), а люминесценция называется резонансной. Такое свечение возникает через 10-8с после возбуждения и потому не является обычным рассеянием.
2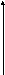 )
S3*
)
S3*

 Е
Е
S2*

hνпог hνизл
S0

В некоторых случаях атом или молекула, поглотившая энергию hνпог при взаимодействии с другими частицами передают им часть полученной энергии и переходят на возбужденный уровень S2*. Излучательный переход с S2* на S0 и образует люминесцентное свечение, которое теперь называется спонтанным. Переход с уровня S3* на уровень S2* не сопровождается испусканием кванта электромагнитного излучения и потому называется безизлучательным. Энергия этого перехода пополняет запас внутренней энергии тела.
3 )
)

 Е S3*
Е S3*
S2*

Sмст hv’ hvбез.изл
 hvпог
hvпог
hvизл
 S0
S0
У некоторых веществ имеются энергетические уровни, переход с которых в основное состояние маловероятен. Поэтому атомы, находящиеся на этом уровне в возбужденном состоянии могут существовать довольно долго. Такие уровни называются метастабильными. Ускорить переход в основное состояние можно сообщив атому дополнительную энергию, которая переводит атом на излучательный переход S2*. Такая люминесценция называется метастабильной (вынужденной или индуцированной). Многие органические вещества в качестве метастабильного имеют триплетный уровень (тиразин).
4) Рекомбинационная люминесценция – является результатом рекомбинационных процессов – электронов и дырок в полупроводниках, электронов и ионов в газах.
Вещества с особенно длительным послесвечением называются фосфорами. Вещества с высокой интенсивностью люминесценции называют люминофорами.
Особый интерес для медиков представляет фотолюминесценция, которая наблюдается у многих жидких и твердых тел, как неорганической, так и органической природы. Возбуждение атомов и молекул обычно вызывается ультрафиолетовой частью оптического диапазона. Спектры излучения при этом имеют для каждого вещества свой характерный вид. Как правило, люминесцентное излучение имеет большую длину волны, чем возбуждающее излучение. Это обстоятельство изложено в правиле Стокса:
При люминесценции спектр излучения в целом и его максимум сдвинуты по отношению к спектру поглощенного излучения в сторону более длинных волн (плакат с тирозином).
Если фотон поглощается уже возбужденным атомом или молекулой, то λлюм< λпогл. Такое излучение называется антистоксовым.
Не все фотоны, поглощенные веществом, вызывают вторичное свечение. Часть их расходует свою энергию на другие внутри молекулярные процессы, например, на увеличение скорости теплового движения. Количественно эту сторону процесса характеризуют величиной, называемой выходом люминесценции.
Квантовый выход – отношение числа квантов люминесцентного излучения к числу поглощаемых квантов за единицу времени :
![]() .
(3)
.
(3)
Вавилов установил: в интервале длин волн, вызывающих в данном веществе люминесценцию, число излучаемых квантов пропорционально числу поглощенных и не зависит от длины волны, т.е.: ηкв= соnst
Энергетический выход – отношение мощности люминесцентного излучения к мощности поглощенного:
![]() (4)
(4)
Выход люминесценции зависит от природы вещества, наличия примесей, температуры и некоторых других параметров и имеет величину от 1-2 % до 70-80 %.
Закон Вавилова: энергетический выход люминесценции сначала растет ~ λвозб , а затем, достигнув максимума, резко падает до нуля.
В медицинской практике явление фотолюминесценции используется при определении природы и состава веществ по цвету, а точнее по спектру его люминесцентного излучения, т.к. вещества обычно испускают не какую-то одну длину волны, а целые наборы длин волн, причем спектр люминесценции не зависит от λвозб . Этот метод называется люминесцентным анализом. Различают макроанализ, когда наблюдение ведут невооруженным глазом и микроанализ, когда спектр излучения исследуют с помощью спектроскопа.
Другие виды люминесценции используются при создании различного рода источников света, применяемых в физиотерапии и для освещения.
Фотолюминесценция наблюдается у многих жидких и твердых тел как неорганической так и органической природы Обычно при этом испускается несколько разных длин волн. Определение природы и состава вещества по спектру его люминесцентного излучения называется люминесцентным анализом. При благоприятных условиях такой анализ позволяют обнаружить вещество в количестве 10-10 г.
Различают качественный макроанализ, когда за люминесцентным излучением наблюдают визуально и микроанализ когда регистрируется не только цвет излучения, но и другие параметры люминесценции.
Макроанализ проводят для обнаружения начальной стадии порчи пищевых продуктов. Например, свежая рыба – не люминесцирует, слегка подпорченная – испускает голубое свечение, а сильно испорченная – желтое и красное. Эта методика используется в фармации для сортировки лекарственных препаратов, для диагностики некоторых грибковых заболеваний. Например, пораженные грибком волосы при их облучении УФИ дают ярко-зеленое свечение. Вообще под воздействием УФИ характерную флуоресценцию имеют многие биоткани (ногти, зубы, хрусталик и роговая оболочка глаза, опухоли и т. д.) и биоорганизмы (бактериальные и грибковые колонии, светлячки и др.). Проводят макроанализ с помощью флуориметра, осветитель которого представляет собой ртутную лампу со светофильтром, пропускающим только УФИ.
При микроанализе регистрируются такие основные параметры люминесценции как:
а) спектр излучения
б) спектр возбуждения
в) энергетический выход
г) время жизни молекул в возбужденном состоянии
д) степень поляризации
Параметры флуоресценции чувствительны к окружению флуоресцирующих молекул. Это позволяет по люминесцентному излучению судить о межмолекулярном взаимодействии, о химических превращениях, микровязкости клеточных мембран и т. д.
В последнее время широкое применение нашли методы флуоресцентных зондов и меток – искусственное внедрение флуоресцирующих молекул в белки и мембраны клеток. Зонд - -------. Метка - ------ .
Изменение флуоресценции зондов и меток позволяет обнаружить конформационные перестройки в белках и мембранах.
Метод люминесцентных меток используют для обнаружения в пробах наркотиков и витаминов С, Д, В, В2 и других веществ не обладающих собственной флуоресценцией.
Проводят микроанализ с помощью специальных люминесцентных микроскопов и спектрофлуориметров.
Микроскопы: осветитель - ртутная лампа и два светофильтра, один перед конденсором – выделяет спектр возбуждения, второй между объективом и окуляром – спектр люминесценции.
Оптическая схема спектрофлуориметра имеет вид:
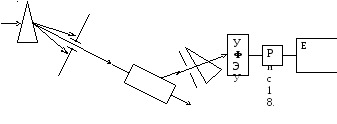
5.3. Рентгеновское излучение. Основные свойства. Тормозное и характеристическое рентгеновское излучение. Действие рентгеновского излучения на вещество. Рентгеноструктурный анализ. Электронный парамагнитный резонанс (ЭПР). Ядерный магнитный резонанс (ЯМР). применение ЭПР и ЯМР методов в исследовании биологических мембран.
РЕНТГЕНОВСКОЕ ИЗЛУЧЕНИЕ.
В 1895 г., исследуя катодные лучи, немецкий ученый Вильгельм Конрад Рентген обнаружил, что флуоресцирующий экран, поднесенный к установке, закрытой плотным непрозрачным для света чехлом, ярко вспыхивает. Был сделан вывод, что существует какое-то неизвестное излучение, для которого материал чехла является прозрачным. Это излучение Рентген назвал X-лучами.
И сследуя
причины появления этого излучения,
Рентген установил, что излучение
появляется в том месте, где пучок
ускоренных электрическим полем электронов
ударяется о стенку катодной трубки.
Исходя из этого обстоятельства, Рентген
сконструировал и построил первый
искусственный источник X-лучей
– рентгеновскую трубку, существенные
черты, конструкции которой сохранились
до наших дней. Трубка (рис. 1) представляет
собой стеклянный баллон с двумя впаянными
основными электродами: анодом А и
катодом К. Катод выполнен в виде спирали
из тугоплавкого металла (W,
Pt), через которую пропускают
ток. При этом, вследствие термоэлектронной
эмиссии, нагретая спираль испускает
электроны. Анод представляет собой
цилиндр, изготовленный из хорошо
проводящего тепло металла (Cu),
торец которого срезан под углом. В
скошенную поверхность торца впаяна
пластинка из тугоплавкого металла -
«зеркало» анода (W, Pt,
Cu и т.п.). В баллоне создается
высокое разряжение Р =10-6-10-7
мм.рт.ст. Между анодом и катодом приложено
высокое напряжение – 40÷200 кВ, а в некоторых
случаях даже до I000 кВ.
Электроны, испускаемые нитью накала,
ускоряются электрическим полем до
скоростей ~2·108 м/с. Фокусирующий
электрод формирует узкий пучок электронов
и направляет его на анод, который,
благодаря косому срезу, направляет
возникающее на «зеркале» рентгеновское
излучение в выходное окно трубки. К.п.д.
рентгеновской трубки составляет всего
1-5 %. Остальная энергия электронного
пучка превращается в процессе
взаимодействия с атомами «зеркала» во
внутреннюю энергию анода. По этой причине
анод приходится интенсивно охлаждать.
С этой целью тело анода часто изготавливают
полым для подвода охлаждающей жидкости
(вода или масло).
сследуя
причины появления этого излучения,
Рентген установил, что излучение
появляется в том месте, где пучок
ускоренных электрическим полем электронов
ударяется о стенку катодной трубки.
Исходя из этого обстоятельства, Рентген
сконструировал и построил первый
искусственный источник X-лучей
– рентгеновскую трубку, существенные
черты, конструкции которой сохранились
до наших дней. Трубка (рис. 1) представляет
собой стеклянный баллон с двумя впаянными
основными электродами: анодом А и
катодом К. Катод выполнен в виде спирали
из тугоплавкого металла (W,
Pt), через которую пропускают
ток. При этом, вследствие термоэлектронной
эмиссии, нагретая спираль испускает
электроны. Анод представляет собой
цилиндр, изготовленный из хорошо
проводящего тепло металла (Cu),
торец которого срезан под углом. В
скошенную поверхность торца впаяна
пластинка из тугоплавкого металла -
«зеркало» анода (W, Pt,
Cu и т.п.). В баллоне создается
высокое разряжение Р =10-6-10-7
мм.рт.ст. Между анодом и катодом приложено
высокое напряжение – 40÷200 кВ, а в некоторых
случаях даже до I000 кВ.
Электроны, испускаемые нитью накала,
ускоряются электрическим полем до
скоростей ~2·108 м/с. Фокусирующий
электрод формирует узкий пучок электронов
и направляет его на анод, который,
благодаря косому срезу, направляет
возникающее на «зеркале» рентгеновское
излучение в выходное окно трубки. К.п.д.
рентгеновской трубки составляет всего
1-5 %. Остальная энергия электронного
пучка превращается в процессе
взаимодействия с атомами «зеркала» во
внутреннюю энергию анода. По этой причине
анод приходится интенсивно охлаждать.
С этой целью тело анода часто изготавливают
полым для подвода охлаждающей жидкости
(вода или масло).
Уже первые опыты обнаружили целый ряд свойств рентгеновского излучения: X-лучи обладают значительной проникающей способностью; ионизируют вещество; засвечивают фотопленку и вызывают образование перекиси водорода в воде; вызывают явление люминесценции; влияют на характер протекание биологических процессов; распространяются прямолинейно и не отклоняются ни в электрическом, ни в магнитном полях.
В дальнейшем установили, что рентгеновское излучение представляет собой электромагнитные волны с длиной от 10-5 до 80 нм.
В природе рентгеновское излучение присутствует в космическом излучении, его испускает солнечная корона, а на земле практически все радиоактивные элементы.
По механизму возбуждения рентгеновское излучение подразделяется на тормозное и характеристическое.
ТОРМОЗНОЕ ИЗЛУЧЕНИЕ.
СПЕКТР ТОРМОЗНОГО РЕНТГЕНОВСКОГО ИЗЛУЧЕНИЯ
Образование тормозного излучения можно
объяснить с позиций электродинамики.
Рассмотрим пучок летящих электронов,
как некоторый ток, которой создает
вокруг себе магнитное поле с индукцией
![]() . На аноде электроны, взаимодействуя с
электронными оболочками атомов вещества,
испытывают сильное торможение, что
эквивалентно уменьшению силы тока, а
значит и магнитной индукции
. На аноде электроны, взаимодействуя с
электронными оболочками атомов вещества,
испытывают сильное торможение, что
эквивалентно уменьшению силы тока, а
значит и магнитной индукции
![]() .
В соответствии с теорией Максвелла это
приводит к появлению фотонов
электромагнитного излучения с энергией
εф = hν , которые и
уносят высвобождающуюся при торможении
электронов кинетическую энергию. До
«удара» об анод все электроны обладают
практически одинаковой энергией Ее
= еU, U
– ускоряющее напряжение (напряжение
между катодом и анодом). В редких случаях
электроны полностью останавливаются
при первом столкновении, и тогда вся
энергия идет на образование одного
кванта электромагнитного излучения:
.
В соответствии с теорией Максвелла это
приводит к появлению фотонов
электромагнитного излучения с энергией
εф = hν , которые и
уносят высвобождающуюся при торможении
электронов кинетическую энергию. До
«удара» об анод все электроны обладают
практически одинаковой энергией Ее
= еU, U
– ускоряющее напряжение (напряжение
между катодом и анодом). В редких случаях
электроны полностью останавливаются
при первом столкновении, и тогда вся
энергия идет на образование одного
кванта электромагнитного излучения:
Ее = εф; еU = hνк. (1)
В большинстве же случаев энергия электронов теряется в результате ряда последовательных столкновений с электронными оболочками разных атомов, превращаясь при этом в тепло или кванты электромагнитного излучения с частотой v меньшей, чем vк (v ≤ vк):
![]()
![]() (2)
(2)
Т.к. условия взаимодействия электронов с атомами анода могут быть самыми разными, то спектр излучения в таком процессе будет сплошным (непрерывным). Он представляет собой (см. табл.) плавную несимметричную кривую, которая имеет: резкую границу со стороны коротких длин волн – λк; четко выраженный максимум и постепенное снижение интенсивности в длинноволновой области. С ростом напряжения весь спектр смещается в сторону более коротких волн, при этом одновременно повышается интенсивность для всех длин волн. Связь между ускоряющим напряжением U (кВ) и коротковолновой границей соответствующего спектра – λк (нм) имеет вид:
