
Лекции
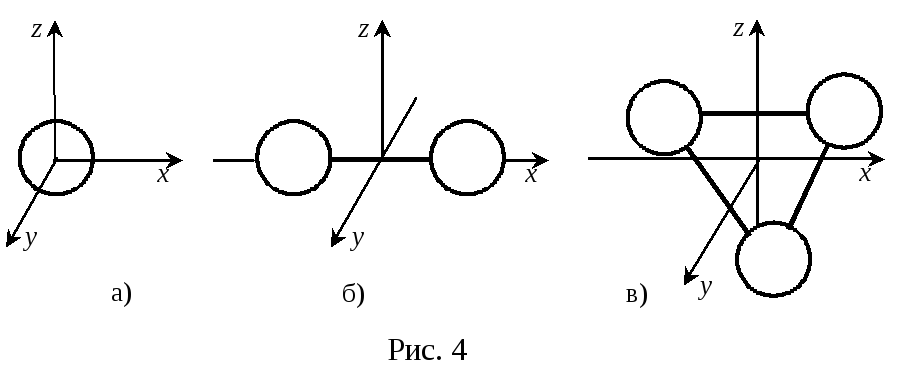
.docДля двухатомных молекул одну из осей вращения всегда можно совместить с осью молекулы (см. рис.4б). Вращение вокруг этой оси равносильно вращению отдельных атомов вокруг оси через центр масс. Энергия такого движения равна нулю. Поэтому двухатомной молекуле с жесткой связью между атомами следует приписать пять степеней свободы: три поступательного и две вращательного.
Для молекул с числом атомов три и более (рис.4в), которые связаны между собой жестко, число степеней свободы равно шести. Если связь между атомами в молекуле имеет упругий характер, то появляются колебательные степени свободы. Однако учет энергии, связанной с колебательными
степенями свободы, как оказалось, довольно сложен, т.к. энергия, которая приходится на одну степень свободы колебательного движения зависит от температуры и частоты колебаний атомов:
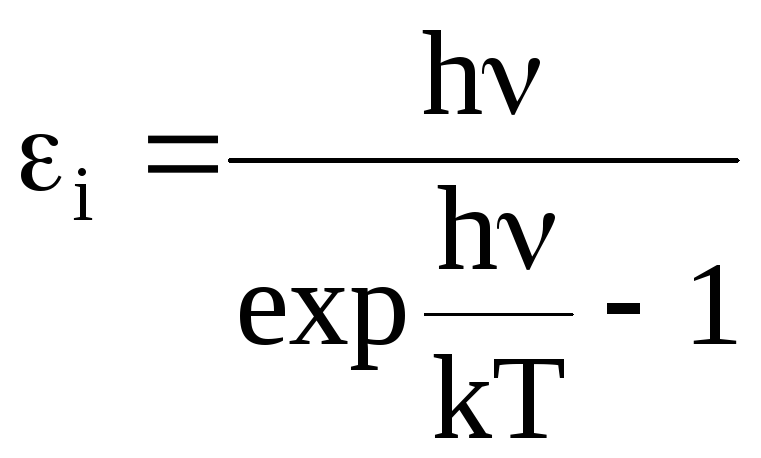 .
(18)
.
(18)
Опыт показывает, что при небольших температурах энергией колебательного движения можно пренебречь. И мы её в дальнейшем учитывать не будем.
Если обозначить
теперь число степеней свободы через j,
то кинетическая энергия одной молекулы
![]() ,
а внутренняя энергия одного моля
идеального газа:
,
а внутренняя энергия одного моля
идеального газа:
![]() ,
(19)
,
(19)
где j = 3 для одноатомных; j = 5 для двухатомных; j = 6 для трёхатомных молекул.
Для произвольной массы газа ∆m:
![]() .
(20)
.
(20)
Эксперимент при низких температурах и невысоких давлениях подтверждает полученные выводы.
Распределение молекул по скоростям (Распределение Максвелла).
Молекулы газа движутся с самыми разными скоростями, причем, и величина, и направление скорости каждой отдельной молекулы непрерывно меняются из-за соударений. Каждая молекула при н.у. испытывает за секунду порядка 109 столкновений. Хаотичность движения предполагает равновероятность направлений движения, т.е. равномерное распределение молекул по направлениям. Иначе дело обстоит с численными значениями скорости. Согласно М-КТ, возможные значения , которые лежат в интервале от нуля до бесконечности, отнюдь не равновероятны. Задача состоит в том, чтобы установить, какая часть от общего числа молекул движется с той или иной скоростью, т.е. найти закон распределения молекул по скоростям. При выводе этого закона Максвелл предполагал, что газ состоит из очень большого числа одинаковых молекул – N, находящихся в состоянии беспорядочного теплового движения при постоянной температуре Т, причем, никакие внешние силы на газ не действуют. Если разбить всю числовую ось скоростей молекул на малые интервалы dυ, то на каждый из них придется некоторое свое число молекул dN(υ) (рис.5): Число dN(υ), очевидно, будет пропорционально общему числу молекул N и ширине интервала dυ. Чтобы записать равенство, необходимо ввести коэффициент пропорциональности, значения которого
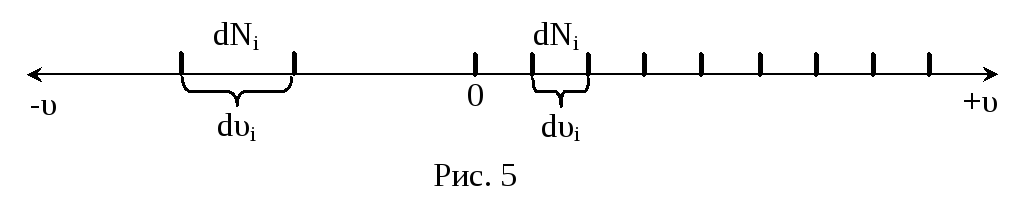
будут разными для разных интервалов, т.е. этот множитель представляет собой некую функцию f(υ). Теперь
dN(υ) = f(υ)N∙dυ. (21)
Множитель f(υ) характеризует распределение молекул по скоростям и называется функцией распределения. Смысл этой функции в том, что она определяет, какая часть молекул имеет скорости, лежащие в интервале от υ до υ + dυ, т.е. вероятность того, что произвольно взятая молекула в данном газе имеет значение скорости из интервала dυ.
![]() или
или
![]() .
(22)
.
(22)
Применяя методы теории вероятности, Максвелл нашел –
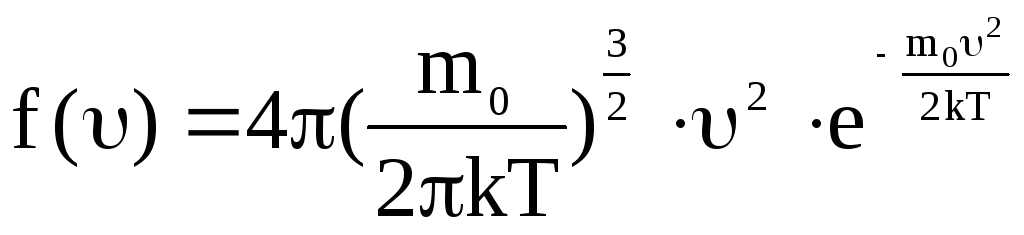 .
(23)
.
(23)
О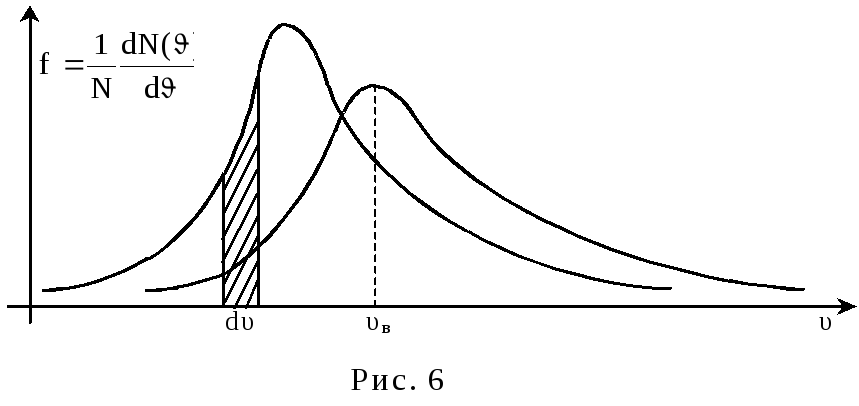 тносительное
число молекул, скорости которых лежат
в интервале от υ до υ + dυ,
как это видно из рисунка, находятся, как
площадь заштрихованной полоски: dN/N
= f(υ)∙dυ.
Очевидно, что площадь под кривой равна
единице, т.е.
тносительное
число молекул, скорости которых лежат
в интервале от υ до υ + dυ,
как это видно из рисунка, находятся, как
площадь заштрихованной полоски: dN/N
= f(υ)∙dυ.
Очевидно, что площадь под кривой равна
единице, т.е.
![]() (24)
(24)
Значение скорости, на которую приходится максимум функции распределения, называется наиболее вероятной скоростью. Ее можно найти, исследовав функцию f(υ) на экстремум:
![]() (25).
(25).
Из формулы (25) следует, что при повышении температуры максимум функции f(υ) сместится вправо, но площадь под кривой всегда равна единице. Это означает, что при повышении температуры кривая распределения будет растягиваться и понижаться (см. пунктирную линию).
Из закона распределения скоростей можно получить выражение для средней арифметической скорости молекул:
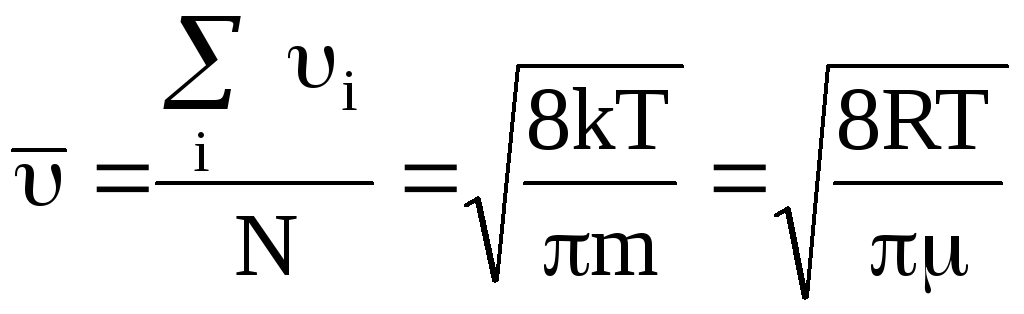 (26).
(26).
Распределение молекул в поле сил тяжести (Распределение Больцмана).
При выводе основного уравнения МКТ газов и распределения Максвелла предполагалось, что на молекулы газа внешние силы не действуют, а это значит, что молекулы распределяются по объему равномерно. Однако молекулы любого газа всегда находятся в потенциальном поле сил тяжести Земли. Тяготение с одной стороны, и тепловое движение молекул - с другой приводят к некоторому стационарному состоянию, при котором давление газа с ростом высоты убывает.
Получим закон изменения давления с высотой, предполагая, что по всей высоте: поле тяготения однородно (g = const); температура одинакова (Т = const); масса всех молекул одна и таже.
П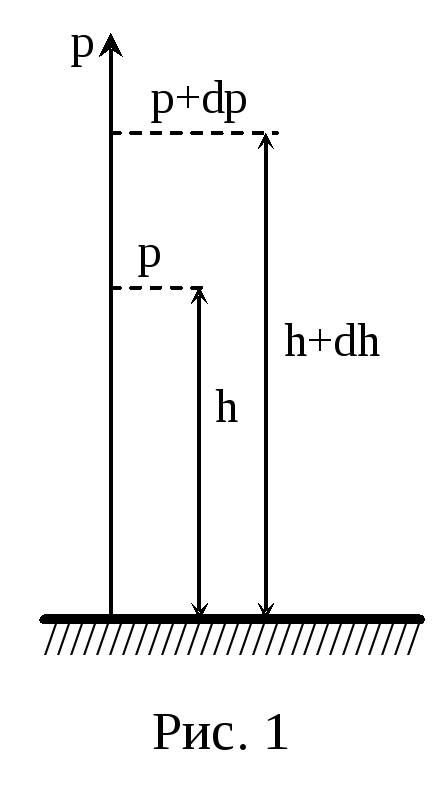 усть
на высоте h давление р,
тогда на высоте h + dh
давление – р+dp. Причём,
если dh > 0, то dp
< 0.
усть
на высоте h давление р,
тогда на высоте h + dh
давление – р+dp. Причём,
если dh > 0, то dp
< 0.
(р + dp) – р = –gdh. Из уравнения состояния , имеем
![]() .
.
Теперь
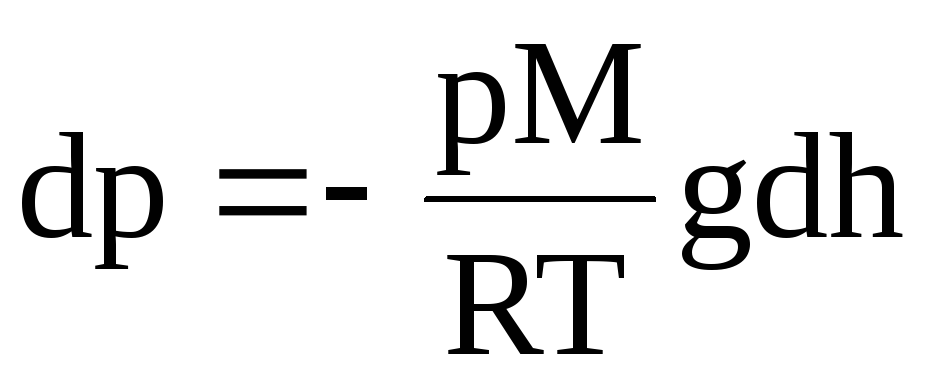 или
или
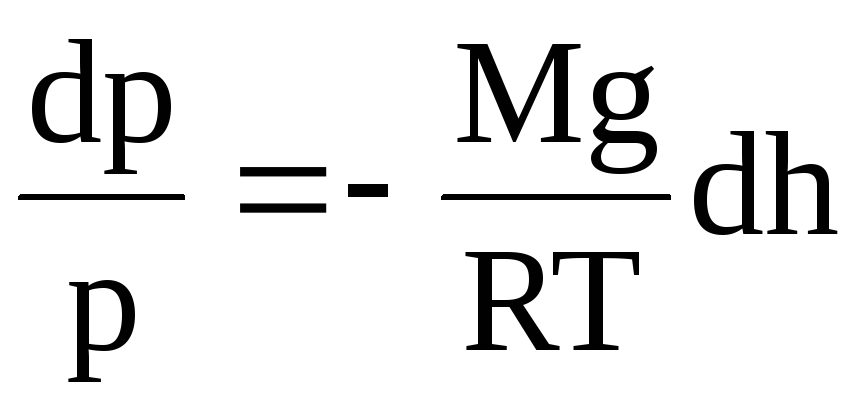 .
.
Интегрируем правую и левую часть:
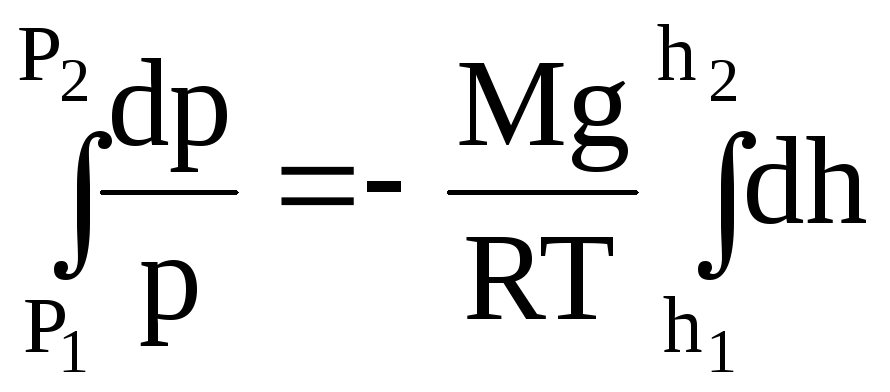 ;
;
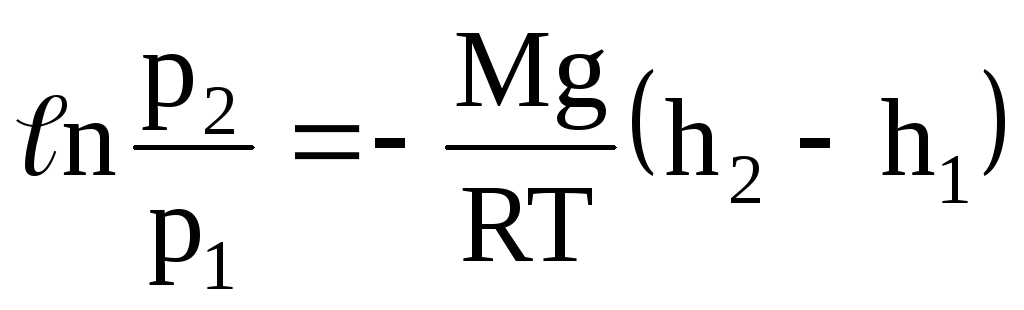 .
.
Откуда,
![]() .
(26)
.
(26)
Это так называемая барометрическая формула. Она позволяет определять давление атмосферы как функцию высоты над уровнем моря:
![]()
Т.к. давление прямо пропорционально концентрации молекул, то можно получить закон изменения концентрации молекул с высотой:
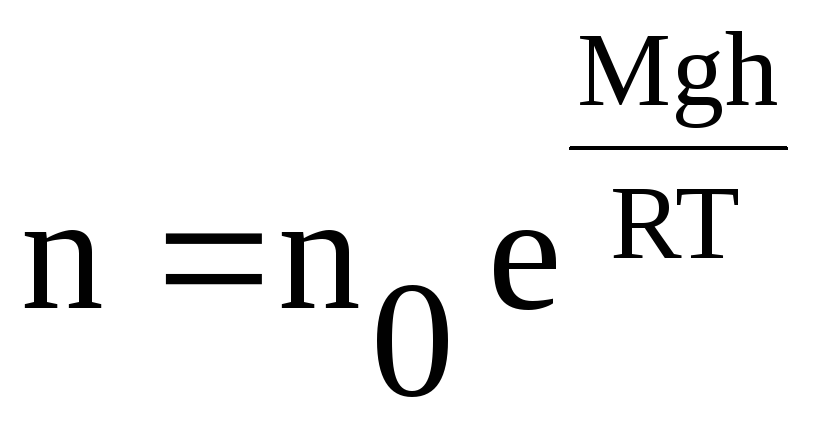 (27)
(27)
У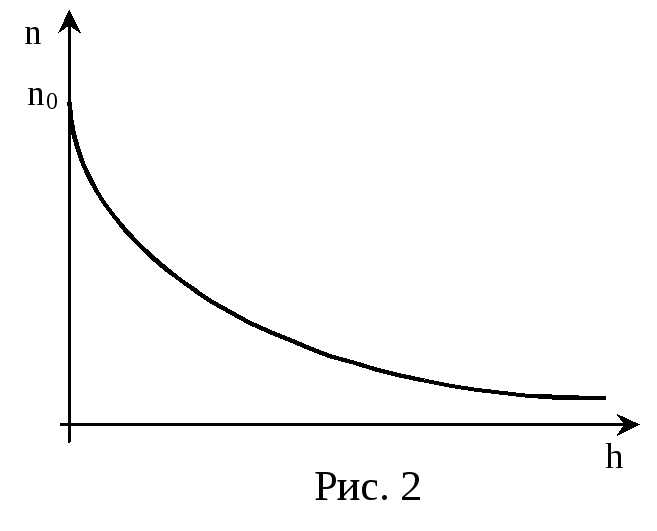 читывая
, что М = m∙NA,
а R = k∙NA
из (27) получим:
читывая
, что М = m∙NA,
а R = k∙NA
из (27) получим:
![]() .
(28)
.
(28)
Или, т.к. mgh = U(h)–потенциальная энергия одной молекулы на высоте h,
то
![]() (29)
(29)
– распределение Больцмана.
2.2 Явление переноса в газах. Средняя длина свободного пробега молекул. Общее уравнение переноса. Уравнение диффузии, уравнение вязкости, уравнение теплопроводности. Коэффициенты переноса. Реальные газы. Уравнение состояния Ван-дер-Ваальса. Критическое состояние вещества.
Молекулы газа в результате хаотического
движения непрерывно сталкиваются друг
с другом. Между двумя последовательными
столкновениями молекула проходит
некоторый путь λ, который называется
длиной свободного пробега. В общем
случае длина этого пути различна, но
т.к. число столкновений очень велико, а
движение беспорядочно, то при постоянных
внешних условиях можно говорить о
средней длине свободного пробега -
![]() .
Если молекулы данного газа испытывают
за 1 секунду в среднем
.
Если молекулы данного газа испытывают
за 1 секунду в среднем
![]() столкновений, то
столкновений, то
![]() ,
(30)
,
(30)
где
![]() –
средняя арифметическая скорость молекул.
–
средняя арифметическая скорость молекул.
Молекулы идеального газа мы рассматриваем
как шарики. Очевидно, что соударение
произойдет, если две молекулы сблизятся
до расстояния равного двум радиусам,
т. е. диаметру молекул d.
Минимальное расстояние, на которое
сближаются при соударении центры двух
молекул, называется эффективным диаметром
молекул. Этот параметр зависит от
![]() ,
а значит и от температуры газа.
,
а значит и от температуры газа.
Для определения
![]() представим себе молекулу с эффективным
диаметром d, которая движется со скоростью
представим себе молекулу с эффективным
диаметром d, которая движется со скоростью
![]() среди
других молекул, которые при этом остаются
неподвижными.
среди
других молекул, которые при этом остаются
неподвижными.
Эта молекула столкнется со всеми
молекулами, центры которых лежат внутри
"ломаного" цилиндра радиусом d. Это
значит, что
![]() равно числу молекул в объеме этого
цилиндра
равно числу молекул в объеме этого
цилиндра
![]() ,
(31)
,
(31)
где n – концентрация
молекул, а V – объём
цилиндра:
![]() .
С учётом этого –
.
С учётом этого –
![]() .
(32)
.
(32)
У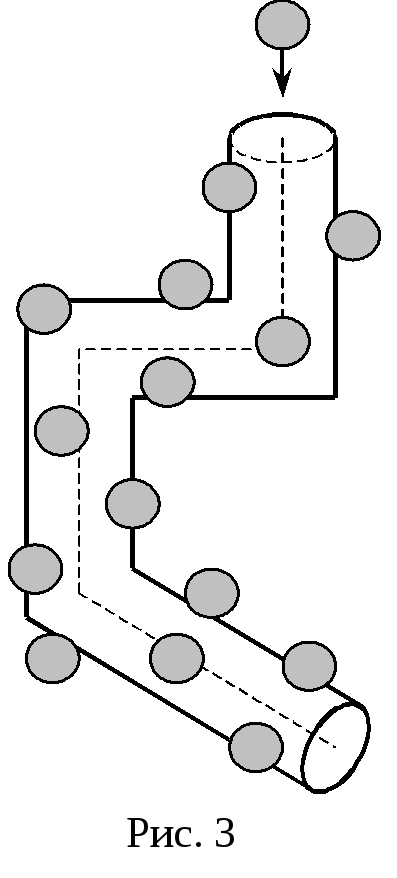 чет
движения других молекул увеличивает
число столкновений в
чет
движения других молекул увеличивает
число столкновений в
![]() раз. Окончательно для Z
получим:
раз. Окончательно для Z
получим:
![]() (33)
(33)
Тогда
![]() (34)
(34)
Т.к. p n, то для разных внешних условий имеем:
![]() (35).
(35).
При н.у. Z = 109
c-1 и
![]() = 5∙10-8 м.
= 5∙10-8 м.
ЯВЛЕНИЯ ПЕРЕНОСА
В термодинамических неравновесных
системах, т.е. в системах, для которых
значения макропараметров (Т, Р,
![]() )
в разных ее точках различны, возникают
необратимые процессы, получившие
название явлений переноса. В
результате таких процессов из одной
локальной области системы в другую
происходит перенос энергии (явление
теплопроводности), массы (явление
диффузии), импульса (внутреннее трение),
заряда и т.д. Это ведет к выравниванию
значений макропараметров по объему
системы. Понятно, что перенос любой
величины объясняется переходом с места
на место некоторого числа частиц (молекул
и атомов) в результате их хаотического
движения.
)
в разных ее точках различны, возникают
необратимые процессы, получившие
название явлений переноса. В
результате таких процессов из одной
локальной области системы в другую
происходит перенос энергии (явление
теплопроводности), массы (явление
диффузии), импульса (внутреннее трение),
заряда и т.д. Это ведет к выравниванию
значений макропараметров по объему
системы. Понятно, что перенос любой
величины объясняется переходом с места
на место некоторого числа частиц (молекул
и атомов) в результате их хаотического
движения.
Получим общее уравнение переноса вдоль направления Ох. Выделим мысленно элемент плоскости, перпендикулярный Ох и площадью ∆S.
Т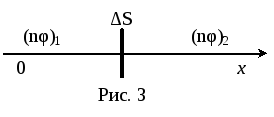 огда
в силу хаотичности движения за время
∆t через ∆S
в направлении Ох перейдёт N частиц:
огда
в силу хаотичности движения за время
∆t через ∆S
в направлении Ох перейдёт N частиц:
![]() (1)
(1)
Здесь n – концентрация
молекул (атомов), а
![]() – их средняя арифметическая скорость.
Переходя через ∆S, каждая молекула
переносит присущие ей массу, заряд,
импульс, энергию или какие-то другие
величины. Обозначим значение величины,
переносимое одной молекулой буквой φ.
Тогда за время ∆t через
площадку ∆S в направлении
оси Ох будет перенесено количество
физической величины
– их средняя арифметическая скорость.
Переходя через ∆S, каждая молекула
переносит присущие ей массу, заряд,
импульс, энергию или какие-то другие
величины. Обозначим значение величины,
переносимое одной молекулой буквой φ.
Тогда за время ∆t через
площадку ∆S в направлении
оси Ох будет перенесено количество
физической величины
![]() (2).
(2).
Очевидно, если концентрация справа тоже n, то и справа налево перейдет столько же частиц. Т.е. результирующий перенос в этом случае равен нулю: ΔN = 0 и ΔNφ = 0.
Если же среда неоднородна, т.е. либо
концентрация частиц, либо значения φ
слева и справа неодинаковы, то более
вероятными будут переходы из областей,
где значение (nφ) больше
в области, где оно меньше. Если предположить,
что (nφ)1 > (nφ)2
, то результирующий перенос величины
φ:
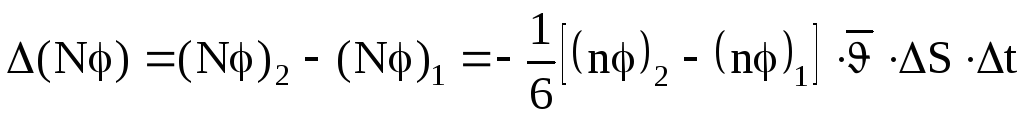 (3)
(3)
Знак «минус» в (3) отражает факт убыли
величины (nφ) в направлении
переноса. Выясним, на каком расстоянии
от ∆S слева и справа следует взять
значения (nφ). Т.к. изменение физических
характеристик молекул происходит только
при соударениях, а до соударения каждая
из молекул прошла расстояние равное
длине свободного пробега, то можно
считать, что (nφ) молекул сохраняются
неизменными на расстоянии, равном длине
свободного пробега
![]() влево и вправо от ∆S. Поэтому разделим
и умножим правую часть (3) на 2
влево и вправо от ∆S. Поэтому разделим
и умножим правую часть (3) на 2![]() :
:
![]() .
(4)
.
(4)
Распределение величины nφ вдоль оси Ох характеризуется градиентом. Если в точке с координатой х2 значение величины – (nφ)2, а в точке х1 – (nφ)1, то под градиентом переносимой величины понимают отношение:
![]() =
=
![]() .
(5)
.
(5)
Тогда
![]() градиент
величины nφ в области площадки ∆S.
градиент
величины nφ в области площадки ∆S.
![]() .
(5)
.
(5)
(5) – общее уравнение переноса.
Диффузия – это перенос массы. При условии однородного по объему распределения скоростей (υ = const), одинаковой температуры, массы и концентрации молекул (T = const, n = const, m0 = const), подставляя вместо φ массу m0, одной молекулы в (5), получим:
![]() , или
, или
![]() .
(6)
.
(6)
Это закон Фика. Здесь D =
![]() – коэффициент диффузии. [D]
= м2/с.
– коэффициент диффузии. [D]
= м2/с.
Теплопроводность – это перенос энергии.
При условии, что по всему объему газа n
= const, масса m0
= const молекул одинакова –
m0 = const,
распределение скоростей по объёму
однородно (υ = const), а средняя
кинетическая энергия поступательного
движения одной молекулы
![]() ,
получим:
,
получим:
![]() ,
или
,
или
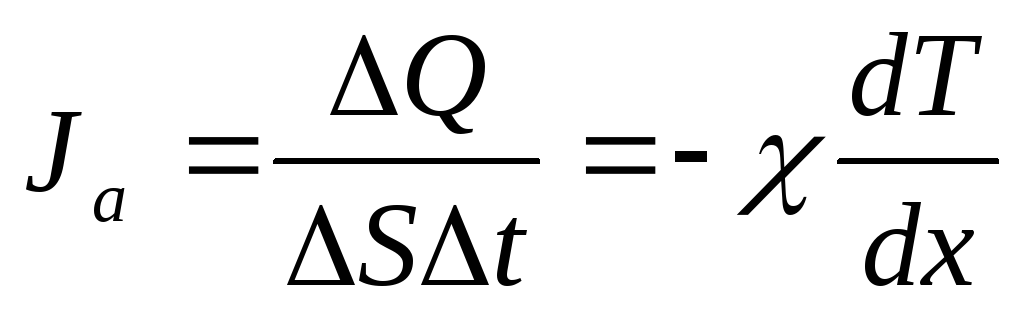 .
(7)
.
(7)
Это закон Фурье.
Здесь
![]() –
коэффициент теплопроводности. [χ]
= Вт/(м·К) = кг·м/(с3·К).
–
коэффициент теплопроводности. [χ]
= Вт/(м·К) = кг·м/(с3·К).
Вязкость – это перенос импульса
между параллельными слоями, которые
движутся со скоростями u1 и u2.
При условии m0 =
const, концентрация частиц
n = const,
распределение скоростей хаотического
движения по объёму однородно
![]() =
const, а импульс одной
молекулы, связанный со скоростью
упорядоченного движения слоев φ = р =
m0u,
для импульса силы взаимодействия слоёв
имеем:
=
const, а импульс одной
молекулы, связанный со скоростью
упорядоченного движения слоев φ = р =
m0u,
для импульса силы взаимодействия слоёв
имеем:
![]() ,
или
,
или
![]() .
()
.
()
Это закон внутреннего трения Ньютона.
![]() –
поперечный градиент скорости, величина
характеризующая быстроту изменения
скорости в направлении х перпендикулярном
направлению движения трущихся слоев.
Динамический коэффициент вязкости
–
поперечный градиент скорости, величина
характеризующая быстроту изменения
скорости в направлении х перпендикулярном
направлению движения трущихся слоев.
Динамический коэффициент вязкости
![]() .
[η] = Па·с.
.
[η] = Па·с.
МОЛЕКУЛЯРНЫЕ СИЛЫ
Силы взаимодействия между молекулами, или, как их еще называют, Ван-дер-Ваальсовские силы имеют электрическую природу. Это кулоновские силы взаимодействия заряженных частиц, из которых состоят атомы и молекулы. Они проявляются на расстояниях, соизмеримых с размерами самих молекул и очень быстро убывают при увеличении расстояния. При этом одновременно действуют силы притяжения (взаимодействие разноименных зарядов) и силы отталкивания (взаимодействие одноименных зарядов). Т.к. реальные частицы не являются точечными, то величина этих сил по разному зависит от расстояния между ними.
Различают три типа сил Ван-дер-Ваальса:
-
ориентационные – действуют между полярными молекулами;
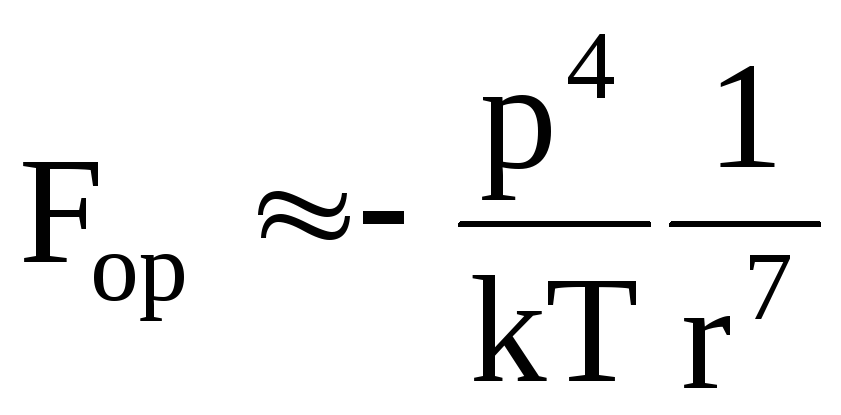
-
индукционные – описывают взаимодействие молекул, поляризация зарядов в которых возникает под воздействием электрических полей соседних частиц;
![]() .
.
Здесь: ринд = ε0αЕ – электрический дипольный момент частиц; α - поляризуемость молекул.
-
дисперсионные – определяют взаимодействие молекул, несимметричное распределение зарядов в которых возникает случайно, в процессе движения электронов по орбитам, что и приводит к образованию мгновенных диполей.
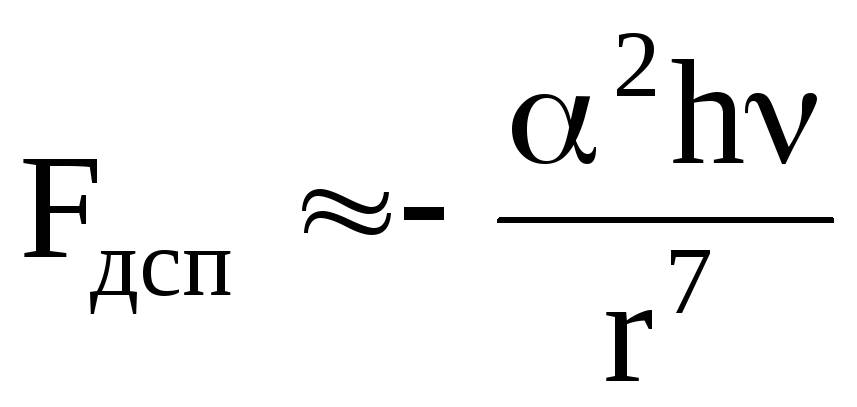
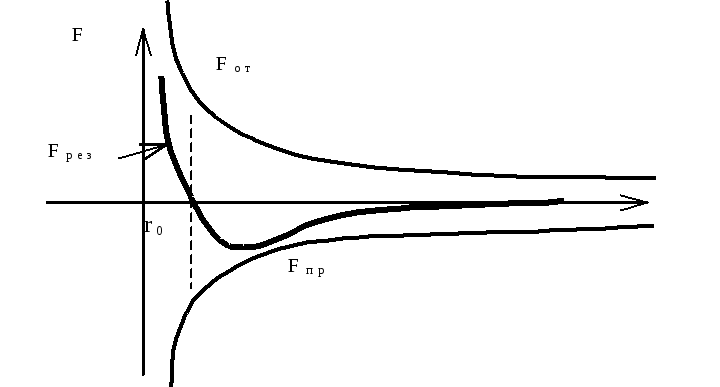
В общем случае все три типа сил могут действовать одновременно Fм = Fо + Fи + Fд . Рассмотрим зависимость сил межмолекулярного взаимодействия от расстояния.
Силы притяжения Fпр считаются отрицательными, а силы отталкивания Fот - положительными. Сумма этих сил дает результирующую Fрез = f(r). На некотором расстоянии r0 между молекулами [Fпр] = [Fот] и результирущая сила F = Fпр + Fот = 0. Если r < r0, то преобладают силы отталкивания. Если r >r0, то преобладают силы притяжения. Однако на расстоянии r > 10-9 м силы В-д-В быстро стремятся к нулю.
С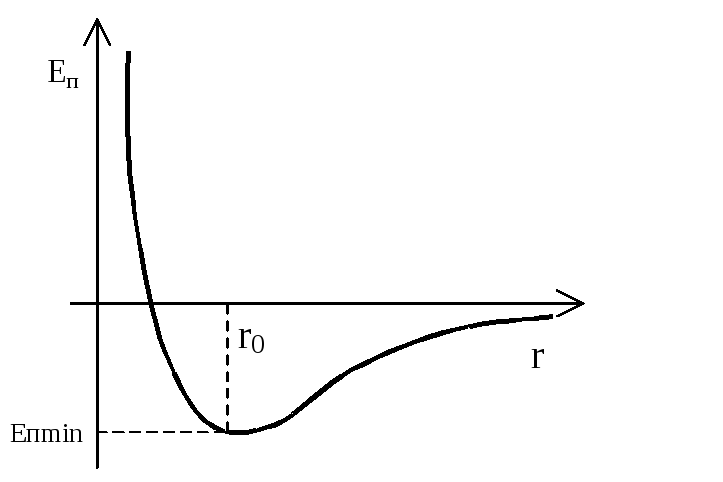 истема
взаимодействующих молекул характеризуется
некоторым запасом потенциальной энергии,
которая сложным образом зависит от r,
Еп = f(r):
истема
взаимодействующих молекул характеризуется
некоторым запасом потенциальной энергии,
которая сложным образом зависит от r,
Еп = f(r):
r → ∞ – Еп → 0 ;
r > 0 и r → r0 – Еп → Еп min , Еп < 0 ;
r = r0 – Еп < 0, Еп = Еп min ;
r < r0 и уменьшается – Еп → ∞, Еп > 0.
Наименьшая потенциальная энергия взаимодействия называется энергией связи молекул. Она равна работе, которую необходимо совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии.
Соотношение Еп min и величины
удвоенной средней энергии одной степени
свободы
![]() является критерием агрегатного вещества.
Если:
является критерием агрегатного вещества.
Если:
-
Еп min << kT - газ;
-
Еп min kT - жидкость;
-
Еп min >> kT – твердое тело.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии.
РЕАЛЬНЫЕ ГАЗЫ
Уравнения молекулярно-кинетической
теории довольно хорошо описывают
поведение реальных газов при достаточно
высокой температуре и низком давлении.
Это и понятно, ведь такое состояние
реального газа наиболее близко к модели
идеального газа, на основе которой
получены все выводы МКТ. Однако с ростом
давления и понижением температуры
среднее расстояние между молекулами
уменьшается и силы молекулярного
взаимодействия растут. Например, при
н.у. объем молекул составляет
![]() от занятого газом объема, а при давлении
500 атм (500 МПа) он будет составлять уже
половину всего объема газа. Совершенно
очевидно, что при этих условиях законы
МКТ перестает работать, например, PV
const
при Т = const.
от занятого газом объема, а при давлении
500 атм (500 МПа) он будет составлять уже
половину всего объема газа. Совершенно
очевидно, что при этих условиях законы
МКТ перестает работать, например, PV
const
при Т = const.
Таким образом, задача заключается в том, чтобы получить такое уравнение состояния реального газа, которое бы учитывало объем молекул и их взаимодействие.
УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
Из всех уравнений состояния реального газа, предложенных в свое время, самым простым и достаточно точным оказалось уравнение голландского физика Ван-дер-Ваальса:
![]()
Как видно, оно получено из уравнения
Клапейрона для моля идеального газа
путем введения поправок. Константы а
и b имеют различные
значения для разных газов и определяются
опытным путем. В СИ
![]() ,
,
![]() .
.
Поправка «b» определяет ту часть объема, занимаемого газом, которая недоступна для движения из-за конечных размеров самих молекул. b = 4 Vмолекулы.
Поправка
![]() определяет внутренне давление
определяет внутренне давление
![]() ,
обусловленное взаимным притяжением
молекул друг к другу. Очевидно, если бы
вдруг это притяжение исчезло, то для
того, чтобы удержать газ в пределах того
же объема, пришлось бы внешнее давление
увеличить на
,
обусловленное взаимным притяжением
молекул друг к другу. Очевидно, если бы
вдруг это притяжение исчезло, то для
того, чтобы удержать газ в пределах того
же объема, пришлось бы внешнее давление
увеличить на
![]() .
.
Для произвольного количества газа
![]() уравнение В-д-В имеет вид
уравнение В-д-В имеет вид
![]() .
.
2.3 Общие свойства и особенности молекулярного строения жидкостей. Явление переноса в жидкостях. Формула Пуазейля. Центрифугирование. Твердые тела. Упругие свойства твердых тел. Закон Гука. Кристаллические тела. Аморфное и жидкокристаллическое состояние веществ. Сублимация. Плавление и кристаллизация. Особенности строения и общие свойства полимеров и жидких кристаллов.
Вещество в зависимости от условий, в которых оно находится, может иметь разные агрегатные состояния: твердое, жидкое газообразное или состояние плазмы. Главным образом это зависит от температуры Т и давления - Р. Значения этих параметров определяет характер взаимодействия между молекулами от чего, в свою очередь, зависит структура и свойства вещества. Жидкость в этом смысле занимает промежуточное положение между газами и твердыми телами. Свойства жидкостей их структура, особенности движения молекул представляют особый интерес для биофизиков и медиков, т.к. биоорганизмы больше, чем на половину состоят из жидкости. Обмен веществ, снабжение клеток кислородом, выведение из организмов продуктов жизнедеятельности обеспечивается именно перемещением жидкостей.
Структура жидкостей (их молекулярное строение) характерна тем, что расстояние между частицами является неодинаковым и непостоянным. В расположении молекул и атомов наблюдается ближний порядок. Это означает, что ближайшие соседи каждой молекулы по отношению друг к другу имеют определенную ориентацию и расположение. Однако, по мере удаления от «центра наблюдения» расположение частиц становится все менее упорядоченным и уже на расстояниях 3-4-ех молекулярных диаметров совершенно исчезает. Такая структура жидкостей обуславливает изотропию свойств.
Исключение в этом плане составляют жидкости с удлиненной или дискообразной формой молекул, для которых при определенных условиях упорядоченная ориентация частиц наблюдается в пределах значительных объемов. Такие жидкости получили название жидких кристаллов, т.к. для них, в силу указанной особенности структуры, наблюдается анизотропия механических, оптических, электрических и др. свойств, подобно тому, как это имеет место в кристаллах.
Тепловое движение частиц жидкостей представляет собой периодические колебания, со средней частотой ν0 = ~1012 с-1 , которые чередуются с нерегулярными переходами, «скачками», частиц с места на место. Время пребывания молекул на одном месте – время релаксации – быстро убывает с ростом температуры:
![]() ,
(1)
,
(1)
где Еа
– энергия активации, энергия, которую
должна приобрести молекула для разрыва
молекулярных связей со своими соседями
при смене местоположения, k
– постоянная Больцмана,
![]() 0
– среднее время «оседлой жизни». Т.к.
cреднее перемещение – δ при «скачке»
составляет расстояние ~ 10-8 – 10-10
м, то
0
– среднее время «оседлой жизни». Т.к.
cреднее перемещение – δ при «скачке»
составляет расстояние ~ 10-8 – 10-10
м, то
![]() при этом
при этом
![]() ~
~![]() ~40
м/с, что дают для жидкостей величины
скоростей поступательного движения
примерно в 20 раз меньшие, чем для газа
при той же температуре.
~40
м/с, что дают для жидкостей величины
скоростей поступательного движения
примерно в 20 раз меньшие, чем для газа
при той же температуре.
