
- •119 Общие вопросы аналитической химии раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) -такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Электродные потенциалы
Электродом в электрохимииназывается поверхность раздела между проводником электрического тока с электронной проводимостью и проводником электрического тока с ионной проводимостью, или, иными словами, место, где электронный механизм переноса электрического заряда изменяется на ионный (и наоборот). В более узком смысле слова электродом часто называют проводник электрического тока с электронной проводимостью.
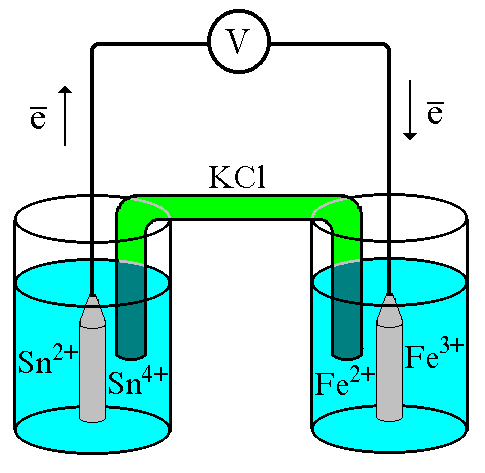
Рис.
7.1.
Схематическое изображение гальванического
элемента
Sn4++
![]() Sn2+
Sn2+
Рис.
7.2. Возникновение
электродного потенциала
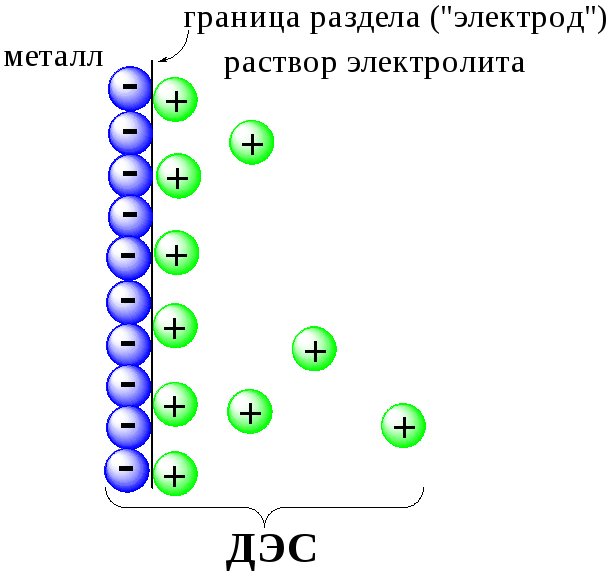
Аналогичные процессы будут происходить и в системе, содержащей Fe2+иFe3+. Однако, так как ионыFe2+обладают меньшей способностью отдавать электроны, чемSn2+, а ионыFe3+, соответственно, большей способностью принимать электроны, чемSn4+, то поверхность платиновой проволоки, опущенной в раствор, содержащийFe2+иFe3+, будет заряжена менее отрицательно, чем опущенной в растворSn2+иSn4+.
Соединим платиновые пластинки, опущенные в растворы, металлическим проводником. Для замыкания цепи соединим оба раствора солевым мостиком - трубкой, содержащей раствор KCl. В полученной системе, называемойгальваническим элементом, начнёт протекать электрический ток. Если включить в данную цепь потенциометр или высокоомный вольтметр, то можно измерить её ЭДС, которая будет характеризовать способность ионовFe3+получать электроны отSn2+.
Абсолютную величину электродного потенциала индивидуального электрода определить невозможно. Возможно определить лишь разность потенциалов двух электродов. В принципе, это можно делать для каждой конкретной реакции. Однако гораздо более удобно выбрать какой-нибудь один стандартный электрод, относительно которого затем будут проводиться все измерения электродных потенциалов. В качестве такого электрода сравнения используется стандартный водородный электрод.
Рис.
7.3 Стандартный
водородный электрод

![]() (рис. 7.3). Для увеличения адсорбирующей
способности платину покрывают слоем
губчатой платины. Для насыщения
поверхности платины водородом через
раствор пропускают газообразныйH2(р = 1 атм). Между водородом, растворённым
в платине, и гидратированными катионами
водорода, находящимися в растворе,
устанавливается равновесие:
(рис. 7.3). Для увеличения адсорбирующей
способности платину покрывают слоем
губчатой платины. Для насыщения
поверхности платины водородом через
раствор пропускают газообразныйH2(р = 1 атм). Между водородом, растворённым
в платине, и гидратированными катионами
водорода, находящимися в растворе,
устанавливается равновесие:
2H+
+
![]()
H2
(Pt)
H2
(Pt)
Потенциал стандартного водородного электрода принят равным нулю при любой температуре.
Стандартный электродный потенциал полуреакции(E0,0) -это ЭДС гальванического элемента, состоящего из находящегося в стандартных условиях электрода, на котором протекает данная полуреакция, и стандартного водородного электрода.
Водородный электрод неудобен в работе, поэтому на практике в качестве стандартных используются вторичные стандартные электроды, потенциал которых относительно СВЭ определён с высокой точностью. Одним из таких электродов является хлоридсеребряный электрод,
Знак стандартного потенциала полуреакции зависит от выбранного направления полуреакции. При изменении направления знак меняется на противоположный. Например, для полуреакции (А) E0= +0,771 В, следовательно, для обратной ей полуреакции (Б)E0= - 0,771 В.
(А)
Fe3+
+
![]()
Fe2+ (Б)
Fe2+
-
Fe2+ (Б)
Fe2+
-
![]()
Fe3+
Fe3+
Потенциал, характеризующий процесс восстановления, например, такой как (А), называется восстановительным, а потенциал, характеризующий процесс окисления, например, такой как (Б) -окислительным. В настоящее время величину электродного потенциала полуреакции принято относить кпроцессу восстановления окисленной формы
Чем больше величина электродного потенциала, тем более сильными окислительными свойствами обладает окисленная форма вещества и более слабыми восстановительными свойствами его восстановленная форма. Например, перманганат-ион при стандартных условиях в кислой среде является более сильным окислителем, чем дихромат-ион.
Cr2O72-
+ 14H+
+
![]()
2Cr3+
+ 7H2O
E0
= +1,33 В
2Cr3+
+ 7H2O
E0
= +1,33 В
MnO4-
+ 8H+
+
![]()
Mn2+ +
4H2O
E0
= +1,51 В
Mn2+ +
4H2O
E0
= +1,51 В
Если для интересующей нас полуреакции значение Е0 в справочной литературе, по той или иной причине, не приведено, то его можно рассчитать, используя потенциалы других полуреакций.
Пример 7.1.Рассчитайте величину Е0 для окислительно-восстановительной пары Fe3+/Fe, если известно, что
Fe2++ 2![]() Fe(
Fe(![]() = -0,473В)Fe3++
= -0,473В)Fe3++![]() Fe2+(
Fe2+(![]() = +0,771В)
= +0,771В)
При сложении первого и второго уравнения мы получим уравнение интересующей нас полуреакции:
Fe3++ 3![]() Fe
Fe
Значение стандартного
электродного потенциала данной
полуреакции не будет равно сумме
![]() и
и![]() ,
т.е. 0,298В. Величина Е0не зависит
от количества вещества (потенциал - это
интенсивная, а не экстенсивная величина),
поэтомупотенциалы нельзя складывать.
,
т.е. 0,298В. Величина Е0не зависит
от количества вещества (потенциал - это
интенсивная, а не экстенсивная величина),
поэтомупотенциалы нельзя складывать.
![]()
В отличие от электродного потенциала Gзависит от количества вещества, поэтомуG3=G1+G2. Следовательно
![]() В
В
Разность электродных потенциалов окислителя, участвующего в прямой реакции, и окисленной формы восстановителя, образующегося в процессе реакции, называется ЭДС реакции (Е).
По величине ЭДС можно судить о том, возможно или нет самопроизвольное протекание данной реакции.
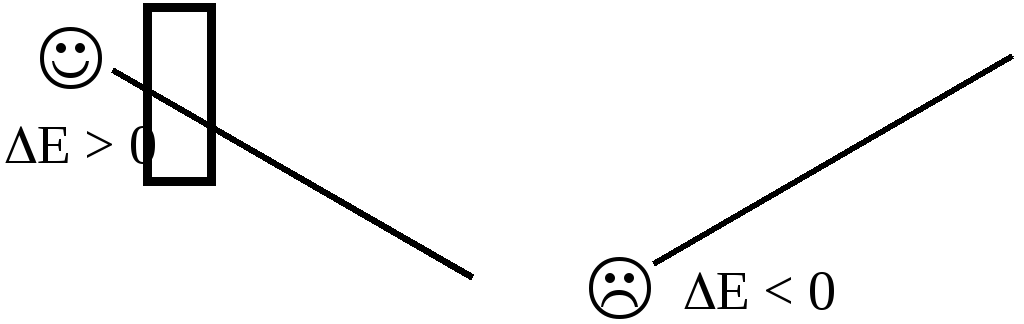
Пример 7.2. Определить, может ли самопроизвольно протекать при стандартных условиях реакция окисления иодид-ионов ионами Fe3+.
2Fe3+ + 2I- 2Fe2+ + I2
![]() =
=
![]() -
-![]() =
0,771 - 0,536 = 0,235В
=
0,771 - 0,536 = 0,235В
Данная реакция может самопроизвольно протекать в прямом направлении.
