
- •119 Общие вопросы аналитической химии раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) -такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Побочные реакции
Ионы, образующиеся при растворении малорастворимого электролита, могут вступать в различные реакции с другими ионами, находящимися в растворе. В результате подобных реакций равновесие “осадок насыщенный раствор” смещается в сторону преимущественного протекания процесса растворения, растворимость малорастворимого электролита увеличивается и при определённых условиях его можно будет практически полностью перевести в раствор.
Пример 6.6.Рассчитать растворимость оксалата бария при рН 4,0.
![]()
![]()
![]()
![]()
У щавелевой кислоты Ka1= 5,610-2,Ka2= 5,410-5. При рН 4,0 в растворе будут находиться оксалат- и гидрооксалат-ионы, концентрация неионизированных молекул щавелевой кислоты будет очень мала, поэтому
![]()
![]()
![]() моль/л
моль/л
Величина рН в данном примере относится не к исходному раствору, в котором предполагается растворять оксалат бария, а к раствору, полученному в результате растворения. Исходная концентрация кислоты в растворе, в котором растворяли оксалат бария, была выше (либо это был буферный раствор с достаточно большой буферной ёмкостью). Это связано с тем, что при растворении оксалата бария и других электролитов, содержащих анионы, являющиеся основаниями, затрачиваются протоны. Если растворимость электролита невелика, то изменение рН будет небольшим, если же она достаточно большая, то и рН в процессе растворения заметно увеличится.
Пример 6.7.Рассчитать растворимость AgBr в 0,50 М NH3.
Как и в предыдущем
примере вначале рассчитаем молярную
долю иона, вступающего в побочную реакцию
(в данном случае (Ag+)),
затем![]() и, наконец, растворимость. Для аммиачных
комплексов серебра:1
= 2,1103,2= 1,7107.
Будем считать, что
и, наконец, растворимость. Для аммиачных
комплексов серебра:1
= 2,1103,2= 1,7107.
Будем считать, что![]() и что при такой большой концентрации
лиганда в растворе преобладает комплекс
[Ag(NH3)2]+.
и что при такой большой концентрации
лиганда в растворе преобладает комплекс
[Ag(NH3)2]+.
![]()
![]()
![]() моль/л
моль/л
6.4. Общие принципы растворения осадков малорастворимых электролитов
Растворение осадка, как это следует из произведения растворимости, происходит, если в растворе над осадком произведение активностей ионов станет меньше величины произведения растворимости. Частичное или полное растворение осадков может происходить при разбавлении раствора; нагревании (если, конечно, нагревание приводит к повышению растворимости), увеличении ионной силы; добавлении к раствору вещества, реагирующего с ионами, образующимися при растворении осадка.
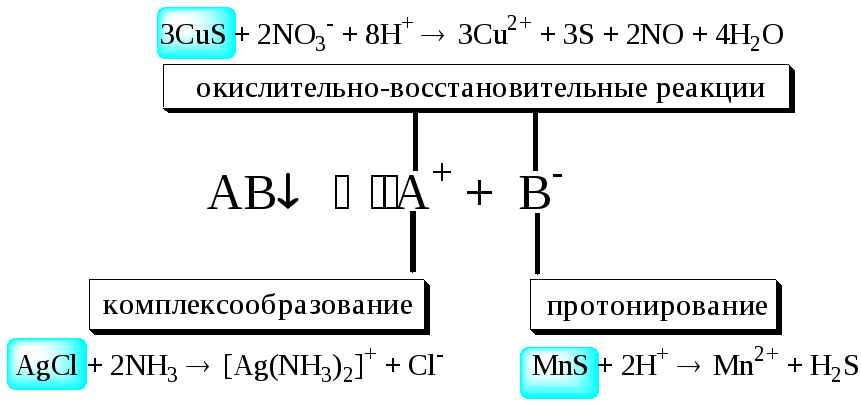
Попробуйте объяснить и подтвердить, если необходимо, расчётами, почему Cu(OH)2растворяется в раствореNH3, аMg(OH)2- нет, почемуAgClне растворяется в разбавленнойHNO3, зачем изBaSO4в процессе переведения его в раствор вначале получают ВаСO3и т.д.
Глава 7
7.1. Общая характеристика окислительно-восстановительных реакций
Окислительно-восстановительными называют реакции, в процессе которых происходит обмен электронами между реагирующими веществами.

В любой окислительно-восстановительной реакции окислитель и восстановитель взаимодействуют друг с другом cобразованием нового восстановителя и нового окислителя.

Поскольку в процессе окислительно-восстановительной реакции происходит лишь перераспределение электронов между реагирующими веществами, то число электронов, отданных восстановителем, должно быть равно числу электронов, полученных окислителем.
7.2. Количественная оценка окислительно-восстановительной способности веществ
Обычно для количественной оценки способности веществ отдавать и принимать электроны используют не константы равновесия, а электродные потенциалы. Это возможно потому, что процессы окисления и восстановления могут быть пространственно разделены.
