
- •ФОТОБИОЛОГИЧЕСКИЕ
- •ФОТОБИОЛОГИЧЕСКИЕ
- •СБИОЛОГИЧЕСКОЙ ТОЧКИ ЗРЕНИЯ
- •2. ДЕСТРУКТИВНО-МОДИФИЦИРУЮЩИЕ
- •Б) МУТАЦИОННЫЕ;
- •Стадии фотобиологического процесса:
- •Все виды электромагнитного излучения ( от коротковолновых рентгеновских лучей до радиоволн) представляют собой
- •Воздействие света разных длин волн вызывает разные фотобиологические эффекты:
- •КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ СВЕТА
- •волновые явления
- •МОДЕЛЬ АТОМА
- •Первый постулат Бора (постулат стационарных состояний):
- •Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов
- •Второй постулат Бора (правило частот) : при переходе атома из одного стационарного состояния
- •Нобелевская премия по физике, 1929 г.
- •ФОТОН как ЧАСТИЦА ОБЛАДАЕТ
- •По аналогии с соотношением между длиной волны
- •ДЛЯ ОПИСАНИЯ СОСТОЯНИЯ
- •ψ - волновая функция характеризует движение электрона в пространстве как волнообразное возмущение; x,
- •В ходе решения волнового уравнения вводятся целые числа - так называемые квантовые числа,
- •Принцип минимума энергии
- •КВАНТОВОМЕХАНИЧЕСКАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА
- •ЭНЕРГЕТИЧЕСКИЕ УРОВНИ АТОМОВ И МОЛЕКУЛ
- •СИНГЛЕТНЫЕ УРОВНИ S(электроны
- •СИНГЛЕТНЫЕ S и ТРИПЛЕТНЫЕ
- •ЭНЕРГЕТИЧЕСКИЕ УРОВНИ МОЛЕКУЛ
- •Пьер Бугер
- •I0 – ИНТЕНСИВНОСТЬ ПАДАЮЩЕГО СВЕТА
- •dI kIcdl dII kcdl ln I kcl C
- •В экспоненциальной форме
- •Перепишем уравнение еще раз в логарифмической форме и избавимся от минуса
- •ЗАВИСИМОСТЬ ОПТИЧЕСКОЙ ПЛОТНОСТИ ОТ КОНЦЕНТРАЦИИ РАСТВОРА
- •УСЛОВИЯ ВЫПОЛНЕНИЯ ЗАКОНА БУГЕРА – ЛАМБЕРТА - БЕРА
- •Иногда используют другую характеристику - КОЭФФИЦИЕНТ ПРОПУСКАНИЯ Т
- •АБСОРБЦИОННАЯ И ДИФФЕРЕНЦИАЛЬНАЯ СПЕКТРОСКОПИЯ БЕЛКОВ
- •ШКАЛА
- •ЛИНЕЙЧАТЫЕ СПЕКТРЫ АТОМОВ
- •СПЕКТР ПОГЛОЩЕНИЯ БАКТЕРИОРОДОПСИНА
- •СПЕКТРЫ ПОГЛОЩЕНИЯ БЕЛКОВ
- •СПЕКТРОФОТОМЕТР - прибор, который измеряет спектры поглощения
- •Особенности спектроскопии биополимеров
- •ПОГЛОЩЕНИЕ БЕЛКОВ
- •Хромофоры белковых молекул
- •ПОГЛОЩЕНИЕ ПЕПТИДНЫХ ГРУПП
- •ПОГЛОЩЕНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ
- •Интерес представляют только те хромофоры белковых молекул, которые поглощают при длинах волн больше
- •Ароматические аминокислоты: триптофан, тирозин и фенилаланин.
- •Спектры поглощения ароматических аминокислот.
- •Изменение рН мало влияет на спектры поглощения изолированных пептидных хромофоров.
- •Многие белки содержат группы, отличающиеся от обычных аминокислот.
- •Очищенный родопсин был измерен дважды: сначала он был выделен из адаптированной к темноте
- •Зеленый
- •Дифференциальный спектр – разностный
- •Если разложить это в степенной ряд по малому параметру и пренебречь членами второго
- •СПЕКТР ПОГЛОЩЕНИЯ ТРИПТОФАНА В ВОДЕ
- •СПЕКТР ПОГЛОЩЕНИЯ (а) и ТЕМПЕРАТУРНО-ПЕРТУРБАЦИОННЫЙ
- •Для получения ТЕМПЕРАТУРНО-ПЕРТУРБАЦИОННЫХ ДИФФЕРЕНЦИАЛЬНЫХ СПЕКТРОВ раствор белка одинаковой концентрации помещают в кюветы, в
- •Методы АБСОРБЦИОННОЙ и ДИФФЕРЕНЦИАЛЬНОЙ СПЕКТРОСКОПИИ широко используются для

МОДЕЛЬ АТОМА
Н.БОРА
Нильс Бор
(1885-1962)
Нобелевская премия, 1922

Первый постулат Бора (постулат стационарных состояний):
атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En.
В стационарных состояниях атом не излучает.
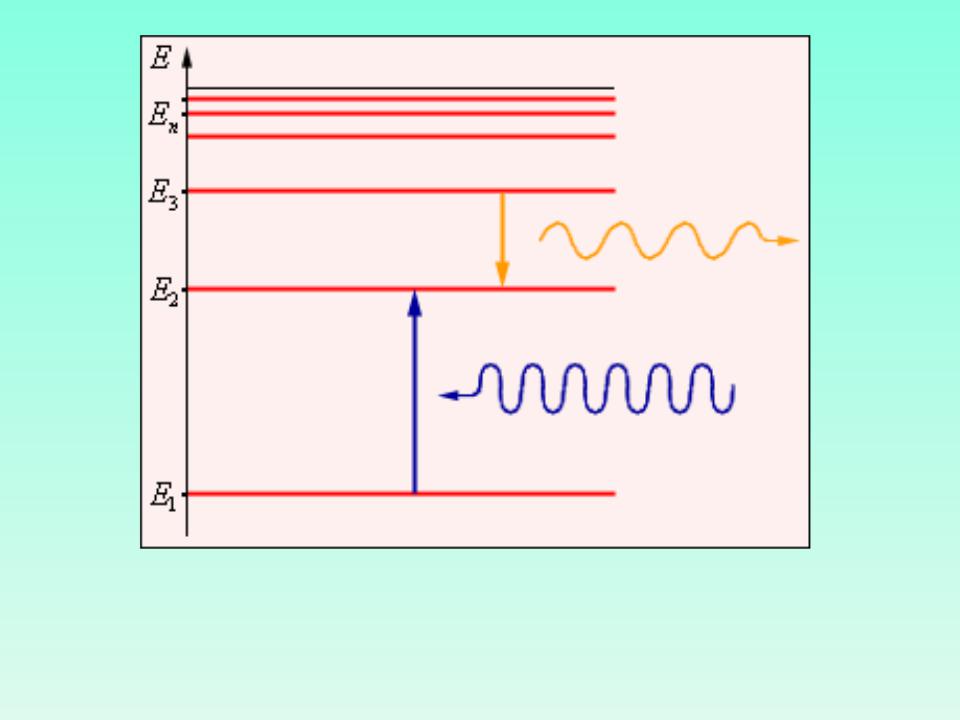
Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов

Второй постулат Бора (правило частот) : при переходе атома из одного стационарного состояния с энергией En в другое стационарное
состояние с энергией Em излучается или
поглощается квант, энергия которого равна разности энергий стационарных состояний
hνnm = En – Em

Нобелевская премия по физике, 1929 г.
Луи ДЕ БРОЙЛЬ
1892 –1987
Выдвинул гипотезу об универсальности
корпускулярно-волнового дуализма.
Он утверждал, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также волновыми свойствами.

ФОТОН как ЧАСТИЦА ОБЛАДАЕТ
ЭНЕРГИЕЙ
E = mc2 = h = hc / λ,
Где m - масса фотона, с - скорость света в вакууме, h -
постоянная Планка, - частота излучения, λ - длина волны
ИМПУЛЬСОМ
p=h /c=h/ λ
ВОЛНОВЫЕ ХАРАКТЕРИСТИКИ: ЧАСТОТА, ФАЗА, ДЛИНА ВОЛНЫ

По аналогии с соотношением между длиной волны
света и энергией фотона де Бройль высказал гипотезу о существовании соотношения между длиной волны и импульсом частицы (массы, умноженной на скорость
частицы).
ФОРМУЛА де БРОЙЛЯ:
λ = h / mv,
ГДЕ m - масса частицы, v - ее скорость, h - постоянная Планка

ДЛЯ ОПИСАНИЯ СОСТОЯНИЯ
ЭЛЕКТРОНА В АТОМЕ ВОДОРОДА В 1926 году ПРЕДЛОЖЕНО УРАВНЕНИЕ
ШРЕДИНГЕРА
Уравнение Э.Шредингера содержит волновую функцию и позволяет определить возможные состояния квантовой системы и их изменение во времени.

ψ - волновая функция характеризует движение электрона в пространстве как волнообразное возмущение; x, y, z - координаты, m - масса покоя электрона, h - постоянная Планка, E - полная энергия электрона, Ep - потенциальная энергия электрона

В ходе решения волнового уравнения вводятся целые числа - так называемые квантовые числа,
которые служат для описания состояний квантово- химической системы.
 Главное квантовое число
Главное квантовое число
Орбитальное квантовое число
Магнитное квантовое число
Спиновое квантовое число
 n l
n l
ml
 ms
ms
