
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«РОСТОВСКИЙ ГОСУДАРСТВЕННЫЙ СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ»
Утверждено
на заседании кафедры физики
08 февраля 2012 г.
Методические указания
к практическим занятиям
«Молекулярная физика и термодинамика»
для всех специальностей и
для всех профилей всех направлений бакалавриата
очной и заочной форм обучения
Ростов-на-Дону
2012
УДК 531.383
Методические указания к практическим занятиям «Молекулярная физика и термодинамика». – Ростов н/Д: Рост. гос. строит. ун-т, 2012. – 8 с.
Содержится краткая теория по молекулярной физике и термодинамике, в качестве пояснений к решению серии задач данного раздела физики. Основаны на учебном пособии «Курс физики» и на «Сборнике задач по курсу физики» Т.И. Трофимовой (изд-во «Высшая школа»), соответствующих действующей программе курса физики.
Предназначены для проведения практического занятия «Молекулярная физика и термодинамика» по программе курса физики для студентов всех специальностей и профилей всех направлений бакалавриата очной и заочной форм обучения.
УДК 531.383
Составитель: профессор В.И. Снежков
Рецензент: доцент Ю.И. Гольцов
Редактор н.Е. Гладких
Темплан 2012 г., поз. ___
Подписано в печать 16.05.12. Формат 60х84 1/16. Ризограф. Бумага писчая. Уч.-изд.л 0,3. Тираж 25 экз. Заказ
Редакционно-издательский центр
Ростовского государственного строительного университета.
334022, Ростов-на-Дону, ул. Социалистическая, 162
© Ростовский государственный
строительный университет, 2012
3
Краткая теория по теме: «Молекулярная физика и термодинамика»
□ Идеальный газ – это такая модель газа, в которой не учитывают размеры молекул, их взаимодействие, а столкновение молекул рассматривают как абсолютно упругий удар.
□ Основное уравнение молекулярно–кинетической теории газа устанавливает зависимость между давлением газа на стенки сосуда и средней кинетической энергией движения молекул: давление идеального газа зависит от концентрации молекул n и их средней кинетической энергии ‹eк› молекул:
р
= ⅔ n‹eк›
= (2/3)n∙mv2/2;
![]()
![]()
где концентрация n молекул – это отношение числа всех молекул к занимаемому ими объему V: n = N/V.
□ Средняя
квадратичная скорость молекул: ‹vкв›
= ![]()
![]() =
=
![]()
![]() R
= 8,31 Дж/(моль∙К) -
универсальная (молярная) газовая
постоянная; k
= R/NA
= 1,38∙10-23
Дж/К - постоянная Больцмана;
R
= 8,31 Дж/(моль∙К) -
универсальная (молярная) газовая
постоянная; k
= R/NA
= 1,38∙10-23
Дж/К - постоянная Больцмана;
m ― масса молекулы, M ―молярная масса газа.
□
Среднее значение
модуля скорости: ‹v›
= 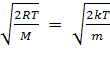
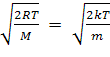 .
□ Наиболее
вероятное значение модуля скорости:
vв
=
.
□ Наиболее
вероятное значение модуля скорости:
vв
= 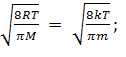
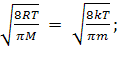
□ Уравнение состояния газа (уравнение Менделеева-Клапейрона):
pV = (m/M)RT
Это уравнение можно преобразовать к виду:
р = nkT
□ Первое начало термодинамики: изменение внутренней энергии системы ΔU при каком-либо переходе из состояния 1 в состояние 2 равно разности переданного количества Q теплоты и работе A совершаемой системой:
4
ΔU = Q – A или Q = ΔU + A
□
Внутренняя энергия
U
идеального газа определяется только
кинетической энергией хаотического
движения его молекул: U
= N‹eк›
= N
![]()
![]() kT
=
kT
= ![]()
![]() RT,
где i
– число степеней свободы ( для одноатомного
газа равно 3, для двухатомного – 5).
RT,
где i
– число степеней свободы ( для одноатомного
газа равно 3, для двухатомного – 5).
