
Адсорбция
.docxЦель работы – получить изотермы полимолекулярной адсорбции паров воды на твёрдом адсорбенте и определить удельную поверхность адсорбента.
АДСОРБЦИЯ
Поверхност-
|
ный атом взаимодействует с меньшим числом соседей, чем объёмный. Меньшее число связей приводит к тому, что поверхностные атомы обладают избыточной энергией. Доля поверхностных атомов обычно невелика, но с уменьшением размера частицы эта доля будет |
Рис. 6.1. Сравнение объёмного (a) и поверхностного (б) атомов |
расти, так как число поверхностных атомов пропорционально квадрату линейного размера, а общее число атомов пропорционально кубу. Отношение площади поверхности вещества к его массе называется удельной поверхностью, её значение может достигать сотен и даже нескольких тысяч м2/г.
На находящуюся в объёме молекулу силы межмолекулярного притяжения действуют со всех сторон, и их равнодействующая равна нулю. Напротив, сумма сил, действующих на молекулу у поверхности, не равна нулю и направлена вниз, стремясь втянуть молекулу внутрь. Это приводит к тому, что поверхностный слой твёрдого тела или жидкости ведёт себя подобно упругой натянутой плёнке и предоставленная самой себе жидкость стремится принять форму шара, т. е. геометрической фигуры с минимальным соотношением поверхность/объём. Если поверхность ограничена некоторой линией или контуром, сила Fтанг., приложенная к единице длины контура l и направленная тангенциально к поверхности, называется поверхностным натяжением :
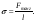 (6.1)
(6.1)
Размерность поверхностного натяжения Н/м или Дж/м2.
При
увеличении площади поверхности на
величину dA
совершается работа
 Для изохорно-изотермического или
изобарно-изотермического процесса эта
работа равна изменению свободной
энергии:
Для изохорно-изотермического или
изобарно-изотермического процесса эта
работа равна изменению свободной
энергии:
 (V,
T = const),
(V,
T = const),
 (Р,
T = const).
(Р,
T = const).
Отсюда видно, что поверхностное натяжение можно определить как свободную энергию, приходящуюся на единицу поверхности:
 (6.2)
(6.2)
Определения (6.1) и (6.2) эквивалентны, размерность σ в обоих случаях одинакова.
Поверхностное натяжение зависит от энергии межмолекулярного взаимодействия и существенно различается для разных жидкостей.
Снизить избыточную поверхностную энергию можно двумя путями: либо за счёт уменьшения удельной поверхности , либо за счёт Ван-дер-Ваальсовых взаимодействий с молекулами из другой фазы, контактирующими с поверхностью. поглощение вещества поверхностью из объёмной фазы называется адсорбцией, вещество, на поверхности которого протекает адсорбция, – адсорбентом, поглощённое вещество – адсорбатом, а вещество в объёмной фазе – адсорбтивом. Впрочем, допустимо также употребление терминов сорбция, сорбент, сорбат, сорбтив.
В зависимости от типа взаимо-действия «адсорбент – адсорбат» различают физическую и химическую адсорбцию (сокращённо физадсорбция и хемосорбция).
При физадсорбции адсорбат удерживают универсальные Ван-дер-Ваальсовы силы, поэтому взаи-модействие «адсорбент – адсорбат» неспецифично. Тепловой эффект при этом обычно составляет не более нескольких десятков килоджоулей на моль адсорбата, энергия активации отсутствует.
При хемосорбции связывание вещества с поверхностью происходит за счёт химической реакции, и процесс хемосорбции обладает её признаками: специфичностью, тепловым эффектом до сотен килоджоулей на моль адсорбата, наличием энергии активации.
Рассмотрим адсорбцию газа на поверхности твёрдого тела. Адсорбция Х, выраженная в граммах адсорбированного вещества, приходящихся на 1 г твёрдого тела, зависит от температуры Т, равновесного давления адсорбируемого газа P, а также свойств адсорбента и исследуемого адсорбтива. Поскольку при адсорбции энтропия системы понижается, то для её самопроизвольного протекания требуется, чтобы энтальпия процесса также была отрицательной. Вследствие этого адсорбция уменьшается с ростом температуры при неизменном давлении адсорбата в соответствии с уравнением изобары химической реакции.
Зависимость адсорбции от давления
Х = f(Р)T,
измеренная при постоянной температуре, носит название изотермы адсорбции (рис. 6.3). Обычно при построении изотермы адсорбции по оси абсцисс откладывается не абсолютное давление адсорбтива Р, а отношение Р/Р0, где Р0 – давление насыщенного пара адсорбтива при данной температуре.

Рис. 6.3. Различные типы изотерм адсорбции согласно классификации Брунауэра, Деминга, Деминга и Теллера (БДДТ)
Предположим, что взаимодействие «адсорбат – адсорбат» отсутствует, поверхность однородна и представляет собой набор «поса- дочных площадок» (рис. 6.4). Запишем уравнение процесса адсорб-
|
ции и десорбции следующим образом:
где Х – молекула адсорбтива, Z – свободная «посадочная площадка», XZ – адсорбированная молекула. Константу равновесия адсорбции можно записать как |
Рис. 6.4. Модель Лэнгмюра |
 где
где
 и
и
 – количество адсорбированных молекул
и свободных мест на единице поверхности
адсорбента.
– количество адсорбированных молекул
и свободных мест на единице поверхности
адсорбента.
Обозначим общее число посадочных мест символом Zm. Это так называемая ёмкость монослоя, т. е. максимальное количество адсорбата, размещающееся на единице поверхности адсорбента слоем в одну молекулу:

Обычно оперируют не абсолютными значениями адсорбции, а безразмерной степенью заполнения Θ – отношением числа адсорбированных молекул к ёмкости монослоя. Понятно, что в модели Лэнгмюра 0 ≤ Θ ≤ 1. Удобно перейти от абсолютного давления Р к относительному давлению Р/Р0, где Р0 – давление насыщенного пара адсорбтива при данной температуре. Поделив числитель и знаменатель на ёмкость монослоя Zm и на Р0, получим:

Поскольку значение Р0 при заданной температуре постоянно, его можно внести в константу, обозначив K = KaP0:

Отсюда
 (6.3)
(6.3)
Уравнение (6.3) называется изотермой Лэнгмюра (рис. 6.5).
|
Рис. 6.5. Изотерма Лэнгмюра |
Проанализируем это урав-нение. При низком давлении (малом значении Р/Р0) членом K∙(Р/Р0) в знаменателе можно пренебречь, и уравнение (6.3) переходит в известную изотерму Генри: Θ = K∙(Р/Р0). При Р/Р0 → 1 значение Θ стремится к единице, т. е. |
к предельной степени заполнения при монослойной адсорбции.
Для практических целей удобнее линеаризовать уравнение (6.3) следующим образом:
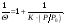
В таком виде оно более удобно для определения величины K.
Фундаментальное для адсорбции и широко используемое уравнение Брунауэра – Эммета – Теллера, сокращённо БЭТ.
Главные исходные предположения модели БЭТ:
-
поверхность энергетически однородна, т. е. энергия связи «адсорбент – адсорбат» одинакова на любом её участке;
-
первые молекулы адсорбтива садятся на поверхность адсорбента, последующие могут садиться как на поверхность адсорбента, формируя первый слой, так и на молекулы адсорбата, формируя второй, третий и т. д. слои (рис. 6.6);
-
константы равновесия адсорбции во всех слоях выше первого одинаковы и равны 1/Р0, где Р0 – давление насыщенного пара адсорбтива;
-
ёмкость монослоя одинакова для всех слоёв;
-
когда Р/Р0 = 1, адсорбат конденсируется так же, как обычная жидкость, и число слоёв становится бесконечным.
Кроме того, предполагается, что между слоями существует динамическое равновесие, т. е. в каждом слое число молекул, испаряющихся и конденсирующихся в любой промежуток времени, равны друг другу
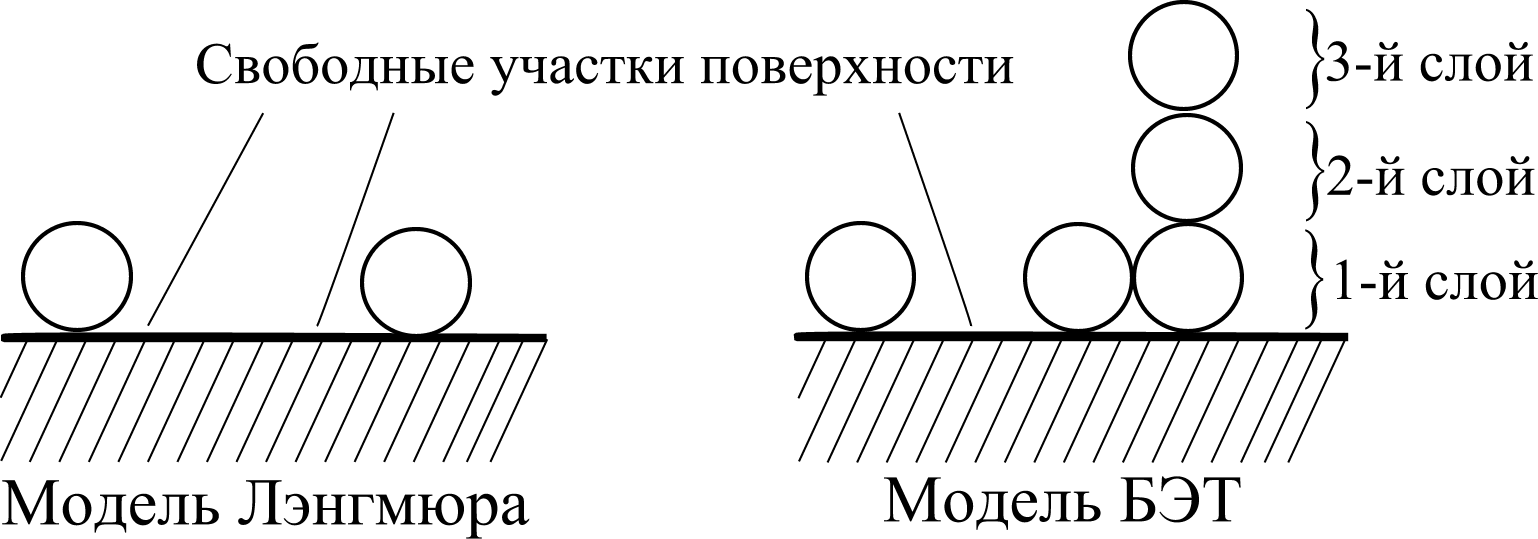
Рис. 6.6. Сравнение моделей Лэнгмюра и БЭТ
Обозначим ёмкость монослоя через Zm, долю свободной поверхности – через Θ0, долю поверхности, занятую слоем в 1 молекулу, – через Θ1, в 2 молекулы – через Θ2, в i молекул – через Θi. Тогда общее количество адсорбированных на единице поверхности молекул Z составит:
 (6.4)
(6.4)
Рассмотрим первый слой. Константа равновесия адсорбции K1 равна
 т.
е.
т.
е.

Для второго слоя:


Для третьего слоя:


Для i-го слоя:
 (6.5)
(6.5)
поскольку согласно модели БЭТ K2 = K3 =…= Ki = 1/Р0.
Для удобства записи обозначим P/Р0 = и домножим уравнение (6.5) на /:
 (6.6)
(6.6)
Видно,
что выражение
 есть некая константа. Перепишем уравнение
(6.6), заменив
есть некая константа. Перепишем уравнение
(6.6), заменив
 на с:
на с:
 (6.7)
(6.7)
Подставим теперь полученное выражение в (6.4) :

Обратим внимание, что

поэтому

Выражение
в квадратных скобках есть бесконечная
геометрическая прогрессия, её сумма
равна
 тогда
тогда
 (6.8)
(6.8)
Используя условие массобаланса, получаем, что доля незанятой поверхности Θ0 равна
 Учитывая,
что в соответствии с (6.7)
Учитывая,
что в соответствии с (6.7)
 получаем:
получаем:

Отсюда

Подставляем найденное значение 0 в (6.8):

Осталось лишь заменить введённую для упрощения выкладок величину на Р/Р0:
 (6.9)
Перед нами знаменитое уравнение
изотермы Брунауэра – Эммета –Теллера.
(6.9)
Перед нами знаменитое уравнение
изотермы Брунауэра – Эммета –Теллера.
Вместо Z, т. е. адсорбции, выраженной в молекулах на единицу площади адсорбента, можно брать Х, т. е. адсорбцию, выраженную в граммах на грамм адсорбента. Так как Z/Zm = Х/Хm, пересчитывать численные коэффициенты не придётся.
На практике используется линеаризованное уравнение БЭТ:
 (6.10)
где
Хm
– ёмкость монослоя, выраженная в граммах
адсорбата на грамм адсорбента.
(6.10)
где
Хm
– ёмкость монослоя, выраженная в граммах
адсорбата на грамм адсорбента.
Вид изотермы БЭТ соответствует кривой II на рис. 6.3. Приближённую оценку удельной поверхности можно сделать, считая, что полное заполнение монослоя примерно соответствует точке перегиба на графике.
Считая, что в монослойной плёнке молекулы всегда располагаются одинаково, плотнейшим образом (рис. 6.7), можно написать:
 где
N
– число молекул адсорбата, а
– площадь «посадочной площадки» одной
молекулы.
где
N
– число молекул адсорбата, а
– площадь «посадочной площадки» одной
молекулы.
Выразив число молекул адсорбата N через величину монослойной адсорбции в граммах сорбата на грамм сорбента Хm, получим формулу для определения удельной поверхности Ауд (размер- ность м2/г):
 (6.11)
(6.11)
Здесь М – молярная масса адсорбата г/моль, Na – число Авогадро 1/моль. Площадь а «посадочной площадки» молекулы на поверхности адсорбента несомненно зависит от способа её измерения, подобно радиусу иона в растворе. Брунауэр и Эммет предложили рассчитывать а по плотности адсорбата в жидком или твёрдом состоянии. Это приводит к формуле

 (6.12)
(6.12)
где – плотность жидкого адсорбата г/м3, а f – фактор упаковки, значение которого зависит от числа ближайших соседей. При двенадцати ближайших соседях в жидкости и шести на плоскости (плотнейшая упаковка) f = 1,091.
В случае растворов избыток энергии поверхностных атомов и поверхностное натяжение зависят от химического состава поверхностного слоя.
Вещество, снижающее поверхностное натяжение растворителя, будет концентрироваться в поверхностном слое. Растворённое вещество, увеличивающее поверхностное натяжение, не будет самопроизвольно концентрироваться в поверхностном слое, и поверхностное натяжение такого раствора будет слабо отличаться от поверхностного натяжения чистого растворителя.
Вещества первого типа называются поверхностно-активными (ПАВ), второго – поверхностно-инактивными. Обычно вещества, которые являются поверхностно-активными в водных растворах, состоят из длинного гидрофобного «хвоста» и гидрофильной «головы». В качестве примера можно привести соли жирных кислот.
Для двухкомпонентного раствора эта связь описывается уравнением
 (6.13)
(6.13)
которое называется изотермой адсорбции Гиббса1. Здесь – поверхностное натяжение, С – концентрация растворённого вещества в растворе, которая предполагается много меньшей, чем концентрация растворителя, Г2 – избыточная концентрация растворённого вещества в поверхностном слое в моль/м2.
Из
уравнения (6.13) видно, что если поверхностное
натяжение раствора снижается при добавке
растворённого вещества, то
 а Г2
> 0 и растворённое вещество действительно
будет самопроизвольно концентрироваться
в поверхностном слое. С помощью изотермы
Гиббса можно количественно рассчитать
величину этого эффекта.
а Г2
> 0 и растворённое вещество действительно
будет самопроизвольно концентрироваться
в поверхностном слое. С помощью изотермы
Гиббса можно количественно рассчитать
величину этого эффекта.
1 Вывод уравнения (6.13) см., например, в работах [1, 8] в списке рекомендуемой литературы (разд. 10).




