
Лабораторный практикум по химии
.pdf
Образовавшийся раствор хромита натрия Na3CrO3 поместить в две пробирки. Одну пробирку оставить в качестве контрольной. В другую пробирку добавить по каплям 30%-ный раствор пероксида водорода до перехода зеленой окраски хромит-иона CrO33– в желтую окраску, обусловленную образованием хромат-иона CrO42–.
Написать уравнение соответствующей реакции. Какую роль выполняет пероксид водорода в данной реакции?
б) Окислительно-восстановительная двойственность пероксида водорода в кислой среде
В качестве окислителя используем KMnO4, в качестве восстановителя - KI.
Выполнение опыта. В две пробирки внести по 2 - 3 капли растворов: в первую - перманганата калия KMnO4, во вторую - иодида калия KI. Затем в обе пробирки добавить по 2 - 3 капли 2 н. раствора серной кислоты и по 3 - 5 капель пероксида водорода. Отметить выделение газа и обесцвечивание раствора в первой пробирке и появление окрашивания - во второй.
Написать уравнения соответствующих реакций, учитывая, что ион MnO4– восстанавливается до иона Mn2+, а ион I– окисляется до I2. Какую роль выполняет пероксид водорода в каждой из реакций?
Опыт 4. Факторы, влияющие на протекание ОВР
Протекание ОВР (возможность протекания, скорость протекания и продукты реакций) находится в зависимости от следующих факторов: природы взаимодействующих веществ, концентрации раствора, температуры, реакции среды, присутствия катализатора.
а) Влияние природы металла на процесс взаимодействия с водными растворами щелочей
Взаимодействие металлов с растворами щелочей зависит от природы металлов. Металлы, гидроксиды которых имеют амфотерный характер, способны вытеснять водород из воды в присутствии растворов сильных щелочей. Реакция идет в две стадии: вначале металл окисляется водой до оксида или гидроксида, который далее взаимодействует со щелочью с образованием соответствующей соли.
PDF created with pdfFactory Pro trial version www.pdffactory.com

Выполнение опыта. В три пробирки поместить по 1 - 2 кусочка металлов: в первую - цинка, во вторую - железа, в третью - алюминия и прибавить по 5 - 7 капель 10%-ного раствора едкого натра NaOH. Дать содержимому пробирок постоять 2 - 3 минуты. Отметить выделение газа в первой и третьей пробирках.
Написать уравнения соответствующих реакций, учитывая, что окислителем является вода и при этом восстанавливается водород.
б) Влияние концентрации кислоты на процесс окисления цинка серной кислотой
Продукты реакции окисления металлов серной кислотой зависят как от природы металла (положения в ряду напряжений), так и от концентрации раствора кислоты. Серная кислота проявляет окислительные свойства как за счет ионов Н+ (в разбавленных растворах), так и за счет ионов SO42–, содержащих атомы серы в высшей степени окисления. В первом случае происходит выделение Н2 в свободном состоянии, во втором случае в зависимости от активности восстановителя могут выделяться SO2, S0, H2S. Цинк является активным восстановителем и окисляется кислотами до Zn2+.
Выполнение опыта. В две пробирки поместить по кусочку цинка и добавить в одну пробирку 5 - 7 капель 2 н. раствора серной кислоты, в другую - столько же концентрированной серной кислоты. Отметить выделение газа в обеих пробирках. Какой газ выделяется? Осторожно подогреть пробирки. В одной из пробирок отметить образование осадка свободной серы. Написать уравнения соответствующих реакций и указать роль цинка в окислительно-восстановительных реакциях.
Сравнить восстановительную активность металлов, способных к выделению водорода из воды и растворов кислот. В какой среде их восстановительная активность больше?
Опыт 5. Окисление меди разбавленной и концентрированной азотной кислотой
Медь относится к неактивным металлам, стоит в ряду напряжений правее водорода и окисляется только азотной и концентрированной серной кислотами. Азотная кислота проявляет сильные окислительные свойства за счет ионов NO3–, содержащих атомы азота в высшей степени окисления, и окисляет все металлы, кроме золота, платины и
PDF created with pdfFactory Pro trial version www.pdffactory.com

металлов платиновой группы. При этом в зависимости от активности восстановителя и концентрации раствора кислоты могут выделяться NO2 (бурый газ), NO (бесцветный газ, окисляющийся кислородом воздуха до NO2), N2, NH3 (бесцветный газ с резким запахом).
Выполнение опыта. В две пробирки поместить по кусочку меди и добавить в одну пробирку 5 - 8 капель 2 н. раствора азотной кислоты, в другую - столько же концентрированной азотной кислоты. Осторожно подогреть пробирки. Отметить выделение газов, их окраску и изменение цвета раствора в обеих пробирках. Какой газ выделяется в каждой из пробирок? Написать уравнения соответствующих реакций и указать роль меди в окислительно-восстановительных реакциях.
Опыт 6. Влияние среды на протекание окислительновосстановительных реакций
В зависимости от реакции среды может измениться характер протекания процесса между одними и теми же веществами. Известно, например, что перманганат-ион является сильным окислителем, но его окислительные свойства зависят от pH среды. Наибольшую окислительную активность перманганат-ион (MnO4–) проявляет в кислой среде, восстанавливаясь до Mn2+; меньшую - в нейтральной или слабощелочной среде, восстанавливаясь до Mn+4 (MnO2); наименьшую - в сильнощелочной, восстанавливаясь до Mn+6 (MnO42–):
Выполнение опыта. В три пробирки внести по 3 - 4 капли раствора перманганата калия и добавить по 2 - 3 капли: в первую - 2 н. раствора серной кислоты, во вторую - воды, в третью - 2 н. раствора щелочи. Во все три пробирки внести по микрошпателю кристаллического сульфита натрия и перемешать растворы до полного растворения кристаллов. Через 1 - 2 минуты отметить обесцвечивание раствора в первой пробирке, выпадение бурого осадка - во второй и быстро исчезающую зеленую окраску раствора - в третьей.
PDF created with pdfFactory Pro trial version www.pdffactory.com

Написать уравнения соответствующих реакций восстановления перманганата калия, учитывая, что перманганат-ион (MnO4–) в кислой среде переходит в ион Mn2+, в нейтральной - в MnO2, а в щелочной - в манганат-ион MnO42–. Сульфит-ион окисляется до сульфат-иона.
Опыт 7. Диспропорционирование йода в щелочной среде
Реакции самоокисления-самовосстановления или диспропорциони-
рования - это реакции, в которых один и тот же элемент и понижает, и повышает свою степень окисления, т.е. сам себя окисляет и сам себя восстанавливает. Такой тип ОВР характерен для неметаллов и соединений, содержащих элемент в промежуточной степени окисления. Например:
3S0 + 6NaOH = 2Na2S–2 + Na2S+4O3 + 3H2O;
2K2Mn+6O4 + 2H2O = 2KMn+7O4 + Mn+4O2 + 4KOH.
Выполнение опыта. В пробирку поместить 1 - 2 кристаллика йода, 3 - 5 капель раствора едкого натра NaOH и нагреть. Отметить обесцвечивание раствора. Написать уравнение реакции, учитывая, что продуктом окисления йода в щелочной среде является иодат натрия NaIO3. К охлажденному раствору прибавить по каплям разбавленный раствор серной кислоты для создания слабокислой среды. Что происходит? Можно ли обратный процесс назвать диспропорционированием?
Опыт 8. Каталитическое диспропорционирование пероксида водорода
Пероксид водорода, содержащий кислород в промежуточной степени окисления –1, при нормальных условиях медленно разлагается (диспропорционирует) на свободный кислород и воду:
2H2O2–1 = O20 + 2H2O–2.
Реакция замедляется при отсутствии освещения (в темноте) и ускоряется в присутствии катализатора (диоксида марганца MnO2).
PDF created with pdfFactory Pro trial version www.pdffactory.com

Выполнение опыта. В пробирку внести 3 - 5 капель 10%-ного раствора пероксида водорода. Отметить, что в обычных условиях заметного разложения пероксида водорода не наблюдается. К раствору добавить несколько крупинок диоксида марганца. Отметить выделение пузырьков газа. Поднести к отверстию пробирки тлеющую лучинку. Какой газ выделяется?
Сделать вывод о влиянии катализатора на скорость реакции.
Опыт 9. Реакция внутримолекулярного окислениявосстановления перманганата калия
Реакции внутримолекулярного окисления-восстановления - это реакции между разными атомами элементов внутри молекулы вещества. При этом у одного из атомов степень окисления понижается (окислитель), а у другого - повышается (восстановитель).
Выполнение опыта. В пробирку поместить 1 - 2 микрошпателя перманганата калия и осторожно нагреть на небольшом пламени горелки. К отверстию пробирки поднести заранее приготовленную тлеющую лучинку. Какой газ выделяется? После прекращения выделения газа дать пробирке остыть, и затем ее содержимое растворить в 6 - 8 каплях воды, перемешивая стеклянной палочкой. Отметить зеленую окраску полученного раствора манганата. Дать раствору постоять 3 - 5 минут. Отметить помутнение раствора, сопровождающееся образованием осадка бурого цвета (MnO2) и раствора розовой окраски.
Написать уравнения соответствующих реакций разложения перманганата калия на манганат калия и кислород, а также диспропорционирования манганата калия K2MnO4 с образованием MnO2 и KMnO4. Добавлением раствора серной кислоты процесс разложения манганата калия можно ускорить. Почему?
Опыт 10. Реакция межмолекулярного окислениявосстановления между иодидом и иодатом калия
Реакции межмолекулярного окисления-восстановления - это реакции между различными веществами, одно из которых является окислителем, другое - восстановителем.
PDF created with pdfFactory Pro trial version www.pdffactory.com

Выполнение опыта. В пробирку поместить 2 - 3 капли раствора иодида калия KI, добавить столько же раствора серной кислоты и 3 - 4 капли раствора иодата калия KIO3. Отметить появление краснобурого окрашивания раствора, обусловленного выделением свободного йода. К раствору добавить 2 - 3 капли бензола. Наблюдать экстрагирование йода бензолом и интенсивное окрашивание бензольного кольца.
Написать уравнение реакции, учитывая, что продуктом окисления I– и восстановления IO3– является свободный йод I2.
Контрольные задания
Задание 1. Получить у преподавателя пробирку с раствором перманганата калия KMnO4. Имея в своем распоряжении растворы серной кислоты, нитрата калия и сульфита натрия, доказать окислительные свойства перманганата калия. Написать соответствующие уравнения реакций.
Задание 2. Получить у преподавателя пробирку с раствором перманганата калия KMnO4. Имея в своем распоряжении растворы серной кислоты, нитрата и нитрита калия, определить, в какой из пробирок находится нитрат калия. Написать соответствующее уравнение реакции.
Задание 3. Получить у преподавателя пробирку с раствором перманганата калия KMnO4. Имея в своем распоряжении растворы серной кислоты, нитрата калия и иодида калия, доказать окислительные свойства перманганата калия. Написать соответствующее уравнение реакции.
Задание 4. Получить у преподавателя пробирку с раствором перманганата калия KMnO4. Имея в своем распоряжении растворы серной кислоты, нитрата калия и сульфида натрия, определить, в какой из пробирок находится нитрат калия. Написать соответствующее уравнение реакции.
Задание 5. Получить у преподавателя пробирку с раствором бихромата калия K2Cr2O7. Имея в своем распоряжении растворы серной кислоты, нитрата калия и сульфита натрия, доказать окислительные свойства бихромата калия K2Cr2O7. Написать соответствующее уравнение реакции.
Задание 6. Получить у преподавателя пробирку с раствором бихромата калия K2Cr2O7. Имея в своем распоряжении растворы серной
PDF created with pdfFactory Pro trial version www.pdffactory.com

кислоты, нитрата и нитрита калия, определить, в какой из пробирок находится нитрит калия. Написать соответствующее уравнение реакции.
Задание 7. Получить у преподавателя пробирку с раствором иодида калия KI. Имея в своем распоряжении растворы серной кислоты, бихромата калия K2Cr2O7 и сульфида натрия, доказать восстановительные свойства иодида калия. Написать соответствующее уравнение реакции.
Задание 8. Получить у преподавателя пробирку с растворами сульфата и сульфита калия. Имея в своем распоряжении растворы серной кислоты и перманганата калия KMnO4, определить, в какой из пробирок находится сульфит калия. Написать соответствующее уравнение реакции.
Задание 9. Получить у преподавателя пробирки с растворами иодида KI и нитрата KNO3 калия. Имея в своем распоряжении растворы серной кислоты и бихромата калия K2Cr2O7, определить, в какой из пробирок находится иодид калия. Написать соответствующее уравнение реакции.
Задание 10. Получить у преподавателя пробирку с раствором перманганата калия KMnO4. Имея в своем распоряжении растворы серной кислоты, сульфата и сульфида натрия, доказать окислительные свойства перманганата калия. Написать соответствующее уравнение реакции.
Задание 11. Получить у преподавателя пробирку с раствором пероксида водорода Н2O2. Имея в своем распоряжении растворы серной кислоты, перманганата и иодида калия, определить, какую роль играет пероксид водорода в каждой из реакций. Написать соответствующие уравнения реакций.
Задание 12. Получить у преподавателя пробирку с растворами пероксида водорода Н2O2 и иодида калия. Имея в своем распоряжении растворы серной кислоты и перманганата калия KMnO4, определить, в какой из пробирок находится пероксид водорода. Написать соответствующие уравнения реакции.
Контрольные вопросы
1.Какие реакции называются окислительно-восстановительными?
2.Определите степень окисления хрома в следующих соединениях:
Cr2O3; K2CrO4; Na2Cr2O7; Cr2(SO4)3; Na3[Cr(OH)6]; (NH4)2Cr2O7.
PDF created with pdfFactory Pro trial version www.pdffactory.com

3. Укажите, в каких из приведенных процессов происходит окисление, а в каких - восстановление азота, как при этом изменяется его степень окисления: NO3– → NO; NO2– → NO3–; NH4+ → N2.
4. Определите, какие из следующих реакций относятся к ОВР:
а) NH4Cl = NH3 + HCl; |
б) 4P + 3KOH + 3H2O = PH3 + 3KH2PO2; |
в) NH4NO3 = N2O + 2H2O; |
г) 3Ge + 4HNO3 = 3GeO2 + 4NO + 2H2O; |
д) H2 + Br2 = 2HBr; |
е) H3BO3 + 4HF = H[BF4] + 3H2O; |
ж) SiCl4 + 2H2O = SiO2 + 4HCl; |
з) K3PO4 + 2H2O = KH2PO4 + 2KOH; |
и) GeO2 + H2O = H2GeO3; |
к) (NH4)2Cr2O7 Cr2O3 + N2 + 4H2O. |
|
5. Определите, какие из следующих ионов могут выполнять функции восстановителей, а какие - окислителей:
Sn2+; I–; WO42–; ClO3–; NO3–; Au3+; S2–; FeO42–; Fe2+ .
6. Определите, какие из перечисленных веществ и за счет каких элементов проявляют окислительно-восстановительную двойственность:
HI; Na2SO3; Mg; K2MnO4; PH3; CO; K2Cr2O7.
7.Расположите ионы Se2–, S2–, Te2– в порядке возрастания их восстановительной активности.
8.Расположите атомы S, Se, Te в порядке возрастания их окислительной активности. Какую роль могут выполнять неметаллы
вОВР?
9.Определите, к какому типу относятся следующие ОВР:
а) 2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4; б) 2H2O2 = 2H2O + O2;
в) 3S + 6KOH = K2SO3 + 2K2S + 3H2O;
г) 4P + 3KOH + 3H2O = PH3 + 3KH2PO2;
д) 2K4[Fe(CN)6] + Br2 = 2KBr + 2K3[Fe(CN)6]; е) (NH4)2Cr2O7 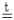 N2 + Cr2O3 + 4H2O.
N2 + Cr2O3 + 4H2O.
10.Какие факторы влияют на протекание ОВР?
11.Какую роль выполняют металлы в ОВР?
12.Используя ионно-электронный метод, закончите следующие ОВР, применяемые для травления металлических пленок,
полупроводников, оксидов:
а) Cu + CrO3 + H2SO4 → Cu2+ + Cr3+; б) Ag + H2O2 + NH4OH → [Ag(NH3)2]+; в) Ti + HF + HNO3 → [TiF6]2– + NO;
PDF created with pdfFactory Pro trial version www.pdffactory.com

г) Au + KBr + Br2 → [AuBr4]–;
д) Cr + KMnO4 + KOH → [Cr(OH)6]3– + MnO42–; е) Si + HF + HNO3 → [SiF6]2– + NO;
ж) Cr2O3 + KOH + KClO3 → CrO42– + Cl–;
з) Nb + HNO3 + NH4F → [NbF7]2– + NO;
и) PbS + H2O2 → PbSO4;
к) Mo + K3[Fe(CN)6] + KOH → MoO42– + [Fe(CN)6]4–;
л) Al + H2O2 + HCl → Al3+;
м) Ag + CrO3 + H2SO4 → Ag++ Cr3+;
н) As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO.
PDF created with pdfFactory Pro trial version www.pdffactory.com

Работа № 9
Электрохимические процессы
Химические источники тока
Опыт 1. Изготовление гальванического элемента и расчет его ЭДС
Гальванические элементы - это химические источники тока. Они состоят из двух электродов первого рода (металлов, опущенных в растворы собственных солей), соединенных во внешней и внутренней цепях.
Рассмотрим элемент, состоящий из металлического цинка, погруженного в 0,1 М раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Схема рассматриваемого гальванического элемента:
(–) Zn|Zn(NO3)2(0,1M)||Pb(NO3)2(0,02M)|Pb (+).
анод катод Поскольку цинк стоит левее в ряду напряжений и является более
активным металлом, он окисляется: Zn – 2e = Zn2+, т.е. этот электрод является анодом.
На свинцовом электроде ( ϕ0Pb > ϕ0Zn ) происходит восстановление
ионов: Pb2+ + 2e = Pb, т.е. он служит катодом.
Во внутренней цепи избыток ионов NO3– через электролитический мостик перемещается из раствора Pb(NO3)2 в раствор Zn(NO3)2.
За счет протекания окислительно-восстановительной реакции возникает электрический ток. Если во внешнюю цепь включить вольтметр, то он покажет определенную разность потенциалов.
ЭДС гальванического элемента рассчитывается как разность электродных потенциалов катода и анода:
Εг.э. = ϕ катода – ϕ анода.
Чтобы определить ЭДС гальванического элемента, необходимо вычислить электродные потенциалы катода и анода. Для этого в табл.П3.7 находим значения стандартных электродных потенциалов
PDF created with pdfFactory Pro trial version www.pdffactory.com
