
Лабораторный практикум по химии
.pdf
Работа № 4
Процессы, протекающие при образовании растворов
Истинные растворы - это многокомпонентные гомогенные системы переменного состава с размером частиц менее 1 нм, находящиеся в состоянии химического равновесия и неограниченно стабильные во времени. В дальнейшем вместо словосочетания «истинный раствор» мы будем говорить просто «раствор».
Процесс растворения веществ сопровождается выделением или поглощением тепла, изменением объема и окраски. Эти, а также некоторые другие явления указывают на химическое взаимодействие растворенного вещества и растворителя. Этот факт впервые был установлен Д.И. Менделеевым, создавшим свою известную гидратную теорию, согласно которой растворение является химическим процессом. При растворении частицы растворенного вещества образуют с молекулами растворителя неопределенные по составу, более или менее прочные соединения, называемые сольватами. В случае, когда растворителем является вода, они называются гидратами. Сольваты образуются тем легче и они тем более устойчивы, чем более полярны молекулы растворенного вещества и растворителя.
Иногда молекулы воды бывают так прочно соединены с частицами растворенного вещества, что при выделении последнего из раствора в виде кристаллов вода входит в их состав. Кристаллы, содержащие в своем составе воду, называют кристаллогидратами, а воду, в них находящуюся, - кристаллизационной.
Опыт 1. Изменение температуры при растворении в воде нитратов и концентрированной серной кислоты
При растворении твердого вещества в воде наблюдаются два
важнейших процесса: во-первых, |
происходит |
образование |
гидратов |
|
(часто это аквакомплексы), что |
связано с |
выделением |
теплоты, |
|
а во-вторых, идет распределение |
гидратированных |
частиц |
вещества |
|
в растворителе, что связано с поглощением теплоты. |
Общий тепловой |
|||
PDF created with pdfFactory Pro trial version www.pdffactory.com

эффект растворения (происходит выделение или поглощение тепла) зависит от того, тепловой эффект какого процесса преобладает.
Выполнение опыта. В две пробирки налить (до 1/3) воды и измерить ее температуру. В первую пробирку поместить 2 - 3 г нитрата аммония, во вторую - несколько капель концентрированной серной кислоты. Содержимое пробирок перемешать и измерить температуру полученных растворов. Отметить, при растворении какого вещества теплота выделяется, а какого - поглощается.
Опыт 2. Изменение объема при растворении спирта в воде
Выполнение опыта. Налить в цилиндр с притертой пробкой 5 - 10 мл воды и осторожно добавить такой же объем спирта. Отметить объем полученного раствора. Закрыть цилиндр пробкой и хорошо перемешать. После охлаждения отметить объем раствора. Объяснить происходящее явление.
Опыт 3. Изменение окраски при растворении сульфата меди в воде
Выполнение опыта. Небольшое количество (~ 0,5 г) медного купороса прокалить в термостате при 120 - 150 °С в течение 15 - 30 минут до почти полного исчезновения синей окраски. Полученный порошок растворить в воде. Наблюдать появление синей окраски. Объяснить происходящее явление.
Опыт 4. Влияние типа растворителя на процесс растворения
Процессы, протекающие при растворении, зависят как от типа растворенного вещества, так и от типа растворителя. «Подобное растворяется в подобном», т.е. в полярных растворителях хорошо растворяются соединения с полярными (ионными) связями. В воде хорошо растворяются сильные основания, кислоты, соли и плохо растворяются ковалентные соединения. В неполярных растворителях
PDF created with pdfFactory Pro trial version www.pdffactory.com

(бензол, четыреххлористый углерод и т.д.) лучше растворяются ковалентные соединения. При этом молекулы растворенных веществ по-разному взаимодействуют с молекулами растворителя.
Выполнение опыта. В три пробирки поместить по 2 - 3 кристалла йода. В первую пробирку добавить немного бензола, во вторую - спирта, в третью - воды. Хорошо перемешать содержимое пробирок.
Отметить цвет полученных растворов. Различная окраска растворов объясняется тем, что неполярные молекулы бензола не соединяются с молекулами йода, а полярные молекулы спирта образуют с йодом сольваты. В воде йод практически не растворяется.
Опыт 5. Зависимость растворимости солей от температуры. Получение пересыщенных растворов
Растворимость твердых веществ в жидкостях всегда ограничена и изменяется в очень широких пределах. Различным изменением растворимости веществ с повышением температуры часто пользуются на практике для отделения друг от друга солей.
Растворимость жидкостей в жидкостях различна. Большинство жидкостей имеют ограниченную взаимную растворимость. При повышении температуры их растворимость в одних случаях увеличивается, а в других - уменьшается.
Растворимость газов также различна. Большая часть газов лучше растворяется в менее полярных растворителях, чем вода. Растворимость газов уменьшается при нагревании и понижении давления. Существует следующая зависимость: масса газа, растворяющаяся в данном объеме жидкости, прямо пропорциональна давлению.
В зависимости от содержания растворенного вещества растворы бывают насыщенные, ненасыщенные и пересыщенные. Насыщенными называют растворы, в которых нерастворенное вещество (в осадке) находится в равновесии с растворенным. Растворимость вещества определяется концентрацией насыщенного раствора. Эту концентрацию выражают коэффициентом растворимости, т.е. количеством граммов растворенного вещества, приходящихся на 100 г растворителя.
Раствор, концентрация которого меньше концентрации насыщенного при данной температуре раствора, называют ненасыщенным. Если же концентрация больше, чем концентрация насыщенного при данной температуре раствора, раствор называют
PDF created with pdfFactory Pro trial version www.pdffactory.com

пересыщенным. Пересыщенные растворы получаются при осторожном охлаждении растворов, полученных при повышенных температурах. Они, как правило, неустойчивы и при понижении температуры или введении в них кристалла растворенного вещества кристаллизуются.
Выполнение опыта. Налить в пробирку воды и добавить немного хлорида натрия. Раствор перемешать, если вся соль растворится, добавить избыток соли. Нагреть содержимое пробирки. Если соль полностью растворится, добавить еще небольшое ее количество до получения насыщенного раствора, находящегося в равновесии с осадком. Осторожно слить с нерастворившихся кристаллов горячий раствор в другую пробирку и дать ему остыть. Получен пересыщенный раствор. Отметить кристаллизацию раствора при охлаждении.
Опыт повторить с нитратом натрия.
Контрольные вопросы
1.Какие процессы наблюдаются при образовании растворов?
2.Укажите внешние признаки, сопровождающие процессы растворения.
3.Перечислите факторы, влияющие на процесс растворения.
4.Охарактеризуйте ненасыщенные, насыщенные и пересыщенные
растворы.
PDF created with pdfFactory Pro trial version www.pdffactory.com

Работа № 5
Приготовление растворов заданной концентрации
Способы выражения концентрации растворенного вещества в растворе. Массовая доля ω - отношение массы растворенного вещества к общей массе раствора (масса вещества в 1 г раствора). ω выражается в относительных единицах или в процентах. Массовая доля, выраженная в процентах, называется процентной концентрацией и обозначается C% (масса вещества в 100 г раствора).
w = |
mв-ва |
, доли |
или С% = |
mв-ва |
×100,% . |
|
|
||||
|
mр−ра |
|
mр−ра |
||
Мольная доля χ - отношение количества молей растворенного вещества к общему количеству молей в растворе:
χ = |
nв−ва |
, |
доли или χ = |
nв−ва |
×100,% . |
|
nр−ра |
nр−ра |
|||||
|
|
|
|
Мольная доля аналогично массовой доле выражается в относительных единицах или процентах.
Объемная доля σ - отношение объема растворенного вещества к общему объему раствора (для газообразных систем):
σ = |
Vв−ва |
, доли или |
σ = |
Vв−ва |
×100,% . |
|
V |
V |
|||||
|
|
|
|
|||
|
р−ра |
|
|
р−ра |
|
Моляльность Cm - отношение количества растворенного вещества к массе растворителя (моль/кг) (количество молей вещества в 1 кг растворителя):
Cm = |
n(в−ва) ×1000 |
или |
Cm = |
m(в−ва) ×1000 |
. |
|
|||||
|
m(р−ля) |
|
|
μ(в−ва) × m(р−ля) |
|
PDF created with pdfFactory Pro trial version www.pdffactory.com

Массовая концентрация ρ - отношение массы растворенного вещества к общему объему раствора (г/л) (масса вещества в 1 л раствора):
ρ = m(в-ва) ×10−3 .
В аналитической химии используется титр T - количество граммов растворенного вещества, содержащееся в 1 мл раствора (г/мл):
Т= m(в−ва) , г/мл.
V(р−ра)
Молярная концентрация CM, или M - отношение количества молей растворенного вещества к общему объему раствора (моль/л) (количество молей вещества в 1 л раствора):
CМ = |
nв−ва |
или СМ = |
mв−ва |
. |
|
|
|||
|
Vр−ра |
μв−ва × Vр−ра |
||
Эквивалентная (или нормальная) концентрация CН - отношение количества эквивалентов (эквивалент - это количество вещества, которое нацело реагирует с 1 молем атомов водорода или вытесняет это количество водорода из его соединений) растворенного вещества к общему объему раствора (моль - экв/л) (количество моль-эквивалентов вещества в 1 л раствора):
C |
н |
= |
nэ(в−ва) |
или С |
н |
= |
|
m(в−ва) |
. |
||
V |
μ |
э(в−ва) |
× V |
||||||||
|
|
|
|
|
|||||||
|
|
|
(р−ра) |
|
|
|
|
(р−ра) |
|
||
Эквивалентная масса соотносится с мольной массой следующим образом:
• для кислот: |
Эк = |
М |
; |
|
|
||
|
|
|
nH+ |
|
|||
• для оснований: |
Эосн |
= |
М |
; |
|
||
|
|
||||||
|
|
|
|
nOH− |
|
||
• для солей и оксидов: |
Э = |
|
|
М |
, |
||
|
n Me ×BMe |
|
|||||
где nH+ - основность кислоты; nOH– - кислотность основания; nMe - число атомов металла в молекуле соли или оксида; BMe - валентность металла.
PDF created with pdfFactory Pro trial version www.pdffactory.com

Например: |
|
|
|
|
|
|
|
|
М |
|
|
|
|
|
|||||||||
ЭH SO |
|
= |
М |
|
= |
98 |
= 49 г/экв; |
Э |
|
= |
= 63 г/экв; |
||||||||||||
4 |
|
|
|
HNO3 |
|
|
|
||||||||||||||||
2 |
|
|
2 |
|
2 |
|
|
|
|
1 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
ЭKOH = М = 56 г/экв; |
ЭBa(OH) |
|
= |
М |
= |
|
171 |
= 85,5 г/экв; |
|||||||||||||||
|
2 |
2 |
|||||||||||||||||||||
|
|
2 |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ЭFeCl |
|
|
= |
|
М |
= 172,5 = 57,5 г/экв; |
ЭAl (SO |
) = |
|
|
М |
|
= 342 = 57 г/экв. |
||||||||||
|
|
1× 3 |
2 × 3 |
|
|||||||||||||||||||
|
3 |
|
|
3 |
|
2 |
4 |
|
3 |
|
6 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Отсюда следует, что для кислот CH = CM . nH+; для оснований
CH = CM . nOH–; для солей и оксидов CH = CM . nMe . BMe.
Моляльность, мольная доля и массовая доля широко применяются в физико-химических исследованиях, так как они не связаны с объемом раствора и не зависят от температуры. В аналитической химии для количественных определений часто пользуются титрованными растворами (растворами с известным титром), а также растворами с известной эквивалентной (нормальной) концентрацией.
Метод приготовления раствора зависит от способа выражения заданной концентрации. Общим для всех методов является то, что сухие вещества взвешиваются на технохимических или аналитических весах в зависимости от величины навески и точности, с которой должен быть приготовлен раствор.
Жидкие вещества отмеряются мерными сосудами: мензурками, цилиндрами, пипетками или бюретками.
При расчете объема жидкостей часто пользуются соотношениями
ρ = m / V; |
V = m / ρ, |
где ρ - плотность жидкости (в г/мл или г/см3); m - масса жидкости (в г); V - объем жидкости (в мл или см3).
PDF created with pdfFactory Pro trial version www.pdffactory.com
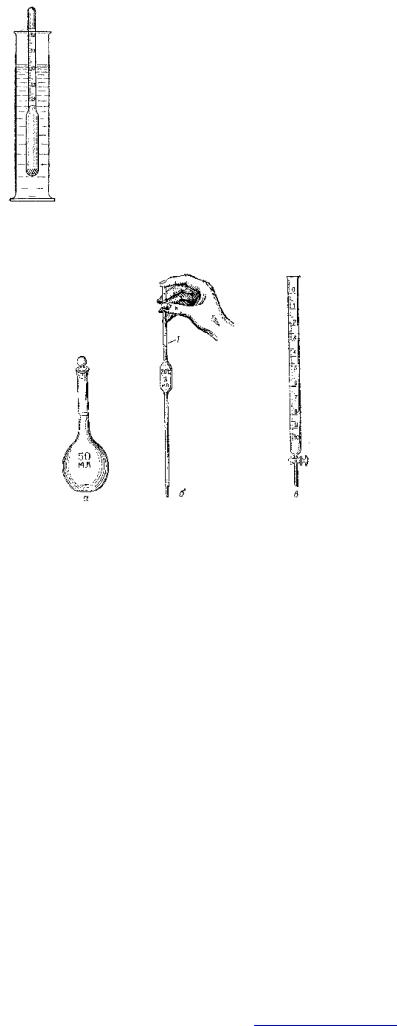
На практике плотность жидких веществ и
растворов измеряется ареометром (рис.1), шкала которого позволяет определять плотность обычно с точностью до 0,005 г/см3, что соответствует погрешности примерно в 1%. Плотность воды при нормальных условиях равна единице, поэтому масса и объем воды количественно совпадают.
Для приготовления растворов с определенной молярной или нормальной концентрацией используются мерные колбы - плоскодонные колбы с узкими горлами, на которых имеется риска, указывающая уровень, до которого нужно долить раствор, и пришлифованными стеклянными пробками (рис.2). Мерными колбами пользуются и в тех случаях, когда необходимо разбавить раствор
Рис.1. Ареометр в строго определенное число раз.
Рис.2. Мерные сосуды для приготовления растворов: а - колба; б - пипетка; в - бюретка
PDF created with pdfFactory Pro trial version www.pdffactory.com

Опыт 1. Приготовление раствора бихромата калия K2Cr2O7 с определенной массовой долей
Выполнить одно из следующих заданий по указанию преподавателя.
Имея сухую соль K2Cr2O7 и воду приготовить растворы заданной процентной концентрации. Определить ошибку эксперимента. Рассчитать молярную, нормальную (эквивалентную) концентрации и титр приготовленного раствора.
Приготовить:
1)60 г 4,5%-ного раствора K2Cr2O7;
2)75 г 4%-ного раствора K2Cr2O7;
3)80 г 3%-ного раствора K2Cr2O7;
4)50 г 6%-ного раствора K2Cr2O7;
5)70 г 5%-ного раствора K2Cr2O7;
6)65 г 2%-ного раствора K2Cr2O7;
7)80 г 1,5%-ного раствора K2Cr2O7;
8)60 г 4%-ного раствора K2Cr2O7;
9)65 г 2%-ного раствора K2Cr2O7;
10)75 г 6%-ного раствора K2Cr2O7.
Выполнение опыта. Рассмотрим конкретный пример приготовления 50 г раствора K2Cr2O7 с массовой долей 3%.
• Вначале необходимо рассчитать массу бихромата калия и объем воды, требующиеся для приготовления искомого раствора.
Пример расчета.
mК 2Cr2O7 = mр−ра ´ω = 50×0,03 =1,5 г ,
mН 2О = mр−ра - mв−ва = 50 -1,5 = 48,5 г .
Поскольку плотность воды равна 1 г/см3, то объем воды равен ее массе, т.е. VH2O = 48,5 мл.
• На весах взвесить рассчитанную массу (1,5 г) бихромата калия. Навеску K2Cr2O7 перенести в стаканчик на 100 мл.
• Отмерить цилиндром или мензуркой рассчитанный объем (48,5 мл) воды и перелить в стаканчик с K2Cr2O7. Смесь перемешать стеклянной палочкой с резиновым наконечником до полного растворения кристаллов соли.
• Определить абсолютную и относительную ошибки эксперимента, для чего:
PDF created with pdfFactory Pro trial version www.pdffactory.com

- измерить плотность полученного раствора ареометром. Для этого часть приготовленного раствора перелить в цилиндр емкостью 50 - 60 мл до 4/5 его объема и осторожно поместить в него ареометр так, чтобы он не касался стенок цилиндра. При этом уровень раствора жидкости должен приходиться на шкалу ареометра. Показание шкалы ареометра на уровне поверхности раствора по нижнему мениску отвечает его плотности;
- рассчитать процентную концентрацию K2Cr2O7 в растворе по его плотности.
Допустим, что плотность приготовленного раствора равна 1,02 г/см3. В нашем примере ρ = 1,02 г/см3 соответствует С% между 3 и 4% (см. табл.П.3.1). Обозначим 3%-ную концентрацию раствора через Стеор и соответствующую ей плотность 1,0193 г/см3 - через ρ1, 4%-ную концентрацию раствора - через С2 и соответствующую ей плотность
1,0264 г/см3 |
- через ρ2, экспериментально полученные величины |
|||||
концентрации и плотности - соответственно через Сэксп и ρэксп. |
||||||
Тогда |
Сэксп = Стеор + |
ρэксп - ρ1 |
. |
|
||
|
|
|||||
|
|
|
ρ2 - ρ1 |
|
||
В нашем примере Сэксп = 3 + |
1,02 -1,0193 |
|
= 3,1% ; |
|||
|
||||||
|
1,0264 -1,0193 |
|
||||
- вычислить абсолютную и относительную ошибки эксперимента: δабс = | Сэксп – Стеор | = 3,1 – 3,0 = 0,1;
δ = δабс ×100 = 3,33% .
Стеор
•Вычислить молярную и эквивалентную концентрации полученного раствора.
•Все расчеты и результаты взвешивания записать в рабочуюотн
тетрадь.
Опыт 2. Приготовление растворов серной кислоты заданной молярной и нормальной концентраций
Выполнить одно из следующих заданий по указанию преподавателя.
Из 10%-ного (по массе) раствора серной кислоты приготовить: 1) 50 мл 0,055 М раствора H2SO4;
PDF created with pdfFactory Pro trial version www.pdffactory.com
