
. Ряд стандартных электродных потенциалов металлов
В ряду активности, а точнее, в ряду стандартных электродных потенциалов, металлы расположены в порядке уменьшения их восстановительных свойств.
|
Li |
K |
Ca |
Na |
Mg |
Al |
Mn |
Zn |
Fe |
Cr |
Cd |
Co |
Ni |
Sn |
Pb |
H2 |
Cu |
Ag |
Hg |
Au |
|
Li+ |
K+ |
Ca2+ |
Na+ |
Mg2+ |
Al3+ |
Mn2+ |
Zn2+ |
Fe2+ |
Cr3+ |
Cd2+ |
Co2+ |
Ni2+ |
Sn2+ |
Pb2+ |
H2+ |
Cu2+ |
Ag+ |
Hg2+ |
Au3+ |
|
3,04 |
2,92 |
2,87 |
2,71 |
2,36 |
1,66 |
1,18 |
0,76 |
0,44 |
0,74 |
0,402 |
0,282 |
0,25 |
0,14 |
0,13 |
0 |
0,34 |
0,80 |
0,85 |
1,50 |
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, истандартными электродными потенциалами окислительно-восстановительных пар
Нернст
изучал поведение электролитов при
пропускании электрического тока и
открыл закон. Закон устанавливает
зависимость между электродвижущей
силой ( разностью потенциалов ) и ионной
концентрацией. Уравнение Нернста
позволяет предсказать максимальный
рабочий потенциал, который может быть
получен в результате электрохимического
взаимодействия, когда известны давление
и температура. Таким образом, этот закон
связывает термодинамику с электрохимической
теорией в области решения проблем,
касающихся сильно разбавленных
растворов. ![]() ,
,
где
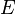 —
электродный
потенциал,
—
электродный
потенциал, 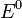 —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;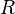 — универсальная
газовая постоянная, равная 8.31
Дж/(моль·K);
— универсальная
газовая постоянная, равная 8.31
Дж/(моль·K);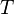 —
абсолютная
температура;
—
абсолютная
температура; — постоянная
Фарадея, равная 96485,35Кл·моль−1;
— постоянная
Фарадея, равная 96485,35Кл·моль−1;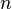 —
число молейэлектронов,
участвующих в процессе;
—
число молейэлектронов,
участвующих в процессе;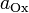 и
и  —активностисоответственноокисленной
и восстановленной форм вещества,
участвующего в полуреакции.
—активностисоответственноокисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если
в формулу Нернста подставить числовые
значения констант ![]() и
и![]() и
перейти отнатуральных
логарифмовкдесятичным,
то при
и
перейти отнатуральных
логарифмовкдесятичным,
то при![]() получим
получим
![]()
85)Германий(Ge) -химический элемент,полуметалл,в химический соединениях обычно проявляет валентность 2 и 4,более стабильные соедин.с 4-валентным Ge.Устойчив к действию воздуха,воду, к растворам щелочи и разбавленной соляной и серной кислот.Растворяется в царской водке и в щелочном растворе перекиси водорода.Медленно окисляется в азотной кислоте.Образует соединения со многими металлами.В присутствии сильных комплексообразователей или окислителей, при нагревании Ge реагирует с кислотами: Ge + H2SO4 конц = Ge(SO4)2 + 2SO2 + 4H2O
Ge + 4HNO3 + 12HCl = GeCl4 + 4NO + 8H2O
С галог:Ge + 2I2 = GeI4
