
Билет1.
1)Материя-полная совокупность физ.регестрируемых частиц. Понятие материя расширялось. С Открытием магнитного поля материя состоит из 2 элементов: вещество и поле(магн. или эл).Вещество –конкретный вид материи ,которое обладает конечной массой покоя. Предметом химии конкретные хим.элементы и их соединения ,а также закономерности,которым подчиняются хим.явления.Одним из основных объектов химии являются вещества, из которых состоят все окружающие нас тела. Телом называется все то, что имеет массу и объем.
Явления, при которых из одних веществ образуются новые вещества, называются химическими. Изучением таких явлений и занимается химия. Химия - это наука о превращениях веществ. Химия изучает состав и строение веществ, условия и пути превращения одних веществ в другие, зависимость свойств веществ от их состава и строения.
• Химия – наука о веществах и законах, по которым происходят превращения одних веществ в другие.
• Вещество и поле - две формы существования материи.
• Вещество – форма материи, которая обладает собственной массой, т.е. массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др.
• Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы.
• Поле – форма существования материи, которая тесно связана с энергией.
• Посредством поля осуществляется взаимодействие между частицами вещества. Неотъемлемым свойством материи является движение.
2)Химия-наука о в-вах и их свойствах,ихстроении,превращениях в результате хим.реакции и явлениях.Экология-наука о взаимодействии организмов между собой и с окр.средой.Велика роль химии в формировании фундаментальных знаний о природе,развития методов исследования .Химия указывает пути получения новых экологически безопасных веществ и материалов.Химическое загрязнение окружающей среды обусловлено следующими факторами: 1) повышением концентрации биогенных элементов из-за канализационных сбросов и стока с полей удобрении, вызывающих бурное развитие водорослей и нарушение баланса в существующих экосистемах; 2) отравлением воды, почвы и воздуха отходами химических производств; 3) воздействием на воду и почву продуктов сжигания топлива, снижающих качество воздуха и вызывающих кислотные дожди; 4) потенциальным заражением воздуха, воды и почвы радиоактивными отходами, образующимися при производстве ядерного оружия и атомной энергии; 5( выбросами углекислого газя и химических веществ, снижающих содержание озона, что может привести к изменению климата или образованию озоновых дыр.
3) Германий(Ge) -химический элемент,полуметалл,в химический соединениях обычно проявляет валентность 2 и 4,более стабильные соедин.с 4-валентным Ge.Устойчив к действию воздуха,воду, к растворам щелочи и разбавленной соляной и серной кислот.Растворяется в царской водке и в щелочном растворе перекиси водорода.Медленно окисляется в азотной кислоте.Образует соединения со многими металлами.В присутствии сильных комплексообразователей или окислителей, при нагревании Ge реагирует с кислотами: Ge + H2SO4 конц = Ge(SO4)2 + 2SO2 + 4H2O
Ge + 4HNO3 + 12HCl = GeCl4 + 4NO + 8H2O
С галог:Ge + 2I2 = GeI4
Билет 2.
4)Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. Исключительное значение для развития химии имело установление трех основных стехиометрических законов.
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон сохранения массы вещества-масса всех веществ,вступивших в реакцию ,равна массе всех продуктов реакции.
Закон Авога́дро —в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул. Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём V=22.3 г,моль. Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Джон Дальтон в 1803 году сформулировал закон кратных отношений:
если два элемента образуют между собой несколько соединений, то на одно и то же весовое количество одного элемента приходятся такие весовые количества другого элемента, которые относятся между собой как небольшие целые числа.
5))Полиме́ры — неорганические и органические, аморфные и кристаллические вещества, состоящие из «мономерных звеньев», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере должно быть достаточно велико. В химии олигомер -молекула в виде цепочки из небольшого числа одинаковых составных звеньев. Синтез полимера-поликонденсация. Поликонденсация — процесс синтеза полимеров из полифункциональных соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды,спиртов и т.п.)при взаимодействии функциональных групп. Линейная и Трехмерная.
Полимеризация – реакция образования полимеров путем последовательного присоединения молекул низкомолекулярного вещества (мономера). Побочных продуктов не образуется. В качестве мономеров используются соединения с кратными связями
6)
Билет3.
Окси́д — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менееэлектроотрицательным элементом.
Основания – хим. соединения, которые в растворе диссоциируют на катионы металла и ионы гидроксильных групп OH.
Кислоты – хим. соединения, которые в растворах диссоциируют на ионы водорода и ионы кислотного остатка.
Соли – продукты замещения атомов водорода в кислоте на металл или гидроксид анионов в основаниях на кислотный остаток.
Основой Номенклатурынеорг. соединений служат названия химических элементов. Как правило, название соединения состоит из двух слов. Одно из них означает принадлежность данного соединения к определённому роду (или классу), другое — к определённому виду.апример, в названии "серная кислота" существительное показывает, что данное вещество относится к кислотам, а прилагательное поясняет, что это кислота, образованная серой.
8)Медь- это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Широко применяется человеком.
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI ). Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета.
Электронное строение атома меди 1s22s22p63s23p63d104s1
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O (темнокрасный кристаллический порошок, применяемый для изготовления рубинового стекла) красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета)
Хлорид меди(I) CuCl - серовато-белый кристаллический порошок, используемый как инсектицид, для очистки ацетилена и денитрации искусственного шелка. Кислота HCuCl2 (с комплексным анионом) используется в газовом анализе для поглощения CO.
Соединения меди(II)
Оксид CuO - черный порошок, активный окислитель, используемый при сжигании органических соединений в элементном анализе. CuO используется также для производства солей, окраски в зеленый или голубой цвет стекла, фарфора, глиняных изделий, для очистки нефти от серы и в медицине. Гидроксид Cu(OH)2 - голубовато-зеленый порошок - в горячих растворах превращается в черный оксид меди(II). Гидроксид меди(II) растворяется в растворе тартрата щелочного металла с образованием тартрата меди CuC4H4O6 (реактив Фелинга), применяемого для обнаружения и определения восстанавливающих сахаров.
Медь получают из ее руд: куприта, содержащего оксид меди, малахита, содержащей основной карбонат меди, халькозина (медный блеск) и халькопирита (медный колчедан), содержащих сульфид меди.
Большая часть мирового производства меди используется в электротехнической промышленности для изготовления проводов. Медь принадлежит к числу микроэлементов, необходимых для нормальной жизнедеятельности растений. Ее вносят в почву с микроудобрениями. Она способствует росту растений, повышению устойчивости против засухи, холода и некоторых заболеваний.
9)
Билет 4.
10)
Все вещества реагируют и образуются в эквивалентных отношениях.
формула, выражающая Закон эквивалентов: m1Э2=m2Э1
Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях
Молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль.
Расчет молярной массы эквивалента вещества осуществляется по следующим правилам:
1)Химические элементы. Мэ = М / n
Где Мэ – молярная масса эквивалента элемента, М – молярная масса элемента, n - валентность.
2)Кислоты и основания.Мэ = М / n
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – основность кислоты или кислотность (количество групп ОН) основания.
3)Соли и оксиды. Мэ = М / (N * n)
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, N – количество катионов в формуле, n – формальный заряд катиона.
4)Окислители и восстановители. Мэ = М / n
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – количество электронов, присоединяемое одной молекулой окислителя или отдаваемое одной молекулой восстановителя.
Молярная масса одного итого же вещества может рассчитываться по – разному, в зависимости от его химических свойств.
11)
Желе́зо — элемент восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат.Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Для железа характерны степени окисления — +2 и +3.
атомная масса 55,847 . порядковый номер железа26=заряд ядра=количество протонов . 56-26=30 количество нейтронов . количество протонов=количеству электронов=26 . строение атома: Fe +26 )2 )8 )14 )2. электронная формула железа 1s2 2s2 p6 3s2 p6 4s2 3d6
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Химически чистое железо получается электролизом растворов его солей.
По данным Геологической службы США (оценка 2011 г.), мировые разведанные запасы железной руды составляют порядка 178 млрд тонн.[15] Основные месторождения железа находятся в Бразилии (1 место), Австралии, США, Канаде, Швеции, Венесуэле, Либерии, Украине, Франции, Индии. В России железо добывается на Курской магнитной аномалии (КМА), Кольском полуострове, в Карелии и в Сибири. Значительную роль в последнее время приобретают донные океанские месторождения, в которых железо совместно с марганцем и другими ценными металлами находится в конкрециях
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Ко́бальт— элемент девятой (по старой классификации — побочной подгруппы восьмой группы) четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 27. атомная масса 58,9332,число электронов=число протонов=27,число нейтронов =32. Электронная формула 1s 22s 22p 63s 23p64s 23d7 Обозначается символом Co (лат. Cobaltum). Простое вещество кобальт (CAS-номер: 7440-48-4) — серебристо-белый, слегка желтоватый металл с розоватым или синеватым отливом.
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для отделения от близкого по свойствам никеля используется хлор, хлорат кобальта (Co(ClO3)2) выпадает в осадок, а соединения никеля остаются в растворе
Самый крупный поставщик кобальта — Демократическая Республика Конго[2]. Также есть богатые месторождения в Канаде, США, Франции, Замбии, Казахстане, России.
Применение- Легирование кобальтом, катализатор химических реакций, Для изготовления постоянных магнитов, 60Со используется в качестве топлива в радиоизотопных источниках энергии.
Ни́кель — элемент десятой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28. Обозначается символом Ni (лат.Niccolum). Простое вещество никель (CAS-номер: 7440-02-0) — это пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен.Число протонов=число электронов=28,Атомная масса 58,6934. Число нейтронов = 31
Никель образует соединения со степенью окисления +2 и +3. При этом никель со степенью окисления +3 только в виде комплексных солей. Для соединений никеля +2 известно большое количество обычных и комплексных соединений. Оксид никеля Ni2O3 является сильным окислителем.
Никель характеризуется высокой коррозионной стойкостью — устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию — образованию на его поверхности плотной оксидной плёнки, обладающей защитным действием. Никель активно растворяется в азотной кислоте.
Основные месторождения никелевых руд находятся в Канаде, России (Мурманская область, Норильский район, Урал, Воронежская область[3]), Кубе, ЮАР, Новой Каледонии и на Украине
Основную массу никеля получают из гарниерита и магнитного колчедана.(восстановлением из руды)
12)
Массовая для меди 68%, цинка 32%,следовательно масса меди, необходимой для сплава 600*0,68=408, цинка 600*0,32=192
Билет 5.
13)Химические явления (химические реакции) – явления, при которых одни химические вещества превращаются в другие
Среди чистых веществ принято различать простые (состоящие из атомов одного химического элемента) и сложные (образованы из атомов нескольких химических элементов) вещества.
Химический элемент — это вид атомов с определённым положительным зарядом ядра. Все химические элементы указаны в Периодической системе элементов Д. И. Менделеева; каждому элементу отвечает свой порядковый (атомный) номер в Периодической системе. Значение порядкового номера элемента и значение заряда ядра атома того же элемента совпадают, то есть химический элемент — это совокупность атомов с одинаковым порядковым номером.
Простое вещество – вещество в состав которого входят атомы одного химического элемента.
Сложное вещество- вещество в состав которого входят атомы разных химических элементов.
Все химические элементы по их свойствам, то есть свойствам свободных атомов и свойствам образуемых элементами простых и сложных веществ, делят на металлические и неметаллические элементы. Условно к неметаллам относят элементы He, Ne, Ar, Kr, Xe, Rn, F, Cl, Br, I, At, O, S, Se, N, P, C и H. К полуметаллам относят B, Si, Ge, As, Sb, Te, иногда — Po. Остальные элементы считаются металлами.
А́томнаяма́сса, относительная атомная масса — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода
Молекуля́рнаяма́сса — масса молекулы, выраженная в атомных единицах массы. Численно равна молярной массе. Молекулярные массы сложных молекул можно определить, просто складывая относительные атомные массы входящих в них элементов.
Моля́рнаяма́сса вещества — масса одного моля вещества. В системе СИ единицей измерения является килограмм на моль (кг/моль). Обозначается буквой M.
Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
Моль (русское обозначение: моль; международное: mol) — единица измерения количества вещества в Международной системе единиц (СИ)
Моль есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
14)
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr (лат.Chromium). Простое вещество хром— твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO•Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России, Зимбабве, Мадагаскаре.
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом
Для хрома характерны степени окисления +2, +3 и +6.
Электронная формула- 1s 22s 22p 63s 23p64s 13d5
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Ма́рганец— элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn(лат.Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белогоцвета. Наряду с железом и его сплавами относится к чёрным металлам.
Электронная формула- 1s 22s 22p 63s 23p64s 23d5
Получают Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита
Характерные степени окисления марганца:0, +2, +3, +4, +6, +7 (+1, +5 мало характерны).
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода
Марганец вводят в бронзы и латуни.
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов,Нахождение в природе:
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры).
15)
Билет 6.
16)
• Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Закон Гесса: Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
![]()
Следствия из закона Гесса: 1.Тепловые эффекты прямой и обратной реакций равны по величине и противоположны познаку.
2.Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учётом коэффициентов в уравнении реакции (то есть помноженные на них).
17)
• Магний : 1s 22s 22p 63s 2 ; Степень окисления : 0, +2 ; Взаимодействие: Mg+HCl =MgCl2+H2 ; Природные источники: ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные карбонаты: доломит, магнезит) , морская вода, рассолы (рапа соляных озёр). Получение : Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. Термический способ получения: В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3•MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции: CaCO3•MgCO3 = CaO + MgO + 2CO2, 2MgO + CaO + Si = CaSiO3 + 2Mg. Применение: Применяется для восстановления металлического титана из тетрахлорида титана. Используется для получения лёгких и сверхлёгких сплавов (самолётостроение, производство автомобилей), а также для изготовления осветительных и зажигательных ракет.
Бериллий : 1s 22s 2 ; Степень окисления : 0, +2 ; Взаимодействие: Be + 2HCl = BeCl2 + H2, Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2, Природные источники : Содержится в земной коре, в морской воде. Получение : 1. действие калия на безводный хлорид бериллия: BeCl2+2K=Be+2KCl , 2. бериллий получают, восстанавливая его фторидом магния: BeF2+Mg=Be+MgF2 , 3. либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды. Применение: Легирование сплавов, рентгенотехника, ядерная энергетика, лазерные материалы, аэрокосмическая техника, ракетное топливо, огнеупорные материалы.
Алюминий : 1s 22s 22p 63s 23p1 ; Степень окисления : 0, +3 ; Взаимодействие: Al+HCl =AlCl3+H2 , 4Al + 3O2 = 2Al2O3 ; Природные источники: содержится в земной коре. Получение: 1. Растворение оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых электродов. 2. Лабораторный : основывается на восстановлении металлическим калием (реакция протекает при нагревании без доступа воздуха): AlCl3+3K=3KCl+Al. Применение: В промышленности, в товарах народного потребления, в военно,авия и ракетном строении, производство алюминиевых порошков и пудр.
Титан : 1s 22s 22p 63s 23p64s 23d2 ; Степень окисления : 0, +2, +3, +4 ; Взаимодействие : Природные источники: Содержится в земной коре, в морской воде, в ультраосновных породах , в основных, в кислых, в глинах и сланцах. Получение: исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а не восстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом. Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2+2C+2Cl=TiCl4+2CO , Образующиеся пары TiCl4 при 850 °C восстанавливают магнием: TiCl4+2Mg=2MgCl2+Ti. Полученную титановую «губку» переплавляют и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку. Применение: для производства военного оборудования, авиация, военно-морской флот, артиллерия, транспорт, в химической, в пищевой, нефтяной и электротехнической промышленности, для изготовления хирургических инструментов
18)
при нормальных условиях (t = 0 °С, р = 101 325 Па, или 1 атм) имеем:
VM = 22,4 л/моль.
Еще одно важнейшее соотношение: мольный объем газа (22,4 л) содержит 6,02•1023 молекул (число Авогадро).
Теперь мы знаем, что такое моль. Это:
– 6,02•1023 молекул;
– 22,4 л вещества в газообразном состоянии при нормальных условиях;
Число Авогадро показывает число молекул в 1 моле любого вещества.
Это 1 грамм массы, выраженный в атомных единицах массы.
1 грамм=6,02*10^23 а. е. м.
Билет 7.
19)Термодина́мика— раздел физики, изучающий соотношения и превращения теплоты и других форм энергии.
Первый закон термодинамики: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
![]()
![]()
Внутренняя энергия (U) – запас энергии системы. Включает в себя все виды энергии, связанные со строением системы, и не включает кинетическую и потенциальную энергии системы как целого. Так как абсолютных знаний о строении вещества не существует, абсолютное значение внутренней энергии найти нельзя.
Энтальпия – запас энергии системы в виде теплоты
20)
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку. Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в узлах кристаллической решётки.Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью.
21)
Электроннаяформуласвинца: 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 ,
6 энергетических уровней, на третьем энергетическом уровне находится 8 электронов.
Билет 8.
1) Существует два классических определения второго закона термодинамики
• Кельвина и Планка
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
• Клаузиуса
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S).
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
100% энергии не может быть преобразовано в работу
Энтропия может вырабатываться, но не может быть уничтожена
Движущие силы химической реакции обусловлены ее стремлением к уменьшению запаса энергии, т.е. к уменьшению энтальпии при p = const и ее стремлением к увеличению энтропии.
В ходе химической реакции участвующие частицы перегруппировываются таким образом, чтобы уменьшалась энергия системы; это проявляется в их сближении и взаимодействии. Вместе с тем реагирующие частицы обладают отчетливой тен-денцией к беспорядочному расположению. Эти два фактора обусловливают хими-ческую обратимость реакций; преобладающее направление реакции определяется значением и знаком величин ΔH и ΔS.
критерием самопроизвольного протекания химических реакций является отрицательное значение энергии Гиббса: ΔG < 0
Для экзотермических реакций (ΔH < 0) величина ΔG также, как правило, меньше нуля, поскольку в уравнении ΔG = ΔH - TΔS при ΔS > 0 вычитаемое будет всегда отрицательным, а при ΔS < 0 - положительным, но небольшим по значению вплоть до очень высоких температур, и, следовательно, не превышающим отрицательного значения ΔH.
Для эндотермических реакций (ΔH > 0), имеющих ΔS < 0, их протекание в за-данном направлении невозможно ни при какой температуре, т.к. всегда ΔG > 0. Для реакций с ΔS > 0 их протекание возможно, но только при таких высоких температурах, когда вычитаемое (- TΔS) превысит положительное значение эн-тальпии реакции.
Таким образом, принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение ΔG.
23)
Пирометаллургия — совокупность металлургических процессов, протекающих при высоких температурах. Это отрасль металлургии, связанная с получением и очищением металлов и металлических сплавов при высоких температурах, в отличие от гидрометаллургии, к которой относятся низкотемпературные процессы.
Гидрометаллурги́я— выделение металлов из руд, концентратов и отходов производства с помощью водных растворов определённых веществ (химических реагентов).
Электронно-лучевая плавка — метод плавки путем использования электронного пучка. Применяется при плавке особо чистых материалов, например, сталей и титана, и материалов, стойких к высокой температуре и химическим воздействиям. При электронно-лучевой плавке загрязнение материала посторонними примесями почти отсутствует. Благодаря наличию высокого вакуума имеется возможность удаления примесей из материала. Легкость управления мощностью электронного пучка позволяет использовать разнообразные режимы плавки. Возможна температура расплава, превышающая температуру плавления. Промышленные электронные плавильные печи имеют мощность свыше 200 кВт и выдают слитки длиной до нескольких метров и весом до нескольких тонн.
Зо́ннаяпла́вка (зо́ннаяперекристаллиза́ция) — метод очистки твёрдых веществ, основанный на различной растворимости примесей в твердой и жидкой фазах. Метод является разновидностью направленной кристаллизации, от которой отличается тем, что в каждый момент времени расплавленной является некоторая небольшая часть образца. Такая расплавленная зона передвигается по образцу, что приводит к перераспределению примесей. Если примесь лучше растворяется в жидкой фазе, то она постепенно накапливается в расплавленной зоне, двигаясь вместе с ней. В результате примесь скапливается в одной части исходного образца. По сравнению с направленной кристаллизацией этот метод обладает большей эффективностью
Вакуумный переплав- При вакуумном дуговом переплаве под воздействием высоких температур, возникающих в зоне электрической дуги между переплавляемым электродом и поддоном кристаллизатора, сталь на нижнем торце электрода расплавляется и капли расплавленного металла падают в ванну, где под воздействием охлаждения кристаллизатора формируется слиток. До начала операции печь вакуумируют (остаточное давление обычно не более 1,33 Па); вакуумные насосы продолжают работать в течение всей плавки. Таким образом, капли металла падают через вакуумированное пространство, при этом обеспечивается очень полное очищение металла от газов, оксидных неметаллических включений (общее содержание кислорода снижается до очень низких пределов), от примесей некоторых цветных металлов и получается плотный слиток
Метод термического разложения летучих соединений металлов-Сущность метода заключается в том, что исходное вещество переводится в парообразное состояние и контактирует с подложкой, нагретой до температуры, при которой оно разлагается или реагирует с другим соединением с образованием на подложке слоя металла или его нелетучих соединений и газообразных продуктов, которые удаляются из зоны реакции. Осаждение может проводится как в вакууме, так и в токе газа-носителя (аргон, азот, гелий, углекислый газ)
24)
0,2М- значит См данн р-ра =0,2. См= кол-во моль сухого в-ва в раст-ре поделит на объем р-ра в литрах.решаем: n( моли в-ва) = 0,1*0,2= 0,02 моль. отсюда кол-во щелочи KOH = 0,02моль. отсода масса щелочи=0,02*40=0,8 грамм.
Билет 9.
25)
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики.
Зависимость скорости реакций от различных факторов
|
Условия |
Примеры |
|
концентрация |
При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением. Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:
Причиной повышения скорости является увеличение числа столкновений реагирующих частиц за счёт увеличения частиц в единице объёма. |
|
температура |
Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа :
Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. |
|
катализатор |
Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции. Влияние, оказываемое катализаторами на химические реакции, называетсякатализом.По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать: гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь; гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз). |
|
площадь соприкосновения реагирующих веществ |
Для увеличения площади соприкосновения реагирующих веществ, их измельчают. Наибольшей степени измельчения достигают путем растворения веществ. Быстрее всего вещества реагируют в растворах. |
|
природа реагирующих веществ |
Например, металлы магний и железо реагируют с соляной кислотой одинаковой концентрации с различной скоростью. Это связано с разной химической активностью металлов. |
ЦЕПНЫЕ РЕАКЦИИ, хим. превращения и ядерные процессы, в к-рых появление промежуточной активной частицы (свободного радикала, атома, возбужденной молекулы в хим. превращениях, нейтрона - в ядерных процессах) вызывает цепь превращений исходных в-в. Примеры хим. цепных реакций- радикальная полимеризация, окисление, пиролиз и галогенирование углеводородов и др. орг. соед.; ядерные цепные процессы - цепноеделение атомных ядер. Данная статья посвящена в основном химическим цепным реакциям.
КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ, реакции, в ходе которых концентрации промежут. соединений и скорость реакции испытывают колебания. Колебания м. б. периодическими, в этом случае значения c(t) колеблющихся концентраций (t - время) можно представить рядом Фурье:
![]()
где аn, bn - коэффициенты разложения ф-ции c(t) в рад (амплитуды отдельных гармонич. компонент), An - комплексные амплитуды, w - частота колебаний (i - мнимая единица)
26) Распространение и формы нахождения металлических элементов в природе.
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее:
алюминия — 8,2%
железа — 4,1%
кальция — 4,1%
натрия — 2,3%
магния — 2,3%
калия - 2,1 %
титана — 0,56%
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%.
В природе металлы встречаются в различном виде:
— в самородном состоянии: серебро , золото , платина , медь , иногда ртуть
— в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.
— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др.
— различных солей

27)
Мельхиор - сплав с массовой долей меди 80%, никеля 20%. Определите массу никеля и меди для получения мельхиора массой 350кг.
100%=350 , 20% =х X=70никель
Медь 280.
Билет 10.
28)



Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми.
Принцип ЛеШателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
•При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
•При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Количественной характеристикой равновесия служит вели¬чина, называемая константой химического равновесия. Рас¬смотрим ее на примере реакции синтеза иодоводорода:
Н2 + I22НI
Согласно закону действия масс (см. § 12), скорости прямой (v1) и обратной (v2) реакций выражаются уравнениями1:
v1=k1[H2][I2]
v2=k2[HI]2
При равновесии скорости прямой и обратной реакций равны друг другу, откуда:
k1[H2][I2]=k2[HI]2 или
k1/k2=[HI]2/[H2][I2]
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции К:k1/k2=^ К или, отсюда окончательно, [HI]2/[H2][I2]=К. В левой части этого уравнения стоят те концентрации взаимо¬действующих веществ, которые устанавливаются при равнове¬сии, — равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину.
29)Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характернымиметаллическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Физсв-ва: Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, обладают различной твёрдостью, Температуры плавления, плотности, пластичностью, хорошо проводят электрический ток, электропроводность теплопроводность
Химические св:На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители
Реакции с простыми веществами: Me + О2,N2,S,H2,C, c к-ми
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Галиды– это группа минералов, формирующих естественные соли
Галиды щелочных металлов представляют собой соли, кристаллы которых обладают высокой степенью ионности и очень просты по своей структуре.Комплексообразование с галидами щелочных металлов для рассматриваемых галидовЭГамалохарактерно, но производные типов МЭГз и МаЭГ известны.
При непосредственном образовании галидов щелочных металлов выделяются значительные количества энергии. Кристаллогидраты образует только Li - LiCl - 2H2O и, кроме фторидов, все соли гигроскопичны. Так, например, из галидов лития только LiF не изменяется при длительном хранении, а остальные соли расплываются.
31)31. Конец 19 и начало 20 веков характеризуется новыми открытиями в физике и химии, изменившими взгляд на атом, как на неизменимую частицу, свидетельствовавшими о сложном составе атомов и о возможности их взаимопревращений.
Первым основополагающим достижением в области изучения внутреннего строения вещества было создание модели атома английским физиком Резерфордом (1911г). По Резерфорду атом состоит из ядра, окруженного электронной оболочкой.
Предложенная Резерфордом схема строения атома или, как обыкновенно говорят, планетарнаямодель атома, легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов, поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.
Моде́льТо́мсона (иногда называемая «пу́динговая модель а́тома») — модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. После открытия им в 1897 году электрона, Томсон предположил, что отрицательно заряженные «корпускулы» (так Томсон называл электроны, хотя ещё в 1894 году Дж. Дж. Стоуни предложил называть «атомы электричества» электронами[1]) входят в состав атома и предложил модель атома, в котором в облаке положительного заряда, равного размеру атома, содержатся маленькие, отрицательно заряженные «корпускулы», суммарный электрический заряд которых равен заряду положительно заряженного облака, обеспечивая электронейтральность атомов. «Корпускулы» в этой модели распределены внутри положительно заряженного облака с одинаковой по объёмуплотностью заряда, подобно изюминкам в тесте пудинга. Отсюда произошёл термин «пудинговая модель атома».

Планетарная
модель атома, или модель Резерфорда, -
историческая модель строения атома,
которую предложил Эрнест Резерфорд в
результате эксперимента с рассеиванием
альфа-частиц. По этой модели атом состоит
из небольшого положительно заряженного
ядра, в котором сосредоточена почти вся
масса атома, вокруг которого движутся
электроны, - подобно тому, как планеты
движутся вокруг Солнца. Планетарная
модель атома соответствует современным
представлениям о строении атома с учётом
того, что движение электронов имеет
квантовый характер и не описывается
законами классической механики.
Исторически планетарная модель Резерфорда
пришла на смену «модели сливового
пудинга»Джозефа Джона Томсона, которая
постулирует, что отрицательно заряженные
электроны помещены внутрь положительно
заряженного атома
32)
Методы защиты от коррозии можно объединить в следующие группы:
1) нанесение защитных покрытий и пленок;
2) изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз;
3) модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом.
В качестве защитных применяют металлические и неметаллические покрытия.
Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка.
В связи с этим они делятся на две группы: катодные и анодные покрытия.
К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больший,
чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов
на стали имеют такой же характер. Катодные покрытия защищают металл только благодаря его изоляции от атакующей
среды. Поэтому свою роль они выполняют только при наличии полнойсплошности. Если в катодном покрытии образуется
щель, то в условиях коррозии она становится катодом, а открытая часть защищаемого металла – анодным элементом.
Анодная поверхность при этом значительно меньше, чем катодная. Электрохимическое разрушение металла
концентрируется на небольшой поверхности. Учитывая опасности, кроющиеся в возможныхнесплошностях катодных
покрытий, их делают сравнительно большой толщины.
Анодные покрытия – это покрытия, выполненные из металла, у которого электродный потенциал меньше, чем у
защищаемого металла. Для железа, работающего в малокислых или нейтральных растворах, анодными покрытиями
являются цинк, алюминий. Защитные свойства анодных покрытий состоят не только в механической изоляции металла
от коррозионной среды. Они заключаются еще и в электрохимическом воздействии. В случае нарушения покрытия и
образования коррозионного элемента, защищаемый металл, являющийся катодом, не разрушается. Небольшие
несплошности в анодных покрытиях не опасны.
Металлические покрытия наносят электроосаждением, погружением в расплавленные металлы, металлизацией
напылением, химическим осаждением солей, диффузией и т. д. В последнее время все большее распространение
получает нанесение покрытий в вакууме.
Неметаллические покрытия применяются в случае возникновения химической реакции металла в соответствующих
средах. К ним, в частности, относят оксидные алюминиевые покрытия, полученные в ходе специального электролитического процесса. Фосфатные покрытия применяются в большинстве случаев с дополнительными защитными средами, как, например, краски, лаки и т. п.
Фосфатирование стали состоит в погружении изделия в разбавленный раствор фосфорной кислоты и кислых фосфатов
цинка или магния. В результате реакции образуется нерастворимый фосфат железа, который в ходе процесса плотно
покрывает поверхность металла. К этой же группе относят керамические покрытия и стекловидные эмали. Эти покрытия
достаточно стойки к воздействию минеральных и органических кислот. Их недостатком является повышенная хрупкость и
низкая стойкость в условиях резких перепадов температуры.
К органическим покрытиям относятся разнообразные лакокрасочные материалы.
Знание механизма коррозии позволило создать методы коррозионной защиты путем наложения на металл такого
потенциала, при котором он становится термодинамически устойчивым. К таким методам относятся катодная защита и
уменьшение агрессивности среды, окружающей металлоконструкцию.
Катодная защита состоит в присоединении к защищаемой конструкции анода-протектора с более отрицательным
электрохимическим потенциалом. Протектор (лат. protector – покровитель, защитник) и служит таким анодом,
препятствующим разрушению защищаемого сплава; сам протектор при коррозии постепенно разрушается.
Протектором может являться любой металл, имеющий по отношению к данному сплаву более отрицательный потенциал.
Однако разница в потенциалах не должна быть слишком большой, чтобы при электрохимическом процессе
не происходило быстрого разрушения протектора.
Протекторы представляют собой обычно небольшие пластинки, присоединяемые к защищаемой детали заклепками или
болтами. Катодную или протекторную защиту широко применяют при защите от морской и подземной коррозии
металлоконструкций, коммуникаций, трубопроводов, сосудов и т. д. В качестве анодов-протекторов для защиты стальных
изделий обычно применяют сплавы магния или цинка. Защита может также осуществляться присоединением защищаемого
металла к отрицательному полюсу постоянного тока.
33)
W=(mв-ва\mр-ра)*100%
mв-ва1= 150*0.02=3г
mв-ва2=350*0.04=14г
W= 17/500* 100=3,4%
Билет 12.
34)Квантовый характер излучения и поглощения энергии. Примерно в начале XX в. исследования ряда явлений (излучений раскаленных тел, фотоэффект, атомные спектры) привели к выводу, что энергия распространяется и передается, поглощается и испускается не непрерывно, а дискретно, отдельными порциями — квантами. Энергия системы микрочастиц также может принимать только определенные значения, которые являются кратными числами квантов.
Предположение о квантовой энергии впервые было высказано М. Планком (1900) и позже обосновано А. Эйнштейном (1905).
![]()
Бо́ровскаямоде́льа́тома (Моде́льБо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка

35)Основными классами неорганических соединений являются оксиды, основания, кислоты и соли
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2
Оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O —оксид натрия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I)
Основания – химические соединения, которые в растворе диссоциируют на катионы металла и ионы гидроксильных групп ОН (ВаОН = Ва + ОН)
Основания, растворимые в воде – щелочи.
Основания называются следующим образом: сначала произносят слово «гидроксид», а затем металл, который его образует. Если металл имеет переменную валентность, то она указывается в названии.
Ca(OH)2 – гидроксид кальция;
Fe(OH)2 – гидроксид железа (II);
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Названия кислородных кислот образуются от названия элемента с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы короткой формы Периодической системы, и слова «кислота». По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например, HCl+7O4 – хлорная кислота,
HCl+5O3 – хлорноватая кислота,
Соли — это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков
для средней соли -
название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Na2SO4- сульфат натрия,
CuSO4- сульфат меди (II)
для кислой соли –
«гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
для основной соли –
«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Mg(OH)Cl - гидроксохлорид магния
36)
Рассчитайте ЭДС гальванического элемента, состоящего из цинкового и свинцового электродов по значениям стандартных потенциалов.
Е0, В (Pb2+ / Pb) – 0.126 катод
Е0, В (Zn2+ / Zn) – 0.763 анод
Билет 13.
37)
В 20-х годах XX столетия было установлено, что любая частица имеет корпускулярно-волновую природу. Согласно теории Л. де Бройля (1924 г.),
каждой
частице с импульсом 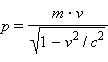 соответствует
волновой процесс с длиной волны λ,
т.е. λ = h / p.
Чем меньше масса частицы, тем больше
длина волны. Для элементарных частиц В.
Гейзенберг сформулировал принцип
неопределенности, согласно которому
невозможно одновременно определить
положение частицы в пространстве и ее
импульс. Следовательно, нельзя рассчитать
траекторию движения электрона в поле
ядра, можно лишь оценить вероятность
его нахождения в атоме с помощью волновой
функции ψ, которая
заменяет классическое понятие траектории.
Волновая функция ψ характеризует
амплитуду волны в зависимости от
координат электрона, а ее квадрат
ψ2 определяет
пространственное распределение электрона
в атоме. В наиболее простом варианте
волновая функция зависит от трех
пространственных координат и дает
возможность определить вероятность
нахождения электрона в атомном
пространстве или его орбиталь.
Таким образом, атомная
орбиталь (АО)
– область атомного пространства, в
котором вероятность нахождения электрона
наибольшая.
соответствует
волновой процесс с длиной волны λ,
т.е. λ = h / p.
Чем меньше масса частицы, тем больше
длина волны. Для элементарных частиц В.
Гейзенберг сформулировал принцип
неопределенности, согласно которому
невозможно одновременно определить
положение частицы в пространстве и ее
импульс. Следовательно, нельзя рассчитать
траекторию движения электрона в поле
ядра, можно лишь оценить вероятность
его нахождения в атоме с помощью волновой
функции ψ, которая
заменяет классическое понятие траектории.
Волновая функция ψ характеризует
амплитуду волны в зависимости от
координат электрона, а ее квадрат
ψ2 определяет
пространственное распределение электрона
в атоме. В наиболее простом варианте
волновая функция зависит от трех
пространственных координат и дает
возможность определить вероятность
нахождения электрона в атомном
пространстве или его орбиталь.
Таким образом, атомная
орбиталь (АО)
– область атомного пространства, в
котором вероятность нахождения электрона
наибольшая.
Волновые функции получаются при решении основополагающего соотношения волновой механики – уравнения Шредингера. Точное решение существует для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения. Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел
38)
Второе начало термодинамики имеет несколько формулировок. Формулировка Клаузиуса:невозможен процесс перехода теплоты от тела с более низкой температурой к телу с более высокой.
Формулировка Томсона: невозможен процесс, результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела. Эта формулировка накладывает ограничение на превращение внутренней энергии в механическую. Невозможно построить машину (вечный двигатель второго рода), которая совершала бы работу только за счет получения теплоты из окружающей среды.
Формулировка Больцмана: Энтропия — это показатель неупорядоченности системы. Чем выше энтропия, тем хаотичнее движение материальных частиц, составляющих систему
Энергия Гиббса (или потенциал Гиббса) — это величина, показывающая изменение энергии в ходе химической реакции.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности процесса является неравенство
ΔG < 0
Таким образом, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном. Увеличение энергии Гиббса
ΔG > 0
свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
Если
ΔG = 0
то система находится в состоянии химического равновесия
39)
Билет 14.
40)Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси. Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l - подуровнем. Магнитное квантовое число (m) характеризует положение электроннойорбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и -1/2 соответствующие противоположным направлениям вращения.
41)У большинства металлов при взаимодействии с окислителями поверхность покрывается пленкой окислов.От защитных свойств оксидных пленок зависит жаростойкость металла, законы роста толщины пленки во времени и многое другое. Для металлических конструкций, парогенераторов и кожухов охлаждаемых машин соединения азота, находящиеся в природной воде, сами по себе не представляют большого вреда (лишь NH3 и NH4+ разрушают медь, цинк и некоторые другие металлы, образуя аммиакаты). Но если в воде присутствуют соединения азота, значит, в ней содержатся те или иные органические вещества (кислоты); последние могут взаимодействовать с металлами, а в парогенераторах увеличивать количество осадка.
42)
Билет 15.
43)
Французский ученый Луи де Бройль
(1892–1987), осознавая существующую в природе
симметрию и развивая представления о
двойственной корпускулярно-волновой
природе света, выдвинул в 1923 г. гипотезу
об универсальности корпускулярно-волнового
дуализма. Он утверждал, что не только
фотоны, но и электроны и любые другие
частицы материи наряду с корпускулярными
обладают волновыми свойствами. С любой
частицей, обладающей импульсом,
сопоставляется волновой процесс с
длиной волны, определяемой формулой
де Бройля: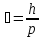 . Принцип неопределённости Гейзенбе́рга .Если
имеется несколько (много) идентичных
копий системы в данном состоянии, то
измеренные значения координаты и
импульса будут подчиняться
определённомураспределению
вероятности —
это фундаментальный постулат квантовой
механики. Волновое уравнение Шредингера
. Принцип неопределённости Гейзенбе́рга .Если
имеется несколько (много) идентичных
копий системы в данном состоянии, то
измеренные значения координаты и
импульса будут подчиняться
определённомураспределению
вероятности —
это фундаментальный постулат квантовой
механики. Волновое уравнение Шредингера
Одним
из основных уравнений квантовой механики
является уравнение Шредингера,
определяющее изменение состояний
квантовых систем с течением времени.
Оно записывается в виде.
![]()
44)Корро́зия— это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер.
Электрохимическая коррозия-Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Водородная и кислородная коррозия
Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией.
Виды коррозий:
Газовая коррозия
Атмосферная коррозия
Подземная коррозия
Точечная коррозия
Коррозия пятнами и др.
45)
Билет 16.
46)Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение пер-вых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто.
Квантово-механические расчеты показывают, что в многоэлектронных энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни).
Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей.
Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули (принцип Паули):
В атоме не могут одновременно находиться два электрона с одинаковым набо-ром четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распре-деление вторых электронов с противоположным спином).
Используя понятия квантовые числа можно сказать, что:
Каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел - главного n, орбитальногоl, магнитного ml, и спинового ms.
Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу:
В невозбужденном атоме все электроны обладают наименьшей энергией (прин-цип наименьшей энергии).
Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательно квантовое возрастание энергии подуровней происходит в следующем порядке: 1s - 2s -2р - 3s – 3р - 4s –3d - 4р - 5s -….
Такой порядок увеличения энергии подуровней определяет расположение эле Мен-тов в Периодической системе.
Заполнение атомныхорбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927г) (правило Хунда):
При данном значении квантового числа l (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов.
Порядок возрастания энергии атомной орбитали в сложных атомах описывает-ся правилом Клечковского: энергия атомной орбитали возрастает в соответ-ствии с увеличением n +l главного и орбитального квантовых чисел. При оди-наковом значении суммы энергия меньше у атомной орбитали с меньшимзна-чением главного квантового числа.
Распределение электронов по различным атомным орбиталям называют электрон-ной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям.
Электронную конфигурацию атома изображают двумя способами – в виде элек-тронных формул и электронно-графических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например. Для основного состоянии атома водорода электронная формула: 1s1.
Более полно строение электронных подуровней можно описать с помощью электро-нографических диаграмм, где распределение электронов по подуровням представ-ляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каж-дом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны обозначают стрелками¬ или ¯ в зависимости от знака спинового квантового числа.
С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s –элементы, р-элементы, d-элементы, f-элементы.
1 правило Клечковского: при возрастании заряда ядра атома заполнение энергетических уровней происходит от орбитали с меньшим значением суммы главного и орбитального квантовых чисел.
2 правило Клечковского: при одинаковом значении суммы n и L орбитали заполняются в порядке возрастания главного квантового числа.
47)
Электролиз — процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
(Если в раствор (расплав) электролита опустить инертные электроды и пропускать постоянный электрический ток, то ионы будут двигаться к электродам, при этом на катоде происходит разряд положительно заряженных ионов – катионов (восстановление), а на аноде разряд отрицательных ионов –анионов, или растворение анода (окисление). Этот процесс называется
электролизом.)
Катионы можно расположить в ряд по относительной способности к разряду на катоде. Анионы также можно расположить в ряд по относительной способности к разряду на аноде. Эти последовательности называют рядами активности (электрохимическими рядами напряжений) металлов и неметаллов.
Первый закон Фараде
В 1832 году Фарадей установил,
что масса m вещества, выделившегося на
электроде, прямо пропорциональна
электрическому заряду q, прошедшему
через электролит:
![]() если
через электролит пропускается в течение
времени t постоянный ток с силой тока
I. Коэффициент
пропорциональности
если
через электролит пропускается в течение
времени t постоянный ток с силой тока
I. Коэффициент
пропорциональности![]() называетсяэлектрохимическим
эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.
называетсяэлектрохимическим
эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
![]()
где ![]() —постоянная
Фарадея.
—постоянная
Фарадея.
Второй закон Фарадея записывается в следующем виде:
![]()
где ![]() —молярная
масса данного
вещества, образовавшегося (однако не
обязательно выделившегося — оно
могло и вступить в какую-либо реакцию
сразу после образования) в результате
электролиза, г/моль;
—молярная
масса данного
вещества, образовавшегося (однако не
обязательно выделившегося — оно
могло и вступить в какую-либо реакцию
сразу после образования) в результате
электролиза, г/моль; ![]() —сила
тока,
пропущенного через вещество или смесь
веществ (раствор, расплав), А;
—сила
тока,
пропущенного через вещество или смесь
веществ (раствор, расплав), А; ![]() —
время, в течение которого проводился
электролиз,с;
—
время, в течение которого проводился
электролиз,с; ![]() —постоянная
Фарадея, Кл·моль−1;
—постоянная
Фарадея, Кл·моль−1; ![]() —
число участвующих в процессе электронов,
которое при достаточно больших значениях
силы тока равно абсолютной величине
заряда иона (и его противоиона), принявшего
непосредственное участие в электролизе
(окисленного или восстановленного).
Однако это не всегда так; например, при
электролизе раствора соли меди(II) может
образовываться не только свободная
медь, но и ионы меди(I) (при небольшой
силе тока).
—
число участвующих в процессе электронов,
которое при достаточно больших значениях
силы тока равно абсолютной величине
заряда иона (и его противоиона), принявшего
непосредственное участие в электролизе
(окисленного или восстановленного).
Однако это не всегда так; например, при
электролизе раствора соли меди(II) может
образовываться не только свободная
медь, но и ионы меди(I) (при небольшой
силе тока).
48)
Билет 17.
49)Теория строения ядра атома, предложенная в 1932 году нашими исследователями Иваненко и Гапоном и немецким ученым Гейзенбергом названа протонно–нейтронной теорией ядра. Согласно этой теории:
–ядро атома состоит из нуклонов /так названы в сумме протоны и нейтроны/;
–суммарное число протонов в ядре /Np=¦р/ обуславливает величину положительного заряда ядра /Zя/. От него зависит число электронов в электронейтральном атоме /Ne/ и порядковый номер в таблице Менделеева /Z/:
Z=Ne=Zя=Np;
–суммарное число нейтронов /Nn=10n/ c cуммарным числом протонов /Np/ дают величину массы ядра /А=Np+Nn/. Эту величину называют массовым числом /А/. Массовое число А равно целому числу, наиболее близкому по значению к атомной массе данного элемента Аэ;
–зная заряд ядра и массовое число можно определить количество протонов в ядре:
Nn=А–Z;
–структура ядра атома может быть выражена следующей формулой:
Zp+(A–Z)n
Закон сохранения массы говорит о том, что в результате химических превращений сумма масс веществ до реакции и сумма масс веществ после реакции одинакова. Общая масса сохраняется, если даже в результате химического процесса получается небольшое количество полезного продукта.
Закон сохранения эл. зарядов :алгебраическая сумма электрических зарядов в замкнутой системе остается постоянной при любых процессах, происходящих в ней
Ядерные реакции классифицируются по следующим признакам:
по роду участвующих в них частиц - реакции под действием нейтронов; реакции под действием заряженных частиц, например, протонов, дейтронов,
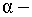 частиц;
реакции под действием
частиц;
реакции под действием 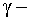 квантов;
квантов;по энергии вызывающих их частиц - реакции при малых энергиях (порядка электрон-вольт), происходящие в основном под действием нейтронов; реакции при средних энергиях (до нескольких мегаэлектрон-вольт), происходящие с участием
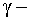 квантов
и заряженных частиц (протоны,
квантов
и заряженных частиц (протоны, 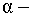 частицы);
реакции при высоких энергиях (сотни и
тысячи мегаэлектрон-вольт), приводящие
к рождению отсутствующих в свободном
состоянии элементарных частиц и имеющих
большое значение для их изучения;
частицы);
реакции при высоких энергиях (сотни и
тысячи мегаэлектрон-вольт), приводящие
к рождению отсутствующих в свободном
состоянии элементарных частиц и имеющих
большое значение для их изучения;по роду участвующих в них ядер - реакции на легких ядрах (A
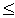 50);
реакции на средних ядрах (50
50);
реакции на средних ядрах (50 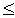 A
A  100);
реакции на тяжелых ядрах (A
100);
реакции на тяжелых ядрах (A  100);
100);По характеру происходящих ядерных превращений - реакции с испусканием нейтронов; реакции с испусканием заряженных частиц; реакции захвата (в этих реакциях составное ядро не испускает никаких частиц, а переходит в основное состояние, излучая один или несколько
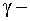 квантов).
квантов).
50) Особенности его - высокие температуры электролита, доходящие иногда до 1000 С, и повышенный расход электроэнергии как на поддержание электролита в расплавленном состоянии, так и на устранение различных вторичных процессов на электродах.
Электрод – реальный физический объект, сделанный в большинстве случаев из химически малоактивных или инертным материалов (графит, медь, платина и т.д.), на поверхности которого протекает определенный электрохимические процессы.
Электролиз – электрохимический окислительно – восстановительный процесс, протекающий под действием постоянного электрического тока. Процесс в ходе которого работа электрического тока преобразуется в химическую реакцию.
Анод – электрод на котором протекает процесс окисления. В реакции электролиза заряжен положительно.
Катод – электрод на котором протекает процесс восстановления. В реакции электролиза заряжен отрицательно.
Электролиз растворов солей имеет особенности, т. к. в реакции могут участвовать еще молекулы воды. При электролизе растворов солей с инертным электродом используют следующие правила (работа по таблице “Электрохимическое напряжение металлов”):
а) на катоде (“-”) восстанавливается вода и выделяется водород, если металл расположен левее марганца,
б) восстанавливается металл, если металл расположен правее водорода;
в) если металл находится между марганцем и водородом, то в зависимости среды реакции могут восстанавливаться металл и водород.
Роль электролиза, его применение в технике и значение терминов “гальванопластика” и “гальваностегия”:
– Методом электролиза в промышленности получают алюминий, а также активные металлы, такие, как калий, натрий, магний, кальций, барий.
– Методом электролиза получают фтор, хлор, едкий натр, водород высшей степени чистоты.
– Электролиз применяют для разделения и очиcтки металлов.
– Гальваностегия – это процесс нанесения путем электролиза на поверхность изделий слоев других металлов для предохранения их от коррозии, для придания их поверхности твердости, в декоративных целях, например хромирование, никелирование, цинкование.
– Гальванопластика – это процесс получения точных копий с рельефных предметов электроосаждением металла. Путем гальванопластики изготовляют матрицы для прессования различных изделий, типографические, печатные, радиотехнические схемы.
51.1) 2Н2О->2Н2+О2-первое ур-е(над 2Н2 поставить 0,25моль, над О2 х моль)
2)СuO+Н2->Cu+H2O-второе ур-е( над Н2 поставить х, над стрелочкой поставить t)
Кол-во CuO=20г/80=0,25моль (М=80 молярная масса CuO)
По ур-ю р-ции 1 кол-во воды относится к колич.водорода как 1:1,следовательно кол-во воды =0,25моль.
mH2O=0,25*18=4,5г.
Т.кро воды=1г/мл, то VH2O=mH2O
Значит VH2O=4,5мл.
Ответ: 4,5мл.
Билет 18.
Естественная радиоактивность — самопроизвольный распад атомных ядер, встречающихся в природе.
ВИДЫ РАДИОАКТИВНОГО РАСПАДА
Альфа - распад
Альфа-частицы испускаются только тяжелыми ядрами, т.е. содержащими большое число протонов и нейтронов. Прочность тяжелых ядер мала. Для того, чтобы покинуть ядро, нуклон должен преодолеть ядерные силы, а для этого он должен обладать достаточной энергией. При объединении двух протонов и двух нейтронов в альфа-частицу ядерные силы в подобном сочетании (между нуклонами частицы) являются наиболее крепкими, а связи с другими нуклонами слабее, поэтому альфа-частица способна "выйти" из ядра. Вылетевшая альфа-частица уносит положительный заряд в 2 единицы и массу в 4 единицы. В результате альфа-распада радиоактивный элемент превращается в другой элемент, порядковый номер которого на 2 единицы, а массовое число на 4 единицы, меньше.
То ядро, которое распадается, называют материнским, а образовавшееся дочерним. Дочернее ядро оказывается обычно тоже радиоактивным и через некоторое время распадается. Процесс радиоактивного распада происходит до тех пор, пока не появится стабильное ядро, чаще всего ядро свинца или висмута.
Бета-распад
Явление бета-распада состоит в том, что ядра некоторых элементов самопроизвольно испускают электроны и элементарную частицу очень малой массы - антинейтрино. Так как электронов в ядрах нет, то появление бета-лучей из ядра атома можно объяснить способностью нейтронов ядра распадаться на протон, электрон и антинейтрино. Появившийся протон переходит во вновь образующееся ядро. Электрон, вылетающий из ядра, и является частицей бета-излучения. Такой процесс распада нейтронов характерен для ядер с большим количеством нейтронов. В результате бета-распада образуется новое ядро с таким же массовым числом, но с большим на единицу зарядом.
Гамма - распад - не существует
Испускание позитрона
Позитронный распад обычно происходит только в ядрах, которые имеют избыток протонов. Когда радионуклид подвергается позитронному распаду, его атомный номер уменьшается на единицу (так как на один протон в ядре стало меньше), но атомная массы остается той же самой (замена протона на нейтрон). Позитронный распад (обозначенный символом b+) сдвигает радионуклид по диагонали вниз на одну ячейку направо на диаграмме нуклидов. Это – противоположно сдвигу, который происходит при бета-распаде.
Испускание нейтрона
Период полураспада - промежуток времени, в течение которого количество радиоактивных ядер в среднем уменьшается вдвое.
![]()
![]()
Правило смещения Содди и Фаянса
Закон описывает, какой элемент и какой изотоп этого элемента получается при том или ином типе радиоактивного распада:
при альфа-распаде создаётся элемент с зарядом ядра, уменьшенным на два, и с атомной массой, уменьшенной на четыре по отношению к родительскому радиоизотопу, например:
 ;
;
при бета-распаде заряд ядра атома созданного элемента возрастает на единицу при неизменной атомной массе, например:
 .
Это справедливо для β--распада,
называемого также электронной эмиссией.
Это единственная форма бета-распада,
которую могли наблюдать и регистрировать
Содди и Фаянс в 1913 году. Позже, в 1930-х
годах, была открыта другая форма
бета-распада — β+-распад,
который можно назвать позитронной
эмиссией.
Кроме того, было открыто явление захвата
электронов,
при котором атомная масса изотопа
остаётся неизменной, как и при β--распаде,
но заряд ядра уменьшается на единицу,
например:
.
Это справедливо для β--распада,
называемого также электронной эмиссией.
Это единственная форма бета-распада,
которую могли наблюдать и регистрировать
Содди и Фаянс в 1913 году. Позже, в 1930-х
годах, была открыта другая форма
бета-распада — β+-распад,
который можно назвать позитронной
эмиссией.
Кроме того, было открыто явление захвата
электронов,
при котором атомная масса изотопа
остаётся неизменной, как и при β--распаде,
но заряд ядра уменьшается на единицу,
например:  .
.
13)Желе́зо-ни́келевыйаккумуля́тор — это вторичный химический источник тока, в котором железо— анод, электролитом является водный раствор гидроксида натрия или калия (с добавками гидроксида лития), катод— гидрат окиси никеля(III).
Железо-никелевый аккумулятор представляет собой железный сосуд ( бак), внутри которого размещены положительные и отрицательные пластины, выполненные в виде коробок из плоских перфорированных лент, заполненных активной массой.
Активный материал содержится в никелированных стальных трубках или перфорированных карманах. С точки зрения стоимости и удельной энергоемкости, они близки к литий-ионным аккумуляторам, а с точки зрения саморазряда, эффективности и напряжения — к NiMH аккумуляторам. Это достаточно выносливые аккумуляторы, стойкие к грубому обращению (перезаряд, глубокий разряд, короткое замыкание и термические удары) и имеющие очень длинный срок службы. Используются для резервного электропитания там, где могут быть постоянно заряжаемыми. Срок службы в таком случае может быть более 20 лет.
Свинцовые аккумуляторы
Кислотные свинцовые аккумуляторы являются наиболее распространенными
среди вторичных химических источников тока. Обладая сравнительно высокой
мощностью в сочетании с надежностью и относительно низкой стоимостью.
Эти аккумуляторы находят разнообразное практическое применение. Своей
популярностью и широкиммаштабом производства они обязаны стартерным
батареям, предназначенным для различных средств передвижения и прежде всего
автомобилей. В этой области их монопольное положение устойчиво и
сохраняется долгое время. На базе свинцовых аккумуляторов комплектуется
подавляющее большинство стационарных и значительная часть вагонных
батарей. Успешно конкурируют с щелочными тяговые свинцовые аккумуляторы.
14.CaH2+2H2O->Ca(OH)2+H2стрелочка вверх, и над H2в правой частипоставить х
1)амега=200*(100-12)/100=176кг
nСaH2=176/42=4,2кмоль (M=42-маляр.масса)
2)По ур-ю р-ции кол-во СаН2относится как 1:1, следовательно кол-во Н=4,2кмоль
V=nH2*22,4=4,2*22,4=94,08 м3.
Ответ: 94,08м3.
Билет 19
52) ИСКУССТВЕННАЯРадиактивность - радиоактивность, наблюдаемая у нуклидов, образующихся в результате ядерных реакций. Открыта И. и Ф. Жолио-Кюри в 1934.
Термоядерная реа́кция — разновидность ядерной реакции, при которой лёгкие атомные ядра объединяются в более тяжёлые, за счёт кинетической энергии их теплового движения.
53)Гальвани́ческийэлеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов вэлектролите, приводящем к возникновению в замкнутой цепи электрического тока
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов
В настоящее время применяют исключительно химическую деполяризацию. Ее сущность заключается в том, что в элемент вводят какой-либо сильный окислитель, который вступает в химическую реакцию с водородом, выделяющимся у положительного электрода, и этим предотвращает его выделение в газообразном состоянии.
ПОЛЯРИЗАЦИЯ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
разность между напряжением гальванического элемента при разряде или заряде и его напряжением при разомкнутой внешней цепи
54)
Билет 20.
55)
Изото́пы — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный(порядковый) номер, но при этом разные массовые числа.
Элементы-плеяды группа близких друг другу и не отделимых друг от друга химических элементов, помещаемых вместе как одно целое в периодической системе
Устойчивые изотопы не подвергаются радиоактивному распаду. Поэтому они сохраняются в природных условиях. Примерами устойчивых изотопов являются кислород-16 и утлерод-12.
Радиактивные изотопы-изотопы, ядра которых нестабильны и испытывают радиоактивный распад
Использованию изотопов-для изучения диффузии в твердых телах
- для выяснения механизма химических реакций
- в качестве меченых атомов
56)Метод электронного баланса В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом:число электронов, отданных восстановителем, должно рав¬няться числу электронов, присоединенных окислителем.
Электронно-ионный метод основан на балансе зарядов ионов. Он особенно удобен тогда, когда нельзя определить степени окисления
57)
Билет 21
58)
Закон Мозли — закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером. Экспериментально установлен английским физиком Генри Мозли в 1913 году.
ПЕРИОДИЧЕСКИЙ ЗАКОН МЕНДЕЛЕЕВА, в химии - закон, сформулированный Дмитрием Ивановичем МЕНДЕЛЕЕВЫМ в 1869 г., согласно которому свойства химических ЭЛЕМЕНТОВ находятся в периодической зависимости от их ОТНОСИТЕЛЬНОЙ АТОМНОЙ МАССЫ. Объединение химических элементов в группы на основании этого закона предшествовало созданию ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ. На основе пробелов в этих группах Менделеев смог предсказать существование и свойства неоткрытых элементов. Однако в его таблице были некоторые отклонения от правила, объяснения которым смогли найти, лишь когда Генри МОЗЛИ в своей работе о РЕНТГЕНОВСКИХ ЛУЧАХ открыл, что периодичность связана с атомным номером (в большей степени, чем с атомной массой), а затем, несколько позже, были открыты ИЗОТОПЫ.
59)Сте́пеньокисле́ния — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону болееэлектроотрицательных атомов
Окисли́тельно-восстанови́тельныереа́кции, — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем
ВИДЫ
Межмолекулярные, Внутримолекулярные ,Диспропорционирование , Репропорционирование.
Свойстваокислительный и восстановительные
60)
СаСО3=СаО+СО2
100г/моль-100процентов
56г/моль-х процентов
W процентов(СаО)=56*100/100=56процентов
Билет 22
61)Фундаментальным принципом построения периодической системы является ее подразделение на группы и периоды. Менделеевское понятие рядов элементов ныне не употребляется, поскольку лишено физического смысла. Группы, в свою очередь, подразделяются на главную (а) и побочную (b) подгруппы. В каждой подгруппе содержатся элементы — химические аналоги. Элементы а- и b-подгрупп в большинстве групп также обнаруживают между собой определенное сходство, главным образом в высших степенях окисления, которые, как правило, равны номеру группы.
Периодом называется совокупность элементов, которая начинается щелочным металлом и заканчивается инертным газом (особый случай — первый период). Каждый период содержит строго определенное количество элементов. Периодическая система состоит из восьми групп и семи периодов, причем седьмой пока не завершен.
Особенность первого периода заключается в том, что он содержит всего 2 элемента: водород и гелий.
Второй период содержит 8 элементов. Он начинается щелочным металлом литием, единственная степень окисления которого + 1. Далее следует бериллий (металл, степень окисления + 2). Бор проявляет уже слабо выраженный металлический характер и является неметаллом (степень окисления + 3). Следующий за бором углерод — типичный неметалл, который проявляет степень окисления как +4, так и — 4. Азот, кислород, фтор и неон — все неметаллы, причем у азота высшая степень окисления + 5 соответствует номеру группы; для фтора известна степень окисления + 7. Инертный газ неон завершает период.
Третий период (натрий — аргон) также содержит 8 элементов. Характер изменения их свойств во многом аналогичен тому, который наблюдался для элементов второго периода. Но здесь есть и своя специфика. Так, магний в отличие от бериллия более металличен, так же как и алюминий по сравнению с бором. Кремний, фосфор, сера, хлор, аргон — все это типичные неметаллы. И все они, кроме аргона, проявляют высшие степени окисления, равные номеру группы.
62)Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Существуют следующие типы гидролиза солей или же три вида солей, которые подвергаются гидролизу:
1.К первому типу относятся соли, которые получены слабым основанием и сильной кислотой. Например, CuCl2, NН2Cl, Fе2(S04)3, этот тип гидролиза называют гидролиз по катиону
2.Второй тип солей, которые подвергаются гидролизу, это соли полученные сильным основанием и слабой кислотой. Это К2С03, Na2S и другие. Это гидролиз по аниону.
3.К третьему типу относят соли, которые получены слабым основанием и слабой кислотой: (NН4)2C03, Fе2(CО3)3. Такой вид гидролиза называется гидролиз по катиону и по аниону
63) СаСО3=СаО+СО2
Масса чистого СаСО3=(80*10)/100=8кг
М(СаСО3)=100г/моль
М(СаО)=56г/моль
100г/моль-56г/моль
8кг-х
Х=(8кг*56г/моль)/100г/моль=4.48кг
Масса(СаО)=4.48кг
Ответ масса(СаО)=4.48кг
Билет 23.


