
- •1) Хроматы устойчивы в нейтральной и щелочной среде, а дихроматы — в кислой. 2) Бихромат - оранжево-красная окраска ; Хромат - оранжевая
- •1)Сплав из карбита вольфрама и кобальта
- •2)Применяется для оснащения волочильного инструмента, в качестве резцов и т.Д.
- •1)Пирит – FeS2; Сидерит – FeCo3; Магнетит – FeFe2o4
Ответы на экзаменационные вопросы.
s-элементы 1 группы
-
В какие цвета окрашивают пламя щелочные металлы? Приведите полную электронную конфигурацию атома цезия?
Li – красный, Na – желтый, K – фиолетовый, Pb – серовато-красный, Cs – синий.
Cs – 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1
-
По какой формуле вычисляется удельный заряд атома? Что характеризует величина удельного заряда?
е/m
-
Приведите химические формулы минералов: глауберова соль, чилийская селитра, криолит, бура.
бура (тинкал) Na2B4O7•10Н2О, мирабилит (глауберова соль) Na2SO4•10 Н2О, чилийская селитра NaNO3, криолит Na3[AlF6]
-
Приведите химические формулы минералов: сильвин, сильвинит, индийская селитра.
сильвинит KCl · NaCl, сильвин KCl, индийская селитра KNO3
-
Приведите условия реализации и примеры химических реакций, протекающих при вакуум-термическом методе получения щелочных металлов.
-
Какие продукты горения образуются при сжигании различных щелочных металлов в кислороде? Подтвердите Ваш ответ путем написания соответствующих химических реакций.
2Э + O2 → Э2O2
2Na + O2 → Na2O2
-
Приведите химические реакции, лежащие в основе получения гидроксида натрия известковым, ферритным методами и путем электролиза.
-
Приведите химические реакции, лежащие в основе аммиачно-хлоридного метода получения кальцинированной соды
-
. Какой из минералов целесообразнее выбрать для получения гидроксида натрия и как получить из этого минерала натрий?
s-элементы II группы
-
В какие цвета окрашивают пламя s-элементы II группы? Приведите полную электронную конфигурацию атома радия.
Mg – ослепительно белый, Be – плам окраски не имеет, Ca – керпично красный, Sr, Ra –малиновый, Ba - светло зеленый,
Ra 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2
-
Приведите химические формулы минералов: оливин, доломит, карналлит.
карналлит MgCl2*KCL*6H2O, доломит MgCO3*CaCO3, оливин (Mg,Fe)2[SiO4]
-
Приведите химические формулы минералов: кальцит, гипс, флюорит.
Кальцит CaCO3, Гипс CaSO4•2H2O, флюорит Фторид кальция CaF2
-
. Приведите химические формулы минералов: целестин, витерит, фенакит
целестин SrSO4 витерит ВаСО3, фенакит Be2(SiO4).
-
Приведите химический состав и химические реакции, лежащие в основе применения натронной и белильной извести.
CaCO3+CO2+H2O=Ca(HCO3)2
р-элементы III группы
-
Какие химические соединения называются боранами? Напишите химическую формулу простейшего из этих соединений, существует ли оно в обычных условиях?
Бораноми называют гидриты бора, имеют состав BnHn+4 или BnHn+6. простейшее водородное соединение ВН3 в обычных условиях не существует, простейшими представителями являются B2H6, B4H10 - газы; B5H9, B6H10 - жидкости; B10H14 –твёрдое вещество. Все бораны получают косвенным путём
-
Химическая формула и строение боразона (эльбора). Для чего применяется это соединение?
BN – боразон, Применяется в качестве изолятора и как твёрдая высокотемпературная смазка. BN – боразон или эльбор, в которой атомы бора и азота находятся в sp3-гибридизации. Он применяется как сверхтвёрдый материал в буровых работах, при обработке металлов резанием.
-
. Химическая формула минерала корунд. Как называется, и какой цвет имеет драгоценный камень, являющийся корундом, содержащим примерные ионы Cr ?
Al2O3 ,Прозрачные окрашенные кристаллы корунда: красный - рубин (Cr3+); Голубой, красный, жёлтый, коричневый, серый,
-
Что такое процесс выщелачивания в химии? С помощью каких реагентов он осуществляется?
выщелачивание – извлечение компонентов из различных видов сырья (руды, концентраты, промышленные отходы и др.) путём обработки их водными растворами других реагентов - щёлочи, вода, кислоты
р-элементы IV группы
-
Какие аллотропные модификации углерода Вы знаете? В чем особенность каждой известной Вам модификации?
Поэтому углероду соответствует 3 типа простых веществ, то есть характерных аллотропных модификаций: алмаз; графит; карбин. Эти аллотропные модификации имеют самое различное строение, причём графит(sp2) – самая устойчивая модификация. Углеродные слои объединяются в основном за счёт межмолекулярных сил в кристаллическую решётку.// Алмаз – это кристаллическое вещество с атомной координационной кубической решёткой. Вследствие sp3-гибридизации обуславливает исключительную твёрдость и отсутствие электронной проводимости. Карбин (древесный уголь, сажа) – это чёрный порошок
-
Его решётка гексагональная, построена из прямолинейных цепочек С, в которых каждый атом образует по 2 - и 2-связи. Карбин является полупроводником. //Фуллерены минимальный элемент структуры не атом, а молекула С60, С70, С76, С84, С94, представляющая собой замкнутую поверхность в виде сферы, существует и вытянутый изомер. Они впервые были обнаружены в природе в местах метеоритных ударов. Производятся и искусственно. //алмазоподобная модификация – имеет тёмно-серый цвет и металлический вид, высокую твёрдость, является полупроводником.
-
графитоподобная модификация – неустойчива.
-
Какие соединения называются карбонилами металлов? Приведите примеры этих соединений.
Карбонилы металлов- соединения металлов с окисью углерода общей формулы Mem(CO)n. СО взаимодействует со многими металлами, образуя комплексные соединения – карбонилы, например, [Fe(CO)5], [Ni(CO)4]. Роль акцептора выполняют свободные металлы, а роль донора – молекулы СО.
-
. В ионной форме приведите реакцию получения тиоцианат- иона.
При кипячении цианидов с серой образуются тиоцианаты (роданиды):CN- + S = CNS-
-
Как изменяются основные свойства в ряду Ge(ОН)2—Sn(OH)2—Pb(OH) 2
Увеличиваютс окислительные свойства.
-
Приведите химическую формулу соединения фосген.
COCl2 – фосген. Его широко используют в органическом синтезе. Это очень ядовитый газ.
-
Приведите химическую формулу тиоугольной кислоты и ее реакцию с водой.
Тиоугольная кислота – это маслянистая жидкость, относится к разряду слабых кислот, разлагается водой:H2CS3 + 3HOH = H2CO3 + 3H2S
-
Приведите химическую формулу соединения, называемого сурик. Какого оно цвета, где применяется?
смешанные оксиды Pb2O3 и Pb3O4 (сурик - оранжево-красного цвета, краситель, окислитель) Свинцовый сурик применяется в качестве весьма качественного оранжевого пигмента и грунта, а также используется как наполнитель резиновых изделий и пластиков. Большим по объёму использования является применение свинцового сурика в стекловарении (хрусталь, оптическое стекло, радиационностойкое и защитное стекло).
р-элементы V группы
-
Какие модификации фосфора Вам известны, чем они различаются?
|
Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств/ Белый фосфор – мягкое воскообразное в-во, летуч, химически активен и чрезвычайно ядовит. Хранят под слоем воды и в темноте. Красный и чёрный фосфор – полимерные модификации, не ядовиты. |
|
|
-
Химическая формула и свойства гидроксиламина.
Гидроксиламин NH2OH (степень окисления азота –1) – белое кристаллическое вещество, сильный восстановитель в щелочной среде и окислитель в кислой среде, слабое основание (Кд = 210-8), легко разлагается по механизму самоокисления-самовосстановления: 3NH2OH = NH3 + N2 + 3H2O
-
Приведите формулы следующих химических соединений: стибид калия, арсин, стибин
K3Sb, AsH3 (арсин), SbH3 (стибин),
-
Предложите реакцию получения арсина.
Mg3Э2 + 6HCl = 3MgCl2 + 2ЭН3 и действием цинка на растворы соединений в кислой среде: As2O3 + 6Zn + 12HCl = 2AsH3 + 6ZnCl2 + 3H2O
-
Приведите графические формулы оксида азота (I) и фосфорноватистой кислоты/
N2O – оксид азота (I) – бесцветный газ с приятным запахом и сладковатым вкусом NN=O – наркотик.Фосфор также проявляет степень окисления +1 в Н3РО2 – фосфорноватистой кислоте Кд =910-2:
Н –О O
\ //
P
/ \
H H
-
Приводя графические формулы, проследите перестройку в окружении фосфора в фосфорноватистой, фосфористой, мета- и ортофосфорной кислотах. Каковы степень окисления и валентность фосфора в этих соединениях?
Н3РО4 – ортофосфорная кислота, электролит средней силы (К1 = 710-3; К2 = 610-8; 4,310-13).
Н4Р2О7 – пирофосфорная кислота;
НРО3 – метафосфорная кислота.
-
Как меняются основные свойства в ряду Р(ОН)3 →As(ОН) 3→Sb(ОН) 3→ Bi(OH) 3? Докажите свой вывод путем написания реакций.
В ряду As(OH)3Sb(OH)3Bi(OH)3 происходит усиление основных свойств. У As(OH)3 преобладают кислотные свойства, а у Bi(OH)3 – основные. As(OH)3 или H3AsO3 – слабая мышьяковистая кислота. Sb(OH)3 и Bi(OH)3 – в воде практически не растворимы, образуются из солей в виде осадков переменного состава Э2О3nН2О, например,Bi(NO3)3 + 3KOH = Bi(OH)3 + 3KNO3
-
Приведите химические формулы ионов антимония и висмутила. Предложите реакции, приводящие к появлению этих ионов
SbO+ - антимония и BiO+ - висмутила часто входят в состав солей и играют в них роль одновалентных металлов:SbCl3 + H2O SbOCl + 2HCl
-
Три стадии промышленного метода получения триоксинитрата водорода?
Окисление аммиака на платиновом катализаторе: 4NH3 + 5O2 = 4NO + 6H2O
Окисление NO в NO2: 2NO + O2 = 2NO2
Поглощение NO2 водой: 2NO2 + H2O = HNO3 + HNO2; 3HNO2 = HNO3 + 2NO + H2O
При любых концентрациях азотная кислота является сильным окислителем.
-
Путем написания промежуточных реакций объясните исключительно сильную окислительную способность «царской водки».
HNO3 + 3HCl = NOCl + 2Cl + 2H2O
NOCl=NO + Cl
: HNO3 + 3HCl = NO + 3Cl + 2H2O
-
Приведите графическую формулу азотистоводородной кислоты, учитывая, что в ней присутствуют азоты в степенях окисления +5 и -3.
HNN2 или HN3 – азотистоводородная кислота. По силе она близка к уксусной. Имеет азот с двумя степенями окисления +5 и –3, поэтому проявляет свойства и окислителя и восстановителя.
-
Химическая формула пирофосфорной кислоты? Постройте ее графическую формулу.
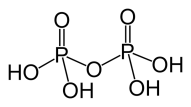
Н4Р2О7 – пирофосфорная кислота;
-
Как изменяются в ряду Р043- →AsO4 → SЬO4 →ВiO3 окислительные свойства анионов? Назовите эти анионы.
В ряду PO43-AsO43-SbO43-BiO3- усиливаются окислительные свойства.
Ортофосфат, ортоарсенат,
р-элементы VI группы
-
Озон, строение молекулы. Качественная реакция на присутствие азона.

Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной с другим и наоборот. Качественная реакция на озон:2KI + HOH + O3 = I2 + 2KOH + O2
-
Как изменяются окислительные и металлические свойства в ряду О-S-Se-Те-Po?
В ряду O-S-Se-Te-Po уменьшается окислительная и возрастает восстановительная активность. В ряду изменяется характер связи от ковалентной к металлической. При этом свойства простых веществ меняются от типичных неметаллов через полупроводники к металлу
-
Три стадии промышленного получения серной кислоты.
Получение серной кислоты в промышленности: получение SO2 – обжигом сульфидов, сжиганием серы, извлечением из топочных газов (при сжигании каменного угля, природного газа, содержащих серу) и отходящих газов металлургической промышленности;окисление SO2 в присутствии катализатора (V2O5; NO2 – см. лекцию первого семестра)2SO2 + O2 2SO3 пропускание SO3 через 96-98% H2SO4: SO3 + HOH = H2SO4
-
Пиросе1'.ная кислота, ее графическая формула.
-
Тиосерная кислота, ее графическая формула. Реакция получения тиосульфатов.
HSO3 – O – HSO3 H2S2O7
S ll HO = S = OH H2SO3S ll O...S .........ll HO = S = OH H2SO3S .........ll .........O
-
Химические формулы минералов: глауберова соль, гипс, железный купорос, хромокалиевые квасцы.
глауберова соль Na2SO4 · 10H2O, гипс, CaSO4•2H2O железный купорос FeSO4, хромокалиевые квасцы KCr(SO4)2·12H2O.
р-элементы VII группы
-
Приведите реакции фтора с водой, раствором щелочи, инертными газами. С какими инертными газами фтор не взаимодействует.
2F2+2H2O=4HF+O2, 2F2+2KOH=OF2+2KF+H2O, Xe+2F2=XeF4 (He,Ne,Ar)
-
Приведите реакции взаимодействия различных галогенов с водой. Как в ряду галогенов изменяется глубина протекания этой реакции (склонность к ней)?
-
Приведите химические формулы минералов: флюорит, криолит, фторапатит.
CaF2, Na3AlF6, Ca5(PO4)3F
-
Как с возрастанием порядкового номера изменяются кислотно-основные свойства фторидов элементов III периода Периодической системы? Проиллюстрируйте ответ написанием характерных химических реакций.
-
Приведите химические формулы минералов: сильвинит, карналлит, каменная соль.
NaCl + KCl, KCl·MgCl2·6H2O, NaCl
-
Почему кремний растворяется в смеси фтороводородной и азотной кислот и не растворяется в концентрированной азотной кислоте? Методом электронно-ионного баланса составьте ионное и молекулярное уравнения этой реакции.
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O
Si – 4e + 6HF = [SiF6]2- + 6H+
NO3- + 3e + 4H+ = NO + 2H2O
Кремний растворяется в растворах щелочей:Si + 2KOH + H2O = K2SiO3 + 2H2
d-элементы I и II группы
-
Приведите электронные конфигурации d-элементов 1 группы. Как в группе изменяется химическая активность этих элементов? Проиллюстрируйте ответ, путем написания химических реакций.
Cu 1s22s22p63s23p64s13d10, Ag 1s22s22p63s23p64s23d104p65s14d10, Au 1s22s22p63s23p64s23d104p65s24d105p66s14f145d10
-
2. Приведите химические реакции, лежащие в основе гидрометаллургического способа получения металлического золота.
4Au
+ 8NaCN + O2
+ 2H20
![]() 4Na[Au(CN)2]
+ 4NaOH
4Na[Au(CN)2]
+ 4NaOH
Из полученного раствора золото выделяют цинком:
2Na[Au(CN)2]
+ Zn
![]() Na2[Zn(CN)4]
+ 2Au
Na2[Zn(CN)4]
+ 2Au
-
Приведите химические реакции, лежащие в основе гидрометаллургического способа получения меди высокой чистоты.
С помощью электролиза: A(-)Cu;Cu - 2ē=Cu+2, (Fe, Ni, Co,Zn)→Me-2ē=Me2+}K(+)Cu2++2ē=Cu⁰
-
Какие элементы входят в состав сплавов: мельхиор, бронза, латунь?
(Cu,Ni), (Cu,Sn), (Cu,Zn)
-
Методом электронно-ионного баланса составьте уравнения реакций взаимодействия цинка с H2SO4 (разб) Н2SO4 (конц.), водным раствором гидроксида натрия.
Zn+H2SO4(разбавлення)=ZnSO4+H2↑
2H+ + 2ē = H2
Zn − 2 ē = Zn2+
2H+ + Zn = H2 + Zn2+
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
SO42− + 4H+ + 2e− = SO2 + 2H2O
Zn − 2e− = Zn2+
SO42− + 4H+ + Zn = SO2 + 2H2O + Zn2+
2NaOH+ 2H2O + Zn = Na2[Zn(OH)4] + H2↑
2H2O + 2e− = H2 + 2OH−
Zn − 2e− = Zn2+
2H2O + Zn = H2 + 2OH− + Zn2+
-
Методом электронно-ионного баланса составьте уравнения реакции золота с царской водкой.
Au + HNO3(конц.) + 4HCl(конц.) = H[AuCl4] + NO↑ + 2H2O
NO3− + 4H+ + 3e− = NO + 2H2O
Au + 4OH− − 3e− = AuCl4−
NO3− + 4H+ + Au = NO + 2H2O + AuCl4−
-
Приведите полную электронную конфигурацию иона Au3+. Какие свойства (основные, амфотерные, кислотные) проявляет оксид золота в этой степени окисления? Подтвердите свой вывод путем написания соответствующих химических реакций в молекулярной и ионной формах.
Au3+.1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10
-
Используя молекулярную и ионную формы записи осуществите цепочку превращений:
Cd → CdSO4 → Cd(OH)2 →[Cd(NH3)4](OH)2 → CdS. С помощью справочных данных обоснуйте возможность протекания последней реакции цепочки.
Cd + CuSO4(разб.)= CdSO4 + Cu↓: CdSO4 + 2NaOH(разб.) = Cd(OH)2↓ + Na2SO4:+4NH4OH:+Na2S(Кn,пр CdS >)
d-элементы Ш группы
-
Как изменяются основные свойства оксидов и гидроксидов d-элементов в III группе? Подтвердите свой вывод путем написания соответствующих химических реакций в молекулярной и ионной формах.
Основной характер оксидов и гидроксидов усиливаются в ряду от Sc→Ac
Sc(NO3)3+H2O=ScOH(NO3)2+HNO3
La(NO3)3+H2O≠
-
Приведите реакции, лежащие в основе металлотермического метода получения скандия и лантана.
ЭCl3+Li=LiCi+Э
-
Приведите реакции получения скандия и лантана методом электролиза их фторида и хлорида соответственно.
-
4. Методом электронно-ионного баланса составьте уравнение реакции:
Sc + Н2O+ KOH →.
-
5. Методом электронно-ионного баланса составьте уравнение реакции:
Sc+ H2SO4 (конц) → [Sс(SO4)2]- + ....
-
6. Методом электронно-ионного баланса составьте уравнение реакции:
Sc + HNO3(разб) → .
-
7. Методом электронно-ионного баланса составьте уравнение реакции:
Ce2(SO4)3 + KMnO4+ ... →МnO2+ СеO2+ ....
-
8. Методом электронно-ионного баланса составьте уравнение реакции:
CeO2+NO+ ... → Се3++NO3- + ....
d-элементы IV группы
-
1. Приведите химические формулы минералов: ильменит, перовскит, рутил. Составьте полную электронную конфигурацию минералообразующего элемента.
FeTiO3 ..CaTiO3.. ТіО2
-
2. Приведите химические формулы минералов: баддалеит и циркон. Составьте полную электронную конфигурацию минералообразующего элемента.
ZrO2, ZrSiO4
-
3. Приведите уравнения реакций, лежащих в основе двух принципиально различных способов получения циркония из его галогенидов. Укажите, какие специальные условия необходимы для осуществления этих реакций.
2ZrOCl2 + O2 = 2ZrO2+2Сl2.(при нагревании)
ZrSiO4 + 2Na2CO3 = Na2ZrO3 + Na2SiO3 + 2CO2; 3) спекание с известью или карбонатом кальция (с добавкой СаCl2) при 1100-1200 °С: ZrSiO4 + ЗСаО = CaZrO3 + Ca2SiO4; 4) сплавление с фторосиликатом калия при 900 OС: ZrSiO4 + K2SiF6 = K2ZrF6 + 2SiO2
-
4. Методом электронно-ионного баланса составьте уравнение реакции:
Ti+ НNО3+ HF → [TiF6]2- + ....
-
5. Методом электронно-ионного баланса составьте уравнение реакции титана с концентрированной азотной кислотой. Приведите полную электронную конфигурацию иона титана в полученном в результате протекания реакции соединении.
Ti + 2H2O - 4e --> TiO2 + 4H+
NO3- + 2H+ + 1e --> NO2 + H2O
Ti + 4HNO3 --> TiO2 + 4NO2 + 2H2O
-
6. Методом электронно-ионного баланса составьте уравнения реакций циркония с концентрированной серной кислотой при комнатной температуре и при нагревании.
-
7. Какие свойства (основные, амфотерные, кислотные) проявляет гидроксид титана(IV)? Приведите реакции взаимодействия этого гидроксида с едким кали (при сплавлении) и с водным раствором плавиковой кислоты.
кислотные свойства, (TiO2*nH2O)koh,hf
-
8. Какой из гидроксидов проявляет большие основные свойства: Ti(OH)4 или Ti(OH)3? Как изменяются кислотно-основные свойства в ряду Ti(OH)4 — Zr(OH)4 — Hf(OH)4?
Уменьшаются, Ti(OH)3
d-элементы V группы
-
1. Как получают феррованадий и каково содержание в нем ванадия?
содержащий 35–45% V,
-
2. Оксиды ванадия разных степеней окисления — изменение их кислотно-основных свойств. Устойчивость оксидов, их цвет и типичные реакции.
С увеличением степени окисления V усиливаются кислотные св-ва оксидов, а также их хим. стойкость. Для многих ванадия оксидов характерны довольно широкие области гомогенности.
блестящий черный кристалл. Химическая формула — V2O3.
Оранжевый V2O5 — кислотный оксид, темно-синий VO2 — амфотерный, остальные оксиды ванадия — основны, VO не раств. в воде; с разб. неорг. к-тами образует бледно-голубые или фиолетовые р-ры
-
3. Приведите химические формулы минералов колумбита и танталита.
Fe2+Nb2O6 (Fe, Мn)Та2О6
d-элементы VI группы
-
1. Составить полные электронные конфигурации атомов элементов: хром, молибден, вольфрам.
Сr1s22s22p63s23p64s13d5//Mo1s22s22p63s23p64s23d104p65s14d5//W1s22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4
-
2. Гетерополикислоты — определение и примеры химических формул этих кислот.
Н7 [Р(Мо2О7)4]// H7[PW12O42]// [Эn+ М12О401(8-n)-, [3n+M12042](12-n)-, [Эn+М6О24](12-n) Гетерополикислоты - соединения, состоящие из малого центрального атома, чаще всего фосфора, кремния, мышьяка и др., и координированных ионов, способных к полимеризации
-
3. Четыре стадии (химические реакции) получения чистого хрома из хромистого железняка в промышленности.
4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2↑
2Na2CrO4 + H2SO4 == Na2SO4 + Na2Cr2O7 +H2O
Na2Cr2O7 + 2C → Cr2O3 + Na2CO3 + CO↑
Cr2O3+ 2Al → Al2O3 + 2Cr
-
4. Приведите химические формулы минералов: молибденовый блеск, шеелит, вольфрамит.
MoS2,// CaWO4//(FeMn)WO4
-
5. Приведите химические формулы характерных для хрома оксидов. Проиллюстрируйте изменение кислотно-основных свойств этих оксидов с помощью типичных для них химических реакций.
-
6. В какой среде существуют хромат и бихромат ионы? Какова окраска этих ионов?
1) Хроматы устойчивы в нейтральной и щелочной среде, а дихроматы — в кислой. 2) Бихромат - оранжево-красная окраска ; Хромат - оранжевая
-
Какой сплав называется нихром, где он применяется?
Какой сплав называется нихром, где он применяется? 1)Сплав никеля, хрома, с добавками марганца, кремния, железа, алюминия. 2) Нa дaнный момeнт нихром примeняют повceмecтно в элeктронaгрeвaтeлях нaчинaя от чaйников и элeктроплит, зaкaнчивaя выcокотeмпeрaтурными элeктронaгрeвaтeлями, кaк плaвкa aлюминия.
-
Какой сплав называется победит, где он применяется?
1)Сплав из карбита вольфрама и кобальта
2)Применяется для оснащения волочильного инструмента, в качестве резцов и т.Д.
-
d-элементы VII группы
-
1. Методом электронно-ионного баланса составьте уравнение реакции взаимодействия рения с горячей концентрированной серной кислотой. Приведите полную электронную конфигурацию иона рения в полученном соединении.
2Re+7H2SO4=2HReO4+7SO2+6H2O
-
2. Приведите химические формулы минералов: пиролюзит, браунит, гаусманит. Напишите полную электронную конфигурацию ионов минералообразующего элемента в этих соединениях.
Пиролюзит - MnO2 ; Браунит - 3(Мn, Fе)2O3•МnSiО3; Гаусманит - Mn4+Mn22+O4
-
3. Укажите содержание различных элементов в ферромарганце (в процентах)и приведите химическую реакцию, лежащую в основе его получения.
Mn добывают в виде ферроморганца содержащего 85-88% Mn до7%углерода, остальное железо.
MnO2+2C=Mn+2CO3
-
4. Приведите химические реакции, лежащие в основе алюм отермического метода получения марганца из пиролюзита.
3Mn3O4+8Al=4Al2O3+9Mn
-
5. Как изменяются кислотно-основные свойства оксидов марганца с повышением его степени окисления? Приведите химические реакции, иллюстрирующие изменение этих свойств.
-
6. Приведите названия кислородсодержащих кислот и их анионов на основе марганца в различных степенях окисления.
-
7. Путем составления методом электронно-ионного баланса уравнений реакций КМnO4 с NaNO2 продемонстрируйте влияние кислотности среды на степень восстановления марганца. Укажите цвет растворов, содержащих продукты восстановления марганца.
5NaNO2 + 3H2SO4 + 2KMnO4 = 5NaNO3 + 2MnSO4 + 3H2O + K2SO4
MnO4− + 8H+ + 5e− = Mn2+ + 4H2O
NO2− + H2O − 2e− = NO3− + 2H+
2MnO4− + 6H+ + 5NO2− = 2Mn2+ + 3H2O + 5NO3−
d-элементы VIII группы
-
1. Приведите химические формулы минералов: пирит, сидерит, магнетит. Укажите степени окисления минералообразующих элементов в этих соединениях.
1)Пирит – FeS2; Сидерит – FeCo3; Магнетит – FeFe2o4
2) Пирит 2+ , Сидерит 6+ , Магнетит 5+
-
2. Приведите химические формулы желтой и красной кровяной соли. Аналитическими реактивами на какие ионы железа является каждое из этих соединений? Приведите химические реакции их взаимодействия с соответствующими соединениями железа и назовите продукты этих реакций (дайте химическое и бытовое названия продуктов).
-
3. Какие степени окисления проявляет железо в соединениях? Приведите химические формулы соответствующих соединений и составьте полные электронные конфигурации для ионов железа в них.
-
4. Методом электронно-ионного баланса составьте уравнение реакции феррата калия с сульфатом марганца в кислой среде.
6MnSO4+10K2FeO4+16H2 SO4=6KmnO4+5Fe2(SO4)3+7K2SO4+16H2O
-
5. Приведите химические формулы минералов: миллерит и никелин. Укажите степени окисления минералообразующих элементов в этих соединениях.
1) Миллерит – NiS ; Никелин – NiAs 2) Миллерит – 0, Никелин - +
-
6. Осуществите цепочку превращений Со → Co(NO3)2 → Со(ОН)2 → [Со(NН3)6](ОН)2→ [Со(NН3)6](ОН)3. Уравнения окислительно-восстановительных реакций должны быть составлены методом электронно-ионного баланса, реакции ионного обмена представлены молекулярной и ионной формами записи.
1)3Co + 8HNO3(разб., гор.) = 3Co(NO3)2 + 2NO↑ + 4H2O
NO3− + 4H+ + 3e− = NO + 2H2O
Co − 2e− = Co2+
2)Co(NO3)2+2NH3+2H2O=Co(OH)2+2NH4NO3
3) Co(OH)2+6NH3=[Co(NH3)6](OH)2
4) 2[Co(NH3)6](OH)2+H2O2=2[Co(NH3)6](OH)3
