
27 гетероциклы II
.doc|
Лекция 28 |
ГЕТЕРОЦИКЛЫ II
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ
ПИРИДИН И ЕГО ГОМОЛОГИ

Строение пиридина

Получение

Пиридин – бесцветная жидкость с т.кип. 115о с характерным неприятным запахом. Хорошо растворим в воде и в органических растворителях, сам используется как растворитель во многих реакциях. Пиридин и его гомологи в небольшом количестве содержатся в каменноугольной смоле.
Химические свойства
Пиридин – ароматическое соединение. Особенности его свойств определяются:
1) наличием свободной, не вовлеченной в ароматическое сопряжение, электронной пары у атома азота, что обусловливает основные и нуклеофильные свойства пиридина;
2) π-дефицитностью углеродных атомов (более электроотрицательный N-атом стягивает на себя электронную плотность), это затрудняет атаку С-атомов электрофилами и делает возможной атаку их нуклеофилами.
Основность и нуклеофильность

Электрофильное замещение
Реакции проходит в более жестких условиях, чем с бензолом и даже чем с нитробензолом (пиридиновый N-атом можно сравнить с заместителем II рода). Электрофил атакует в 3-положение, имеющее относительно бόльшую электронную плотность:

Нуклеофильные реакции
а) замещение
Нуклеофильная атака идет в места с наименьшей электронной плотностью –
2 (α) и 4 (γ):
Аминирование (реакция Чичибабина)

Гидроксилирование

б) присоединение
При гидрировании пиридина в присутствии катализаторов образуется продукт полного гидрирования – пиперидин:

в) присоединение гидрид-иона
Соли пиридиния присоединяют гидрид-ион, образуя восстановленную форму хиноидной структуры, эта реакция обратима. Такие превращения происходят при функционировании пиридиннуклеотидных коферментов НАД и НАДФ:

Окисление гомологов пиридина
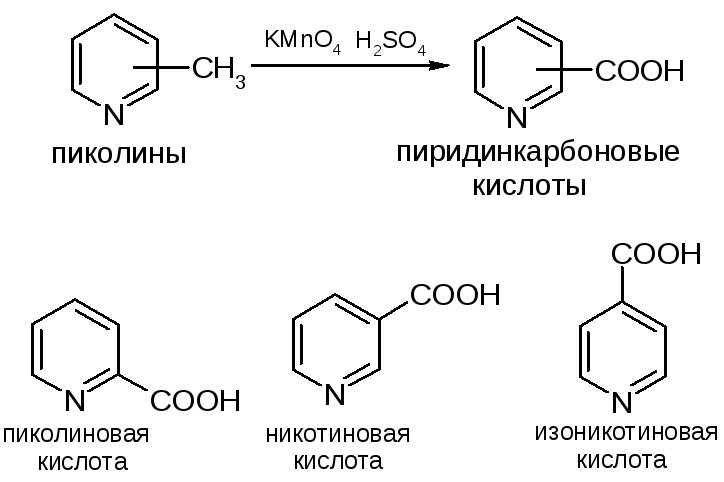
Природные и лекарственные вещества – производные пиридина

Никотинамид – витамин РР, составная часть коферментов – пиридиндинуклеотидов НАД и НАДФ. Кордиамин – лекарственное средство, стимулятор ЦНС.


Пиридоксин и пиридоксаль – две формы витамина В6; пиридоксаль и пиридоксамин – переходящие друг в друга соединения, участвуют в биохимических взаимопревращениях аминокислот и оксокислот.

Ряд алкалоидов содержат пиридиновое кольцо (см. дальше).
ХИНОЛИН

Получение

Химические свойства
В отношении основности и нуклеофильности хинолин аналогичен пиридину:

Электрофильные реакции
Электрофильная атака хинолина идет по бензольному циклу, имеющему бόльшую электронную плотность, преимущественно в положения 5 и 8.
а) замещение

8-оксихинолины образуют очень прочные не растворимые в воде комплексы с металлами и применяются в аналитической химии, этим же объясняется их антибактериальное действие.
б) окисление

Нуклеофильные реакции
Нуклеофилы атакуют π-дефицитный пиридиновый цикл хинолина в α- и γ-положения.
а) замещение
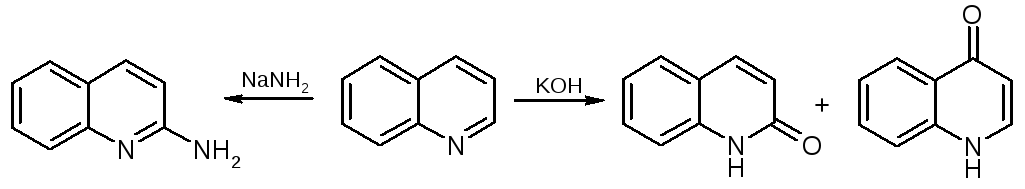
б) восстановление (гидрирование)

Производные бензопиридинов – лекарственные вещества
Производные 8-оксихинолина – см. выше.
Фторхинолоны
Это аналоги налидиксовой кислоты, высоко активные антибактериальные вещества с широким спектром действия:

Производные акридина:

ПИРАН

γ-Пиран – не ароматическая система, но при окислении он превращается в ароматическую соль пирилия:

Характерным химическим свойством γ-пирона является его сравнительно высокая основность, которая связана с тем, что образующийся катион имеет строение пирилиевой соли:

БЕНЗОПИРАН, ФЛАВОН

В растениях распространены соединения, содержащие конденсированную систему бензопирана. Этот цикл лежит в основе структуры токоферолов (витамин Е). Полигидроксильные производные 2-фенилбензо[2,3]-γ-пирона – флавона – имеют желтую окраску и обладают свойствами антиоксидантов, ингибирующих радикальные процессы окисления. Пример такого соединения – кверцетин. Гликозид кверцетина – рутин – и родственные ему вещества (витамин Р) используются, в частности, в фармации как профилактическое и лечебное средство для укрепления кровеносных сосудов.
ЛИТЕРАТУРА:
Основная
1. Тюкавкина Н.А., Зурабян С.Э., Белобородов В.Л. и др. – Органическая химия (специальный курс), кн.2 – Дрофа, М., 2008 г., с. 16-41.
Дополнительная
1. Н.А.Тюкавкина, Ю.И.Бауков – Биоорганическая химия – ДРОФА, М., 2007 г., с. 298-304.
28.09.09
