
- •Основные вопросы учебной программы по физике (1 семестр)
- •5. Центр масс механической системы и закон его движения.
- •11. Удар абсолютно упругих и неупругих тел. Превращения энергии и законы сохранения.
- •12. Момент импульса и момент силы относительно неподвижной точки. Момент импульса и момент силы относительно неподвижной оси.
- •13. Закон сохранения момента импульса материальной точки и системы материальных точек.
- •14. Момент инерции относительно неподвижной оси вращения. Теорема Штейнера. Кинетическая энергия вращающегося тела. Момент инерции тонкого стержня. Работа и мощность при вращении твердого тела.
- •15. Преобразования Галилея. Механический принцип относительности. Специальная и общая теория относительности. Принцип эквивалентности.
- •16. Постулаты специальной теории относительности. Преобразования Лоренца.
- •28. Волновая поверхность. Фронт волны. Сферическая волна. Затухающие волны. Плоская волна. Фазовая скорость и дисперсия волн.
- •29. Энергия волны. Плотность энергии. Средний поток. Плотность потока. Вектор Умова.
- •30. Принцип суперпозиции волн. Интерференция волн. Когерентность. Уравнение стоячей волны и его анализ.
- •32. Опытное обоснование корпускулярно-волнового дуализма вещества. Формула де Бройля. Экспериментальное подтверждение гипотезы де Бройля.
- •33. Волновая функция и ее физический смысл. Временное и стационарное уравнения Шредингера. Стационарные состояния. Собственные функции и собственные значения.
- •34. Соотношение неопределенностей. Ограниченность механического детерминизма.
- •35. Свободная частица. Частица в одномерной потенциальной яме. Квантование энергии и импульса частицы. Принцип соответствия Бора.
- •36. Квантовый гармонический осциллятор. Влияние параметров потенциальной ямы на квантование энергии. Туннельный эффект.
- •37. Статистический метод исследования. Вывод уравнения молекулярно-кинетической теории газов для давления. Средняя кинетическая энергия молекул.
- •39. Закон Максвелла для распределения частиц идеального газа по скоростям и энергии теплового движения. Физический смысл функции распределения. Характеристические скорости.
- •46. Применение первого начала термодинамики к изопроцессам и адиабатическому процессу в идеальном газе. Зависимость теплоемкости идеального газа от вида процесса.
- •47. Обратимые и необратимые процессы. Круговой процесс. Цикл Карно и его к.П.Д. Для идеального газа. Тепловые машины.
- •48. Второе начало термодинамики. Энтропия. Энтропия идеального газа.
- •49. Статистическое толкование второго начала термодинамики.
- •50. Реальные газы. Отступления законов реальных газов от законов для идеальных газов. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнение Ван-дер-Ваальса.
- •51. Изотермы реального газа. Опыт Эндрюса. Критические параметры.
- •52. Внутренняя энергия реального газа. Эффект Джоуля-Томсона.
- •53. Фазовые переходы первого и второго рода.
- •54. Классические представления о теплоемкости твердых тел. Теория Эйнштейна. Теория Дебая.
- •55. Понятие о фононах. Статистика фононного газа. Плотность состояний.
- •57. Статистика Ферми-Дирака и Бозе-Эйнштейна. Фермионы и бозоны. Квантовые числа. Спин электрона. Принцип неразличимости тождественных частиц. Принцип Паули.
46. Применение первого начала термодинамики к изопроцессам и адиабатическому процессу в идеальном газе. Зависимость теплоемкости идеального газа от вида процесса.
При изотермическом процессе температура газа остается постоянной в течение всего процесса. Уравнение состояния газа в этом случае имеет вид:



В случае изотермического процесса кривая является гиперболой и называется изотермой.
При изобарическом процессе давление газа остается неизменным:


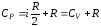
Этому процессу соответствуют на диаграмме P,V горизонтальные прямые изобары.
Зависимость давления от температуры при постоянном объеме представляет собой в координатах P, V вертикальную прямую, называемую изохорой.
 Отношение
Отношение
 представляет собой величину, характерную
для каждого газа и определяемуючислом
степеней свободы
молекул газа.
представляет собой величину, характерную
для каждого газа и определяемуючислом
степеней свободы
молекул газа.
47. Обратимые и необратимые процессы. Круговой процесс. Цикл Карно и его к.П.Д. Для идеального газа. Тепловые машины.
Реальный термодинамический процесс всегда необратим. Рассмотрим некоторый равновесный процесс, совершаемый системой под влиянием внешнего воздействия так, что система последовательно проходит через ряд равновесных состояний из начального в конечное. Если ту же последовательность состояний можно реализовать в обратном порядке и при этом не изменить состояния окружающих тел, то процесс будет обратимым.
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное.
Тепловая машина состоит из нагревателя, рабочего тела и охладителя рабочего тела. Охладителем, в конечном счете, служит окружающая среда. Тепловая машина работает по принципу замкнутого цикла, совершая круговой процесс.


Цикл Карно — цикл, состоящий из четырех последовательных обратимых процессов: изотермического расширения, адиабатного расширения, изотермического сжатия и адиабатного сжатия.

48. Второе начало термодинамики. Энтропия. Энтропия идеального газа.
Величина
 называется энтропией. Энтропия — важная
термодинамическая характеристика
системы, такая же, как, например, внутренняя
энергия.
называется энтропией. Энтропия — важная
термодинамическая характеристика
системы, такая же, как, например, внутренняя
энергия.
Второе начало термодинамики: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
При
изотермическом процессе работа равна
теплу, переданному или отданному
системой A = ΔQ.
По определению
 и, стало быть, энтропия
и, стало быть, энтропия
 .
.
49. Статистическое толкование второго начала термодинамики.
1. Энтропия замкнутой системы не может убывать.
2.
Никакая тепловая машина не может иметь
 по циклу Карно.
по циклу Карно.
3.
Если 2 тела
 привести в тепловой контакт, то теплота
будет переходить от более нагретого к
более холодному.
привести в тепловой контакт, то теплота
будет переходить от более нагретого к
более холодному.
4. Не существует вечного двигателя второго рода.
50. Реальные газы. Отступления законов реальных газов от законов для идеальных газов. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнение Ван-дер-Ваальса.
При рассмотрении реальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия.
Силы,
которые проявляются на расстояниях
 м
и быстро убывают с увеличением расстояния
между молекулами. Такиесилы
называются
короткодействующими.
м
и быстро убывают с увеличением расстояния
между молекулами. Такиесилы
называются
короткодействующими.
Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.

Учет собственного объема молекул и их притяжения - Уравнение Ван-дер-Ваальса:
 где
а-постоянная Ван-Дер-Ваальса; b-объем,
занимаемый самими молекулами.
где
а-постоянная Ван-Дер-Ваальса; b-объем,
занимаемый самими молекулами.
