
ответ 3,
.docx1. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
набери там ковалентная связь Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
про ковалентную в википедии смотри. А структура воды объясняется диполь-дипольным взаимодействием вроде. Старый стал, не помню нифига
2, какую ковалентную связь называют полярной? исходя из значений электроотрицательности атомов соответствующих элементов,определите,какая из связей:HCl,ICl,BrF-наиболее полярна
Ковалентная полярная-связь между двумя разными неметаллами. HCL наиболее полярна. у H электороотрицательность 1,01 ; у Cl Э.О. 2,83 2,83-1,01=1,82. тоже самое и с остальными,и получается,что у HCl наибольшая разность,следовательно,HCl наиболее полярен
3,Какой способ образования ковалентной связи называют донорно-акцепторным? Какие хи-мические связи имеются в ионах NH4+ и BF4-? Укажите донор и акцептор.
Ковалентные полярные и донорно-акцепторные. Доноры: водород и фтор. Акцепторы: азот и бор.
донорно-акцепторный - вид ковалентной связи, при которой атом , имеющий свободную орбиталь( акцептор) принимает спаренные электроны другого атома ( донора)
4. Как метод валентных связей (ВС) объясняет тетраэдрическое строение молекулы CCl4? Имеет ли молекула CCl4 диполь? Почему?
Метод валентных связей объясняет тетраэдрическое строение молекулы CCl4 тем, что атом углерода находится в состоянии sp3-гибридизации. Молекула тетрахлорметана не имеет диполь потому, что атом углерода экранируют атомы хлора в виду тетраэдрического строения молекулы (атом углерода находится в центре тетраэдра)
sp и sp3 гибридизацией, соответственно.
5, Какую ковалентную связь называют s-связью и какую p-связью? Разберите на примере строения молекулы азота
Сигма-связь (σ) - это связь, образованная электронными облаками по линии, соединяющей ядра атомов. Одинарные связи всегда являются ?-связями. Пи-связь (π) - это связь, образованная перекрыванием электронных облаков по обе стороны от линии, соединяющей ядра атомов. Атом азота, обладающий электронной конфигурацией 1s22s22p3, имеет три р-орбитали, расположенные во взаимно перпендикулярных направлениях - по осям х, у и z. Предположим, что два атома азота приближаются друг к другу, двигаясь по оси y. Тогда при достаточном сближении две 2py-орбитали перекрываются, образуя общее электронное облако, которое располагается вдоль оси, соединяющей ядра атомов (рис.). Ковалентная связь, образованная электронным облаком с максимальной плотностью на линии, соединяющей центры атомов, называется ?-связью.
7. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?
Распределение
электронов атома серы по квантовым
ячейкам в нормальном состоянии.
 Из
данного электронного строения атома
видно, что количество неспаренных
электронов равно 2. Соответственно
валентность в таком состоянии равна
2.
Атома
серы имеет два возбужденных состояния.
Из
данного электронного строения атома
видно, что количество неспаренных
электронов равно 2. Соответственно
валентность в таком состоянии равна
2.
Атома
серы имеет два возбужденных состояния.
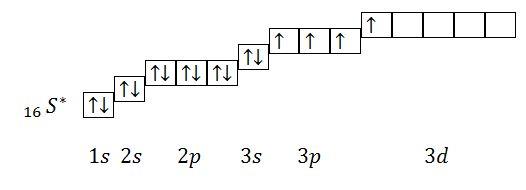 Из
данного электронного строения атома
видно, что количество неспаренных
электронов равно 4. Валентность = 4.
Из
данного электронного строения атома
видно, что количество неспаренных
электронов равно 4. Валентность = 4.
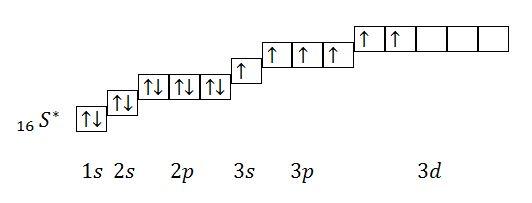 Из
данного электронного строения атома
видно, что количество неспаренных
электронов равно 6. Валентность = 6.
В
молекуле сероводорода угол H-S-H равен
92°. И поэтому в сероводороде отсутствует
гибридизация атомных орбиталей. Значит
связи между водородом и серой образуют
р-орбитали (для которых угол равен 90°).
Из
данного электронного строения атома
видно, что количество неспаренных
электронов равно 6. Валентность = 6.
В
молекуле сероводорода угол H-S-H равен
92°. И поэтому в сероводороде отсутствует
гибридизация атомных орбиталей. Значит
связи между водородом и серой образуют
р-орбитали (для которых угол равен 90°).
|
8. Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S и линейное молекулы СО2. |
|
Решение: Ковалентная, как и донорно-акцепторная химическая связь образуется между атомами, расположенными в пространстве друг относительно друга определенным образом – направленно. Это вызвано необходимостью наибольшего перекрывания волновых функций (атомных орбиталей) электронов, образующих связь, что должно приводить к минимальной энергии системы. По методу ВС атомная орбиталь принимает форму, позволяющую ей более полно перекрываться с орбиталью соседнего атома. Изменить свою форму атомная орбиталь может, лишь комбинируясь с другими атомными орбиталями иной симметрии этого же атома. В результате комбинации различных орбиталей (s, p, d, f и т.д.) возникают новые атомные орбитали промежуточной формы, которые называются гибридными. Получающиеся гибридные орбитали центрального атома имеют определенную направленность в пространстве. Этим и объясняется строение молекул. 16S – 1s22s22p63s23p4 p-элемент s p d
Изменить
свою «форму» атомная орбиталь может
лишь комбинируясь с другими атомными
орбиталями иной симметрии этого же
атома. Гибридизация осуществляется
при возбуждении атома, т.е. требует
затрат энергии.
В возбужденном состоянии: s p
А
результате:
одна
s + одна p- орбиталь → две sp- гибридные
орбитали,
так как центральный атом
С образует две связи с кислородом. Две
sp- гибридные орбитали имеют следующее
направление от ядра атома:
|
10. Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
Водородная связь - вид химической связи, в основе которой лежит взаимодействие атома водорода, соединённого ковалентной связью с электроотрицательным атомом (S, О, N и др.), и неподелённой парой электронов другого атома (обычно О, N). Такая связь может быть межмолекулярной и внутримолекулярной. H2O и HF, имея меньший молекулярный вес, плавятся и кипят при более высоких температурах, благодаря наличию водородных связей. Так например молекулы воды, из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
