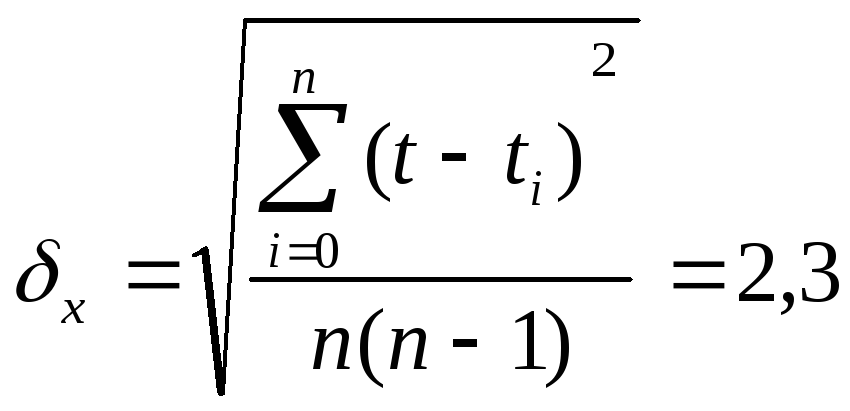1-26 Готово
.docФедеральное агентство по образованию Российской Федерации
Национальный исследовательский
ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Физико-технический институт
Кафедра общей физики
Наименование учебной дисциплины - Физика
Лабораторная работа № 1-26
Определение средней длины свободного
пробега и эффективного диаметра молекул
воздуха
Исполнитель:
Студент, группы 0Б01 (_______) С.Ю. Харченко
подпись
(_______)
дата
Руководитель,__________ (_______)_____________И.О.Фамилия
Должность, ученая степень, звание подпись
(_______)
дата
Томск –2011
Цель работы: проверка применимости модели идеального газа для воздуха при комнатной температуре и атмосферном давлении.
Приборы и принадлежности: сосуд с пробкой, в которую вставлен капилляр, мерный сосуд для сбора вытекающей жидкости; измерительная линейка для определения высоты жидкостей, микроскоп с прозрачной градуировочной линейкой и срез капилляра для определения его радиуса.
Краткое теоретическое обоснование методики измерений
Идеальным газом называют систему материальных точек, потенциальная энергия взаимодействия которых пренебрежимо мала по сравнению с их кинетической энергией. Обмен энергией между частицами в таких случаях происходит только в момент удара. При этом, в большинстве случаев, полагают удар двух частиц абсолютно упругим без перехода части кинетической энергии в потенциальную энергию возбужденной молекулы или атома.
Подобная модель является приближенным и хорошо отвечает наблюдаемым свойством газов при выполнении условия D<< <>, где D – эффективный диаметр частиц газа, а <> - средняя длина свободного пробега частиц между соударениями.
В молекулярно-кинетической теории газов под эффективным диаметром понимают наименьшее расстояние между частицами, на которое они могут сблизиться при соударении. На первой стадии столкновения микрочастиц (молекул или атомов) их кинетическая энергия переходит в потенциальную энергию деформированных электронных оболочек. Затем, на последующей стадии, энергия упругодеформированных электронных оболочек переходит в кинетическую энергию разлетающихся частиц. Очевидно, что чем выше кинетическая энергия частиц, тем на меньшее расстояние они могут сблизиться при ударе. Поэтому величина эффективного диаметра молекул газа не является «константой», а зависит от параметров состояния газа (в первую очередь – от температуры).
Молекулярно-кинетическая теория позволила получить формулы, в которых макроскопические параметры газа (давление, объем, температура), связаны с его микропараметрами (размеры, масса молекулы, ее скорость). Пользуясь этими формулами, можно при помощи легко измеряемых макропараметров – давления, температуры, коэффициента внутреннего трения – получить интересующие нас микропараметры.
В данной работе вычисляется средняя длина свободного пробега по коэффициенту внутреннего трения (вязкости).
Из молекулярно-кинетической теории вытекает формула, связывающая вязкость со средней длиной свободного пробега молекулы.
![]() (1)
(1)
где - коэффициент внутреннего трения (вязкости); - плотность газа; <> - средняя длина свободного пробега; <> - средняя арифметическая скорость теплового движения молекул с учетом максвелловского распределения молекул по скоростям
![]() (2)
(2)
Плотность газа при давлении P, температуре T и молярной массе
![]() .
(3)
.
(3)
Величину
внутреннего трения газа ()
можно определить, используя закон
Пуазейля, согласно которому объем газа,
протекающего по трубке радиусом r,
длиной
![]() за время t выражается
следующим образом:
за время t выражается
следующим образом:
![]() (4)
(4)
Комбинируя (1) и (4) с учетом (2) и (3), получаем рабочую формулу для расчета средней длины пробега молекул
![]()
![]() (5)
(5)
Учитывая, что R = 8,31 Дж/Кмоль, = 0,029 кг/моль, рассчитываем коэффициент пропорциональности в формуле (5)
 (Дж/кгК)1/2.
(Дж/кгК)1/2.
Таким образом, формула (5) примет следующей вид:
![]() (6)
(6)
где r
– радиус капилляра;
![]() -
длина капилляра; P,
T – давление и
температура воздуха, вошедшего в сосуд
за время t;
-
длина капилляра; P,
T – давление и
температура воздуха, вошедшего в сосуд
за время t;
![]() - разность давлений на концах капилляра.
Средняя длина свободного пробега <
- разность давлений на концах капилляра.
Средняя длина свободного пробега <![]() >
и эффективный диаметр молекулы D
связаны между собой соотношением
>
и эффективный диаметр молекулы D
связаны между собой соотношением
![]() (7)
(7)
где n – концентрация молекул газа при давлении (P) и температуре (T)
![]() (8)
(8)
где
![]() = 00С = 273 К;
= 00С = 273 К;![]() = 760 мм. рт. ст.
= 760 мм. рт. ст.
![]() 105 Па;
105 Па;
![]() = 2.71025 м-3 -
число Лотшмидта, т. е концентрация при
нормальных условиях (
= 2.71025 м-3 -
число Лотшмидта, т. е концентрация при
нормальных условиях (![]() ,
,![]() )
)
Эффективный диаметр молекулы воздуха (D) можно вычислить из формулы (7), выражающей его связь с длиной свободного пробега (<>). С учетом соотношения (8) получим
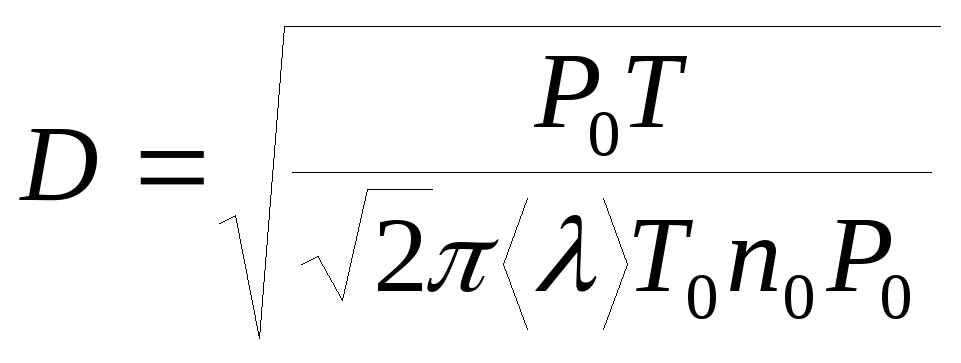 (9)
(9)
Таблица 1
Результаты измерений.
|
№ п/п
|
h1 |
h2 |
∆P |
t |
r |
V |
T |
P |
l |
|
м |
м |
Па |
c |
м |
м3 |
К |
Па |
м |
|
|
1 2 3 |
0,284 0,283 0,282 |
0,253 0,252 0,251 |
2631,3 2621,5 2611,7 |
221 214 219 |
0,14 *10-3 0,14 *10-3 0,14 *10-3 |
50*10-6 50*10-6 50*10-6 |
296 296 296 |
105 105 105 |
0,07 0,07 0,07 |
|
Ср. знач. |
0,283 |
0,252 |
2621,5 |
218 |
|
|
|
|
|
Расчеты для таблицы №1

Погрешность прямых измерений t
Рассчитываем погрешность косвенных измерений для <λ>:
![]()
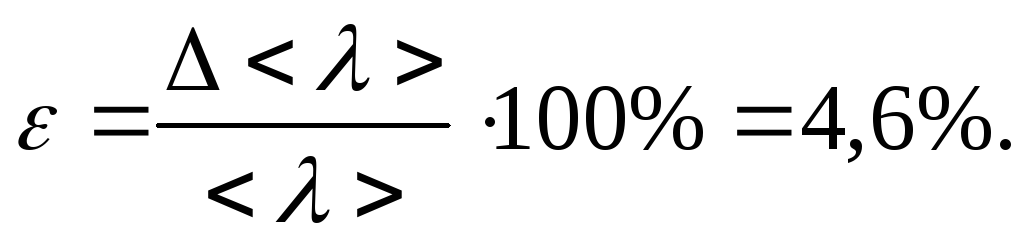
Вывод:
В ходе данной лабораторной работы проверили применимость модели идеального газа для воздуха при комнатной температуре и давлении. Определили среднюю длину свободного пробега <λ>=1,77·10-7м, рассчитали погрешность косвенных измерений для <λ> она составила 4.6% . Эффективный диаметр молекул воздуха получили равным
D = 2.2·10-10м. Так как длина свободного пробега <λ> больше эффективного диаметра, то можно сделать вывод, что взаимодействием молекул между собой можно пренебречь.
![]()