
ЛЕКЦИЯ 5 ВМС
.DOCЛекция 5.
Поликонденсация.
Поликонденсация – это процесс образования высокомолекулярных соединений, при котором рост полимерных цепей сопровождается выделением низкомолекулярных веществ. В отличие от полимеризации, при поликонденсации элементный состав полимеров не совпадает с составом мономерных соединений. Различие определяется составом выделяющегося низкомолекулярного продукта. Мономеры, используемые в реакциях поликонденсации, должны содержать функциональные группы, способные участвовать в обменных реакциях или реакциях замещения. Их можно разделить на три основных типа. К первому типу относятся мономеры, содержащие в молекулах одинаковые функциональные группы, не способные в определённых условиях реагировать между собой, например, диамины или дихлорангидриды карбоновых кислот. Полимер в этом случае образуется в результате поликонденсации разных мономеров, способных взаимодействовать друг с другом:
nH2NRNH2 + nClOCOŔCOCl → [-HNRNHCOŔCO-]n + 2nHCl
Ко второму типу относятся мономеры, содержащие различные функциональные группы, которые способны реагировать друг с другом, приводя к образованию полимера, например гидроксикислоты или аминокислоты:
nHОRCOOH → [-RCOО-]n + nH2O
nH2NRCOOH → [-RCONH-]n + nH2O
К третьему типу относятся мономеры, содержащие одинаковые функциональные группы, способные реагировать между собой в данных условиях, например гликоли, поликонденсация которых приводит к образованию простых полиэфиров:
nHOROH → [-OR-]n + nH2O
По типу и числу участвующих в реакции мономеров различают гомополиконденсацию, в которой участвует минимально возможное число типов мономеров – один или два, и сополиконденсацию.
Би- или полифункциональность исходных мономеров является обязательным условием получения высокомолекулярных продуктов. В линейной поликонденсации участвуют бифункциональные мономеры, приводящие к образованию линейных полимеров. Для проведения сетчатой (трёхмерной) поликонденсации необходимо использование мономеров с тремя или большим числом функциональных групп. В этом случае образуются пространственно сшитые полимеры, например, фенолоформальдегидные смолы:
O H
OH
H
OH


 n
+ 3n CH2O
→ n HOCH2
CH2OH
→
n
+ 3n CH2O
→ n HOCH2
CH2OH
→
CH2OH

 OH
OH
OH
OH
~
 CH2
——CH2——
CH2~
CH2
——CH2——
CH2~
→ ׀ ׀
CH2 CH2

 ׀ ׀
׀ ׀


~CH2 CH2~ ~CH2 CH2~
OH OH
Выделяют также полициклоконденсацию, при которой продукт линейной поликонденсации подвергается внутримолекулярной циклизации, например, в случае взаимодействия дигидразидов с дихлорангидридами дикарбоновых кислот с образованием полиоксадиазолов:
H2NHNOC-R-CONHNH2 + ClOC-R′-COCl —→
- HCl
→ [-HNHNOC-R-CОNHNHOC-R′-CO-]n —→
-H2O



 N-N N-N
N-N N-N



 → [-R-C
C—R′—C C—]n
→ [-R-C
C—R′—C C—]n
O O
Реакции поликонденсации, как и все реакции конденсации, большей частью являются равновесными. Их можно осуществлять в условиях, близких к равновесным (равновесная поликонденсация) или когда равновесие сдвинуто в сторону образования полимера (неравновесная поликонденсация).
Примером равновесной поликонденсации может быть синтез полиамидов из аминокислот или дикарбоновых кислот и диаминов, а образование фенолоформальдегидных смол и полиамидов из дихлорангидридов дикарбоновых кислот и диаминов являются примерами неравновесной поликонденсации. При проведении неравновесной поликонденсации подбирают такие реагенты и такие условия, чтобы реакция протекала далеко от равновесия, т.е. отсутствовали деструкция полимера низкомолекулярными продуктами, обменные реакции и т.п. Этого достигают проведением процесса при таких низких температурах, при которых обменные реакции замедлены, а исходные вещества достаточно реакционноспособны, чтобы в этих условиях образовывать полимер, а также получением полимера такого химического строения, который не способен к гидролизу и иным деструктивным превращениям при взаимодействии с низкомолекулярным продуктом поликонденсации и с исходными веществами.
При равновесной поликонденсации для максимального превращения исходных веществ в полимер из системы необходимо удалять низкомолекулярный продукт реакции. С этой целью поликонденсацию проводят при повышенных температурах (обычно в токе инертного газа) , на заключительной стадии процесс проводят в вакууме. Смещение равновесия путём удаления из сферы реакции низкомолекулярного соединения способствует получению полимера с большей молекулярной массой.
В некоторых случаях при взаимодействии функциональных групп наряду с линейными полимерами образуются побочные циклические продукты. Направление реакции, т.е. возможность протекания циклизации или линейной поликонденсации, определяется в основном условиями проведения реакции и строением исходного бифункционального вещества. При разбавлении системы и повышении температуры поликонденсации выход циклических продуктов, как правило, возрастает. Циклизация является основным направлением реакции в тех случаях, когда могут образовываться ненапряжённые пяти- и шестичленные циклы (например, при циклизации аминомасляной, аминовалериановой, оксимасляной кислот).
Кинетика линейной поликонденсации. Обычно при рассмотрении кинетики поликонденсации принимают, что реакционная способность функциональных групп не зависит от размера молекул и вязкости реакционной среды. Принятие этих экспериментально проверенных допущений позволяет при расчёте скорости процесса пользоваться единой константой скорости реакции и заменять концентрации молекул концентрациями функциональных групп.
Скорость линейной поликонденсации, схематично изображённой следующим образом,
X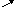 -R-X
+ Y-R-Y → X(-R-)nY
+ X-Y
-R-X
+ Y-R-Y → X(-R-)nY
+ X-Y
X-R-Y + X-R-Y
измеряется скоростью изменения концентрации одной из расходуемых в реакции функциональных групп (CX или CY):
-dCX/dt = -dCY/dt = k′CкатCXCY
где k′ - эффективная константа, имеющая размерность константы скорости реакции третьего порядка, Скат – концентрация катализатора.
Катализаторами поликонденсации служат те же соединения, которые катализируют аналогичные реакции конденсации низкомолекулярных веществ. Например, в качестве катализаторов полиэтерификации используют минеральные кислоты, сульфокислоты, кислые соли и др. Концентрация катализатора остаётся в течение всего процесса постоянной, что позволяет заменить k′Cкат на k - эффективную константу скорости второго порядка.
Принимая, что СX = CY = C, получим:
- dC/dt = kC2
После интегрирования и последующих преобразований это уравнение приобретает вид
ktC0 = q/(1-q)
где q = (C0 – Ct)/C0 – глубина превращения, С0 и Сt – начальная и текущая концентрации функциональных групп.
Данное уравнение справедливо для неравновесных процессов и для начальной стадии равновесных процессов, на которой скоростью обратной реакции можно пренебречь.
Кинетические параметры равновесной и неравновесной реакций сильно различаются. Равновесные реакции характеризуются относительно малыми скоростями реакций (k ≈ 10-3 – 10-5 л/(моль∙с) в обычных условиях) и довольно высокими значениями энергии активации (85 – 170 кДж/моль); они могут быть как экзо-, так и эндотермическими. Для неравновесной поликонденсации характерны в основном высокие скорости реакций (k до 105 л/(моль∙с)) и низкие значения энергии активации (8 – 40 кДж/моль); эти процессы, как правило, сильно экзотермичны.
Средняя степень полимеризации образующегося полимера выражается уравнением Карозерса
Pn = C0/C = 1/(1 - q) = 1 + kC0t
Из уравнения следует, что Pn однозначно определяется глубиной превращения и линейно возрастает с увеличением продолжительности реакции. Согласно графику зависимости средней степени полимеризации от




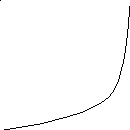 Pn
Pn
10


5



 2
2

0,5 0,8 1,0 q
глубины превращения, приведённому на рисунке, высокомолекулярные продукты могут получаться только при степенях превращения q > 0,95. При меньших конверсиях образуются лишь олигомерные вещества (в отличие от цепной полимеризации, при которой высокомолекулярные продукты могут образовываться уже при самых малых степенях превращения).
Теоретически при линейной поликонденсации степень полимеризации образующегося продукта должна бесконечно увеличиваться с ростом q. Однако, практически достичь степени полимеризации, превышающей 103, очень трудно. Одна из причин этого – трудность соблюдения строгих стехиометрических соотношений реагирующих функциональных групп из-за присутствия примесей и протекания побочных реакций. При отсутствии стехиометрического соотношения функциональных групп, если CX < CY, средняя степень полимеризации определяется по уравнению
_ 1 + r
Pn = ————— ,
1 + r – 2rq
где r = CX/CY < 1 – отношение исходных концентраций функциональных групп.
Для получения продуктов высокой молекулярной массы состав смеси должен быть весьма близок к стехиометрическому, например: для r = 0,91 Pn = 10; для r = 0,99 Pn = 100. Только при r = 0,999 Pn = 1000. Расчёт сделан для q = 1, на практике такое значение q не достигается, и предельное значение Pn ниже.
Причиной понижения Pn может быть, в частности, присутствие монофункциональных веществ, присоединение которых к концу растущей цепи останавливает его дальнейший рост. Монофункциональные соединения могут образовываться в реакционной системе в результате побочных реакций. В некоторых случаях небольшие количества монофункциональных соединений специально вводят в реакционную смесь для регулирования молекулярной массы образующихся полимеров и придания стабильности продукту, у которого в этом случае на концах цепей будут функциональные группы одного типа. Такие добавки называют стабилизаторами молекулярной массы.
Основным фактором ограничения Pn при линейной равновесной поликонденсации является обратимость основной реакции, приводящая к деструкции образовавшихся макромолекул в результате их реакции с низкомолекулярным продуктом реакции, например, водой. Зависимость предельной степени полимеризации от концентрации низкомолекулярного вещества выражается уравнением поликонденсационного равновесия _ ______
Pn = √ Kp/[A] , где Кр – константа конденсационного равновесия; [A] – концентрация низкомолекулярного продукта реакции, находящегося в равновесии с полимером.
Из этого соотношения следует, что для получения высокомолекулярных полимеров необходимо тщательно удалять низкомолекулярный продукт реакции. Например, для получения полиэфиров с Pn = 100 (Кр = 4,9 при 280˚С) допустимое содержание воды не должно превышать тысячных долей процента.
Молекулярно-массовое распределение. Характерным признаком образующегося при линейной поликонденсации полимера является его полидисперсность или широкое молекулярно-массовое распределение. Количественная характеристика полидисперсности выводится на основе статистического анализа поликонденсации и расчёте вероятности существования полимерных молекул, содержащих х структурных единиц. Эта вероятность эквивалентна величине qх-1(1 – q), где q – степень завершённости реакции. Средние степени полимеризации равны
Pn = 1/(1 – q); Pw = (1 + q)/(1 – q); Pw/Pn = 1 + q
Из последнего соотношения видно, что в ходе поликонденсации ширина распределения растёт от 1 при q = 0 до 2, когда теоретически все функциональные группы исчерпаны (q = 1).
Эта закономерность резко отлична от закономерностей роста макромолекул в цепных реакциях. Там молекулярно-массовое распределение задаётся инициирующей или каталитической системой, природой мономера и не зависит от глубины реакции.
Обменные реакции. В ходе равновесной поликонденсации в некоторых системах происходит взаимодействие концевых функциональных групп с функциональными группами внутри полимерной цепи. Такие процессы имеют место и в тех случаях, когда образующиеся новые группы (амидные, сложноэфирные) способны реагировать с функциональными группами исходных веществ. Так, при действии дикарбоновой кислоты на сложноэфирную связь полиэфира происходит реакция ацидолиза:
 ~- OR′- O--OCRCO-~ ↔ ~-OR′OOCRCOOH
~- OR′- O--OCRCO-~ ↔ ~-OR′OOCRCOOH
+ +
HOOCRCO--OH HOOCRCO-~
В результате реакции из одной макромолекулы образуется две, но более короткие. Аналогичная картина наблюдается при алкоголизе и аминолизе.
Макромолекулы могут реагировать друг с другом, образуя амидные или сложноэфирные связи. В случае взаимодействия макромолекул полиамида происходит реакция переамидирования:
 ~-NHR′NH--OCRCO-~
~-NHR′NH
OCRCO-~
~-NHR′NH--OCRCO-~
~-NHR′NH
OCRCO-~
+ ↔ ׀ + ׀
~-OCRCO--NHR′NH-~ ~-OCRCO HNR′NH-~
При взаимодействии макромолекул полиэфира протекает реакция переэтерификации.
В результате обменных реакций общее число связей не изменяется, изменяется только молекулярная масса, а молекулярно-массовое распределение стремится к наиболее статистически вероятному.
