
TITRIMETRIChESKIE_METODY_METODIChKA
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Титриметрические методы в фармацевтическом анализе
Практикум для студентов по специальности
060108 (040500) – Фармация
Воронеж 2005
2
Утверждено научно-методическим советом химического факультета (протокол №7 от 13.01.2005.г.)
Составители: О.Ф.Стоянова, И.В.Шкутина, В.Ф.Селеменев, М.В.Рожкова
Практикум подготовлен на кафедре аналитической химии химического факультета Воронежского государственного университета.
Рекомендуется для студентов 1 и 2 курсов фармацевтического факультета.
3
СОДЕРЖАНИЕ
I. Сущность титриметрического анализа………………………………. 4 II. Кислотно-основное титрование (протолитометрия)……………… 12
Лабораторные работы
1.Приготовление и стандартизация вторичных стандартных растворов 12
2.Определение временной (карбонатной) жесткости воды ………………19
3.Определение содержания органической кислоты в образцах биологического материала …………………………………………………. 20
4.Определение количества соды и щелочи при совместном присутствии 22
5.Определение содержания кислоты борной в препарате ……………….. 23
6.Определение содержания натрия салицилата в препарате ……………..25
7.Определение содержания кислоты никотиновой в препарате ………… 26
III. Титрование в неводных средах ………………………………………28
Лабораторная работа
Определение содержания калия ацетата в препарате …………………..…29
IV. Комплексонометрия ……………………………………………………30
Лабораторные работы
1.Стандартизация раствора трилона Б ……………………………………..33
2.Определение общей жесткости воды …………………………………… 35
3.Определение железа, кальция и магния при совместном присутствии . 36
4.Определение железа, цинка и магния при совместном присутствии …..39
5.Определение алюминия, кальция и магния при совместном присутствии
6.Определение лекарственных препаратов соединений оксида магния и цинка ………………………………………………………………………… 44
V. Окислительно-восстановительное титрование (оксредметрия) … 46
Лабораторные работы
1.Стандартизация раствора перманганата калия ………………………….48
2.Определение содержания железа в растворе ……………………………50
3.Стандартизация раствора тиосульфата натрия по дихромату калия …..52
4.Иодометрическое определение ионов меди ……………………………..54
5.Определение содержания пероксида водорода иодометрическим титрованием ………………………………………………………………..55
6.Определение содержания резорцина в препарате ……………………….57
7.Определение содержания анальгина в препарате ……………………….59
8.Определение содержания стрептоцида в препарате ……………………60
VI. Осадительное титрование …………………………………………… 61
Лабораторная работа
Определение содержания калия бромида в препарате ……………………62
Титриметрические методы анализа в фармации и химикофармацевтической промышленности ……………………………………63
Литература …………………………………………………………………...67
4
I. СУЩНОСТЬ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
Титриметрия - это метод количественного анализа, основанный на точном измерении объема раствора реактива известной концентрации, затраченного на химическую реакцию с определяемым веществом. Раствор реагента с точно известной концентрацией называется
стандартным раствором, или титрантом. Процесс постепенного приливания раствора титранта к раствору анализируемого вещества называют титрованием.
По способу приготовления различают первичные и вторичные стандартные растворы. Первичный стандартный раствор готовят растворением точного количества чистого химического вещества известного стехиометрического состава в определенном объеме раствора. Для приготовления многих стандартных растворов применяют фиксаналы. Фиксаналы - точно отвешенные массы твердых веществ или точно отмеренные объемы их растворов, помещенныe в запаянные стеклянные ампулы. Вторичный стандартный раствор получают следующим образом: готовят раствор с приблизительной концентрацией, близкой к требуемой, и определяют его концентрацию (стандартизируют) по подходящему первичному стандарту. Первичный стандарт должен отвечать ряду требований:
-иметь состав, строго соответствующий химической формуле;
-быть химически чистым. Квалификация чистоты не ниже х.ч. (химически чистое);
-быть химически устойчивым как в твердом виде, так и в растворе;
-обладать по возможности большой молярной массой.
Реакция титрования должна удовлетворять следующим требованиям:
-быть строго стехиометричной;
-протекать быстро;
-протекать количественно;
-должен существовать способ, фиксирующий момент окончания реакции.
При титровании расходуется количество реагента, химически эквивалентное определяемому веществу, то есть точно отвечающее стехиометрии реакции. Конец реакции называют точкой стехиометричности, или точкой эквивалентности (ТЭ).
Экспериментально конец титрования устанавливают по изменению цвета раствора, индикатора или какого-либо физико-химического свойства раствора. Эта точка называется конечной точкой титрования (КТТ).
В титриметрии используются реакции всех типов - с переносом протона, электрона, а также процессы осаждения и комплексообразования.
По способу выполнения различают прямое, обратное титрование и титрование заместителя. При прямом титровании титрант непосредственно добавляют к титруемому веществу.
В случае обратного титрования к определяемому веществу добавляют заведомый избыток титранта, реагирующего с исследуемым
5
веществом в стехиометрическом количестве, проводят реакцию до конца, а затем избыток непрореагировавшего титранта оттитровывают другим стандартным раствором. Этот способ используют, если скорость прямой реакции мала или не удается подобрать подходящий индикатор.
Если реакция нестехиометрична или протекает очень медленно, применяют способ титрования заместителя. К анализируемому раствору добавляют вспомогательный реагент, с которым определяемый компонент реагирует стехиометрически, а получающийся в эквивалентном количестве продукт реакции (заместитель) оттитровывают подходящим титрантом.
Расчеты в титриметрии
Способы выражения концентраций раствора
В аналитической химии применяют самые разнообразные способы выражения концентраций, но чаще имеют дело с количеством вещества в определенном объеме. Молярная концентрация (С) - отношение числа моль растворенного вещества к объему раствора (моль/дм3, или моль/л). Однако для расчетов в титриметрии концентрацию титранта и титруемого вещества можно выражать в моль эквивалентов вещества (СЭ) в одном кубическом дециметре (дм3), или в одном литре (л) раствора.
Эквивалентом называют реальную или условную частицу вещества, равноценную одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Например, в реакции
aА + bВ |
сС + dD, |
которую можно записать в виде |
|
А + b/аВ |
с/аС + d/аD, |
условная частица b/аВ, равноценная одной частице А, называется эквивалентом вещества В в данной реакции. Множитель b/a называют фактором эквивалентности вещества В в данной реакции и обозначают
fэ (B).
Молярная масса эквивалента МЭ равна молярной массе вещества М, умноженной на фактор эквивалентности fэ.
Мэ=Мfэ.
Молярная масса вещества численно равна сумме относительных молярных масс атомов, входящих в его состав. Молярную концентрацию эквивалентов (СЭ) иначе называют нормальной концентрацией и обозначают русской буквой н. Так как эквивалент вещества зависит от типа реакции, то при использовании нормальной концентрации необходимо указывать фактор эквивалентности fэ, иначе возникает неоднозначность. Например, 1н. Na2CO3 может означать, что в 1 л растворено 53 г карбоната натрия (при fэ = 1 / 2) или 106 г (при fэ =1). В тех случаях, когда fэ = 1, предпочтительнее пользоваться обычной молярной концентрацией. В привлечении нормальной концентрации нет особой необходимости. Например, 0,1 н. Na2CO3 (fэ = 1/2) то же, что 0,1 М
6
(1/2 Na2CO3). Если указан эквивалент вещества (обычно в скобках), то молярную концентрацию эквивалентов обозначают также буквой С. Например, С (НСl) = 0,1 М или С (1/2 Н2SO4) = 0,1 М или С (1/5 КMnO4) =
0,1 М.
Между молярной концентрацией (С) и молярной концентрацией эквивалентов (Сэ) существует связь, выражаемая следующей формулой:
С = Сэfэ.
Пример. Укажите фактор эквивалентности щавелевой кислоты в реакции
Н2С2 О4 + 2NaOH = Na2C2O4 + 2H2O.
Определите молярную массу эквивалента щавелевой кислоты. Представьте форму записи концентрации раствора, содержащего 0,20 моль эквивалентов щавелевой кислоты в 0,50 дм3 раствора.
Решение. В данной реакции одна молекула Н2С2О4 равноценна двум ионам водорода, следовательно, fэ(H2C2O4) = 1/2, а молярная масса эквивалента равна 1/2 молярной массы Н2С2О4·2Н2О. Молярная масса щавелевой кислоты равна 126 г/моль. Следовательно, молярная масса эквивалента будет равна 1/2 ее молярной массы, т.е. 63 г/моль. Если в 0,50 дм3 содержится 0,20 моль эквивалентов щавелевой кислоты, то в одном кубическом дециметре будет содержаться 0,40 моль эквивалентов этой кислоты. Таким образом, С (1/2 Н2С2О4 · 2Н2О) = 0,40 моль/дм3,
или 0,40 М.
Другие приемлемые формы записи 0,40 М (1/2 Н2С2О4) или 0,40 н.
Н2С2О4 (fэ = 1/2 ).
Вычисление результатов определений в титриметрическом анализе
Количество определяемого компонента в титриметрии вычисляют, исходя из того, что определяемое вещество и титрант взаимодействуют между собой в строго определенных соотношениях, отвечающих стехиометрическому уравнению используемой реакции:
аS + вХ → продукты реакции,
где а моль титранта S взаимодействует с в моль титруемого вещества Х. Если отношение а/в =1, то число миллимоль титранта (ν S) будет
равно числу миллимоль определяемого вещества (ν X)
ν S = ν Х .
Число миллимоль титранта (νS) вычисляют, зная объем (VS, мл) и молярную концентрацию титранта (СS)
ν S=VSCS .
Для определяемого вещества
ν X=VXCХ .
Массу вещества Х в миллиграммах (mX) вычисляют, умножая число миллимоль на молярную массу определяемого вещества (MX)
mX= VSCSMX .
7
Если отношение а/в ≠ 1, тогда удобнее пользоваться молярной концентрацией эквивалентов (Сэ) и использовать молярную массу эквивалента (Мэ). В точке эквивалентности количество миллимоль эквивалентов титранта (nS) и титруемого вещества nХ, будут равны:
nS= nX .
Эта запись представляет собой математическое выражение закона кратных отношений Дальтона: вещества реагируют между собой эквивалентами. Он служит основой всех количественных расчетов в титриметрии. Так как n = СэV, то для любых реагирующих веществ по закону эквивалентов
n1 = n2, или CЭ,1V1 = CЭ,2V2.
Следовательно, если известны молярная концентрация эквивалентов, объем титранта (Сэ, т, Vт) и объем раствора определяемого вещества (Vх), можно найти неизвестную концентрацию определяемого вещества:
СЭ,ТVТ
Сэ, х = VХ .
Массу вещества (m х, мг) вычисляют по формуле: mХ =CЭ,SVS MЭ,Х .
В титриметрии возможны два варианта проведения титрования: метод пипетирования и метод отдельных навесок.
Метод пипетирования заключается в титровании порций раствора (аликвот Vх), отбираемых пипеткой из мерной колбы определенного объема (Vо), в которой растворена навеска анализируемого вещества, взятая на аналитических весах. Массу определяемого вещества (m) вычисляют по уравнению
|
m, г |
СЭ,Т VТ VО M Э |
10 3 |
( для прямого титрования ), |
|
|
|||
|
|
VХ |
||
|
|
|
||
где Vт |
– среднее арифметическое из результатов параллельных |
|||
титрований; |
|
|
|
|
Мэ |
– молярная масса эквивалента определяемого вещества. |
|||
Коэффициент 10-3 вводят потому, что все объемы выражают в см3, а концентрация титранта Сэ,т выражена в моль эквивалентов / дм3.
Для нахождения массовой доли определяемого вещества необходимо
учесть массу навески mo: |
|
|
,% |
m |
100. |
|
||
|
mo |
|
Метод отдельных навесок состоит в том, что n навесок вещества (mo1, mo2 и т.д.), взятых на аналитических весах (г), растворяют в небольших объемах растворителя и проводят титрование каждого раствора.

8
В этом случае количество вещества в каждой навеске равно Сэ, тVт миллимоль эквивалентов и тогда
,% |
1 |
( |
CЭ,Т V1,Т |
|
CЭ,Т V2,Т |
...)М Э 100 10 3 . |
n |
m01 |
|
m02 |
|||
|
|
|
|
Метод пипетирования более экспрессен и менее трудоемок, но и менее точен, чем метод отдельных навесок.
ОБРАБОТКА РЕЗУЛЬТАТОВ МЕТОДОМ МАТЕМАТИЧЕСКОЙ СТАТИСТИКИ
Реальное число (n<20) результатов эксперимента называют выборочной совокупностью, где n – варианта.
Перед обработкой данных с применением математической статистики выявляют промахи и исключают их из числа полученных результатов выборочной совокупности, для чего используют простой метод с применением Q-критерия. Суть метода заключается в расчете величины Qэксп., равной отношению разности выпадающего и ближайшего к нему результата к размаху варьирования (разности наибольшего и наименьшего из результатов выборочной совокупности) и в сравнении
Qэксп с критическим |
значением |
Qкрит при доверительной |
вероятности |
|||
Р=0,90. Если Qэксп. > Qкрит, выпадающий результат является промахом и его |
||||||
отбрасывают; при Qэксп |
< Qкрит результат не отбрасывают. |
|
||||
|
|
|
|
|
|
Таблица 1. |
Значения Q-критерия (доверительная вероятность Р=0,90). |
||||||
|
|
|
|
|
|
|
n |
|
Qкрит |
|
n |
|
Qкрит |
|
|
|
|
|
|
|
3 |
|
0,94 |
|
7 |
|
0,51 |
4 |
|
0,76 |
|
8 |
|
0,47 |
5 |
|
0,64 |
|
9 |
|
0,44 |
6 |
|
0,56 |
|
10 |
|
0,41 |
|
|
|
|
|
|
|
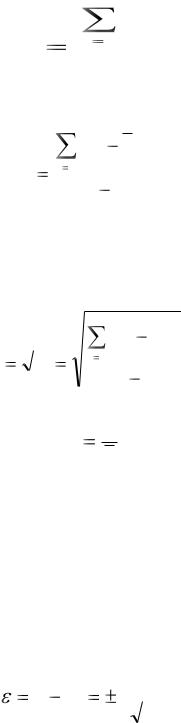
9
При обработке данных рассчитывают следующие основные характеристики выборочной совокупности.
Среднее для выборки из n результатов
n
|
|
хi |
|
|
х |
i 1 |
. |
||
n |
||||
|
|
|||
|
|
|
||
Дисперсию, характеризующую рассеяние результатов относительно среднего
n
(хi х)2
V |
i 1 |
|
. |
|
n |
1 |
|||
|
|
В знаменателе последней формулы стоит число, равное n-1. Оно представляет собой число степеней свободы и в общем случае обозначается как f. f – это число независимых данных (n) в выборочной совокупности минус число связей между ними (f = n-1).
Стандартное отклонение
|
|
|
n |
|
|
|
|
|
|
|
|
(х |
i |
|
х)2 |
||
S |
V |
|
i 1 |
|
|
|
|
. |
|
n |
|
1 |
|
||||
|
|
|
|
|
|
|
||
Относительное стандартное отклонение
S Sr х
Дисперсия, стандартное отклонение и относительное стандартное отклонение характеризуют воспроизводимость (случайные ошибки) результатов химического анализа.
При обработке данных химического анализа обычно определяют также величину доверительного интервала измеряемой величины (ε) для заданной доверительной вероятности (при отсутствии систематических погрешностей в этом интервале с соответствующей вероятностью находится истинное значение хист). Этот интервал рассчитывают, используя выражение
|
|
t p, f |
S |
|||
|
|
|||||
х хi |
|
|
|
|
, |
|
|
|
|
|
|||
|
|
|
||||
|
|
|
n |
|||
где tp,f – коэффициент распределения Стъюдента;
S – стандартное отклонение, рассчитанное для выборочной совокупности из n данных.
Доверительную вероятность Р обычно принимают равной 0,95, хотя в зависимости от характера решаемой задачи она может быть равной 0,90 или 0,99. Если известно истинное значение хист, то доверительный интервал характеризует как воспроизводимость результатов химического

10
анализа, так и их правильность. Если хист неизвестно, то доверительный интервал ε характеризует только воспроизводимость результатов, причем
r х .
Таблица 2.
Значения t для доверительной вероятности Р=0,95.
Число степеней |
t0,95,f |
Число степеней |
t0,95,f |
cвободы, f |
|
свободы, f |
|
|
|
|
|
1 |
12,70 |
6 |
2,45 |
2 |
4,30 |
7 |
2,37 |
3 |
3,18 |
8 |
2,31 |
4 |
2,78 |
9 |
2,26 |
5 |
2,57 |
10 |
2,23 |
|
|
|
|
Пример. Вычисление величин стандартного отклонения и доверительного интервала при стандартизации раствора вторичного
стандарта – соляной кислоты. |
|
|
|
Большинство |
химико-аналитических |
определений |
является |
косвенными, то есть сначала проводят прямые измерения величин у1, у2,…, уn, а затем по формулам, связывающим эти величины с определяемой х=f (у), вычисляют значения х, которые и подвергают статистической обработке.
Так, при определении концентрации раствора соляной кислоты проводят 6-10 раз титрование им стандартного раствора карбоната натрия известной концентрации и для каждого титрования рассчитывают с точностью до четвертого знака концентрацию HCl по формуле
СHCl,М |
С(1/ 2Na2CO3 )V (Na2CO3 ) |
. |
|
V (HCl) |
|||
|
|
Данные заносят в таблицу 3, предварительно оценив их с помощью расчета Qэксп и отбросив результаты, для которых Qэксп > Qкрит (грубые промахи).
