
TITRIMETRIChESKIE_METODY_METODIChKA
.pdf
11
Таблица 3.
Статистическая обработка результатов определения молярной концентрации раствора HCl.
N |
V(HCl),мл |
С(НСl),М |
|
|
|
|
|
|
|
|
|
Расчетные |
|
|
||||||||||||||
|
|
|
|
|
|
хi |
|
|
|
|
|
|
|
|
|
формулы |
|
|
||||||||||
|
|
|
|
|
|
х х |
( хi |
х )2 |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
||
3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(х i |
|
|
х)2 |
|
|
||||
4. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
i 1 |
|
|
|
|
|
|
|
|
, |
|
5. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
1 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
6. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
, |
|
|
|
|
|
|||
9. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V=S |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
Sr |
|
|
|
. |
|
|
||||
|
V = |
|
x = |
|
|
|
Σ( хi |
|
х ) |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
х |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
По формулам, приведенным в таблице 3, рассчитывают величины стандартного отклонения S, относительного стандартного отклонения Sr и дисперсии V. Затем по таблице 2 находят величину t0, 95, f для n вариант и рассчитывают доверительный интервал
t0,95, f |
S |
|||
|
|
|||
|
n |
. |
||
|
|
|
|
|
|
|
|
|
|
Результаты математической обработки данных заносят в таблицу 4.
Таблица 4.
n |
|
|
|
S |
V |
Sr |
Ε |
|
x |
||||||
|
c (HCl) |
|
|
|
|
||
|
|
|
|
|
|
|
|
x
± ε
Конечный результат статистической обработки |
x |
размерность моль/л, причем погрешность допустима только значащей цифре концентрации раствора.
Например, x ± ε = 0,1023 ± 0,0002 М или x ± ε = 0,102 ± 0,003 М.
± ε имеет в последней

12
II. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ (ПРОТОЛИТОМЕТРИЯ)
В основе метода кислотно-основного титрования лежит протолитическая реакция:
SH2+ + S - |
2SH, |
в частности, в водных растворах: |
|
Н3О+ + ОН - |
2Н2О. |
Метод применим для определения концентрации кислот (алкалиметрия), оснований (ацидиметрия), амфолитов, азота и серы в органических соединениях.
Определение конечной точки титрования в методе кислотноосновного титрования основано на резком изменении величины рН вблизи точки эквивалентности. Конечную точку титрования устанавливают с помощью индикаторов, изменяющих свою окраску в зависимости от рН раствора.
Первичными стандартными растворами для определения концентрации кислот служат растворы декагидрата тетрабората натрия (Na2B4O7∙10H2O) и карбоната натрия (Na2CO3); для определения концентрации оснований - щавелевой кислоты (Н2С2О4∙2Н2О) или янтарной кислоты (С2Н4(СООН)2). В качестве вторичных стандартных растворов применяют чаще всего растворы НCl и NaOH.
Лабораторная работа №1
ПРИГОТОВЛЕНИЕ И СТАНДАРТИЗАЦИЯ ВТОРИЧНЫХ СТАНДАРТНЫХ РАСТВОРОВ
Цель работы: приобретение навыков приготовления первичных и вторичных стандартных растворов, применяемых в методе кислотноосновного титрования. Освоение методики титрования растворов.
Задачи работы. Приготовление первичного стандартного 0,1 М (1/2 Na2CO3) раствора карбоната натрия и вторичных стандартных 0,1М растворов хлороводородной кислоты и гидроксида натрия. Стандартизация растворов НСl и NaOH.
Сущность работы.
Данная лабораторная работа состоит из нескольких этапов: приготовление первичного стандартного раствора карбоната натрия по точной навеске; получение из концентрированных растворов соляной кислоты и гидроксида натрия разбавлением приблизительно 0,1М растворов HСl и NaOH с последующей их стандартизацией. Концентрацию и титр кислоты устанавливают по раствору карбоната натрия, концентрацию и титр гидроксида натрия – по 0,1М фиксанальному раствору соляной кислоты.
13
При титровании соды соляной кислотой протекает реакция:
2HСl + Na2CO3 = 2NaCl + CO2↑ + Н2О.
Из этого уравнения следует, что в точке эквивалентности раствор содержит слабую угольную кислоту, и его рН можно рассчитать по формуле:
рН = 1/2 рКа1 - 1/2 lg Cа = 1/2 ∙ 6,4 - 1/2 lg 2,5 ∙ 10-2 = 4,0.
Следовательно, величина рН раствора в точке эквивалентности будет равна 4,0, и для титрования в качестве индикатора можно применять метиловый оранжевый (рТ = 4,0).
Поскольку один моль карбоната натрия в этой реакции эквивалентен двум моль ионов водорода, фактор эквивалентности Na2CO3 равен 1/2. Молярная масса эквивалента карбоната натрия Мэ будет равна половине его молярной массы, т.е. 106 ∙1/2 = 53 (г/моль).
В формулах для расчета рН протолитов нужно использовать только молярные концентрации растворов; поэтому концентрация угольной кислоты в соответствии с формулой С=Сэ∙1/2 будет равна 0,05М, а с учетом разбавления при титровании в 2 раза – 0,025, или 2,5∙10-2 М.
Материалы и оборудование.
1.Карбонат натрия, Na2CO3, х.ч., безводный.
2.Соляная кислота, HCl, плотностью ~1,1г/см3.
3.Гидроксид натрия, NaOH, плотностью ~ 1,1 г/см3.
4.Индикатор метиловый оранжевый, 0,1 %-й водный раствор.
5.Аналитические весы.
6.Часовое стекло.
7.Воронка.
8.Мерная колба емкостью 100,00 см3.
9.Пипетка емкостью 10,00 см3.
10.Бюретка емкостью 25,00 см3 .
11.Мензурка емкостью 250 см3.
12.Мерная пробирка емкостью 10 см3.
1. Приготовление 100 см3 0,1 (1/2 Na2CO3) М раствора
карбоната натрия
Выполнение работы.
Рассчитывают величину навески Na2CO3, необходимую для
приготовления 100 см3 |
0,1 М |
раствора, учитывая, что молярная масса |
эквивалента карбоната |
натрия |
в реакции с соляной кислотой равна |
53 г/моль: |
|
|
m(Na2CO3) = C(1/2Na2CO3) ∙ V(Na2CO3) ∙M(1/2Na2CO3) =
=0,1моль/дм3 ∙ 0,1 дм3 ∙53 г/моль = 0,53 г.
Следовательно, для приготовления 100 см3 0,1М (1/2 Na2CO3) раствора Na2СО3 требуется 0,53 г. На часовом стекле берут навеску карбоната натрия. Отвесить точно вычисленную массу трудно, поэтому на

14
технических весах взвешивают необходимое количество соли, а затем определяют массу навески на аналитических весах с точностью до
0,0002 г.
В чистую мерную колбу на 100 см3 помещают сухую воронку и переносят навеску карбоната натрия, тщательно обмывая часовое стекло и воронку небольшим количеством дистиллированной воды из промывалки. Объем воды в колбе не должен быть больше 2/3. Перемешивают содержимое колбы до полного растворения соли. Доливают в колбу дистиллированную воду до метки. Прибавление воды заканчивают с помощью пипетки, добавляя воду по каплям, держа колбу так, чтобы метка находилась на уровне глаз. Приготовив раствор, тщательно перемешивают его, закрыв колбу пробкой.
Рассчитывают концентрацию и титр приготовленного раствора карбоната натрия по формулам:
С(1/ 2Na2CO3 ), M |
m(Na2CO3 )1000 |
, |
|
M (1/ 2Na2CO3 )V |
|||
|
|
где m (Na2CO3) – навеска карбоната натрия, г; V – объем приготовленного раствора, см3;
М(1/2Na2CO3) – молярная масса эквивалента Na2СO3.
3 |
m(Na2CO3 ) |
|
|
T (1/ 2Na2CO3 ),г / см |
|
. |
|
V |
|||
|
|
2.Приготовление 200 см3 примерно 0,1 М раствора
соляной кислоты
Выполнение работы.
Раствор соляной кислоты заданной концентрации готовят из более концентрированного раствора методом разбавления. Рассчитывают количество безводной кислоты, необходимой для приготовления 200 см3 раствора, содержащего 0,1 моль НСl в 1 дм3. Для дальнейших вычислений измеряют плотность концентрированного раствора кислоты с помощью ареометра. Раствор соляной кислоты наливают в сухой цилиндр и погружают в него ареометр. Отсчет по шкале ареометра проводят по нижнему мениску сверху вниз с точностью 0,001 г/см3. По таблице находят процентную концентрацию кислоты и вычисляют объем раствора, в котором содержится необходимое количество соляной кислоты.
В мензурку объемом 250-300 см3 наливают ~ 150 см3 дистиллированной воды. Цилиндром отмеряют рассчитанный объем исходного раствора НСl, приливают в мензурку с водой и доливают до нужного объема, соответствующего 200 см3. Приготовленный раствор тщательно перемешивают. Раствор соляной кислоты готов для стандартизации.

15
Пример. Рассчитать объем концентрированного раствора соляной кислоты, необходимой для приготовления 200 см3 ~0,1М раствора кислоты.
Вычисляют количество безводной НСl, необходимой для приготовления 200 см3 0,1М раствора. Молярная масса соляной кислоты равна 36,5 г/моль, поэтому в 200 см3 0,1М раствора ее должно содержаться
0,73 г:
m(HCl) = C(HCl)∙V(HCl)∙M(HCl) = 0,1моль/дм3 ∙0,2 дм3 ∙36,5 г/моль =0,73 г.
Предположим, что измеренная плотность концентрированного раствора соляной кислоты 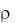 = 1,050 г/см3. По таблице в справочнике находят, что данной плотности соответствует 10%-я концентрация НСl. Рассчитывают массу 10%-го раствора кислоты, содержащей 0,73 г безводной кислоты.
= 1,050 г/см3. По таблице в справочнике находят, что данной плотности соответствует 10%-я концентрация НСl. Рассчитывают массу 10%-го раствора кислоты, содержащей 0,73 г безводной кислоты.
100 г раствора содержит 10 г НСl
m г --------------------- |
|
|
0,73 г НСl, |
|
m, г = |
100 0,73 |
7,3 . |
||
|
10 |
|||
|
|
|||
Определяют объем исходного раствора кислоты, соответствующий |
||||
вычисленной массе : |
|
|
|
|
V, см3 = m / = 7,3 / 1,050 |
= 7,0. |
|
||
Таким образом, для приготовления 200 см3 0,1 М раствора соляной |
||||
кислоты необходимо взять 7,0 см3 |
|
кислоты плотностью 1,050 г/см3 . |
||
3. Стандартизация раствора соляной кислоты
Выполнение работы.
Стандартизацию раствора соляной кислоты проводят с помощью первичного стандарта карбоната натрия, приготовленного по точной навеске. При титровании используют индикатор метиловый оранжевый.
Заполнение бюретки раствором соляной кислоты. Тщательно вымытую бюретку дважды ополаскивают небольшими порциями приготовленного раствора соляной кислоты. Используя воронку, заполняют бюретку кислотой так, чтобы нижний край мениска жидкости был несколько выше нулевого деления. Затем заполняют раствором кислоты носик бюретки, вытеснив из соединительного шланга пузырьки воздуха. Убрав воронку, выпускают кислоту из бюретки таким образом, чтобы нижний край мениска находился на уровне нулевого деления шкалы бюретки.
Чистую пипетку емкостью 10,00 см3 ополаскивают раствором карбоната натрия. В колбу для титрования отбирают пипеткой 10,00 см3 раствора Na2CO3 и прибавляют 1-2 капли индикатора метилового оранжевого. В другой конической колбе готовят раствор “свидетеля”.
16
Отбирают 40 см3 дистиллированной воды, прибавляют 1-2 капли 0,1М раствора кислоты и 1-2 капли метилового оранжевого. Раствор приобретает оранжевую окраску.
На основание штатива кладут лист белой бумаги, ставят под бюретку колбу для титрования и приступают к титрованию. Приливают из бюретки раствор соляной кислоты по каплям, непрерывно перемешивая содержимое колбы. В конечной точке титрования желтая окраска раствора изменяется на розовую (окраска “свидетеля”) от прибавления одной капли раствора соляной кислоты. Делают отсчет объема соляной кислоты, затраченной на титрование, по нижнему краю мениска, при этом глаза должны находиться на уровне мениска. Первое титрование считают ориентировочным. Титрование повторяют несколько раз, пока различие в результатах не будет превышать 0,05 см3. Результаты титрования записывают в таблицу.
Таблица Концентрация раствора Na2CO3 , С(1/2Na2CO3 ), М..................………..
Объем раствора Na2CO3, взятого на титрование,см3 ..............…………
Объем раствора НСl, пошедшей на титрование, см3
1-е титрование....................................................................................……
2-е титрование....................................................................................……
3-е титрование ......................................................................................…
и т.д.
Средний объем раствора НСl, пошедшей на титрование V, см3 ……..
Расчет концентрации соляной кислоты проводят по формуле:
С(НСl), M |
С(1/ 2Na2CO3 )V (Na2CO3 ) |
. |
|||
|
|
|
|||
V (HCl) |
|||||
|
|||||
|
|
||||
Концентрация раствора НСl, моль/дм3 ............................. |
……………. |
||||
4. Приготовление 200 см3 0,1 М раствора гидроксида натрия
Выполнение работы.
Раствор гидроксида натрия заданной концентрации готовят из более концентрированного раствора методом разбавления, аналогично описанному в п.2.
Рассчитывают количество безводного гидроксида натрия, необходимого для приготовления 200 см3 0,1М раствора. Молярная масса гидроксида натрия равна 40 г/моль. Следовательно, в 200 см3 0,1М раствора NaOH его должно содержаться 0,8 г:
m(NaOH) = C (NaOH)∙V(NaOH)∙M(NaOH) = 0,1моль/дм3 ∙0,2 дм3 ∙40г/моль= = 0,8 г.
17
Измеряют плотность концентрированного раствора гидроксида натрия ареометром и находят по таблице соответствующую этой плотности процентную концентрацию NaOH. Зная процентную концентрацию NaOH, рассчитывают объем его раствора, необходимого для приготовления разбавленного раствора заданной концентрации (см. пример в п.2).
В мензурку объемом 250-300 см3 приливают ~150 см3 дистиллированной воды. Отмеряют цилиндром рассчитанный объем гидроксида натрия, переносят его в мензурку с водой и добавляют воду до объема 200 см3. Раствор перемешивают. Точную его концентрацию устанавливают по фиксанальному стандартному раствору соляной кислоты.
5. Приготовление 0,1 М раствора соляной кислоты из фиксанала
Фиксаналы (стандарт-титры) служат для приготовления первичных стандартов. Фиксанал - это запаянная стеклянная ампула с количеством вещества, необходимого для приготовления 1 дм3 раствора с молярной концентрацией эквивалентов, равной 0,1 моль/дм3. Промышленность выпускает фиксаналы с различными веществами как в виде растворов (серная, соляная кислоты; гидроксиды калия и натрия), так и в виде сухих веществ (перманганат калия, карбонат или оксалат калия). В коробочке с фиксаналами имеется стеклянный боек и острая стеклянная палочка. Приготовление раствора из фиксанала заключается в том, чтобы количественно перенести содержимое ампулы в мерную колбу емкостью 1дм3, растворить, довести объем до метки дистиллированной водой и тщательно перемешать.
Выполнение работы.
Ампулу тщательно моют и ополаскивают дистиллированной водой. В чистую мерную колбу емкостью 1,00 дм3 вставляют воронку и в нее вкладывают стеклянный боек так, чтобы острый конец его был обращен вверх. Затем разбивают дно ампулы, ударяя им о боек. Верхнюю часть ампулы пробивают стеклянной палочкой и дают содержимому ее полностью вытечь или высыпаться в колбу. Через образовавшееся отверстие ампулу тщательно промывают дистиллированной водой. Ополаскивают ампулу с внешней стороны и обмывают воронку. Убрав воронку, доводят объем жидкости в колбе дистиллированной водой до метки. Приготовленный раствор тщательно перемешивают.

18
6. Стандартизация раствора гидроксида натрия
Сущность работы.
Для стандартизации раствора гидроксида натрия применяют стандартный 0,1000 М раствор соляной кислоты, приготовленный из
фиксанала. |
При титровании протекает реакция: |
|
НCl |
+ NaOH = NaCl + |
H2O . |
В точке эквивалентности |
величина рН раствора равна 7. Скачок |
|
титрования для 0,1М растворов находится в интервале рН от 4 до 10. Для определения конечной точки титрования выбирают индикатор, интервал перехода окраски которого лежит в эквивалентной области (в пределах скачка титрования). В данном случае титрование можно проводить, используя в качестве индикатора как метиловый оранжевый (рТ = 4 ), так и фенолфталеин (рТ = 9).
Выполнение работы.
Тщательно вымытую бюретку дважды ополаскивают раствором соляной кислоты. Заполняют бюретку раствором кислоты так, чтобы в ней не оставалось пузырьков воздуха. Чистую пипетку ополаскивают раствором гидроксида натрия. В колбу для титрования отбирают пипеткой 10,00 см3 раствора NaOH, прибавляют 1-2 капли метилового оранжевого и титруют раствором соляной кислоты. В конечной точке титрования окраска раствора переходит из желтой в оранжевую. Титрование повторяют несколько раз, при этом различие в результатах не должно превышать 0,050 см3. Результаты титрования записывают в таблицу.
Таблица.
-----------------------------------------------------------------------------------------
Концентрация раствора НСl, М........................................................…….
Объем раствора NaOH, взятого на титрование, см3....................……….
Объем раствора НСl, пошедшей на титрование,см3……………………
1-е титрование .....................................................................................…...
2-е титрование.......................................................................................…..
3-е титрование ............................................................................................
и т.д.
Средний объем раствора НСl, пошедшей на титрование, см3...………
Расчет концентрации NaOH проводят по формуле:
С(NaOH ), M |
С(HCl)V (HCl) |
|
|
|
. |
||
V (NaOH ) |
|||
|
|||
|
|

19
Лабораторная работа №2
ОПРЕДЕЛЕНИЕ ВРЕМЕННОЙ (КАРБОНАТНОЙ) ЖЕСТКОСТИ ВОДЫ
Цель работы: определение карбонатной жесткости воды методом кислотно-основного титрования.
Сущность работы. Жесткость воды обусловлена присутствием в воде растворимых солей кальция и магния. Карбонатная жесткость определяется содержанием в воде гидрокарбонатов этих металл-ионов. При кипячении они разлагаются:
Ca(HCO3 )2 t О CaCO3 + H2O + CO2;
Mg(HCO3)2 t О MgCO3 + H2O + CO2.
При этом жесткость воды устраняется или уменьшается, поэтому карбонатную жесткость называют устранимой или временной. Жесткость воды выражают в ммоль/дм3. Карбонатную жесткость определяют титрованием воды стандартным раствором соляной кислоты. В результате титрования протекают реакции:
Ca(HCO3)2 + 2 HCL = CaCL2 + 2 H2CO3 2 CO2
2 CO2  2 H2O
2 H2O
Mg(HCO3)2 + 2 HCL = MgCL2 +2 H2CO3 2 CO2
2 CO2
2 H2O
В точке эквивалентности образуется слабая угольная кислота, рН раствора близок к 4,00. Поэтому титрование проводят с индикатором метиловым оранжевым (рТ=4).
Материалы и оборудование.
1.Соляная кислота, НСl, 0,1 М стандартный раствор.
2.Анализируемый раствор жесткой воды.
3.Метиловый оранжевый, 0,1%-й водный раствор.
4.Бюретка емкостью 25,00 см3.
5.Пипетка емкостью 50,00 см3.
6.Колба для титрования.
7.Воронка.
Выполнение работы.
В колбу для титрования отбирают пипеткой 50,00 см3 анализируемой воды. Прибавляют 2 капли метилового оранжевого и титруют раствором

20
соляной кислоты до перехода окраски индикатора из желтой в розовую. Титрование проводят со “свидетелем”. Повторяют анализ несколько раз, полученные результаты записывают в таблицу и рассчитывают среднее значение объема соляной кислоты, пошедшей на титрование. Расчет карбонатной жесткости воды проводят по формуле:
Н , ммоль / дм3 |
С(HCl)V (HCl) 1000 |
|
||
|
|
, |
||
V (H |
2O) 2 |
|||
|
||||
|
|
|||
где V(Н2О) - объем воды, взятой для титрования.
Коэффициент 2 в знаменателе приведенной формулы позволяет перейти от размерности ммоль экв/дм3 к нужной – ммоль/дм3. Фактор эквивалентности fэ для гидрокарбонатов кальция и магния при титровании с метиловым оранжевым равен ½.
Лабораторная работа № 3
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОРГАНИЧЕСКОЙ КИСЛОТЫ В ОБРАЗЦАХ БИОЛОГИЧЕСКОГО МАТЕРИАЛА
Цель работы: определение содержания щавелевой кислоты в исследуемом образце методом кислотно-основного титрования.
Сущность работы.
В биологическом материале содержатся различные органические кислоты, в частности, такие как щавелевая и винная. Для определения щавелевой кислоты в качестве титранта используют раствор гидроксида натрия. Взаимодействие щавелевой кислоты с гидроксидом натрия протекает по уравнению:
Н2С2О4 + 2NaOH = Na2C2O4 + 2H2O.
Из этого уравнения следует, что в точке эквивалентности прибавленная щелочь полностью превращается в соль, образованную сильным основанием и слабой кислотой, и рН раствора рассчитывают по формуле:
рН = 7 + 1/2 р Кa2 + 1/2 lgСВ,
где рКa2 = - lgКa2.
Здесь Кa2 – константа диссоциации щавелевой кислоты по второй ступени. Если концентрация щавелевой кислоты С(1/2Н2С2О4 ) равна 0,1 М, то
величина рН в точке эквивалентности будет равна:
рН = 7 + 1/2 (4,27) + 1/2 lg 0,025 = 8,35.
Следовательно, зафиксировать точку эквивалентности можно, применяя индикатор фенолфталеин (рТ = 9,0).
