
Baza_testy_otvety
.doc-
Классы неорганических соединений
Дать название оксиду по международной номенклатуре: N2O
В
оксид азота (I)
Д
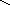 ать
название соли по ее графической
формуле: K-O
ать
название соли по ее графической
формуле: K-OS=O
 H-O
H-OВ
калия гидросульфит
Определить формулу соли натрия тиосульфат (гипосульфит):
А
Na2S2O3
Б
Na2SO4
В
NaHSO4
Г
NaHSO3
Назвать соль, образующуюся при взаимодействии кальция гидрокарбоната и хлороводородной кислоты:
Б
кальция хлорид
Дайте название кислоте: HCN
Г
циановодородная (синильная)
Определить формулу соли – кальция гидрокарбонат:
Б
Ca(HCO3)2
Дайте название кислоте: H2SO3
Г
сернистая
Дать название соли по ее графической формуле: Na-O-С=O
|
Na-O-С=О
А
натрия оксалат
Дать название соли по ее графической формуле: Cl-Cu-Cl
В
меди хлорид
Дайте название кислоте: H2S2O3
А
тиосерная
Определить формулу соли натрия гидросульфат:
В
NaHSO4
Назвать соль, образующуюся при взаимодействии сульфида железа (II) и серной кислоты:
В
железа (II) сульфат
Дайте название кислоте: HSCN
А
родановодородная
Определить формулу соли натрия оксалат:
Б
Na2С 2O4
Дать название оксиду по международной номенклатуре: NO2
Б
оксид азота (IV)
Соли какой кислоты называются ацетаты?
Б
Уксусной
Качественный анализ
При добавлении разбавленного раствора H2SO4 к анализируемому раствору образовался белый мелкокристаллический осадок. Присутствие каких ионов вероятно в растворе?
Б
Ba2+
Аналитические реакции между электролитами записывают
В
слабые электролиты и малодиссоциированные вещества в молекулярном виде
При добавлении к анализируемому раствору раствора нитрата свинца (ΙΙ) образовался черный осадок. Присутствие каких ионов вероятно в растворе?
В
S2-
В качественном анализе используют методы
А
хроматографический
Что называется стандартизацией?
Г
Приготовление раствора определённой концентрации
При добавлении разбавленного раствора HCl к анализируемому раствору образовался белый творожистый осадок. О присутствии каких ионов это свидетельствует?
В
Серебра
При добавлении к анализируемому раствору нитрата серебра образовался желтый осадок. Присутствие каких ионов вероятно в растворе?
А
I-
Для определения хлорид-ионов в растворе используют реактив:
Б
AgNO3
Если реагирующие вещества и продукты их взаимодействия бесцветны, то для установления точки эквивалентности визуальным методом в раствор анализируемого вещества добавляют:
В
индикатор
Алкалиметрия – это метод определения содержания:
В
Кислот в растворе титрованием стандартным раствором основания
Ацидиметрия – это метод определения содержания:
А
Оснований в растворах титрованием стандартным раствором кислоты
Объем рабочего раствора, затраченного на реакцию с анализируемым раствором, определяют с помощью:
Г
бюретки
Чему равны эквивалентные массы KOH и HCl?
Г
56 и 36,5
Чему равны эквивалентные массы H2SO4 и NaOH?
В
49 и 40
Раствор какого вещества используется как титрант (рабочий раствор) в методе алкалиметрии:
А
гидроксида натрия
Раствор какого вещества используется как титрант (рабочий раствор) в методе ацидиметрия:
В
соляной кислоты
Резкое изменение рН на кривой титрования в методе нейтрализации наблюдается вблизи точки эквивалентности. Этот участок называется:
Б
скачок титрования
Укажите метод анализа к которому относится титрование в соответствии с реакцией 2 KOH + H2SO4 = K2SO4 + 2 H2O
В
кислотно-основное титрование
Рабочими растворами в методе нейтрализации являются растворы:
Г
сильных кислот и оснований
Чему равна эквивалентная масса гидроксида калия?
Б
56 г/моль
Укажите метод анализа к которому относится титрование по реакции:
2 Na2S2O3 + I2 = Na2S4O6 + 2 NaI
Г
Окислительно-восстановительное (оксидиметрия)
Укажите метод анализа к которому относится титрование по реакции:
Н+ + ОН ‾ = Н2O
Б
Кислотно-основное титрование
Укажите метод титриметрического анализа, в котором титрантом является серная кислота:
Г
Ацидиметрия
Термодинамика
В экзотермической реакции...
В
энтальпия реакционной системы уменьшается ( ΔН < 0 )
Г
давление реакционной системы повышается
При рассмотрении химической реакции понятие система означает...
Г
исходные реагенты и продукты реакции
Какая из написанных ниже реакций отвечает теплоте образования оксида азота (II) в стандартных условиях (ΔНо298)
Г
2NН3 + 5/2О2 = 2 NO + 3Н2О
Энтальпия системы является мерой её:
В
Теплосодержания
Условно принято, что энтропия идеального кристалла при температуре абсолютного нуля равна:
Г
0
Стандартные термодинамические величины характеризуют состояние системы при следующих значениях температуры и давления:
В
Т=298оК, p=101,3 кПа
Учет и оценку энергетических превращений, сопровождающих физические и химические процессы, изучает наука:
Б
Химическая термодинамика
Определите, какое математическое выражение соответствует первому закону термодинамики.
В
ΔU = Q - A
Определите, какое математическое выражение соответствует второму закону термодинамики.
Б
ΔG = ΔH - TΔS
Процессы, протекающие при постоянной температуре, называются:
Г
Изотермическими
В эндотермической реакции...
А
энтальпия реакционной системы повышается (ΔН > 0 )
Определите, какому закону соответствует следующая формулировка: “Самопроизвольно процессы всегда идут в направлении от менее вероятного к более вероятному состоянию системы”?
Б
Второй закон термодинамики
Символом H обозначается одна из функций состояния термодинамической системы. Укажите название этой функции
Б
Энтальпия
Символом S обозначается одна из функций состояния термодинамической системы. Укажите название этой функции.
В
Энтропия
Символом U обозначается одна из функций состояния термодинамической системы. Укажите название этой функции
Г
Внутренняя энергия
Укажите, каким символом обозначается изобарно-изотермический потенциал, называемый свободной энергией Гиббса?
Г
G
Возможно ли самопроизвольное протекание реакции при условии Δ H > 0, Δ S < 0
В
В прямом направлении реакция самопроизвольно не протекает
Раздел химии, изучающий тепловые эффекты химических процессов – термохимия, базируется на законе, согласно которому тепловые эффекты химических реакций, протекающих при постоянном объёме и давлении, зависят от природы и состояния исходных веществ и конечных продуктов и не зависят от промежуточных реакций. Укажите автора этого закона.
А
Гесс
Кинетика
Основным понятием химической кинетики является скорость химической реакции. Укажите, как в общем виде выражается скорость химической реакции при постоянном объёме системы.
Г
υ = ±ΔC/Δτ
Указать во сколько раз возрастает скорость химической реакции при повышении температуры на 10оС
Б
В 2-4 раза
Укажите кинетическое уравнение в общем виде для реакций первого порядка:
Б
υ = k [A]
Укажите кинетическое уравнение в общем виде для реакций второго порядка:
В
υ = k [A] [B]
Укажите кинетическое уравнение в общем виде для реакций третьего порядка:
Г
υ = k [A]2 [B]
Укажите кинетическое уравнение в общем виде для реакций нулевого порядка:
А
υ = k
Порядок реакции по веществу А в кинетическом уравнении υ = k [A]х [B]у равняется.
Б
х
Порядок реакции по веществу В в кинетическом уравнении υ = k [A]х [B]у равняется.
В
у
Общий порядок реакции в кинетическом уравнении υ = k [A]х [B]у равняется.
Г
х+у
Общий порядок реакции в кинетическом уравнении υ = k [NO]2 [O2] равняется.
Г
3
Порядок реакции по NO в кинетическом уравнении υ = k [NO]2 [O2] равняется.
В
2
Порядок реакции по O2 в кинетическом уравнении υ = k [NO]2 [O2] равняется.
Б
1
Указать кинетическое уравнение реакции, в котором общий порядок реакции и порядок реакции по данному реагенту одинаковы:
Б
υ = k [A]
Промотор (активатор) – это вещество, которое в незначительном количестве
Б
Увеличивает активность катализатора
Единицами измерения скорости химической реакции являются:
Г
моль / (л · сек)
Указать единицы измерения, в которых измеряется константа скорости реакции нулевого порядка:
Г
моль / (л · сек)
Указать единицы измерения, в которых измеряется константа скорости реакции первого порядка:
А
л / (моль·сек)
Указать единицы измерения, в которых измеряется константа скорости реакции второго порядка:
А
л / (моль·сек)
Химическое равновесие
В момент химического равновесия ΔG реакции
Б
ΔG = 0
В каком направлении сместится химическое равновесие в системе:
CO2(г) + С(т) ↔ 2CO(г) ΔH = +171 кДж при повышении температуры?
А
Вправо
В какую сторону сместится химическое равновесие в системе
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(ж)
при повышении давления?
А
Вправо
В каком направлении сместится химическое равновесие в системе:
2CO2(г) ↔ 2CO(г) + O2(г) ΔH = +567,8 кДж при понижении температуры?
Б
Влево
В каком направлении сместится химическое равновесие в системе:
H2 + Cl2 ↔ 2HCl ΔH = -91,8кДж при понижении температуры?
Б
Влево
В какую сторону сместится химическое равновесие в системе
2SO2(г) + O2(г) ↔ 2SO3(г)
при понижении давления?
Б
Влево
В какую сторону сместится химическое равновесие в системе
Fe3O4(т) + 4H2(г) ↔ 3Fe(т) + 4H2O(г)
при повышении давления?
В
Не сместится
В какую сторону сместится химическое равновесие в системе при понижении давления
CH4(г) + 2H2O(г) ↔ CO2(г) + 4H2(г)
А
Вправо
В каком направлении сместится химическое равновесие в системе:
H2 + I2 ↔ 2HI H = -51.8кДж при повышении температуры?
А
Вправо
В системе 2SO2(г) + O2(г) ↔ 2SO3(г) ΔН < 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования SO2.
В
Повышением температуры
В системе СаСО3 (тв) ↔ СаО (тв) + СO2 (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования СаО.
Б
Понижением температуры
В системе СO2 (г) + С (тв) ↔ 2СO (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования СО.
В
Увеличением концентрации СО2
В системе 2 HI (г) ↔ I2 (г) + Н2 (г) ΔН < 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования HI.
Г
Повышением давления
При каком значении Кр обратимые реакции проходят с наиболее полным превращением исходных веществ в продукты
В
Кр > 1
Для обратимой реакции связывания кислорода гемоглобином Kр равна 1300 при 37оС.
Hb + O2 ↔ HbO2. Куда смещено равновесие реакции?
А
Вправо
В системе Fe3O4 + 4 H2 (г) ↔ 3 Fe (тв) + 4 Н2О (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования Fe.
Б
Понижением температуры
В системе 2SO2(г) + O2(г) ↔ 2SO3(г) ΔН < 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования SO3.
В
Понижением давления
В системе NH4Cl (тв) ↔ NH3 ( г) + HCl (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования NH4Cl.
Б
Понижением температуры
В системе NH4Cl (тв) ↔ NH3 ( г) + HCl (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования NH3.
Г
Повышением температуры
Определить окислитель в данной реакции: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Б
Cl2
Чему равна эквивалентная масса KMnO4, если он в процессе восстановления превращается в MnO2?
Б
52,7
На аноде гальванического элемента происходит процесс:
А
Окисления
Для определения хлора в питьевой воде пользуются методом:
А
Перманганатометрии
Укажите вещество, в котором азот может быть только окислителем:
А
HNO3
Указать вещество, в котором азот может быть только восстановителем:
Г
NH3
Сколько электронов принимает атом азота в полуреакции (NO2)- → NO
Б
1
В медицинской практике используют раствор перманганата калия в качестве антисептического средства. Какую степень окисления имеет марганец в перманганате калия.
В
+7
В медицинской практике используют раствор соединения, в котором степень окисления кислорода равна –1. Определите это соединение.
Г
H2O2
Степень окисления марганца в анионе (MnO4)2- составляет:
В
+6
Степень окисления азота в катионе (NH4)+ составляет:
Б
-3
В каком превращении степень окисления серы увеличивается:
В
SO2 → SO3
В каком превращении степень окисления серы уменьшается:
А
S → H2S
В какой химической реакции углерод является окислителем:
В
С + 2 Н2 → СН4
Восстановителями являются атомы или ионы в таких степенях окисления, в которых они способны:
А
Присоединять электроны
Окислителями являются атомы или ионы в таких степенях окисления, в которых они способны:
Б
Отдавать электроны
Электрохимия
В электрохимическом ряду напряжений металлы расположены по возрастанию:
В
Стандартных электродных потенциалов
В качестве стандартного электрода для измерения электродных потенциалов используют электрод:
Б
Водородный
Почему в стоматологической практике не рекомендуется использовать металлы и сплавы с разной электрохимической активностью?
Б
Создаётся гальваническая система и возникает э.д.с.
Гальванический элемент используют для:
Б
Превращения химической энергии в электрическую
В каком направлении движутся электроны во внешней системе гальванического элемента:
Cd|Cd2+||Cu2+|Cu?
А
От кадмиевого электрода к медному
В основе работы цинк-никелевого гальванического элемента лежит реакция:
А
Ni2+ + Zn ↔ Ni + Zn2+
Не производя вычислений указать у какого гальванического элемента значение э.д.с. будет наибольшим?
В
Al| Al3+||Ag+|Ag
Что такое гальванические элементы?
Б
Устройства для превращения химической энергии в электрическую
Редокс – потенциал – это потенциал:
В
окислительно-восстановительный
Стандартные окислительно-восстановительные потенциалы характеризуют возможность системы
Б
функционировать в качестве восстановителя или окислителя
По какому уравнению рассчитывается мембранный потенциал
Б
e = RT/nF lnС1/С2
Чему равняется n в уравнении Нернста для медного электрода
В
2
В результате работы цинк-медного гальванического элемента масса цинкового электрода:
Б
Уменьшается
В результате работы цинк-медного гальванического элемента масса медного электрода:
А
Увеличивается
Укажите условие, при котором окислительно-восстановительная реакция проходит в прямом направлении:
А
eоко > 0
Растворы. Растворимость
Среди перечисленных ниже твердых веществ в воде хорошо растворим
Б
силикат натрия
Чему равен угол между связями в молекуле воды?
А
104о5'
Химическая (сольватная) теория растворов веществ предложена более 100 лет назад
Б
Менделеевым
Растворимость малорастворимых веществ (типа AgCl или BaSO4) характеризуют с помощью специальной константы, которая называется:
Г
Произведением растворимости
В какой из жидкостей растворимость газа будет наибольшей:
Б
в воде
Что является причиной кессонной болезни?
В
Повышение растворимости газа в крови при резком понижении давления
Укажите формулу закона Генри, в соответствии с которым при постоянной температуре растворимость данного газа прямо пропорциональна парциальному давлению газа.
Г
С = kP
Укажите формулу закона Сеченова, в соответствии с которым растворимость данного газа меньше в растворах электролитов по сравнению с растворимостью в чистом растворителе.
Б
С = Соe-КСэ
Чему равна диэлектрическая проницаемость воды при 20 оС:
Б
78,5
Растворимость газов в воде при повышении температуры
А
Уменьшается
Влияние электролитов на растворимость газов описывается законом:
В
Сеченова
Во время пребывания в горной местности у человека могут развиваться симптомы гипоксии. Влияние какого фактора обуславливает появление таких симптомов?
Г
Уменьшение парциального давления кислорода
Растворимость кислорода при одинаковой to и парциальном давлении наибольшая в:
А
Морской воде
Б
0.9% растворе NaCl
В
Дистиллированной воде
Г
Плазме крови
Как будет изменяться растворимость газов с повышением температуры
В
Уменьшается
Растворимость твердых веществ в воде при повышении температуры (в основном)
Г
Сначала уменьшается, а затем увеличивается
В 100 мл воды при стандартных условиях растворяется 1 г вещества. Данное вещество является:
А
растворимым
При комнатной температуре ограничено растворимы:
Б
Вода и фенол
Формулировка «раствор с массовой долей вещества 10%» обозначает:
Б
В 90 г воды растворено 10 г вещества
2
Процесс электролитической диссоциации это:
А
распад электролита на ионы при действии электрического тока
Б
распад электролита на ионы при действии воды
В
распад электролита на ионы при действии неполярных растворителей
Г
распад электролита на молекулы при действии воды
3
Процесс электролитической диссоциации нитрата бария описывается уравнением:
А
Ba(NO3)2 ↔ Ba4+ + 2 NO32-
Б
Ba(NO2)2 ↔ Ba2+ + 2 NO2-
В
Ba(NO3)2 ↔ Ba2+ + 2 NO3¯
4
Молекулы каких веществ при диссоциации по первой ступени образуют катионы с зарядом 2+
А
угольная кислота
Б
гидроксид железа (ΙIΙ)
В
нитрат магния
Г
карбонат натрия
5
Какой фактор увеличивает степень диссоциации слабых электролитов?
А
Охлаждение
Б
Нагревание
В
Увеличение парциального давления
Г
Уменьшение парциального давления
6
С точки зрения теории кислот и оснований Бренстеда-Лоури, кислоты – это вещества, которые:
А
Присоединяют протон H+
Б
Отдают протон H+
В
Имеют свободную пару электронов
Г
В составе молекулы имеют кислород
7
С точки зрения теории кислот и оснований Брендстеда-Лоури, основания – это вещества, которые:
А
Присоединяют протон H+
Б
Отдают протон H+
В
Имеют свободную пару электронов
Г
В составе молекулы имеют кислород
8
Из предложенных электролитов выбрать сильный:
А
HF
Б
CH3COOH
В
HCN
Г
CaCl2
9
Из предложенных веществ выбрать неэлектролит:
А
MgSO4
Б
CO
В
CuCl2 и KCl
Г
HNO3
10
Из предложенных электролитов выбрать сильный:
А
BaSO4
Б
NH4OH
В
NaCl
Г
HF
11
Электролитическая диссоциация – это распад на ионы под действием молекул растворителя (Н2О) веществ, которые имеют тип связи, свойственный соединениям:
А
CH4
Б
O2, HCl
В
CO, H2
Г
NaОН, HCl
12
Количественной характеристикой силы электролита является:
А
Степень гидролиза
Б
Изотонический коэффициент
В
Степень диссоциации
Г
Ионная сила раствора электролита
13
Константа диссоциации слабого электролита – это отношение к равновесной молярной концентрации молекул электролита, которые не распались на ионы…
А
Суммы равновесных молярных концентраций ионов электролита
Б
Разницы равновесных молярных концентраций ионов электролита
В
Суммы равновесных моляльностей ионов электролита
Г
Произведения равновесных молярных концентраций ионов электролита
14
По силе электролитической диссоциации чистая (дистиллированная) вода относится к:
А
Сильным электролитам
Б
Слабым электролитам
В
Неэлектролитам
Г
Электролитам средней силы
15
Количественной характеристикой межионных электростатических взаимодействий в растворе электролита является:
А
Степень гидролиза
Б
Изотонический коэффициент
В
Константа гидролиза
Г
Ионная сила раствора электролита
16
Процесс электролитической диссоциации сульфата натрия описывается уравнением:
А
Na2SO3 ↔ 2Na+ + SO32-
Б
Na2SO4 ↔ Na+ + SO42-
В
Na2SO4 ↔ 2Na+ + SO42-
17
С точки зрения теории кислот и оснований Аррениуса, основания – это вещества, которые:
А
Отдают ОН-
Б
Отдают протон H+
В
Имеют свободную пару электронов
Г
В составе молекулы имеют кислород
18
С точки зрения теории кислот и оснований Аррениуса, кислоты – это вещества, которые:
А
Присоединяют протон H+
Б
Отдают протон H+
В
Имеют свободную пару электронов
Г
В составе молекулы имеют кислород
19
Гидроксид аммония относится к:
А
Сильным электролитам
Б
Слабым электролитам
В
Неэлектролитам
20
Укажите, какая из приведенных кислот является слабым электролитом?
A
HBr
Б
HI
В
HF
Г
HCl
21
Кислые соли являются сильными электролитами:
A
Только по первой ступени
Б
Только по последней ступени
В
Не являются электролитами
Г
По всем ступеням
22
Укажите заряд аниона, который образуется при диссоциации Al(NO3)3:
A
- 1
Б
- 2
В
- 3
Г
- 4
23
Указать заряд аниона, который образуется при диссоциации сульфида натрия:
A
- 1
Б
- 2
В
- 3
Г
- 4
24
Вода плохо проводит электрический ток. Добавление какого вещества к воде увеличивает ее электропроводность:
A
Метанол
Б
Фруктоза
В
Хлорид калия
Г
Мочевина
25
Какие ионы не могут одновременно находиться в растворе:
A
NH4+ и NO3‾
Б
Ba2+ и Cl‾
В
Na+ и CO32‾
Г
Zn2+ и CO32‾
26
Какие ионы не могут одновременно находиться в растворе:
A
NH4+ и Cl‾
Б
Ba2+ и NO3‾
В
Mg2+ и РO43‾
Г
Al 3+ и Br‾
Коллигативные свойства
1
Осмос – это:
А
Односторонняя самопроизвольная диффузия молекул растворяемого вещества из раствора с низкой концентрацией в раствор с высокой концентрацией.
Б
Односторонняя самопроизвольная диффузия молекул растворителя из раствора с высокой концентрацией в раствор с низкой концентрацией.
В
Односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану в раствор.
Г
Давление, которое необходимо приложить к раствору, чтобы прекратить диффузию через полупроницаемую мембрану.
2
Одинаковое ли осмотическое давление будут иметь растворы сахарозы, хлорида калия, сульфата натрия одинаковой молярной концентрации при одинаковой температуре?
А
Одинаковое
Б
Различное
В
Зависит от атмосферного давления
Г
Одинаковое при любой температуре
3
Для уничтожения бактерий, вызывающих ботулизм, в качестве консерванта используется раствор с высоким содержанием сахара. С чем это связано?
А
С нарушением подвижности бактерий.
Б
С явлением плазмолиза.
В
С явлением гемолиза.
Г
С явлением изоосмоса.
4
Какие электролиты будут иметь одинаковое осмотическое давление при одинаковой температуре и молярной концентрации.
А
Na2SO4 и NaCl
Б
NaCl и KCl
В
CaCl2 и KCl
Г
NaCl и BaCl2
5
Какое из следующих свойств относится к коллигативным?
А
Температура кипения растворителя
Б
Электролитическая диссоциация
В
Температура кипения раствора по сравнению с чистым растворителем
Г
Растворимость веществ
6
Плазмолиз живой клетки происходит, если поместить её в:
А
0,9 % раствор NaCl
Б
10 % раствор NaCl
В
Дистиллированную воду
Г
1 % раствор NaCl
7
Одинаковое ли осмотическое давление будут иметь растворы натрия хлорида, кальция хлорида, фруктозы при одной и той же температуре и одинаковой молярной концентрации?
А
Одинаковое
Б
Различное
В
Зависит от атмосферного давления
Г
Одинаковое при любой температуре
8
Для какого из растворов NaCl осмотическое давление будет наибольшим:
А
С(NaCl) = 0,1 моль/л
Б
С(NaCl) = 0,0001 моль/л
В
С(NaCl) = 0,01 моль/л
Г
С(NaCl) = 0,001 моль/л
9
Для какого из растворов изотонический коэффициент будет наибольшим:
А
С(NaCl) = 0,1 моль/л
Б
С(NaCl) = 0,0001 моль/л
В
С(NaCl) = 0,01 моль/л
Г
С(NaCl) = 0,001 моль/л
10
Для какого из электролитов изотонический коэффициент будет наибольшим:
А
С(NaCl) = 0,01 моль/л
Б
С(K2SO4) = 0,01 моль/л
В
С(KCl) = 0,01 моль/л
Г
С (MgSO4) = 0,01 моль/л
11
Для какого из водных растворов температура замерзания будет наименьшей:
А
Сm (NaCl) = 0,01 моль/кг
Б
Сm (K2SO4) = 0,01 моль/кг
В
Сm (KCl) = 0,01 моль/кг
Г
Сm (MgSO4) = 0,01 моль/кг
12
Для какого из водных растворов температура замерзания будет наибольшей:
А
Сm (СaCl2 ) = 0,1 моль/кг
Б
Сm (LiNO3) = 0,1 моль/кг
В
Сm (глюкозы) = 0,1 моль/кг
Г
Сm (K2SO4) = 0,1 моль/кг
13
Для какого из водных растворов температура замерзания будет наименьшей:
А
Сm (глюкозы ) = 0,1 моль/кг
Б
Сm (LiNO3) = 0,1 моль/кг
В
Сm (сахарозы) = 0,1 моль/кг
Г
Сm (фруктозы) = 0,1 моль/кг
14
Для какого из водных растворов температура кипения будет наибольшей:
А
Сm (FeCl3) = 0,01 моль/кг
Б
Сm (KCl) = 0,01 моль/кг
В
Сm (K2SO4) = 0,01 моль/кг
Г
Сm (NaCl) = 0,01 моль/кг
15
Для какого из водных растворов температура кипения будет наибольшей:
А
Сm (NaNO3) = 0,01 моль/кг
Б
Сm (NaClO4) = 0,01 моль/кг
В
Сm (Na2SO4) = 0,01 моль/кг
Г
Сm (AlCl3) = 0,01 моль/кг
16
Какое осмотическое давление должны иметь растворы, которые используются в медицинской практике как изотонические растворы или кровезаменители:
А
500-600 кПа
Б
740-800 кПа
В
800-900 кПа
Г
400-500 кПа
16
Какой из растворов хлорида натрия будет гипотоническим по отношению к крови:
А
ω (NaCl) = 0,009
Б
ω (NaCl) = 0,9
В
ω (NaCl) = 0,00009
Г
ω (NaCl) = 0,09
17
Какой из растворов хлорида натрия будет гипертоническим по отношению к крови:
А
ω (NaCl) = 0,009
Б
ω (NaCl) = 0,0009
В
ω (NaCl) = 0,00009
Г
ω (NaCl) = 0,09
18
Какой из растворов при to 37oC имеет меньшее осмотическое давление:
А
С (СaCl2 ) = 0,1 моль/л
Б
С (LiNO3) = 0,1 моль/л
В
С (глюкозы) = 0,1 моль/л
Г
С (K2SO4) = 0,1 моль/л
19
Чему будет равняться изотонический коэффициент Вант-Гоффа для хлорида кальция, если это вещество полностью продиссоциировало в водном растворе:
А
i = 1
Б
i = 2
В
i = 3
Г
i = 4
20
Чему будет равняться изотонический коэффициент Вант-Гоффа для хлорида натрия, если это вещество полностью продиссоциировало в водном растворе:
А
i = 1
Б
i = 2
В
i = 3
Г
i = 4
21
Осмотическое давление раствора можно рассчитать пользуясь:
А
Законом Вант-Гоффа
Б
1-м законом Рауля
В
2-м законом Рауля
Г
Законом Генри
22
Изменение температуры кипения раствора можно рассчитать пользуясь:
А
Законом Вант-Гоффа
Б
1-м законом Рауля
В
2-м законом Рауля
Г
Законом Генри
23
Изменение давления пара над раствором можно рассчитать пользуясь:
А
Законом Вант-Гоффа
Б
1-м законом Рауля
В
2-м законом Рауля
Г
Законом Генри
24
Чему будет равняться изотонический коэффициент Вант-Гоффа для сульфида калия, если это вещество полностью продиссоциировало в водном растворе:
А
i = 1
Б
i = 2
В
i = 3
Г
i = 4
рН
1
Константа диссоциации воды (моль/л) при температуре 25оС равна:
А
1,810-18
Б
1,810-14
В
1,810-16
Г
1,810-5
2
Ионному произведению воды соответствует:
А
Кводы = [H+] [OH-]
Б
Кводы = [H+] - [OH-]
В
Кводы = [H+] / [OH-]
Г
Кводы = [H+] + [OH-]
3
Какая среда раствора при рН = 7,36
А
сильнощелочная
Б
нейтральная
В
слабокислая
Г
слабощелочная
4
В каком пределе лежит значение [H+] в кислой среде?
А
[H+] > 10-7
Б
[H+] < 10-7
В
[H+] = 10-7
5
Водородный показатель 0.001 М раствора соляной кислоты равен (=1):
А
0
Б
3
В
1
Г
2
6
Какая среда раствора при рН = 1?
А
сильнокислая
Б
нейтральная
В
слабокислая
Г
слабощелочная
7
В каком пределе лежит значение [ H+] в нейтральной среде?
А
[ H+] > 10-7
Б
[ H+] = 10-7
В
[ H+] < 10-7
8
В каком пределе лежит значение [ H+] в щелочной среде?
А
[ H+] > 10-7
Б
[ H+] = 10-7
В
[ H+] < 10-7
9
Смещение кислотно-щелочного равновесия крови в сторону снижения pH называют:
А
Алкалозом
Б
Ацидозом
В
Гомеостазом
Г
Равновесием
10
Смещение кислотно-щелочного равновесия крови в сторону повышения pH называют:
А
Алкалозом
Б
Ацидозом
В
Гомеостазом
Г
Равновесием
11
Водородный показатель плазмы крови в норме может колебаться в пределах:
А
0.9 - 1.5
Б
6.8 - 7.0
В
8.5 - 9.5
Г
7.36 - 7.4
12
Водородный показатель желудочного сока в норме может колебаться в пределах:
А
0.9 - 1.5
Б
6.8 - 7.0
В
8.5 - 9.5
Г
7.36 - 7.4
13
Чему равно значение pH раствора соляной кислоты С = 0.01 моль/л, α = 1?
А
7
Б
1
В
2
Г
3
14
Чему равно значение pH раствора гидроксида натрия С = 0. 1 моль/л, α = 1?
А
13
Б
7
В
12
Г
1
15
Водородный показатель рассчитывается по формуле:
А
pK = - lg Ka
Б
pH = - lg [H+]
В
pH = - lg [OH-]
Г
pOH = - lg [H+]
16
Гидроксильный показатель рассчитывается по формуле:
А
pK = - lg Ka
Б
pH = - lg [H+]
В
pOH = - lg [H+]
Г
pOH = - lg [OH-]
17
Молярная концентрация ионов [H+] желудочного сока равняется 10-2 моль/л. Чему равняется рОН.
А
10
Б
11
В
12
Г
13
18
Чему равно значение рН при значении [ H+] = 10-9?
А
9
Б
10
В
8
Г
6
19
Для коррекции кислотно-щелочного равновесия при ацидозе рекомендован раствор:
А
NaHCO3
Б
HCl
В
NaCl
Г
NaOH
20
Физиологическое значение рН мочи:
А
1 - 3
Б
3 - 6
В
5 - 8
Г
6 - 9
21
Молярная концентрация гидроксид ионов желудочного сока равняется 10-12 моль/л. Чему равняется рН:
А
12
Б
10
В
2
Г
4
22
На значение рН в растворе оказывают влияние ионы:
А
Na+
Б
Cl‾
В
OH‾
Г
K+
23
Молярная концентрация ионов водорода артериальной крови равняется 4,0·10-8 моль/л. Чему равняется рН:
А
7,4
Б
7,0
В
7,2
Г
8,4
24
Молярная концентрация ионов водорода венозной крови равняется 2,3·10-7 моль/л. Чему равняется рН:
А
6,6
Б
5,6
В
7,3
Г
7,2
25
рН слюны человека равняется 6. Чему равна молярная концентрация ионов [H+] :
А
110-6
Б
110-7
В
1106
Г
6106
26
рН секрета поджелудочной железы человека равняется 8. Чему равна молярная концентрация ионов [H+] :
А
810-8
Б
110-8
В
1108
Г
1107
27
Ацидоз – это отклонение рН крови до:
А
8,3
Б
8,0
В
7,5
Г
7,1
28
Алкалоз – это отклонение рН крови до:
А
6,5
Б
6,8
В
7,7
Г
7,1
Гидролиз солей
1
Какая из следующих солей подвергается гидролизу:
А
NaI
Б
KNO3
В
ZnSO4
Г
BaCl2
2
По какому из ионов протекает гидролиз CH3COOK?
А
по аниону
Б
по катиону
В
по катиону и аниону
Г
нет гидролиза
3
Какова реакция среды в растворе CH3COOK?
А
щелочная
Б
нейтральная
В
кислая
4
Какая из солей гидролизуется в большей степени?
Kа(HCN) = 710-10; Kа(H2SO3) = 610-8; Kа(HF) = 110-4
А
NaCN
Б
Na2SO3
В
NaF
5
Какая из следующих солей подвергается гидролизу:
А
CrCl3
Б
NaNO3
В
KClO4
Г
Ba(NO3)2
6
По какому из ионов протекает гидролиз соли CrCl3
А
по аниону
Б
по катиону
В
по катиону и аниону
Г
нет гидролиза
7
Какова реакция среды в растворе соли NaBr?
А
щелочная
Б
нейтральная
В
кислая
8
Какая из солей гидролизуется в большей степени?
Kа(H2S) = 510-8; Kа(H3AsO3) = 610-10; Kа(Н3PO4) = 110-2
А
K2S
Б
Na3AsO3
В
K3PO4
9
Какая из приведённых солей подвергается гидролизу и обуславливает кислую реакцию среды:
А
NaCl
Б
CH3COONH4
В
KCN
Г
NH4Cl
10
Какая из следующих солей подвергается гидролизу:
А
NaBr
Б
K2C2O4
В
KNO3
Г
Na2SO4
11
По какому из ионов протекает гидролиз (NH4)2SO4?
А
по аниону
Б
по катиону
В
по катиону и аниону
12
Какая из солей гидролизуется в меньшей степени?
Kа(H2SO3) = 210-2; Kb(NH4OH) = 510-8; Ka(H3AsO3) = 610-10
А
Na2SO3
Б
NH4I
В
K3AsO3
13
С целью предотвращения гидролиза, лекарственные препараты хранят:
А
В виде разбавленных растворов, при высокой температуре
Б
В виде разбавленных растворов, при низкой температуре
В
В виде концентрированных растворов, при высокой температуре
Г
В виде концентрированных растворов, при низкой температуре
14
Константа гидролиза Кг соли слабой кислоты и сильного основания – это отношение ионного произведения воды (КН2О) к:
А
Сумме молярных концентраций ионов
Б
Константе диссоциации сильного основания
В
Произведению молярных концентраций ионов
Г
Константе диссоциации слабой кислоты
15
Константа гидролиза Кг соли сильной кислоты и слабого основания – это отношение ионного произведения воды (КН2О) к:
А
Константе диссоциации сильной кислоты
Б
Сумме молярных концентраций ионов
В
Константе диссоциации слабого основания
Г
Произведению молярных концентраций ионов
16
Гидролиз соли – это реакция взаимодействия соли с водой, в результате которой:
А
Образуется сильный электролит и, как правило, не изменяется кислотность среды
Б
Образуется газ или осадок и, как правило, не изменяется кислотность среды
В
Образуется слабый электролит и, как правило, изменяется кислотность среды
Г
Кислотность среды изменяется, образуются сильные электролиты
17
Степень гидролиза (h) – это отношение к общему количеству вещества растворенной соли:
А
Молярной концентрации соли
Б
Количества вещества соли, которое продиссоциировало
В
Количества вещества соли, которое гидролизуется
Г
Массовой доли соли
18
Указать, какое действие вызовет смещение гидролиза ацетата натрия влево:
А
Повышение температуры
Б
Повышение давления
В
Добавление уксусной кислоты
Г
Добавление воды
19
Для уменьшения гидролиза соли, образованной слабым основанием и слабой кислотой необходимо:
А
Повышение температуры
Б
Добавление соли
В
Добавление слабой кислоты
Г
Добавление воды
20
Указать водный раствор электролита, который имеет наименьшее значение рН:
А
NaCl
Б
KCl
В
NH4Cl
Г
Ba(OH)2
21
Гидролиз солей относится к реакциям:
А
Соединения
Б
Замещения
В
Окисления
Г
Обмена
22
Указать водный раствор электролита, который имеет наибольшее значение рН:
А
Ba(NO2)2
Б
NH4Cl
В
CH3COONH4
Г
KCl
23
Определить реакцию среды при гидролизе соли, образованной слабым основанием и слабой кислотой, если Кд кислоты > Кд основания
А
Кислая
Б
Щелочная
В
Нейтральная
24
Определить реакцию среды при гидролизе соли, образованной слабым основанием и слабой кислотой, если Кд кислоты < Кд основания
А
Кислая
Б
Щелочная
В
Нейтральная
25
Определить реакцию среды при гидролизе соли, образованной слабым основанием и слабой кислотой, если Кд кислоты = Кд основания
А
Кислая
Б
Щелочная
В
Нейтральная
26
Какое значение рН имеет раствор при гидролизе соли, образованной слабой кислотой и сильным основанием:
А
рН < 7
Б
рН > 7
В
рН = 7
27
Какое значение рН имеет раствор при гидролизе соли, образованной сильной кислотой и слабым основанием:
А
рН < 7
Б
рН > 7
В
рН = 7
Буферные растворы
1
Из предлагаемых веществ выбрать возможные компоненты для приготовления буферных растворов:
А
NaHCO3 и CO2·H2O; HCl и NaCl
Б
H2SO4 и NaOH; NaHCO3 и H2O
В
HNO3 и KOH; CH3COOH и NH4Cl
Г
NaHCO3 и CO2·H2O; CH3COOH и CH3COONa
2
Используя величины рКд слабых электролитов, выбрать оптимальный буферный раствор для проведения исследований при рН равном 7,4
А
рК (СН3СООН) = 4,76
Б
рК (Н2РО4- ) = 7,20
В
рК (СО2·Н2О) = 6,35
Г
рК (NH3·Н2О) = 4,74
3
Компонентами кислотного буферного раствора являются:
А
Слабая кислота и соль сильной кислоты и сильного основания
Б
Слабая кислота и соль этой кислоты и слабого основания
В
Слабая кислота и соль сильной кислоты и слабого основания
Г
Слабая кислота и соль этой кислоты и сильного основания
4
Компонентами основного буферного раствора являются:
А
Сильное основание и соль этого основания и слабой кислоты
Б
Сильное основание и соль этого основания и сильной кислоты
В
Слабое основание и соль этого основания и слабой кислоты
Г
Слабое основание и соль этого основания и сильной кислоты
5
рН кислотного буферного раствора можно рассчитать по формуле
А
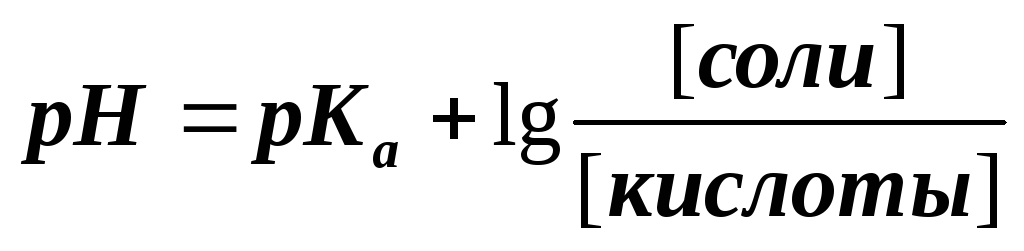
Б
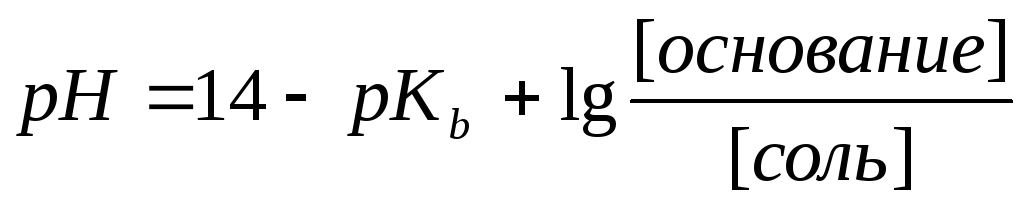
В
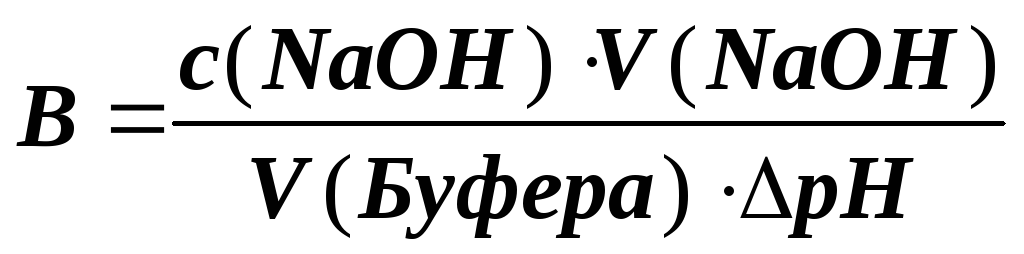
Г
pH = -lg[H+]
6
рН основного буферного раствора можно рассчитать по формуле
А

Б

В
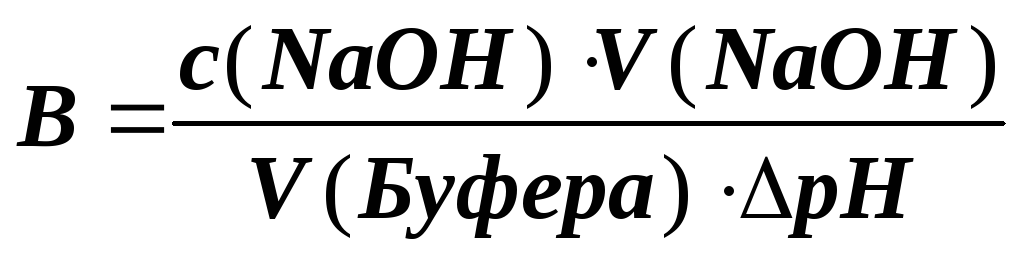
Г
pОH = -lg[ОН-]
7
Основными величинами, которые влияют на величину рН буферного раствора являются:
А
Ионное произведение воды
Б
Произведение молярных концентраций компонентов буферного раствора
В
рК слабого электролита
Г
Концентрация буферного раствора
8
Из приведенных пар веществ выбрать компоненты ацетатного буферного раствора
А
CH3COONH4, CH3COOH
Б
(CH3COO)2Mg, CH3COOH
В
CH3COONa, CH3COOH
Г
(CH3COO)2Zn, CH3COOH
9
Из приведенных пар веществ выбрать компоненты гидрокарбонатного буферного раствора
А
Na2CO3, NaHCO3
Б
Na2CO3, NaOH
В
Na2CO3, H2CO3
Г
CO2·H2O, NaHCO3
10
Буферные растворы – это растворы, которые способны
А
Поддерживать значение рН при неограниченном разведении
Б
Поддерживать значение рН при добавлении небольших количеств сильных кислот или щелочей
В
Поддерживать значение рН при добавлении растворов солей
Г
Поддерживать значение рН при добавлении любых количеств сильных кислот или щелочей
11
Буферная емкость измеряется:
А
Количеством кислоты, добавление которой к буферному раствору не изменяет его рН
Б
Количеством кислоты или основания, добавление которых к 1 л буферного раствора изменяет его рН на единицу
В
Количеством основания, добавление которого к 1 л буферного раствора изменяет его рН на две единицы
Г
Количеством кислоты или основания, добавление которых к буферному раствору не изменяет его рН
12
Единицы измерения буферной емкости:
А
Моль/л
Б
%
В
г/л
Г
Моль/кг
13
Максимальное значение буферной емкости наблюдается при:
А
рН = рК
Б
рН < рК
В
рН > рК
Г
рН = рК + 1
14
В состав буферных систем крови не входит:
А
аммиачный
Б
гидрокарбонатный
В
гемоглобиновый
Г
фосфатный
