
- •Декарбоксилирование аминокислот.
- •Азотистый обмен
- •Факторы определяющие состояние белкового обмена.
- •Различают 3 вида азотистого баланса:
- •Биологическая ценность белков.
- •Переваривание и всасивание
- •Обмен дикарбоновых аминокислот.
- •Виды нуклеиновых кислот
- •Структура нуклеопротеидов.
- •Виды мутаций:
- •Обмен нуклеотидов.
- •Механизм транскрипции днк
Общие пути обмена аминокислот.
Пути распада аминокислот до конечных продуктов можно разделить на 3 группы:
-
Пути распада, связанные с превращением NH2-групп.
-
Декарбоксилирование
 -СООН
групп.
-СООН
групп. -
Превращения углеродного скелета аминокислот.
Превращение
![]() -аминогрупп
аминокислот.
-аминогрупп
аминокислот.
В тканях организма происходит отщепление аминогрупп с образованием аммиака. Этот процесс называется дезаминированием. Возможны 4 типа дезаминирования:
-
Восстановительное
R-CH-COOH
![]() R-CH2-COOH
+ NH3
R-CH2-COOH
+ NH3
|
NH2
-
Гидролитическое
R-CH-COOH
![]() R-CH-COOH
+ NH3
R-CH-COOH
+ NH3
| |
NH2 OH
-
Внутримолекулярное
R-CH2-CH-COOH
![]() R-CH=CH-COOH
+ NH3
R-CH=CH-COOH
+ NH3
|
NH2
-
Окислительное
R-CH-COOH
![]() R-C-COOH
+ NH3
R-C-COOH
+ NH3
| ||
NH2 O
Окислительное дезаминирование бывает 2 видов: прямое и непрямое (трансдезаминирование).
Прямое окислительное дезаминирование осуществляется оксидазами. В качестве кофермента содержат ФМН или ФАД. Продуктами
реакции являются кетокислоты и аммиак.
Трансдезаминирование – основной путь дезаминирования аминокислот. Трансдезаминирование проходит в 2 этапа.
Первый
– трансаминирование – перенос аминогруппы
с любой аминокислоты на
![]() -кетокислоту
без промежуточного образования аммиака;
-кетокислоту
без промежуточного образования аммиака;
Второй – собственно окислительное дезаминирование.
В результате первого этапа аминогруппы «собираются» в составе глутаминовой кислоты. Второй этап связан с окислительным дезаминированием глутаминовой кислоты.
Трансаминирование аминокислот было открыто советскими учеными Браунштейном и Крицман (1937г).
R R1 R R1
| | | |
HC-NH2
+ C=O
![]() C=O + HC-NH2
C=O + HC-NH2
| | | |
COOH COOH COOH COOH
Реакция трансаминирования обратима, она катализируется ферментами – аминотрансферазами.
Акцептором
аминогрупп в реакциях трансаминирования
являются три
![]() -
кетокислоты: пируват, оксалоацетат,
2-оксоглутарат. Наиболее часто акцептором
NH2-групп служит
2-оксоглутарат (
-
кетокислоты: пируват, оксалоацетат,
2-оксоглутарат. Наиболее часто акцептором
NH2-групп служит
2-оксоглутарат (![]() -кетоглутарат),
реакция приводит к образованию
глутаминовой кислоты:
-кетоглутарат),
реакция приводит к образованию
глутаминовой кислоты:
-
СН3 COOH CH3 COOH
| | АЛТ | |
НСNH2
+ CH2
![]() C=O + (CH2)2
C=O + (CH2)2
| | | |
COOH CH2 COOH CHNH2
| |
C=O COOH
| глутамат
COOH
Аминотрансферазы содержат в качестве кофермента производные пиридоксина (витамин В6) – пиридоксаль-фосфат и пиридоксамин-фосфат.
(Механизм реакции трансаминирования с участием пиридоксальфосфата – учебник.)
-
Окислительное дезаминирование глутаминовой кислоты.
Биологический смысл реакций трансаминирования состоит в том, чтобы собрать аминогрупы всех распадающихся аминокислот в составе одной аминокислоты – глутаминовой. Глутаминовая кислота поступает в митохондрии клеток, где происходит второй этап трансдезаминирования – собственно дезаминирование глутаминовой кислоты. Реакция катализируется глутаматдегидрогеназой, которая в качестве кофермента содержит НАД+ или НАДФ+.
COOH СООН
| |
( CH2)2
CH2)2
![]() (CH2)2
(CH2)2
| |
CHNH2 НАД НАДН+Н+ C=O
| |
COOH COOH
Клиническое значение определения активности трансаминаз.
Для клинических целей определяют активность АлТ и АсТ, которые катализируют следующие реакции:
Аспартат
+
![]() -кетоглутарат
-кетоглутарат![]() оксалоацетат
+ глутамат
оксалоацетат
+ глутамат
Аланин
+
![]() -кетоглутарат
-кетоглутарат
![]() пируват
+ глутамат
пируват
+ глутамат
В сыворотке крови здоровых людей активность этих трансаминаз ниже, чем в органах. При поражении органов наблюдается выход трансаминаз из очага поражения в кровь. Так, при инфаркте миокарда уровень АсТ сыворотки крови уже через 3-5 ч после наступления инфаркта повышается в 20-30 раз. При гепатитах повышается более умеренное и затяжное.
Декарбоксилирование аминокислот.
Процесс отщепление карбоксильной группы в виде СО2 называется декарбоксилированием и приводит к образованию биогенных аминов, которые оказывают фармакологическое действие на физиологические функции человека.
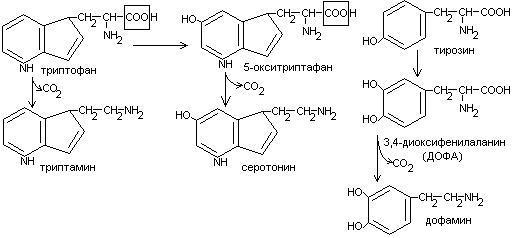
Серотонин обладает сосудосуживающим действием, участвует в регуляции артериального давления, t тела, дыхания, медиатор нервных процессов.
Дофамин- предшественник катехоламинов.
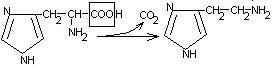
гистидин гистамин
Гистамин обладает сосудорасширяющим действием. Он образуется в области воспаления, участвует в развитии аллергических реакций.
НООС-(СН2)2-СН-СООН
![]() СН2-СН2-СН2-СООН
СН2-СН2-СН2-СООН
| |
глутамат
NH2 NH2
![]() -аминомасляная
кислота (ГАМК)
-аминомасляная
кислота (ГАМК)
ГАМК является тормозным медиатором. В лечебной практике используется при лечении эпилепсии (резкое сокращение частоты припадков).
Орнитин декарбоксилируясь дает диамин – путресцин, а лизин – кадаверин.
СН2-СН2-СН2-СН-СООН![]() СН2-СН2-СН2-СН2-NH2;
СН2-СН2-СН2-СН2-NH2;
| | |
NH2 NH2 NH2
CH2-CH2-CH2-CH2-CH-COOH![]() СН2-СН2-СН2-СН2-CH2-NH2
СН2-СН2-СН2-СН2-CH2-NH2
| | |
NH2 NH2 NH2
В организме биогенные амины подвергаются реакции окислительного дезаминирования с образованием альдегидов и аммиака. Процесс осуществляется при участии моноаминооксидаз.
Схематически механизм трансдезаминирования можно представит так:

Пути превращения аминокислот в печени.
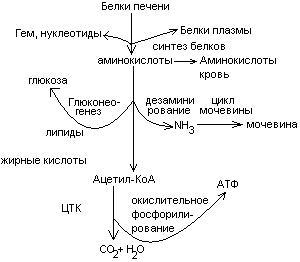
Включение углеродных скелетов аминокислот в цикл лимонной кислоты.
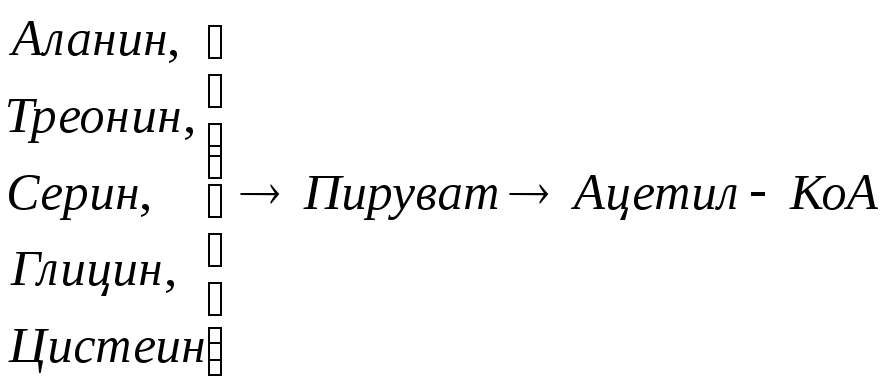

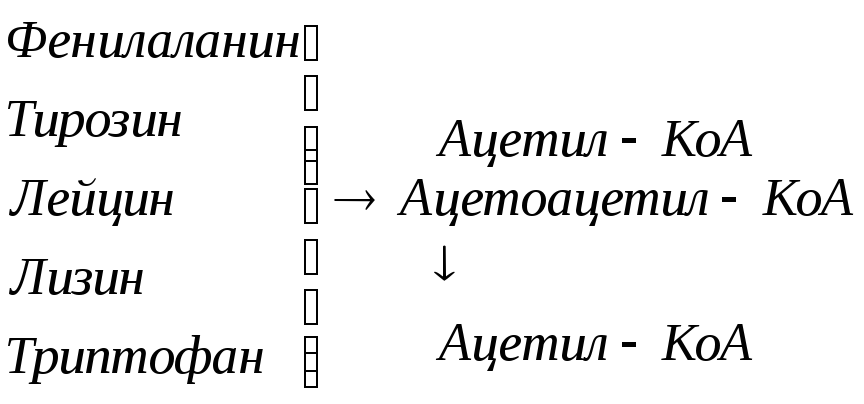
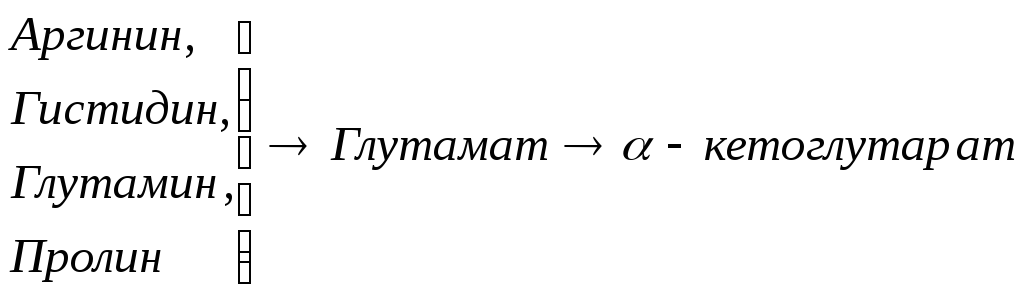
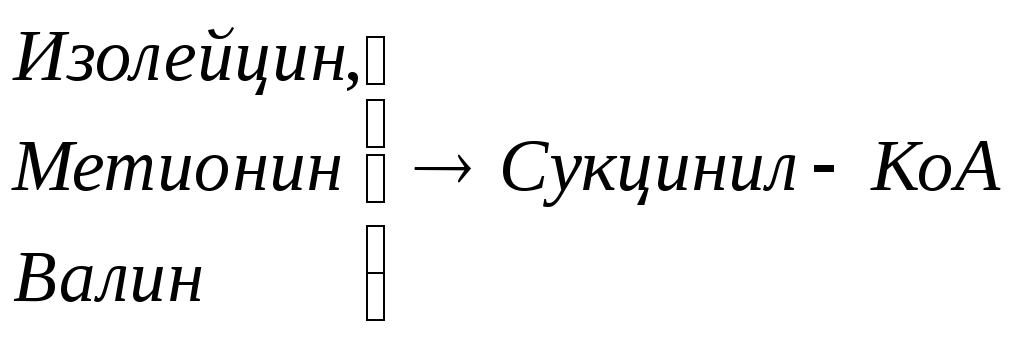
![]()
![]()
Синтез аминокислот
Заменимые аминокислоты образуются в печени из глутаминовой кислоты. Источником всех атомов углерода (а также азота аминогрупп) пролина, орнитина и аргинина является глутамат.
Источником углерода аланина, серина и глицина служат трехуглеродные промежуточные продукты гликолиза, а источником азота их аминогрупп – глутамат; аспартат получает углерод от оксалоацетата, а азот от глутамата.
![]() -кетоглутарат
+ NH3 + НАДН (или НАДФН)
-кетоглутарат
+ NH3 + НАДН (или НАДФН)
![]() Глутамат + НАД+ (или НАДФ+)
Глутамат + НАД+ (или НАДФ+)
Глутамат
+
![]() -кетокислота
-кетокислота
![]()
![]() -кетоглутарат
+ аминокислота
-кетоглутарат
+ аминокислота
![]() -кетокислота
+ NH3 + НАДН (НАДФН)
-кетокислота
+ NH3 + НАДН (НАДФН)
![]() аминокислота + НАД+ (НАДФ+)
аминокислота + НАД+ (НАДФ+)
Восстаниовительное аминирование в печени и других тканях обеспечивает сохраниение и повторное использование аммиака. Большая часть аминокислот синтезируется в результате переноса аминогрупп от других аминокислот без превращения в NH3.
Трансаминирование
= переаминирование = аминирование
![]() -кетоглутарата.
-кетоглутарата.
Мак-Мюррей, стр.276
Трансаминированию в печени не подвергаются аминокислоты с разветвленной цепью – лейцин, изолейцин, валин.
Эти аминокислоты вступают в реакции трансаминироания в почечной и мышечной тканях.
Лизин и треонин не вступают в реакцию трансаминирования.
Азотистый обмен
В организме человека ежесуточно распадается на аминокислоты около 400 г беков и столько их синтезируется.
Основная функция белков пластическая. Белки могут выполнять энергетическую функцию при избыточном их поступлении с пищей или в экстремальных ситуациях, когда белки тела подвергаются усиленному распаду. Этот процесс наблюдается при голодании или патологии (при сахарном диабете). При сгорании 1 г белков высвобождается 16,8 кДж.
Под термином «резервные» белки понимают не особые отложения белков, а легкомобилизуемые при необходимости тканевые белки, которые после гидролиза под действием тканевых протеиназ дают аминокислоты.
