
ГОСы Все предметы / Ответы для 5 курса / сульфацил-10
.docЗадача №10
Провести все виды внутриаптечного контроля для данной лекарственной формы согласно приказа МЗ РФ №214
Rp: Sol. Sulfacyli-natrii 20% - 10 ml
D.S. По 2 кап. 3 раза в день в оба глаза.
Количественный анализ провести методом ацидиметрии
Дать обоснование метода
Написать уравнения реакций
Сделать расчет допустимых норм отклонений
Рассчитать содержание сульфацила натрия в лекарственной форме
Методика
1 мл лекарственной формы (пипетка Мора) поместить в мерную колбу на 50 мл и довести водой до метки. 5 мл разведения (пипетка Мора) отмерить в колбу для титрования, прибавить 2 капли метилоранжа и 1 каплю метиленового синего. Титровать раствором кислоты хлористоводородной (0,1 моль/л) до сиреневой окраски.
М.м. (сульфацила натрия) = 254,24 г/моль
Сделать заключение о качестве препарата (лекарственной формы)
Ответ
На анализ поступила ЖЛФ для наружного применения – глазные капли, раствор сульфацила-натрия 20%-10мл.
![]()
Согласно приказа МЗ РФ №214 провожу следующие виды контроля:
-
Физический контроль. Бесцветная, прозрачная жидкость без механических примесей.
Норма отклонений на объем
10мл ± 10% ± 1мл.
9мл ≤ х ≤11мл
Вывод: Объем ЛФ соответствует прописанному в рецепте.
-
Химический контроль.
а) реакция на первичную ароматическую аминогруппу – (Н2N-Ar) - образования азокрасителя по реакции диазотирования с последующим азосочетанием.
Реакция основана на том, что первичные ароматические амины при действии натрия нитрита в кислой среде легко образуют соли диазония (реакция диазотирования), которые далее при реакции азосочетания с β-нафтолом в щелочной среде образуют азокраситель. Появляется вишнево-красное окрашивание или образуется оранжево-красный осадок.
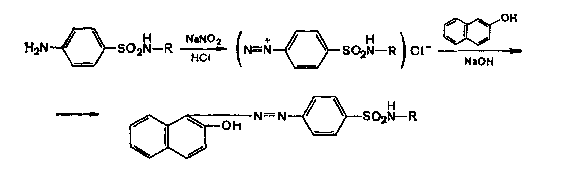
б) При действии на раствор сульфацила натрия раствором меди сульфата образуется осадок голубовато-зеленого цвета, который не изменяется при стоянии (отличие от других сульфаниламидных препаратов).
2![]() + CuSO4
→
+ CuSO4
→
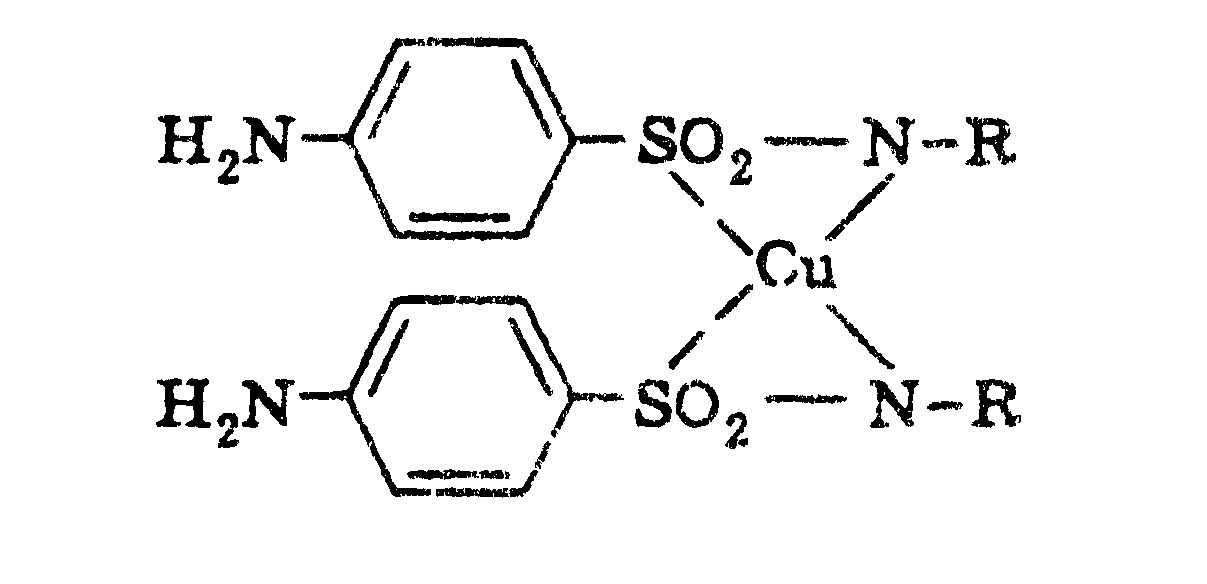 ↓
+
2Na2SO4
↓
+
2Na2SO4
в) На катионы натрия – пирохимическая реакция. Соли Na+ окрашивают бесцветную часть пламени спиртовки в желтый цвет.
Вывод: Лекарственная форма соответствует своему наименованию.
Количественное определение:
Метод кислотно-основного титрования.
f = 1
Титрование проводят с разведением, так как содержание сульфацила-натрия >5%
М.м. (сульфацила натрия) = 254,24 г/моль
Расчет титра
Т(сульфацила-натрия)
=
![]() =
=
![]() = 0,02542
г/мл
= 0,02542
г/мл
1 мл 0,1 н. раствора хлористоводородной кислоты соответствует 0,02542 г сульфацила-натрия.
Расчет допустимых норм отклонений на 2,0 сульфацила – натрия, прописанного в рецепте:
2,0 ± 5% = 0,1
1,9 ≤ х ≤2,1
Формула для расчета:
X
(г) =
![]()
где V(HCl) – объем титранта, пошедшего на титрование, мл;
k – поправочный коэффициент;
Т(сульфацила-натрия) – титр сульфацила-натрия;
V(лф) – объем лекарственной формы, мл;
V(мер.колбы) – объем мерной колбы, взятой для разведения, мл;
V(пипетки) – навеска, взятая для разведения, мл;
а – аликвота, мл.
Также количественное определение можно проводить методом нитритометрии по ароматической аминогруппе или методом рефрактометрии, т.к. сульфацила натрия в ЛФ более 5%.
Заключение о качестве ЛФ
