
- •Гбоу впо «Сургутский государственный университет хмао-Югры»
- •Лабораторная работа № 2 Определение щелочности воды
- •Лабораторная работа № 3 Приготовление и анализ водной вытяжки почв
- •Лабораторная работа № 4 Определение в почвах фосфора, доступного растениям
- •Лабораторная работа № 5 Определение потенциальной кислотности почв
- •Список литературы
Гбоу впо «Сургутский государственный университет хмао-Югры»
Институт естественных и технических наук
Кафедра безопасности жизнедеятельности
Методические указания к лабораторным работам по дисциплине
«Физико-химические процессы в техносфере»
Составители: к.х.н., доц. Е.В. Севастьянова, к.х.н., доц. Т.С.Андреева
Сургут, 2013
Содержание
Лабораторная работа №1. Определение жесткости воды…………………….3
Лабораторная работа № 2. Определение щелочности воды……………….......5
Лабораторная работа № 3. Приготовление и анализ водной вытяжки
Почв на содержание Сl‾, SO2-, Са2+……………………………………………….8
Лабораторная работа № 4. Определение в почвах фосфора, доступного растениям. ………………………………………………………………………11
Лабораторная работа № 5. Определение потенциальной кислотности почв…...14
Список литературы…………………………………………………………………17
Лабораторная работа №1
Определение жесткости воды
Теоретическая часть
Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция и магния. Числовое значение жесткости, выраженное в моль/м3, равно числовому значению жесткости, выраженному в миллиграмм – эквивалентах на литр (мг-экв/л); 1 мг–экв/л соответствует содержанию в воде 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Mg2+. Величину жесткости можно определить по уравнению:
Ж = [Ca2+] / (M(Ca2+)∙ f(Ca2+) + [Mg2+] / (M(Mg2+)∙ f(Mg2+) = [Ca2+] / 20,04 + [Mg2+] / 12,16;
где Ж – жесткость воды, моль/л;
[Ca2+] и [Mg2+] – концентрации ионов кальция и магния, мг/л;
f(Ca2+) и f(Mg2+) – факторы эквивалентности ионов кальция и магния (f(Ca2+)=f(Mg2+)= ½); M(Ca2+) и (M(Mg2+) – молярные массы ионов кальция и магния
Жесткость, определяемую по выше приведенному уравнению называют общей жесткостью воды, поскольку в воде различают карбонатную, некарбонатную. устраняемую и неустраняемую жесткость воды.
Классификация природных вод по величине жесткости:
|
Жесткость, моль/л |
Группа воды |
|
< 1,5 1,5 – 3,0 3,0 – 5,4 5,4 – 10,7 >10,7 |
Очень мягкая Мягкая Средней жесткости Жесткая Очень жесткая |
Под карбонатной жесткостью понимается количество ионов кальция и магния, связанных с карбонат- и гидрокарбонат –ионами.
Некарбонатная жесткость воды определяется как разность значений общей и карбонатной жесткости.
Устраняемая жесткость воды представляет собой часть карбонатной жесткости, которая удаляется при кипячении воды. Устраняемую жесткость определяют экспериментально.
Неустраняемая жесткость воды определяется как разность значений общей и устраняемой жесткости воды.
Комплексонометрическое титрование основано на реакциях образования комплексов ионов металлов с аминополикарбоновыми кислотами (комплексонами). Из многочисленных аминополикарбоновых кислот наиболее часто используют этилендиаминтетрауксусную кислоту (H4Y):
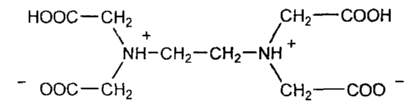
Вследствие низкой растворимости в воде сама кислота не подходит для приготовления раствора титранта. Для этого обычно используют дигидрат ее двунатриевой соли Na2H2Y·2H2O (ЭДТА). Эту соль можно получить добавлением к суспензии кислоты гидроксида натрия до рН ≈ 5. В большинстве случаев для приготовления раствора ЭДТА используют коммерческий препарат, а затем раствор стандартизуют. Можно также использовать фиксанал ЭДТА.
Реакции взаимодействия различных катионов с ЭДТА в растворе можно представить уравнениями:
Са2+ + Н2У2- = CaY2- + 2Н+,
Bi3+ + H2Y2- = BiY- + 2Н+,
Th4+ + H2Y2- = ThY + 2H+.
Видно, что независимо от заряда катиона образуются комплексы с соотношением компонентов 1:1. Следовательно, молярная масса эквивалента ЭДТА и определяемого иона металла равны их молекулярным массам.
Степень протекания реакции зависит от рН и константы устойчивости комплексоната. Катионы, образующие устойчивые комплексонаты, например, Fe(III), могут быть оттитрованы в кислых растворах. Ионы Ca(II), Mg(II) и другие, образующие сравнительно менее устойчивые комплексонаты, титруют при рН = 9 и выше.
Конечную точку титрования определяют с помощью металлоиндикаторов - хромофорных органических веществ, образующих с ионами металлов интенсивно окрашенные комплексы.
Константы устойчивости этилендиаминтетраацетатов кальция и магния различаются на 2 порядка (логарифмы констант устойчивости равны 10,7 и 8,7 для кальция и магния соответственно при 20°С и ионной силе 0,1). Поэтому эти ионы нельзя оттитровать раздельно, используя только различие в константах устойчивости комплексонатов. При рНопт ≈ 10 в качестве металлоиндикаторов используют эриохромовый черный Т. При этих условиях определяют сумму кальция и магния. В другой аликвотной части создают рН > 12, вводя NaOH, при этом магний осаждается в виде гидроксида, его не отфильтровывают, и в растворе определяют комплексонометрически кальций в присутствии мурексида, являющегося металлоиндикатором на кальций. Магний определяют по разности.
Следы тяжелых металлов титруются совместно с кальцием и магнием, поэтому их маскируют перед титрованием цианидом калия или осаждают сульфидом натрия либо диэтилдитиокарбаминатом натрия. Практически все ионы, присутствующие в воде, можно замаскировать цианидом калия и триэтаноламином; не маскируются щелочные металлы, кальций и магний.
1,0 мл 0,0100 М раствора ЭДТА эквивалентен содержанию 0,408 мг Са; 0,561 мг СаО; 0,243 мг Mg; 0,403 мг MgO.
Экспериментальная часть
Реагенты:
ЭДТА, 0,0500 М стандартный раствор.
Аммиачный буферный раствор с рН = 10 (67 г NH4C1 и 570 мл 25%-го NH3 в 1 л раствора).
NaOH (или КОН), 2 М раствор.
Металлоиндикаторы: эриохромовый черный Т; мурексид (смесь с хлоридом натрия в соотношении 1:100).
Выполнение определения
Определение суммы кальция и магния. Отбирают пипеткой 10,00 мл анализируемого раствора из мерной колбы вместимостью 100 мл в коническую колбу для титрования вместимостью 100 мл, прибавляют 2-3 мл буферного раствора с рН = 10, дистиллированной воды 15 мл, перемешивают и прибавляют на кончике шпателя 20-30 мг смеси эриохромового черного Т и хлорида натрия. Перемешивают до полного растворения индикаторной смеси и титруют раствором ЭДТА до изменения окраски раствора из винно-красной в голубую.
Определение кальция. Отбирают пипеткой 10,00 мл анализируемого раствора в коническую колбу вместимостью 100 мл, прибавляют 2-3 мл раствора NaOH или КОН, разбавляют водой примерно до 25 мл, вводят 20-30 мг индикаторной смеси мурексида с хлоридом натрия и титруют раствором ЭДТА до изменения окраски раствора из розовой в фиолетовую от одной капли раствора ЭДТА.
Определение магния. Объем титранта, израсходованный на титрование магния, вычисляют по разности объемов ЭДТА, пошедшей на титрование суммы кальция и магния при рН = 10 и на определение кальция при рН = 12.
