
- •Уральский государственный экономический университет
- •Уральского государственного экономического университета
- •Введение
- •Погрешности измерения физических величин
- •Работа № 1 определение момента инерции маятника максвелла
- •Теория метода и описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Определение ускорения свободного падения
- •Основы теории колебаний
- •Порядок выполнение работы
- •Контрольные вопросы
- •Литература
- •Порядок выполнение работы
- •Контрольные вопросы
- •Литература
- •Определение коэффициента пуассона методом адиабатического расширения
- •Основы термодинамики
- •Описание метода
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Деформация изгиба и измерение модуля юнга.
- •Основы теории упругой деформации
- •Описание установки
- •Порядок выполнение работы
- •Контрольные вопросы
- •Литература
- •Оглавление
Порядок выполнение работы
1. С помощью микрометра измерить диаметр шарика d. Выполнить не менее трех измерений и определить среднее значение диаметра
![]() .
.
2. Без толчка отпустить шарик в сосуд и засечь время его движения между метками а и b на участке, где его движение можно считать равномерным.
3. Определить расстояние между метками S и скорость установившегося движения шарика
![]() .
.
4. Полученные значения скорости и диаметра подставить в формулу (3.5) и определить коэффициент вязкости. Значения плотности вещества 1 и жидкости 2 задаются преподавателем.
5. Данные занести в табл. 3.1.
Таблица 3.1
Результаты измерений и расчетов
|
N шарика |
d1, м |
d2, м |
d3, м |
|
t, с |
υ, м/с |
η, Па∙с |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
6. Определить среднее значение коэффициента вязкости и найти относительную и абсолютную погрешности методом обработки косвенных измерений.
Контрольные вопросы
1. Что называется вязкостью?
2. В чем различие механизма вязкости в жидкости и газе?
3. Каков физический смысл коэффициента вязкости?
4. В каких единицах измеряется коэффициент вязкости?
5. Как изменяется с температурой динамический коэффициент вязкости жидкости? Газа?
6. В чем сущность метода Стокса?
7. Как выводится расчетная формула для вычисления вязкости по методу Стокса?
8. Как определяется скорость падения шарика?
9. Какие силы действуют на шарик при его движении в жидкости?
10. Как определяется плотность жидкости и материала шарика?
Литература
Трофимова Т.И. Курс физики. М.: Изд. центр «Академия», 2007. §8, 31, 32, 48, 66.
РАБОТА № 4
Определение коэффициента пуассона методом адиабатического расширения
Цель работы: изучение теоретических основ равновесной термодинамики и статистической физики и экспериментальное определение отношения теплоемкостей Cp/Cv для воздуха.
Приборы и принадлежности: закрытый стеклянный баллон с краном, манометр, поршневой насос.
Основы термодинамики
Термодинамика – раздел физики, изучающий закономерности превращения энергии. В термодинамике макроскопические объекты (тела, поля), выделенные из окружающей среды, способные обмениваться энергией друг с другом и с окружающей средой, называют термодинамическими системами. Обычно макроскопические объекты состоят из достаточно большого числа частиц. Для исследования этих объектов используются два дополняющих друг друга метода: статистический и термодинамический. Статистический метод базируется на модельных представлениях об атомно-молекулярной структуре вещества, использует усредненные значения микроскопических параметров и значения макроскопических параметров, определяемые на основе теории вероятностей. В термодинамическом методе исследования термодинамическая система рассматривается как один целостный объект, и ее состояние задается термодинамическими параметрами (макроскопическими параметрами системы), характеризующими ее свойства. Например, для газов обычно используется абсолютная температура (температура по шкале Кельвина – Т), давление (Р), объем (V). Переход из одного термодинамического состояния в другое называется термодинамическим процессом. В зависимости от взаимодействия с окружающей средой различают изолированные и открытые системы. Система называется: изолированной, если обмен энергией и веществом возможен лишь между телами, входящими в систему; открытой, если она обменивается веществом, энергией с окружающей средой.
Термодинамика подразделяется на равновесную и неравновесную. Равновесная термодинамика изучает процессы в системах, находящихся в равновесном состоянии, а также процессы, протекающие при нарушении и восстановлении равновесия (например, такие явления, как теплопроводность или диффузия). Равновесным состоянием – состоянием термодинамического равновесия – называется такое состояние термодинамической системы, в котором отсутствуют всякие потоки (энергии, вещества, импульса и т.д.), а макроскопические параметры системы с течением времени самопроизвольно не изменяются. Неравновесная термодинамика изучает системы, находящиеся в неравновесном состоянии, т. е. в состоянии, когда имеют место макроскопические потоки, обусловленные взаимодействием системы с внешней средой. В равновесной термодинамике процессы рассматриваются как квазистатические или, что то же самое, квазиравновесные. Предельным случаем квазиравновесного процесса является происходящий бесконечно медленно процесс, состоящий из непрерывно следующих друг за другом состояний термодинамического равновесия. Реально такой процесс протекать не может, однако если макроскопические изменения в системе происходят достаточно медленно (за промежутки времени, значительно превышающие время установления термодинамического равновесия), можно считать реальный процесс квазистатическим (квазиравновесным).
Термодинамические параметры состояния системы связаны друг с другом, и эта связь может быть представлена в виде уравнения. Конкретный вид уравнения зависит от физических свойств рассматриваемой термодинамической системы. Обобщение многочисленных экспериментальных данных показывает, что большинство газов в достаточно широком диапазоне внешних условий можно считать идеальными. В молекулярной физике идеальный газ – модель газа, в которой предполагается следующее:
потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией;
между молекулами не действуют силы притяжения или отталкивания;
соударения частиц между собой и со стенками сосуда абсолютно упругие, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Связь термодинамических параметров состояния идеального газа выражает уравнение Менделеева-Клапейрона:
![]() ,(4.1)
,(4.1)
где M
– молярная
масса; R
= 8,314
![]() – универсальная газовая постоянная.
– универсальная газовая постоянная.
В результате экспериментальных и теоретических исследований Ю.Р. Майера (1814 – 1878), Д.П. Джоуля (1818 – 1889) и других ученых стало понятно, что между тепловыми, механическими, электромагнитными, химическими, биологическими процессами существует связь, которая носит характер превращений. В качестве меры, сохраняющей свое численное значение при таких превращениях, используется энергия. Каждое тело обладает внутренней энергией, которая обусловлена движением и взаимодействием молекул. С точки зрения термодинамики, внутренняя энергия – однозначная функция термодинамических параметров состояния (Т, Р и т.п.), ее изменение не зависит от вида процесса, а определяется разностью внутренних энергий конечного и начального состояний. Было установлено, что в процессе превращений выполняется закон сохранения энергии, математическим выражением которого применительно к термодинамическим системам является первое начало термодинамики. Если система получила извне теплоту Q, совершила механическую работу A, при этом произошло изменение ее внутренней энергии на ΔU, то согласно первому началу термодинамики
Q = ΔU + A, (4.2)
т.е. теплота, переданная системе, идет на изменение внутренней энергии и на совершение системой работы.
Количество теплоты (теплота) и работа являются энергетическими характеристиками процессов изменения состояния термодинамических систем. При этом количество теплоты (теплота) характеризует изменение внутренней энергии системы в процессе теплообмена (путем теплопроводности, конвекции, излучения). Если при теплообмене не происходит изменения фазы вещества (в частности, агрегатного состояния), то меняется температура, и количество теплоты определяется соотношением
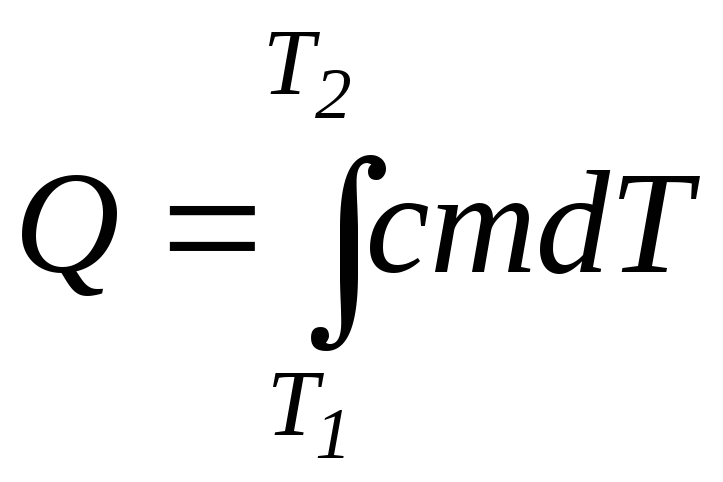 ,
(4.3)
,
(4.3)
где m – масса вещества; Т1 и Т2 – начальная и конечная температуры; с – удельная теплоемкость. Теплоемкость характеризует способность вещества изменять температуру при сообщении ему в процессе теплообмена количества теплоты. Удельной теплоемкостью вещества c называется величина, численно равная количеству теплоты, которое нужно сообщить единице массы, чтобы увеличить его температуру на 1 К. Молярной теплоемкостью вещества C называется величина, численно равная количеству теплоты, которое нужно сообщить молю, чтобы увеличить его температуру на 1 К. Для газов теплоемкость зависит от условий, при которых производится нагревание. Обычно выделяют теплоемкость (в частности, молярную) при постоянном объеме СV и при постоянном давлении СР.
Если меняется фаза (при плавлении или кристаллизации, парообразовании или конденсации, а также при сгорании), что происходит при постоянной температуре, теплота рассчитывается по формуле
![]() , (4.4)
, (4.4)
где k – удельная теплота фазового перехода.
Термодинамическая работа – физическая величина, характеризующая изменение энергии системы при изменении ее внешних параметров при взаимодействии с внешними телами, т.е. в процессе совершения работы. Термин «работа» используется в двух смыслах: работа как величина и работа как процесс. Совершение работы может изменить любой вид энергии системы. Термодинамическая работа – величина, характеризующая изменение внутренней энергии в процессе совершения работы. Например, работа совершаемая при изменении объема идеального газа
 ,
(4.5)
,
(4.5)
где V1 и V2 – начальный и конечный объемы.
Многочисленные наблюдения и опыты показывают, что реальные термодинамические процессы необратимы. Термодинамический процесс называется обратимым, если при совершении его сначала в прямом, а затем в обратном направлении как сама система, так и внешние тела, с которыми она взаимодействовала, возвращаются в исходные состояния, при этом ни в системе, ни в окружающей среде не остается никаких изменений. Необходимым и достаточным условием обратимости является равновесность всех последовательных состояний в процессе. Процесс, не удовлетворяющий условиям обратимости, называется необратимым. Проиллюстрируем на примерах. Газ, находящийся в части сосуда, отделенный от другой части перегородкой, самопроизвольно заполняет весь сосуд, если удалить перегородку. Без постороннего вмешательства (самопроизвольно) газ не соберется в той части сосуда, где он находился первоначально. Следовательно, процесс расширения газа в пустоту необратим. Если привести в соприкосновение два тела с различной температурой, то тепло самопроизвольно перейдет от нагретого тела к холодному и их температуры выравняются. Обратный процесс самопроизвольно никогда не произойдет. В природе существует универсальная тенденция перехода изолированной системы к равновесному состоянию. Отметим, что находящаяся в тепловом равновесии термодинамическая система не способна совершать работу, так как работа связана с упорядоченным движением.
Для описания необратимого стремления изолированной системы к равновесию вводится физическая величина, называемая энтропией. Энтропия S – функция состояния системы, являющаяся мерой беспорядка. Эта величина впервые введена в 1865годуР. Клаузиусом. Он определилизменение энтропии dS термодинамической системы при обратимом процессе как отношение количества теплаδQ к величине абсолютной температурыT:
![]()
![]() (4.6)
(4.6)
Изменение энтропии является мерой необратимости процессов в изолированной системе и характеризует направленность процессов в такой системе. Клаузиусом установлен закон - второе начало термодинамики, определяющее направление тепловых процессов в изолированных системах: при любых происходящих в изолированной термодинамической системе тепловых процессах система стремится к равновесному состоянию, при этом энтропия системы возрастает и достигает максимального значения в тепловом равновесии. Этот закон можно сформулировать более лаконично: в изолированной системе энтропия не убывает
![]()
![]() (4.7)
(4.7)
Л. Больцман дал статистическую трактовку этого закона, введя понятие термодинамической вероятности. Необратимость тепловых процессов имеет вероятностный характер. Переход системы из равновесного состояния в неравновесное не совсем невозможен, а лишь подавляюще маловероятен. Термодинамическая вероятность W состояния системы – это число микросостояний (конкретных распределений частиц), осуществляющих данное макросостояние системы с определенными термодинамическими параметрами. Энтропия S связана с термодинамической вероятностью состояния выражением
![]() , (4.8)
, (4.8)
где k – постоянная Больцмана.
В равновесном состоянии энтропия максимальна, ее изменение и направленные процессы прекращаются.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (Р, V и T). Интерес представляют квазистатические процессы, в которых один из параметров (Р, V или T) остается неизменным. Такие процессы называются изопроцессами.
Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T (Т = const). Из уравнения (4.1) состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества в сосуде произведение давления Р газа на его объем V должно оставаться постоянным:
![]() . (4.9)
. (4.9)
Это уравнение называют законом Бойля–Мариотта. На плоскости (P, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол P~1/V, которые называются изотермами (рис. 4.1).
|
|
|
Рис. 4.1. Семейство изотерм |
При изотермическом процессе внутренняя энергия газа не меняется (ΔU = 0), и первое начало термодинамики, согласно выражению (4.2), имеет вид:
![]() , (4.10)
, (4.10)
т.е. количество теплоты, переданное системе, расходуется на совершение работы.
Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V (V = const) и при условии, что количество вещества в сосуде остается неизменным.
Как следует из уравнения (4.1) состояния идеального газа, при этих условиях давление газа P изменяется прямо пропорционально его абсолютной температуре T (закон Шарля):
P~T или
![]() .
(4.11)
.
(4.11)
На плоскости (P, T) изохорные процессы для заданного количества вещества при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 4.2).
|
2 |
|
Рис. 4.2. Семейство изохор: V3 > V2 > V1 |
Так как при изохорном процессе объем остается постоянным, система не совершает работы (А = 0), и первое начало термодинамики, согласно выражению (4.2), имеет вид
![]() ,
(4.12)
,
(4.12)
т.е. количество теплоты, переданное системе, идет на изменение внутренней энергии. Рассматривая этот процесс для моля идеального газа, получим
![]() .(4.13)
.(4.13)
где ΔUM – изменение внутренней энергии моля газа; СV – молярная теплоемкость при постоянном давлении.
![]() .
(4.14)
.
(4.14)
Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении P (Р = const). При этих условиях объем газа V изменяется прямо пропорционально его абсолютной температуре Т (закон Гей-Люссака):
V~T.
Уравнение изобарного процесса для некоторого неизменного количества вещества имеет вид:
![]()
![]() (4.15)
(4.15)
На плоскости (V, T) изобарные процессы при разных значениях давления P изображаются семейством прямых линий, которые называются изобарами (рис. 4.3).
|
|
|
Рис. 4.3. Семейство изобар: Р3 > Р2 > Р1 |
При изобарном нагревании газа (при постоянном давлении) кроме теплоты, идущей на повышение внутренней энергии газа, необходима еще теплота для совершения работы расширения газа:
![]() .
(4.16)
.
(4.16)
Следовательно,
![]() .
.
Согласно выражению (4.2), первое начало термодинамики для моля идеального газа при изобарном процессе имеет вид
![]() ,
,
где СP - молярная теплоемкость при постоянном давлении.
![]() .(4.17)
.(4.17)
Тогда с учетом (4.1) для моля идеального газа имеем
![]() (4.18)
(4.18)
– уравнение Майера.
Адиабатическим называют процесс, происходящий без теплообмена с окружающей средой. Практически реальный процесс можно приблизить к адиабатическому, проводя его достаточно быстро, чтобы не успевал происходить теплообмен с внешней средой. Первое начало термодинамики для адиабатического процесса будет иметь вид
![]() или, согласно
выражению (4.2),
или, согласно
выражению (4.2),
![]() .
(4.19)
.
(4.19)
То есть работа совершается за счет изменения внутренней энергии.
Адиабатический процесс в идеальном газе описывается уравнением Пуассона
![]() .(4.20)
.(4.20)
Отношение теплоемкостей
![]() (4.21)
(4.21)
называется коэффициентом Пуассона.
На плоскости (Р, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При адиабатическом расширении газ совершает положительную работу (A > 0); поэтому его внутренняя энергия уменьшается (ΔU < 0). Это приводит к понижению температуры газа. Вследствие этого давление газа при адиабатическом расширении убывает быстрее, чем при изотермическом расширении (рис. 4.4).
|
|
|
Рис. 4.4. Семейства изотерм и адиабат идеального газа |
Согласно выражениям (4.6) и (4.19) изменение энтропии газа при адиабатическом процессе
![]() ,
т.е.S=const.
(4.22)
,
т.е.S=const.
(4.22)
Поэтому данный процесс называют изоэнтропийным и относят к изопроцессам.
В данной работе определяется коэффициент Пуассона.
Статистический смысл теплоемкости определяется на основе закона Больцмана о равномерном распределении энергии по степеням свободы молекул. Числом степеней свободы тела называется число независимых координат, необходимых для полного определения положения тела в пространстве. Число степеней свободы материальной точки (3 поступательных степени свободы) i = 3, двух жестко связанных материальных точек (3 поступательных и 2 вращательных степени свободы)i = 5 и множества жестко связанных материальных точек, не лежащих на одной прямой (3 поступательных и 3 вращательных степени свободы)i = 6. Поэтому можно считать, что молекулы одноатомного газа имеют 3 степени свободы, двухатомного – 5, многоатомного – 6.
Так как согласно основному уравнению молекулярно-кинетической теории для идеального газа средняя кинетическая энергия поступательного движения одноатомной молекулы
![]() (4.23)
(4.23)
где k– постоянная Больцмана, аТ– абсолютная температура, то, в соответствии с законом Больцмана, для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия
![]() .
(4.24)
.
(4.24)
Тогда средняя кинетическая энергия молекулы
![]() ,
(4.25)
,
(4.25)
а внутренняя энергия моля идеального газа
![]() . (4.24)
. (4.24)
Учитывая выражения (4.15) и (4.17), получаем:
![]() ,
(4.25)
,
(4.25)
![]() .
(4.26)
.
(4.26)
Таким образом, коэффициент Пуассона зависит только от числа степеней свободы молекул, из которых состоит газ:
![]() . (4.27)
. (4.27)
В настоящей работе
определяется
![]() для воздуха, рассматриваемого как смесь
газов, в которой преобладают двухатомные
молекулы.
для воздуха, рассматриваемого как смесь
газов, в которой преобладают двухатомные
молекулы.




