
Температура плавлення
Температура плавлення (Тпл) є найважливішою константою, що характеризує тверду речовину.
Температурою плавлення сполуки називають температуру, при якій його кристалічна фаза знаходиться в рівновазі з власним розплавом. Температура плавлення відповідає температурі, при якій тиск пари над твердим речовиною дорівнює тиску пари над рідиною.
Визначити температуру плавлення можна в процесі плавлення або в процесі кристалізації розплаву. Так, якщо виключено переохолодження, то температура кристалізації збігається з температурою плавлення. Зазвичай під температурою плавлення мають на увазі інтервал температур між появою перших крапель рідини і повним переходом твердої речовини в рідкий стан. Для чистих індивідуальних речовин цей інтервал вимірюється частками градуса. Точніше визначити температурний інтервал плавлення можна шляхом повторного плавлення зразка після його застигання.
Присутність домішок, як правило, знижує температуру плавлення речовин. Якщо випробуваний зразок плавиться при більш низькій температурі, ніж наведена в літературі для даної речовини, це вказує на недостатню його чистоту.
При очистці речовини, температуру плавлення необхідно визначати після кожної стадії його очищення, наприклад після кожної перекристалізації. Якщо послідуюча перекристалізації вже не призводить до підвищення температури плавлення і вона збігається з наведеною в літературі, то речовина вважається цілком чистою.
Додатковим критерієм чистоти речовини може служити також температурний інтервал, в якому відбувається плавлення. Так, якщо чисті продукти повністю розплавляються в межах 0,5 – 1,0оC, то сильно забруднені речовини не мають чіткої температури плавлення і при нагріванні перетворюються в рідину поступово, в межах декількох градусів. Однак це правило справедливо не завжди, тому не слід робити висновку про якість продукту лише на підставі температурного інтервалу плавлення.
Якщо температури плавлення двох досліджуваних зразків близькі або збігаються, цей факт ще не може служити доказом того, що вони являють собою одну і ту ж речовину. Для більш надійного встановлення їх ідентичності визначають температуру плавлення змішаної проби. Суміш готують, ретельно розтираючи приблизно рівні кількості однієї та іншої речовини на годинниковому склі. Депресія температури плавлення, тобто зниження температури плавлення суміші у порівнянні з Тпл вихідних зразків однозначно вказує на те, що вони являють собою різні речовини. Відсутність депресії (суміш плавиться при тій же температурі, що і вихідні сполуки) служить доказом ідентичності речовин за умови, що інші константи обох речовин (наприклад, положення п’ятен на тонкошаровій хроматограмі) також збігаються.
Винятки спостерігаються, наприклад, у тих випадках, коли досліджувані речовини вступають в хімічну взаємодію один з одним, утворюючи нову сполуку з більш високою температурою плавлення. Депресії в цьому випадку може і не спостерігатися, хоча суміш приготовлена з різних речовин.
Практично рекомендується всі три проби - двох чистих речовин та їх суміші - плавити одночасно на одному приладі. Таким чином різницю виявити легше. При використанні капілярного методу конструкція приладу повинна дозволяти одночасне введення трьох капілярів.
Слід зазначити, що визначення температури плавлення з метою попередньої ідентифікації речовин дає надійні результати лише в тих випадках, коли речовини плавляться без розкладання . Щоб переконатися в стійкості сполуки при плавленні, їй дають закристалізуватися і розплавляють ще раз. Якщо повторне плавлення відбувається при тій же температурі, отриманому результату можна довіряти. Температура плавлення речовин, нестійких при нагріванні, не є постійною величиною. Вона значною мірою залежить від умов визначення - швидкості нагрівання, кількості речовин, наявності кисню повітря і іншого. Практично розкладання речовини починається ще до того, як вона розплавиться. Продукти розкладання дають депресію з основною речовиною, внаслідок чого температура плавлення виявляється нижчою від істинної. При строгому дотриманні сталості умов визначення можна домогтися задовільного відтворення результатів. У таких випадках допускається використовувати температуру плавлення з розкладом для характеристики речовини. Слід тільки мати на увазі, що точність отриманих цифр дуже відносна і вони справедливі тільки для обраних конкретних умов визначення. Якщо розкладання обумовлено окисненням речовини киснем повітря, температуру плавлення визначають в атмосфері інертного газу або у вакуумі.
За допомогою вимірювання тільки температури плавлення не можна скласти остаточного судження про чистоту випробуваного зразка або про ідентичність двох зразків.
Для отримання більш надійного заключення слід скористатися даними елементного аналізу (порівнюють результати експериментального визначення процентного вмісту елементів, що входять до складу даної речовини, з обчисленим за хімічною формулою), а також різних фізико-хімічних методів (тонкошарової хроматографії, УФ- та ІЧ– спектроскопії, ЯМР, та ін).
Найбільш поширеним з усіх методів визначення температури плавлення органічних речовин є визначення температури плавлення капілярним методом. Для цього невелику кількість тонко розтертого і добре висушеного препарату поміщають у запаяний з одного кінця тонкостінний капіляр, який прикріплюють до термометра і поміщають в нагрівальний блок. Використовують капіляр довжиною 45-50 мм, діаметром 1,0-1,2 мм для безбарвних речовин і 0,8-1,0 мм для забарвлених. Для воскоподібних і волокнистих речовин можна використовувати капілярні трубки трохи більшого розміру. При заповненні капіляра його відкритий кінець кілька разів вдавлюють в порошкоподібну речовину, поміщену на годинникове скло. Після цього капіляр кілька разів вдаряють заповненим кінцем об поверхню столу. Наповнений капіляр кидають запаяним кінцем вниз 10-15 разів через скляну трубку висотою 800 мм і діаметром 15-20 мм, поставлену вертикально на скляну або кахельну пластину, до ущільнення речовини в шар 2-3 мм. Температуру плавлення гігроскопічних речовин визначають у капілярах, запаяних з обох кінців; при цьому капіляр повинен бути занурений цілком в нагрівальну баню (нагрівальний блок).
Капіляр закріплюють на термометрі гумовим колечком (кільце відрізане від відповідного за розмірами гумового шланга). Проба речовини повинна перебувати на рівні ртутного резервуара термометра. В звичайних умовах нагрівання при переході з твердого стану в рідкий в капілярі можна спостерігати такі явища: усадка речовини (стовпчик речовини змінює свою форму, стискаючись і відстаючи від стінок капіляра, без видимого переходу в рідкий стан); запотівання (на внутрішній поверхні капіляра з'являються крапельки рідини, речовина спікається, не втрачаючи своєї зв'язності); часткове плавлення (в капілярі поряд з твердими частинками утворюється меніск рідини по всьому перетину капіляра). Після цього, за трохи вищої температури настає стан повного розплавлення.
Температуру плавлення (топлення) здебільшого відзначають по термометру, коли речовина повністю розплавилась, утворивши прозорий розплав.
Щоб уникнути досить великих і часом недостатньо надійних поправок на виступаючий стовпчик ртуті, рекомендується застосовувати укорочені термометри з набору ТЛ-6 (за Аншютцем).
Деякі органічні речовини плавляться з розкладанням (поява забарвлення , виділення газу). Температура розкладання зазвичай нечітко виражена і часто не може бути точно відтворена.
Визначення температури плавлення в капілярах може бути виконано дуже точно, якщо попередньо приблизно визначити температуру плавлення речовини, як сказано вище, а потім капіляр з речовиною помістити в прилад, нагрітий на кілька градусів нижче цього приблизного значення.
Відомо кілька конструкцій приладів для визначення температури плавлення капілярним методом. Найбільш простим з них є прилад ПТОП (рис. 1.1). Цей прилад складається з круглодонної колби на 100-150 мл з горлом довжиною 90 мм і діаметром 30 мм. У колбу наливають на 2/3 її обсягу теплоносій, в якості якого використовують концентровану сірчану кислоту , парафінове або силіконове масло.
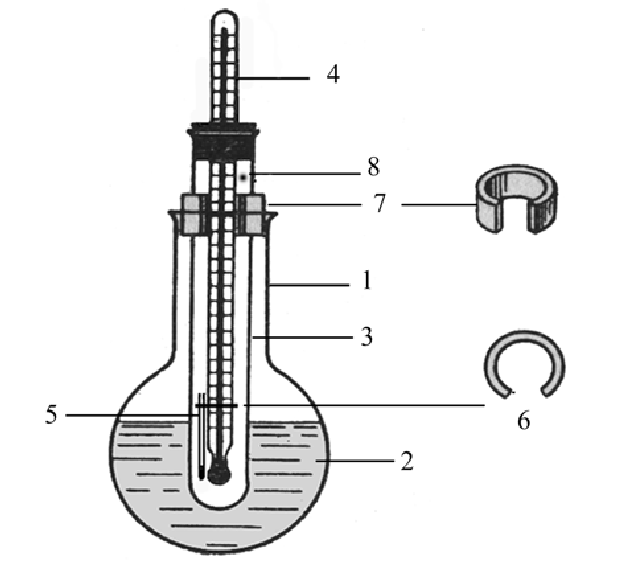
Рис . 1.1 . Прилад для визначення температури плавлення ПТОП
1 - колба, 2 - теплоносій, 3 - пробірка, 4 - термометр, 5 - капіляр з речовиною, 6 - кільце для кріплення капіляра , 7 - кільце для кріплення пробірки, 8 - отвір в пробірці.
У горло колби вставляють спеціальну пробірку довжиною 150 мм і діаметром близько 15 мм, яку фіксують у горловині колби спеціальним колечком з прорізом (щоб уникнути вибуху, можливого при нагріванні герметично закритого посуду); крім того, на пробірці є отвір для сполучення з атмосферою. Пробірку закривають корковою пробкою зі вставленим в неї укороченим термометром, нижній кінець якого повинен знаходитися на кілька міліметрів вище дна пробірки.
Вміст колби нагрівають до температури на 10-15° С нижче передбачуваної температури плавлення препарату, вимірюючи температуру в приладі термометром, після чого в пробірку поміщають укорочений термометр з капіляром так, щоб ні термометр, ні капіляр не торкались дна і стінок пробірки. Потім продовжують нагрівати прилад, підвищуючи температуру зі швидкістю 0,5°С за хвилину. Якщо речовина в процесі плавлення розкладається, то швидкість нагріву збільшують до 2-3°С за хвилину або капіляр з препаратом поміщають в прилад, попередньо нагрітий до температури приблизно на 5 ° С нижче передбачуваної температури плавлення. Початком плавлення вважають появу першої краплі розплавленого речовини або поява меніска в капілярі, а кінцем - момент повного розплавлення речовини. Обидві температури відзначають і вважають інтервалом плавлення досліджуваної речовини.
При визначенні температури плавлення речовин, що плавляться нижче 170°С застосовують порожню пробірку без колби. Сульфатну кислоту, робота з якою вимагає великої обережності, можна використовувати при визначенні температури плавлення до 250°С. Якщо концентрована сульфатна кислота набуває в процесі роботи бурий відтінок, то для знебарвлення до неї додають декілька кристалів нітрату калію або нітрату натрію. Суміш концентрованої сульфатної кислоти (7 мас. частин) і сульфату калію (3 частини) після 5-хвилинного кип'ятіння при енергійному перемішуванні перетворюється на прозору рідину, яку можна використовувати як теплоносій до 320°С (суміш гігроскопічна і її слід оберігати від потрапляння вологи).
