
- •Методические указания
- •1. Цель работы.
- •2. Возникновение горения
- •3. Горение (взрыв) газовых и пылевых смесей
- •4. Параметры, определяющие пожарную опасность веществ
- •Общие сведения о пожаре и пожарной опасности
- •1. Пожарная опасность
- •2. Причины пожаров
- •3. Распространение пожаров
- •Огнестойкость и возгораемость строительных конструкций
- •1. Строительные конструкции и противопожарная защита
- •2. Возгораемость строительных материалов и конструкций
- •3. Перекрытия
- •4. Экраны
- •5. Водяные завесы
- •6. Противопожарные зоны
- •2. Понятия и определения вынужденной эвакуации
- •4. Параметры движения людей
- •5. Нормирование процесса эвакуации
- •6. Расчет продолжительности эвакуации
- •7. Конструктивно-планировочные решения
- •Организация пожарной охраны и тушение пожаров
- •1. Государственный пожарный надзор
- •2. Пожарная охрана на новостройках
- •3. Огнегасительные вещества и средства пожаротушения
- •4. Средства тушения пожаров
- •5. Средства извещения 0 пожарах
- •Противопожарная защита новостроек
- •1. Пожарная опасность новостроек
- •2. Строительный генеральный план (стройгенллан)
- •3. Производство строительно-монтажных работ
- •Библиографический список рекомендуемой литературы
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Тульский государственный университет»
Кафедра «Аэрологии, охраны труда и окружающей среды»
Методические указания
по САМОСТОЯТЕЛЬНОЙ РАБОТЕ СТУДЕНТОВ
по дисциплине
“Теория горения и взрыва”
Направление подготовки: 280700 «Техносферная безопасность»
Профиль подготовки: «Безопасность технологических процессов и производств»
Квалификация (степень) выпускника: бакалавр
Форма обучения: очная
Тула 2012 г.
Методические указания по СРС составлены д.т.н., доц. Машинцовым Е.А и обсуждены на заседании кафедры Аэрологии, охраны труда и окружающей среды факультета горно-строительный.
протокол №___ от "___"____________ 2012 г.
Зав. кафедрой ________________ Э.М. Соколов
Методические указания по СРС пересмотрены и утверждены на заседании кафедры Аэрологии, охраны труда и окружающей среды факультета горно-строительный.
протокол №___ от "___"____________ 20___ г.
Зав. кафедрой ________________ Э.М. Соколов
1. Цель работы.
Углубление знаний по способов и методов борьбы с огнем, причин возгораний, средств предотвращения возгораний, и средств изменяющих огнестойкие свойства строительных материалов..
2. Состав работы
2.1. Подготовка к освоению разделов.
2.1.1 Горение и пожароопасные свойства веществ
2.1.2 Общие сведения о пожаре и пожарной опасности
2.1.3 Огнестойкость и возгораемость строительных конструкций
2.1.4 Пожарная профилактика при внутренней планировке зданий
2.1.5 Противопожарные преграды
2.1.6 Вынужденная эвакуация людей из зданий
2.1.7. Организация пожарной охраны и тушение пожаров
2.1.8. Противопожарная защита новостроек
3. Дидактический материал для освоения разделов
ГОРЕНИЕ И ПОЖАРООПАСНЫЕ СВОЙСТВА ВЕЩЕСТВ
ОБЩИЕ СВЕДЕНИЯ О ГОРЕНИИ
Условия и виды горения. Горением называется сложный физико-химический процесс, основой которого является быстро протекающая реакция окисления, сопровождающаяся выделением тепла и излучением света.
В обычных условиях, т. е. при нахождении горючих веществ и материалов в воздухе, горение представляет собой реакцию взаимодействия их с кислородом воздуха. Оно возникает и продолжается при сочетании горючего вещества, воздуха и источника воспламенения. При этом горючее вещество и воздух, соприкасающийся с ним, составляют горючую систему, а источник воспламенения является импульсом, вызывающим в ней реакцию горения. Система является горючей только при определенном соотношении в ней горючего вещества и воздуха. Так, например, система, состоящая из паров бензина и воздуха, является горючей только при содержании в ней паров бензина от 0,76 до 5,4% объемных.
Источником воспламенения называется любое тело, имеющее температуру и запас тепла, достаточный для нагревания некоторого объема горючей системы до возникновения в ней горения. К источникам воспламенения относятся источники тепла (пламя, искра, нагретое тело) или тепловое проявление какого-либо другого вида энергии: химической (экзотермическая реакция), механической (удар, сжатие, трение), электрической (электрический разряд) и т. д.
В установившемся процессе горения постоянным источником воспламенения является зона горения, т. е. та область, где происходит реакция, выделяется тепло и излучается свет. В зависимости от состояния горючей системы и условий протекания реакции в ней различают диффузионное и кинетическое горение.
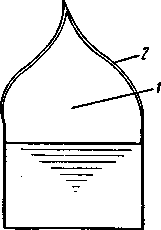
Рис. 18-1. Строение
диффузионного пламени
Диффузионным называют горение, скорость которого зависит от скорости диффузии кислорода в зону реакции. Пламя диффузионного горения состоит из двух зон (рис. 18-1). В зоне 1, которая занимает почти весь объем пламени, находятся горючие пары или газы, движущиеся к зоне горения 2. Горение в зоне отсутствует, так как кислород в нее не поступает. Пары и газы, приближаясь к зоне горения, нагреваются за счет диффузии в них нагретых продуктов сгорания из зоны горения. В результате нагрева пары и газы разлагаются с образованием молекул с более низким молекулярным весом, атомов и радикалов, которые поступают в зону горения. Зона горения 2 представляет очень тонкий газовый слой, в котором за счет диффузии кислорода воздуха образуется и сразу же сгорает горючая смесь.
В зоне горения происходит выделение тепла, поэтому температура ее самая высокая в объеме пламени.
Высота пламени
зависит от скорости диффузии к нему
кислорода и определяется из соотношения
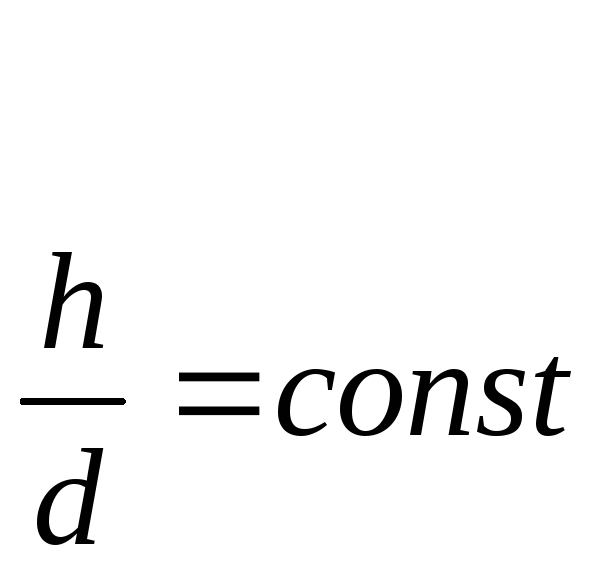
где h — высота пламени;
d — диаметр резервуара, или наибольшая сторона основания штабеля твердого горючего вещества.
Опыт показывает, что относительная высота пламени — при горении жидкостей и твердых веществ колеблется от 1,5 до 2. Диффузионное горение является наиболее распространенным в быту и технике, оно же протекает и на пожаре.
Кинетическим называется горение заранее приготовленной горючей смеси, скорость которого не зависит от диффузии кислорода в зону горения и определяется только скоростью передачи тепла теплопроводностью от зоны горения к негорящей еще смеси. Поэтому скорость кинетического горения характеризуется нормальной скоростью распространения пламени, которая не превышает нескольких метров в секунду. Горение с такой скоростью в замкнутом объеме представляет собой взрыв, поэтому смеси паров, газов и пыли с воздухом называют взрывоопасными.
При распространении пламени по газовоздушной смеси, находящейся в трубе большой длины, нормальное горение переходит детонационное, скорость которого составляет 1000—4000 м/сек. При детонации передача энергии горючей смеси происходит при помощи ударной волны. Детонация газовых смесей наблюдалась при распространении пламени в трубах и в цилиндрах двигателей.
Расчеты процесса горения. Методика расчета количества воздуха, необходимого для горения, зависит от состава горючего вещества и его агрегатного состояния. При горении индивидуальных химических соединений расчет количества воздуха VI ведется по уравнению горения вещества в воздухе
![]() ,
(18.1)
,
(18.1)
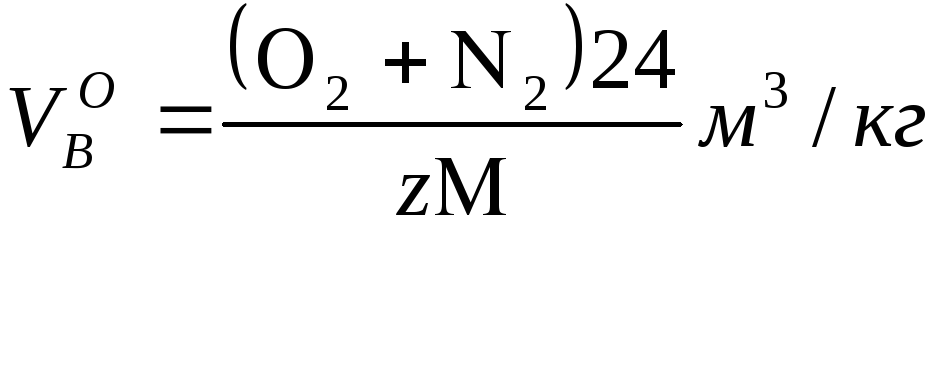
где
![]() —
число молей кислорода в уравнении
горения;
—
число молей кислорода в уравнении
горения;
![]() —число молей
азота;
—число молей
азота;
z — число молей горючего;
М — молекулярный вес горючего.
При горении веществ, представляющих сложную смесь химических соединений (древесина, торф, каменный уголь, бензин, керосин), количество воздуха определяется по формуле
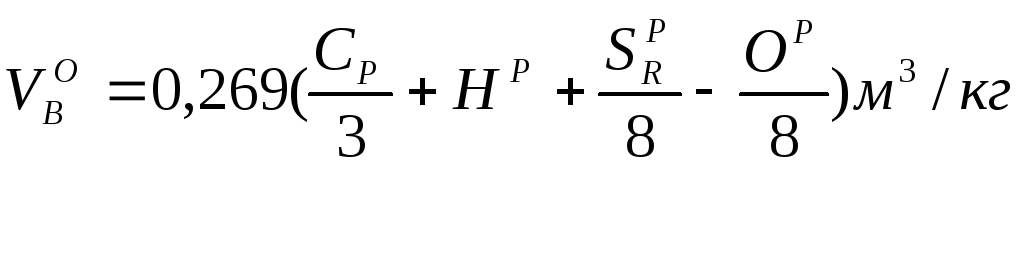 (18.2)
(18.2)
где![]() ,
,![]() ,
,![]() ,
,![]() —
весовой процент углерода, водорода,
серы и
—
весовой процент углерода, водорода,
серы и
кислорода в рабочей
массе горючего вещества (под рабочей
массой понимается состав горючего
вещества, каким он вступает в процесс
горения). Найденное по формулам количество
воздуха называется теоретическим. В
действительности при горении веществ
на пожарах воздуха затрачивается
значительно больше. Отношение количества
воздуха, действительно затраченного
на горение
![]() к теоретическому
к теоретическому![]() называется
коэффициентом избытка воздуха;
называется
коэффициентом избытка воздуха;
![]()
На пожарах в зданиях а изменяется в широких пределах (от 2 до 20).
В результате
горения образуются твердые, жидкие и
газообразные продукты сгорания. Состав
их зависит от состава горящего вещества
и условий его горения. На пожарах чаще
всего горят органические вещества
(древесина, ткани, резина, нефтепродукты
и др.), в состав которых главным образом
входят углерод, водород, кислород и
азот. При горении их образуются продукты
сгорания:
![]() ,СО,
,СО,![]() ,
,![]() ,
которые при высоких температурах все
находятся в газообразном состоянии.
,
которые при высоких температурах все
находятся в газообразном состоянии.
Дым представляет собой дисперсную систему, состоящую из мельчайших частиц твердых продуктов сгорания, взвешенных в смеси газообразных продуктов сгорания с воздухом. При горении органических веществ твердыми частицами дыма является углерод (сажа) — продукт неполного горения веществ.
Неполным называется горение при недостатке воздуха. В процессе его образуются продукты, которые еще способны гореть: окись углерода, сажа, спирты, альдегиды, кислоты и другие вещества. Эти же соединения, но в меньшем количестве находятся в дыме при полном горении. Образуются они обычно перед фронтом распространения горения, где происходит разложение горящего вещества, но температура недостаточна для возникновения горения образовавшихся продуктов разложения.
В связи с применением в строительстве пластмасс в дыме пожаров могут присутствовать также хлористый водород, сероводород, окислы азота, синильная кислота и многие другие, вредные для дыхания вещества. Так, например, при горении линолеума «Релин» образуются сероводород и сернистый газ. При горении пенополиуретана — синильная кислота и толуидендиизоционат, при горении аминопластов (мипора, шпорка) — синильная кислота, при горении винипласта — хлористый водород и окись углерода.
Расчет количества
продуктов полного сгорания индивидуальных
химических соединений
![]() производится
по уравнению горения веществ в воздухе
производится
по уравнению горения веществ в воздухе
![]()
![]() (18.3)
(18.3)
где
![]() — число молей углекислого газа;
— число молей углекислого газа;
![]() —число молен паров
воды;
—число молен паров
воды;
![]() —число молей азота;
—число молей азота;
d — число молей горючего вещества.
При горении веществ, представляющих сложную смесь химичес¬ких соединений, количество продуктов сгорания определяется по
Формуле
![]() (18.4)
(18.4)
где![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() —
весовые доли углерода, водорода, серы,
—
весовые доли углерода, водорода, серы,
азота, кислорода и влаги в горючем веществе.
При а > 1 количество продуктов сгорания равно
![]()
Количество тепла, выделяющееся при сгорании одной весовой или объемной единицы горючего вещества, называется теплотой сгорания. Теплота сгорания веществ приводится в справочниках.
Калориметрическая температура горения (без учета потерь тепла на излучение, нагрев конструкций и т. д.) определяется по формуле
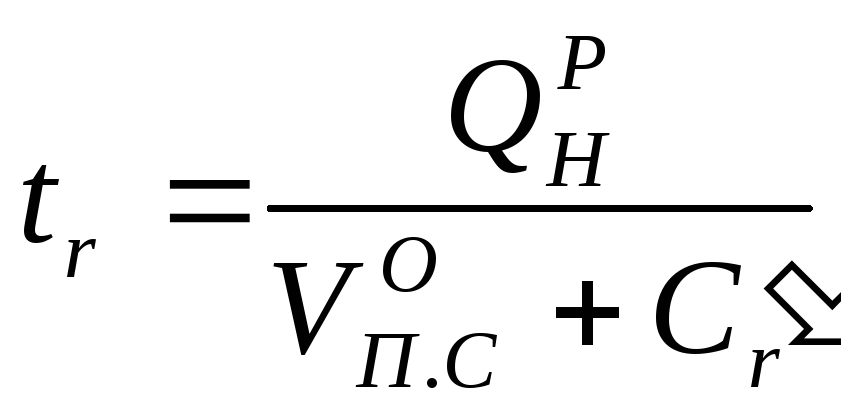
Где
![]() —
низшая теплота сгорания;
—
низшая теплота сгорания;
![]() —удельный объем
продуктов сгорания;
—удельный объем
продуктов сгорания;
![]() —средняя теплоемкость
не разбавленных воздухом продуктов
сгорания.
—средняя теплоемкость
не разбавленных воздухом продуктов
сгорания.
Температура пожара в помещении определяется по формуле
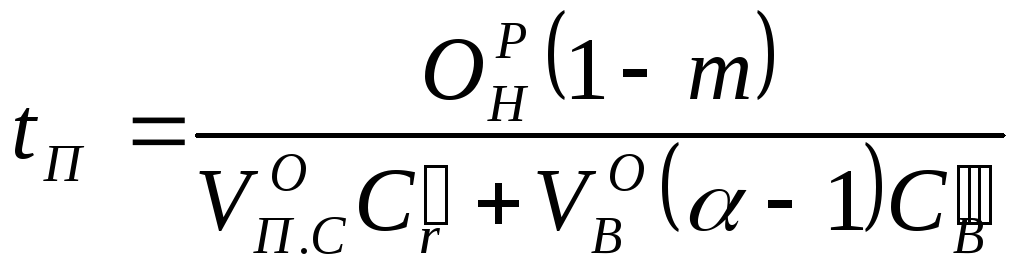 (18.5)
(18.5)
где m — доля потерь теплоты сгорания на излучение, нагрев конструкций,
горючего
вещества и т.д. (m
=0,154![]() 0,5);
0,5);
![]() —средние теплоемкости
продуктов сгорания и воздуха.
—средние теплоемкости
продуктов сгорания и воздуха.
