
КороткМетодикиЛр
.pdfЕ.А. Григорьева
Методики лабораторных работ по химии
Челябинск, 2014
Таблица П1
Растворимость кислот, оснований и солей в воде
Катионы |
|
|
|
|
|
|
Анионы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH- |
Cl- |
Br- |
I- |
S2- |
SO32- |
SO42- |
NO3- |
PO43- |
CO32- |
SiO32- |
CH3COO- |
H+ |
|
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
NH4+ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Na+, K+ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Cu2+ |
Н |
Р |
Р |
– |
Н |
– |
Р |
Р |
Н |
– |
– |
Р |
Ag+ |
– |
Н |
Н |
Н |
Н |
Н |
М |
Р |
Н |
Н |
– |
Р |
Mg2+ |
Н |
Р |
Р |
Р |
– |
Н |
Р |
Р |
Н |
Н |
– |
Р |
Ca2+ |
М |
Р |
Р |
Р |
– |
Н |
М |
Р |
Н |
Н |
Н |
Р |
Ba2+ |
Р |
Р |
Р |
Р |
– |
Н |
Н |
Р |
Н |
Н |
Н |
Р |
Zn2+ |
Н |
Р |
Р |
Р |
Н |
Н |
Р |
Р |
Н |
Н |
Н |
Р |
Al3+ |
Н |
Р |
Р |
Р |
– |
– |
Р |
Р |
Н |
– |
– |
М |
Sn2+ |
Н |
Р |
Р |
М |
Н |
– |
Р |
– |
Н |
– |
– |
Р |
Pb2+ |
Н |
М |
М |
Н |
Н |
Н |
Н |
Р |
Н |
Н |
– |
Р |
Cr3+ |
Н |
Р |
Р |
Р |
– |
– |
Р |
Р |
Н |
– |
– |
Р |
Mn2+ |
Н |
Р |
Р |
Р |
Н |
Н |
Р |
Р |
Н |
Н |
– |
Р |
Fe2+ |
Н |
Р |
Р |
Р |
Н |
Н |
Р |
Р |
Н |
Н |
– |
Р |
Fe3+ |
Н |
Р |
Р |
– |
– |
– |
Р |
Р |
Н |
– |
– |
Р |
Ni2+,Co2+ |
Н |
Р |
Р |
Р |
Н |
Н |
Р |
Р |
Н |
Н |
– |
Р |
Cd2+ |
Н |
Р |
Р |
Р |
Н |
Н |
Р |
Р |
Н |
Н |
Н |
Р |
Р– растворимые; М – малорастворимые; Н – нерастворимые;
–вещество не существует или разлагается водой.
2
Лабораторная работа № 1. Классы неорганических соединений
Цель работы: ознакомиться с методами получения оксидов, кислот, оснований (щелочей), солей и изучить их свойства.
Приборы и реактивы: аппарат Киппа, пробирки, кислоты, основания, соли, индикаторы.
Опыт 1. Изменение окраски индикаторов в различных средах
1.Налейте в одну пробирку немного дистиллированной воды, в другую – раствор гидроксида натрия NaOH, в третью - раствор серной кислоты H2SO4. В каждую пробирку добавьте 2-3 капли лакмуса. Наблюдайте изменения окраски.
2.То же самое проделайте с индикаторами метилоранжем и фенолфталеином. 3.Результаты опыта занесите в таблицу.
Опыт 2. Получение и свойства основного оксида
1.Возьмите в сухую пробирку небольшое количество основной соли – карбоната гидроксомеди (II) (CuOH)2CO3 и нагрейте.
2.Наблюдайте изменения при нагреве соли.
3.Образовавшийся оксид меди (II) разделите на две пробирки. В одну из пробирок добавьте немного дистиллированной воды и взболтайте.
4.В другую пробирку добавьте немного разбавленной серной кислоты H2SO4 и взболтайте.
5. Наблюдайте происходящие изменения.
Опыт 3. Получение и свойства кислотного оксида
1.Налейте в пробирку 2-3 мл насыщенного раствора гидроксида кальция Са(ОН)2 (известковой воды).
2.Пропустите через раствор оксид углерода (IV) СО2, полученный в аппарате Киппа действием соляной кислоты НС1 на мрамор СаСО3.
3.Напишите уравнения реакций получения оксида углерода (IV) и его взаимодействия с
Са(ОН)2.
Опыт 4. Получение кислоты, растворимой в воде
1.Налейте в пробирку 2…3 мл дистиллированной воды, добавьте несколько капель лакмуса и пропустите углекислый газ из аппарата Киппа. Как меняется окраска индикатора?
2.Напишите уравнение реакции. Как диссоциирует угольная кислота в водном растворе? Составьте уравнения ступенчатой диссоциации угольной кислоты. Дайте названия кислотным остаткам.
Опыт 5. Получение нерастворимой в воде кислоты
1.Налейте в пробирку немного раствора молибдата аммония (NH4)2MoO4, добавьте 2…3 капли концентрированной соляной кислоты НСl. Наблюдайте выпадение осадка молибденовой кислоты. Отметьте цвет осадка. Составьте уравнение реакции. 2.Определите степень окисления молибдена в полученной кислоте.
Опыт 6. Получение растворимого в воде основания (щелочи)
1.Поместите в пробирку кусочек оксида кальция (негашеной извести) СаО и прибавьте немного дистиллированной воды.
2.Взболтайте содержимое пробирки, прибавьте 1…3 капли фенолфталеина. Что наблюдается?
3

3.Напишите уравнение реакции. Составьте уравнения ступенчатой диссоциации гидроксида кальция. Дайте названия основным остаткам.
Опыт 7. Получение нерастворимых в воде оснований
1.Налейте в три пробирки по 2 – 3 мл растворов солей: MgCl2, CuSO4, FeCl3. В каждую пробирку добавьте немного раствора гидроксида натрия NaOH.
2.Наблюдайте процессы образования оснований.
Опыт 8. Получение малорастворимых средних солей
a) Налейте в пробирку 1…2 мл раствора нитрата свинца Pb(NO3)2 и добавьте такой же объём разбавленной серной кислоты Н2SO4. Что наблюдается? Напишите уравнение реакции и назовите получившиеся соединения.
б) Налейте в пробирку 1…2 мл раствора хлорида бария ВаCl2 и добавьте такой же объём хромата калия K2CrO4. Что наблюдается? Напишите уравнение реакции и назовите получившиеся соединения.
Опыт 9 Б. Получение и свойства кислой соли
1.Налейте в пробирку 2…3 мл раствора гидроксида кальция (известковой воды) Са(ОН)2. Пропустите оксид углерода (IV) СО2 из аппарата Киппа до растворения осадка карбоната кальция.
2.Наблюдайте образование кислой соли. Напишите уравнение реакции получения кислой соли и дайте ей название.
3.К раствору полученной кислой соли налейте 1-2 мл известковой воды. Что наблюдается? Напишите уравнение реакции. Как кислая соль может быть переведена в среднюю?
Опыт 10. Получение и свойства основной соли
1.Налейте в пробирку 2…3 мл раствора хлорида кобальта (II) CoCl2, добавьте 3…4 капли (не более!) разбавленной щелочи (NaOH), взболтайте и поставьте в штатив. Через 3-5 минут наблюдайте образование зеленого осадка основной соли.
2.Взболтайте раствор с осадком и разлейте в две пробирки. В одну пробирку добавьте 2…3 мл щелочи NaOH. Во вторую пробирку прилейте 1…2 мл соляной кислоты НС1.
Лабораторная работа № 2. Определение эквивалентного числа и молярной массы эквивалентов цинка
Цель работы: изучить метод определения молярной массы эквивалентов цинка по объёму вытесненного им водорода из кислоты.
Приборы и реактивы: прибор для определения молярной массы эквивалентов цинка, термометр, барометр, раствор соляной кислоты 1:1, навеска цинка.
В данной работе молярную массу эквивалентов цинка находят методом вытеснения водорода из кислоты с последующим измерением его объёма. Водород, собираясь над водой, смешивается с её парами, поэтому, чтобы установить давление собственно водорода, необходимо ввести поправку на парциальное давление водяных паров.
Парциальным, называется давление, которое производит компонент газовой смеси,
занимая объём, равный объёму смеси. Давление p H 2 , производимое водородом, вычисляют как разность общего давления смеси газов Р (в данном случае оно равно
атмосферному) и парциального давления паров воды p H 2O , т.е. p H 2 = Р – p H 2O .
4
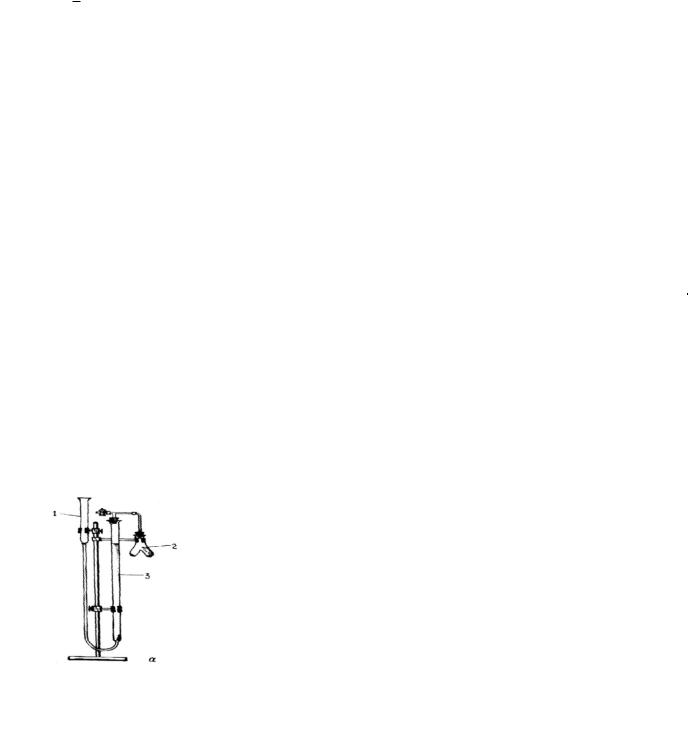
Давление водяных паров является величиной постоянной для данной температуры.
Значения p H 2O в зависимости oт температуры опыта приведены в табл. 1.
Прибор (см. рис. 1.) для определения молярной массы эквивалентов цинка методом вытеснения водорода из кислоты состоит из бюретки (градуированного сосуда ёмкостью 50 мл) (3), пробирки (2) и уравнительного сосуда (воронки) (1), укреплённых на штативе. Верхний конец бюретки и пробирки герметично закрыты пробками и соединены между собой трубочкой. Нижний конец бюретки соединен с воронкой резиновой трубкой длиной 40 – 50 см. Перед проведением опыта прибор проверяют на герметичность. Для этого поднимают воронку над кольцом, служащим креплением её к бюретке и наблюдают изменение уровня воды в бюретке. Если прибор герметичен, то при поднятии воронки уровень воды в бюретке в первый момент немного повысится, но затем становится постоянным.
|
|
|
|
|
|
|
|
|
|
Таблица 1 |
|
|
Давление насыщенного пара воды |
|
H 2O при различных температурах |
||||||||
|
p |
||||||||||
t, C |
Давление |
t, C |
Давление |
t, C |
Давление |
|
|||||
кПа |
мм рт.ст. |
кПа |
|
|
мм рт.ст. |
кПа |
мм рт.ст. |
|
|||
|
|
|
|
|
|
||||||
10 |
1,23 |
9,21 |
18 |
2,06 |
|
15,47 |
24 |
2,98 |
22,37 |
|
|
12 |
1,40 |
10,51 |
19 |
2,20 |
|
16,47 |
25 |
3,17 |
23,75 |
|
|
14 |
1,59 |
11,98 |
20 |
2,34 |
|
17,53 |
26 |
3,36 |
25,20 |
|
|
15 |
1,70 |
12,78 |
21 |
2,49 |
|
18,64 |
27 |
3,65 |
26,73 |
|
|
16 |
1,82 |
13,63 |
22 |
2,64 |
|
|
19,82 |
28 |
3,78 |
28,34 |
|
17 |
1,94 |
14,52 |
23 |
2,81 |
|
|
21,06 |
29 |
4,00 |
30,03 |
|
Рис. 1. Прибор для определения молярной массы эквивалентов цинка
Если же герметичность нарушена, то уровень воды в бюретке все время повышается. В случае нарушения герметичности прибора нужно обратиться к преподавателю. После проверки герметичности прибора можно приступить к выполнению работы.
Отсоедините пробирку и перемещением воронки установите уровень воды в бюретке на нулевом делении (см. по нижнему мениску) или немного ниже, отметив при этом уровень воды по делениям бюретки с точностью до 0,1 мл (V1).
Ход работы:
1.Получите у преподавателя навеску цинка (mZn).
2.Определите температуру в помещении (t), давление (p) по имеющимся в лаборатории приборам.
3.В пробирку налейте разбавленную (1:1) соляную кислоту НСl (до 2/3 её объёма).
4.Навеску цинка положите на сухую сторону пробирки, находящейся в наклонном положении.
5.Плотно закройте пробирку пробкой, присоединив её к прибору, снова проверьте прибор на герметичность и стряхните цинк в кислоту. Наблюдайте выделение водорода и вытеснение воды из бюретки.
5

6. После окончания реакции воду в бюретке и воронке приведите к одинаковому уровню, затем зафиксируйте уровень воды в бюретке (V2).
Расчеты:
1.Вычислите объём водорода (VH2), вытесненного металлом из соляной кислоты, мл.
2.Определите давление насыщенного пара воды p H 2O при температуре опыта (по
табл. |
1). Приведите |
найденный |
объём водорода (VH2) к нормальным условиям по |
|||||||
уравнению: |
Vо |
VH 2 |
P pH 2O 273 |
, |
|
|
|
|||
|
|
T 760 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
где Vo – объём водорода при нормальных условиях, мл; T = (t + 273), K. |
||||||||||
3. |
Вычислите молярную массу эквивалентов цинка по формуле, зная, что объём |
|||||||||
1 молярной массы эквивалентов водорода равен 11200 мл/моль (11,2 л/моль). |
||||||||||
|
|
|
Мэк(Zn)ЭКСП = |
m Zn 11200 |
. |
|
||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
Vo H2 |
|||
4. |
По уравнению реакции взаимодействия цинка с соляной кислотой, определите |
|||||||||
эквивалентное число цинка и теоретическую молярную массу эквивалентов цинка. |
||||||||||
|
|
|
|
Мэк(Zn)ТЕОР = Мэк(Zn) : Z |
||||||
5. |
Сравните полученную молярную массу эквивалентов цинка с теоретической. |
|||||||||
Вычислите относительную ошибку опыта: |
|
|
M эк Zn ТЕОР M эк Zn ЭКСП |
100% . |
||||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
M эк Zn ТЕОР |
|
Лабораторная работа № 3. Приготовление растворов заданной концентрации. Проверка концентрации приготовленного раствора
Цель работы: Привитие навыков приготовления растворов. Знакомство с методами проверки концентрации приготовленного раствора.
Приборы и реактивы: Цилиндры, колба мерная, стаканчик, промывалка, стеклянная палочка, часовое стекло, технохимические весы, соль NaCl, ареометры.
Опыт 1. Приготовление раствора хлорида натрия (NaCl) с заданной массовой долей в процентах. Проверка концентрации приготовленного раствора измерением его плотности.
Этот способ применяется, главным образом, для приготовления растворов солей и щелочей из навески.
1. Получите у преподавателя задание.
Приготовьте 150 граммов раствора NaCl с массовой долей:
Вариант |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
|
(NaCl), % |
6 |
8 |
10 |
12 |
14 |
16 |
|
|
|
|
|
|
|
2. Проверьте концентрацию приготовленного раствора по плотности раствора, измеренной ареометром.
Ход работы:
1.Рассчитайте массу хлорида натрия и массу воды для приготовления раствора заданной концентрации.
2.На технохимических весах с точностью до 0,01 г взвесьте часовое стекло. Затем поместите на него сухую соль NaCl и взвесьте рассчитанную массу NaCl также с точностью до 0,01 г:
6

3.Пересчитайте массу воды, необходимую для приготовления раствора на объём, зная, что плотность воды = 1 г/мл.
4.Отмерьте необходимый объём воды цилиндром на 200 мл.
5.Перенесите соль в стаканчик на 200 мл, затем обмойте туда же часовое стекло водой из цилиндра и перелейте в стаканчик остаток воды.
6.Размешайте раствор стеклянной палочкой и снова вылейте раствор в мерный цилиндр на 100 мл до 80 мл.
7.Определите плотность приготовленного раствора ареометром.
8.Найдите в табл. 2 по плотности массовую долю растворённого NaCl в процентах для приготовленного раствора. В том случае, если измеренное значение плотности окажется между двумя табличными, то массовую долю растворённого хлорида натрия найдите
методом интерполяции. Сравните полученную величину ( ЭКСП) приготовленного раствора с заданной ( теор).
9. Рассчитайте относительную ошибку опыта по формуле: |
|
ТЕОР ЭКСП 100% |
|
|
ТЕОР |
10. Вычислите молярную концентрацию и молярную концентрацию эквивалентов NaCl приготовленного раствора.
Таблица 2
Плотность водных растворов хлорида натрия
, г/мл |
, % |
, г/мл |
, % |
|
|
|
|
1,013 |
2 |
1,086 |
12 |
1,027 |
4 |
1,101 |
14 |
1,041 |
6 |
1,116 |
16 |
1,056 |
8 |
1,132 |
18 |
1,071 |
10 |
1,148 |
20 |
Лабораторная работа № 4. Кинетика химических реакций
Цель работы: Изучить зависимость скорости гомогенной реакции от концентрации реагирующих веществ при постоянной температуре.
Приборы и реактивы: бюретки, химические стаканчики, пробирки, термометр, секундомер, водяная баня, дистиллированная вода, Na2S2О3, H2SО4.
Опыт 1. Зависимость скорости разложения тиосерной кислоты от концентрации реагирующих веществ при постоянной температуре
Опыт выполняется при комнатной температуре. Возьмите три небольших стаканчика. В первый стаканчик налейте из бюретки 10 мл 0,125 М раствора Na2S2О3 и 20 мл Н2О; во второй – 20 мл 0,125 М раствора Na2S2О3 и 10 мл Н2О; в третий – 30 мл 0,125 М раствора Na2S2О3. Затем в пробирку налейте 10 мл 0,25 М раствора H2SО4. Раствор H2SО4 вылейте в первый стаканчик и отметьте время с момента сливания раствора до появления коллоидных частиц серы – помутнения раствора. Подобным образом поступите со вторым и третьим стаканчиками.
7
Уравнение взаимодействия тиосульфата натрия и серной кислоты:
Na2S2О3 + H2SО4 = S + SО2 + Na2SО4 + Н2О.
Данная реакция сложная. Изучение механизма реакции показало, что она протекает через
три последовательные стадии: |
|
1. Na2S2О3 + H2SО4 = H2S2О3 + Na2SО4 |
– быстрая; |
2. Н2S2О3 = S + H2SО3 |
– медленная; |
3. H2SО3 = SО2 + Н2О |
– быстрая. |
Написать кинетическое уравнение для сложной реакции (по лимитирующей стадии). Результаты опыта занести в таблицу.
Средняя скорость реакции разложения тиосерной кислоты в зависимости от её концентрации при постоянной температуре может быть рассчитана как величина обратно пропорциональная времени: = 1/ .
Сделайте вывод: как меняется скорость гомогенной реакции от концентрации реагирующих веществ при постоянной температуре? Рассчитайте во сколько раз изменится скорость реакции (υ2/υ1 и υ3/υ2) при увеличении концентрации тиосульфата натрия в 2 и 3 раза.
Опыт 2. Зависимость скорости разложения тиосерной кислоты от температуры при её постоянной начальной концентрации
Первый вариант опыта проводите при комнатной температуре t °C. Возьмите две пробирки. В первую налейте 5 мл 0,125 М раствора Na2S2О3, во вторую – 5 мл 0,25 М раствора H2SО4. Вылейте содержимое одной пробирки в другую. Отметьте время с момента сливания растворов до начала помутнения раствора. Второй вариант проводите при температуре на 10° выше комнатной (t + 10°). Для этого пробирки с растворами Na2S2О3 и H2SО4, взятыми в том же количестве, что и в варианте первом, поместите в водяную баню, температура которой t + 10°. Выдержите пробирки при этой температуре 5…7 минут. Затем содержимое их слейте вместе и отметьте время с момента сливания растворов до начала помутнения этой смеси. Третий вариант проводите аналогично второму при температуре на 20° выше комнатной t + 200. Для каждого опыта рассчитайте среднюю скорость реакции.
На основании полученных данных постройте график зависимости скорости реакции от температуры, отложив на оси абсцисс значение температуры, а на оси ординат – среднюю скорость реакции. Полученные точки плавно соедините. Сделайте вывод о зависимости скорости реакции от температуры и объясните эту зависимость. Вычислите температурный коэффициент скорости реакции.
Лабораторная работа № 5. Химическое равновесие
Цель работы: Изучить влияние концентрации реагирующих веществ на смещение химического равновесия.
Приборы и реактивы: стаканчик, пробирки. Насыщенные растворы FeCl3 и KCNS. Кристаллические соли FeCl3, KCNS, КСl, дистиллированная вода.
Опыт 1. Влияние концентрации на смещение химического равновесия
FeCl3 + 3 KCNS Fe(CNS)3 + 3 КС1
8
В стаканчик налейте 20 мл дистиллированной воды и добавьте по 2 капли насыщенных растворов FeCl3 и КCNS. Полученный раствор разлейте поровну в четыре пробирки. Первая пробирка используется для контроля. Во вторую пробирку добавьте немного кристаллов соли FeCl3, в третью – KCNS, в четвертую – КС1. Содержимое каждой пробирки перемешайте. Отметьте изменение интенсивности окраски раствора в каждом случае, сравнивая с раствором в контрольной пробирке. Результаты опыта занесите в таблицу.
Сделайте вывод о влиянии концентрации реагирующих веществ на смещение химического равновесия, исходя из принципа Ле Шателье – Брауна.
Лабораторная работа № 6. Реакции обмена в растворах электролитов
Цель работы: Ознакомиться с методами получения слабых кислот и оснований. Изучить влияние введения одноименного иона на смещение равновесия диссоциации слабого электролита. Ознакомиться с различными типами реакций обмена в водных растворах электролитов.
Приборы и реактивы: пробирки, кислоты, основания, соли, индикаторы.
Опыт 1. Получение слабой кислоты и слабого основания
а) В пробирку налейте немного раствора ацетата натрия СН3СООNa. Добавьте несколько капель концентрированной соляной кислоты НСl. Раствор перемешайте стеклянной палочкой и слегка подогрейте. Определите по запаху образование уксусной кислоты. Напишите молекулярное и ионно-молекулярное уравнения реакции. По величине Кд определите, какая из кислот слабая?
Опыт 2. Смещение равновесия диссоциации слабого основания
б) Налейте в пробирку немного раствора аммиака NH4ОH и добавьте две капли раствора фенолфталеина. Какова окраска раствора? Окрашенный раствор разлейте в две пробирки. Одна пробирка используется для контроля, a в другую бросьте несколько кристалликов хлорида аммония NH4Сl. Раствор перемешайте. Сравните окраску раствора
вобеих пробирках. Напишите уравнения диссоциации NH4ОH и NH4Сl. Объясните изменение окраски раствора, пользуясь выражением константы диссоциации гидроксида аммония. Что надо прибавить к раствору слабого основания, чтобы сместить равновесие
всторону образования недиссоциированных молекул?
Опыт 3. Реакции нейтрализации
Налейте в две пробирки по 2…3 мл 2 М раствора едкого натра и добавьте по одной капле фенолфталеина. Почему изменилась окраска раствора? В первую пробирку по каплям добавьте 2 М раствора соляной кислоты, во вторую – 2 М раствор уксусной кислоты до обесцвечивания раствора. Почему растворы обесцветились? Напишите молекулярные и ионно-молекулярные уравнения реакций. Какая из реакций нейтрализации является обратимой, а какая – необратимой и почему? Объясните смещение равновесия для обратимой реакции.
Опыт 4. Условие выпадения осадка
В две пробирки налейте по 2…3 мл 0,005 М раствора нитрата свинца Рb(NО3)2. В одну из них добавьте такой же объём 0,05 М раствора хлорида калия КС1, а в другую – такой же объём 0,05 М раствора йодида калия KI. В какой из пробирок выпал осадок? Объясните полученные результаты, используя произведение концентраций ионов в растворе и
9
значения произведений растворимости для PbC12 и РbI2. Составьте молекулярные и ионно-молекулярные уравнения реакций.
Опыт 5. Влияние величины произведения растворимости электролита на его способность к химическому взаимодействию
Налейте в одну пробирку 2…3 мл раствора сульфата железа (II) FeSO4, а в другую – такой же объём раствора сульфата меди (II) CuSO4. Налейте в обе пробирки по 3…4 мл раствора сульфида натрия Na2S. К полученным осадкам FeS и CuS прилейте немного 2 М раствора соляной кислоты. Какой из осадков растворился?
Опыт 6. Необратимая реакция обмена, идущая с образованием газообразного продукта реакции
В две пробирки налейте по 2…3 мл раствора соды Na2CO3. Проверьте наличие в растворе
иона CO32 . Для этого в одну пробирку добавьте немного раствора хлорида кальция CaCl2. Какое вещество выпало в осадок? Напишите молекулярное и ионно-молекулярное уравнения реакции. Во вторую пробирку налейте немного разбавленного раствора соляной кислоты и наблюдайте выделение газа. Напишите молекулярное и ионномолекулярное уравнения реакции. Рассчитайте G0 реакции. Подогрейте слегка пробирку, дожидаясь конца выделения газа, и добавьте немного раствора хлорида кальция. Почему не выпадает осадок СаСО3?
Опыт 7. Обратимая реакция обмена, идущая с образованием менее растворимого соединения, чем исходное
В пробирку налейте немного раствора нитрата серебра AgNO3 и добавьте раствор хлорида натрия NaCl. Какое вещество выпало в осадок? Напишите молекулярное и ионно-молекулярное уравнения реакции. Затем в ту же пробирку налейте немного раствора сульфида натрия Na2S. Почему цвет осадка изменился? Напишите молекулярное и ионно-молекулярное уравнения реакции. На основании значений ПР объясните в каком направлении смещено равновесие. Рассчитайте G0 реакции.
Лабораторная работа № 7. Гидролиз солей
Цель работы: Определить характер среды при гидролизе солей. Исследовать влияние температуры на гидролиз солей.
Приборы и реактивы: Пробирки, дистиллированная вода, индикаторы, кристаллические соли 1 вариант: Na2CO3; CrCl3; (NH4)3PO4; NaCl,
2 вариант: Al2(SO4)3; Na3PO4; СН3СООNН4; КС1, 3 вар.: SnCl2; Na2CO3; (NH4)3PO4; NaCl, 4 вариант: Na3PO4;CuSO4; СН3СООNН4; KCl, 5: СН3СООNа; (NH4)3PO4; Al2(SO4)3; NaCl, 6 вариант: Na3PO4; SnCl2; СН3СООNН4; KCl.
Опыт 1. Гидролиз средних солей и определение характера среды раствора этих солей
1.Возьмите четыре пробирки. В каждую пробирку налейте дистиллированной воды. Добавьте соответствующий индикатор.
2.В каждую пробирку насыпьте небольшое количество соли (несколько кристалликов). 3.Установите, как изменится окраска индикаторов в растворах солей. Определите характер среды индикаторами: фенолфталеином - щелочную, лакмусом - кислую. 4.Какие соли подвергаются гидролизу?
10
