
- •Южно-Уральский государственный университет
- •Оглавление
- •Введение
- •Лабораторная работа № 1 определение основных показателей качества воды
- •Определение физических показателей воды:
- •1. Определение запаха
- •2. Определение цветности
- •3. Определение прозрачности
- •Определение химических показателей воды
- •1. Активная реакция воды (рН)
- •2. Общая щелочность воды
- •3. Общая жесткость воды
- •4. Окисляемость воды
- •5. Свободная углекислота
- •6. Определение содержания общего железа
- •7. Общая кислотность сточных вод
- •8. Определение содержания ионов хлора Cl–
- •10. Определение иона азотистой кислоты no2– (нитриты)
- •Лабораторная работа № 2 коагулирование природных вод
- •Лабораторная работа № 3 нейтрализация и обезжелезивание кислых производственных сточных вод
- •Лабораторная работа № 4 умягчение воды методом известкования и катионного обмена Умягчение воды методом известкования
- •Умягчение воды методом обмена ионов
- •Лабораторная работа №5 стабилизация воды с повышенной карбонатной жесткостью подкислением
- •Лабораторная работа №6 обеззараживание воды ионами серебра и методом хлорирования Обеззараживание воды ионами серебра
- •Хлорирование воды
- •Приложение
- •Библиографический список
Лабораторная работа № 3 нейтрализация и обезжелезивание кислых производственных сточных вод
На предприятиях черной металлургии, на машиностроительных и металлообрабатывающих заводах широко используется химическая обработка металлов кислотами в процессе травления. В результате образуются кислые железосодержащие стоки, имеющие свободные кислоты, (преимущественно серную, иногда смесь кислот) и соли железа (в основном FeSO4). Сброс таких стоков в водоемы без очистки вызывает обескислороживание воды. Соли железа в результате гидролиза и окисления образуют осадки ржаво-рыжего цвета. При большом загрязнении в водоемах полностью исчезает органическая жизнь, вода становится непригодной для водоснабжения, В настоящее время железосодержащие кислые стоки очищают либо для повторного использования в производстве, либо для последующего сброса в водоемы. Наиболее распространенным способом очистки таких сточных вод является известкование. При поступлении раствора известкового молока в стоки происходит нейтрализация свободных кислот. В частности, для серной кислоты, по уравнению
![]() .
.
Присутствующее в стоках сернокислое железо диссоциирует
![]() ,
,
а ионы железа подвергаются гидролизу
![]()
Чтобы обеспечить полный гидролиз и выделение всего Fe(OH)2 необходимо повысить pH нейтрализуемых стоков до 8,5–9,0. При более низких значениях pH часть солей железа не подвергается гидролизу и остается в растворенном состоянии. Коагуляция Fe(OH)2 достигается повышением pH сточных вод до 3,5–9,0 путем добавления известкового молока. Образующиеся хлопья гидрата закиси железа Fe(OH)2 выпадают в осадок. При достаточно длительном контакте сточных вод с кислородом воздуха гидрат закиси Fe(QH)2 переходит в гидрат окиси Fe(OH)3.
![]() .
.
Приближенный расчет дозы извести для нейтрализации железосодержащих кислых стоков производится по формуле:
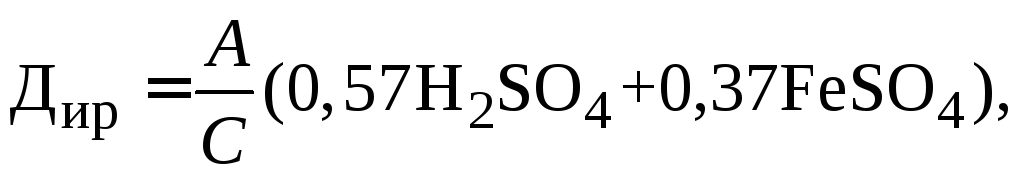 мг/л, (3.1)
мг/л, (3.1)
где А – коэффициент запаса расхода извести по сравнению с теоретическим. Этот коэффициент должен обеспечить такой, избыток извести, чтобы pH при нейтрализации было в пределах 8,5–9,0 (обычно А =1,2…1,4); С – содержание СaO в продажной извести. Эту дозу уточняют в процессе эксплуатации, руководствуясь данными контрольных анализов; коэффициенты (0,57) и (0,37) определяют количество весовых частей извести, необходимых нейтрализации одной весовой части. Н2SО4 и FeSО4 соответственно (по стехеометрическому расчету); H2SO4 – количество серной кислоты и FeSO4 – железного купороса в пересчете по анализу стоков.
Оптимальную дозу извести для нейтрализации и обезжелезивания производственных сточных вод находят экспериментальным путем. Для выполнения работы студенту выдается исходная проба сточных вод.
Порядок проведения лабораторной работы
1. Определить качественные показатели исходных стоков:
— активную реакцию pH;
— содержание железа, мг/л;
— общую кислотность, мг экв /л,
Методика определения показателей приведена в лабораторной работе № 1.
2. Провести пробное известкование данной сточной воды введением раствора известкового молока, определить, его оптимальную дозу и эффект обезжелезивания и нейтрализации.
Пробную нейтрализацию проводят в пяти цилиндрах введением расчетной дозы извести, определяемой по формуле (3.1). Для уточнения расчетной дозы берутся поправочные коэффициенты от 0,8 до 1,2. В каждый цилиндр с водой добавляют известковое молоко в соответствии с указанными коэффициентами. Например, в 1-й цилиндр ДИ=0,8·ДИР; во 2-й ДИ=0,9·ДИР; в 3-й ДИ=1,0·ДИР и т.д. Воду в цилиндрах перемешивают специальной мешалкой и оставляют в спокойном состоянии на 30 мин. Через 30 мин замечают цилиндр, в котором происходит наилучшее выпадение хлопьев. Каждые 10 мин фиксируют изменение состояния обрабатываемой воды (хлопьеобразование, уровень осаждающейся взвеси, состояние осветленного слоя воды и высоту уплотнения осадка). Все данные сводят в табл. 3.1.
Наименьшая доза реагента, при которой произошло наилучшее выпадение осадков и их уплотнение при pH 9, считается оптимальной.
Таблица 3.1
|
Наименование |
Номера цилиндров | ||||
|
1 |
2 |
3 |
4 |
5 | |
|
Доза извести, мг/л |
|
|
|
|
|
|
Количество раствора известкового молока, соответствующее дозе, мл/л |
|
|
|
|
|
|
То же в пересчете на 0,5л пробы |
|
|
|
|
|
|
Высота осадка в цилиндре через 5 мин |
|
|
|
|
|
|
через 10 мин |
|
|
|
|
|
|
через 15 мин |
|
|
|
|
|
|
через 20 мин |
|
|
|
|
|
|
через 25 мин |
|
|
|
|
|
|
через 30 мин |
|
|
|
|
|
Примечание: Пример перерасчета дозы реагента на соответствующий объем данной концентрации приведен в Приложении.
3. Определить качественные показатели сточной воды при оптимальной дозе реагента путем фильтрования осветленного слоя вод через бумажный фильтр:
— активную реакцию pH;
— общую щелочность, мг-экв /л;
— общую жесткость, мг-экв/л;
— содержание железа, мг/л;
Обосновать изменение отдельных показателей качества сточной воды.
4. Составить отчет о работе, заполнив табл.3.2 и начертить график уплотнения осадка во времени во всех пяти цилиндрах
Таблица 3.2
|
Наименование воды |
Наименование качественных показателей | ||||
|
Кислотность, мг-экв/л |
Содержание железа общего, мг/л |
Щелочность, мг-экв/л |
Жесткость, мг-экв/л |
рН | |
|
Исходная сточная |
|
|
|
|
|
|
После нейтрализации при ДИ (опт), мг/л |
|
|
|
|
|
5. Выполнить задание к лабораторной работе по нейтрализации и обезжелезиванию кислых стоков.
На заводе ежечасно образуется 500 м3 отработанных кислых стоков. Их загрязняют серная кислота и сульфат железа. После нейтрализации и обезжелезивания этих стоков воду разрешается спускать в реку.
Необходимо определить:
1. Оптимальную дозу извести для обработки данной сточной воды, мг/л;
2. Эффект очистки сточной воды при данной дозе, %;
3. Суточный расход технической извести, т;
4. Суточный расход 5%-ного раствора известкового молока, м3/сут.
