
- •Южно-Уральский государственный университет
- •Оглавление
- •Введение
- •Лабораторная работа № 1 определение основных показателей качества воды
- •Определение физических показателей воды:
- •1. Определение запаха
- •2. Определение цветности
- •3. Определение прозрачности
- •Определение химических показателей воды
- •1. Активная реакция воды (рН)
- •2. Общая щелочность воды
- •3. Общая жесткость воды
- •4. Окисляемость воды
- •5. Свободная углекислота
- •6. Определение содержания общего железа
- •7. Общая кислотность сточных вод
- •8. Определение содержания ионов хлора Cl–
- •10. Определение иона азотистой кислоты no2– (нитриты)
- •Лабораторная работа № 2 коагулирование природных вод
- •Лабораторная работа № 3 нейтрализация и обезжелезивание кислых производственных сточных вод
- •Лабораторная работа № 4 умягчение воды методом известкования и катионного обмена Умягчение воды методом известкования
- •Умягчение воды методом обмена ионов
- •Лабораторная работа №5 стабилизация воды с повышенной карбонатной жесткостью подкислением
- •Лабораторная работа №6 обеззараживание воды ионами серебра и методом хлорирования Обеззараживание воды ионами серебра
- •Хлорирование воды
- •Приложение
- •Библиографический список
5. Свободная углекислота
Накопление свободной углекислоты в воде открытых водоемов указывает на неблагоприятные условия течения окислительных процессов, слабую аэрацию и недостаточный фотосинтез. Такая вода обладает высокой агрессивностью.
Определение свободной углекислоты производится путем титрования её едким натром в присутствии фенолфталеина.
![]() .
.
Ход определения. К 100 мл исследуемой воды прибавляют 3–5 капель фенолфталеина и титруют 0,02н – раствором NaOH.
Конец реакции определяется получением раствора с устойчивой бледно-розовой окраской, соответствующей стандартному раствору. Количество растворенной углекислоты вычисляется по формуле:
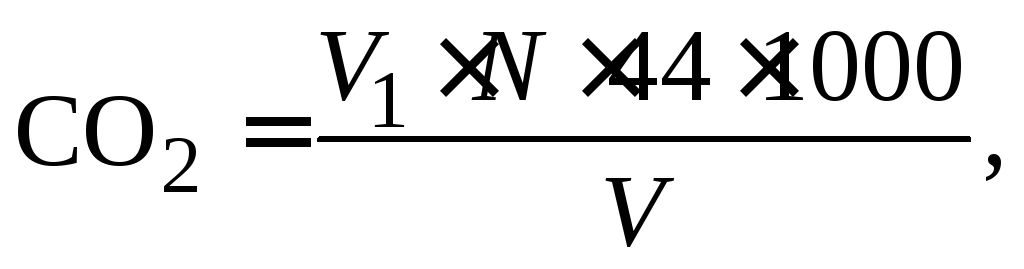 мг/л, (1.6)
мг/л, (1.6)
где V1 – объем раствора NaOH, идущий на титрование, мл; N – нормальность раствора; V – объем воды, взятой для титрования, мл.
6. Определение содержания общего железа
а) При малых концентрациях железа (для природных вод)
В природных водах концентрация железа зависит от происхождения источника водоснабжения. В воды поверхностных источников железо попадает чаще всего с промышленными сточными водами. Наличие железа в подземных источниках обусловлено вымыванием из пород, с которыми вода соприкасается. Содержание железа в природных водах, чаще всего не превышает 20–30 мг/л.
Ход определения. В мерную колбу на 250 мл наливают 100 мл исследуемой воды, добавляют 2 мл концентрированной соляной кислоты HCl и несколько кристаллов персульфата аммония для перевода Fe2+ в Fe3+. Содержимое колбочки хорошо перемешивают и затем добавляют 2 мл 50% раствора роданистого аммония. Полученную окраску сравнивают с эталонными растворами, содержащими железо от 0,1 до 2 мг/л.
Для колориметрирования необходимо взять колбу с эталонным раствором, соответствующую нижнему пределу окраски, перенести в один из цилиндров Генера, а в другой цилиндр налить исследуемый раствор. Окраску сравниваемых растворов уравнять путем слива исследуемой воды. Содержание общего железа вычисляют по формуле:
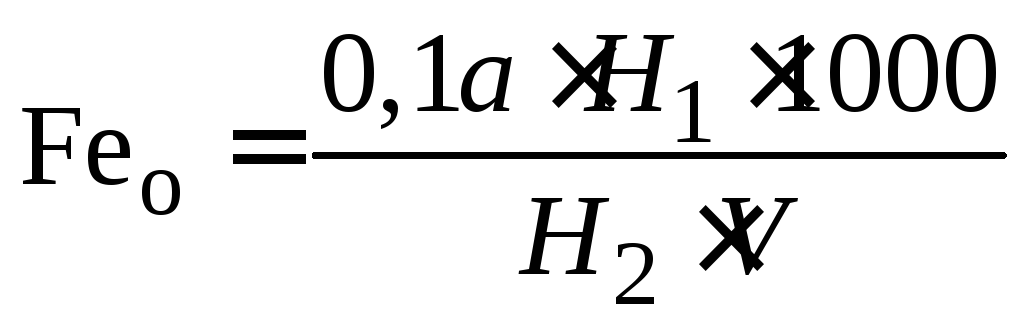 ,
мг/л, (1.7)
,
мг/л, (1.7)
где 0,1а – концентрация железа в эталонном растворе, мг/л; Н1 – высота столба в цилиндре Генера с эталонным раствором, мл; Н2 – высота столба в цилиндре Генера с испытуемой водой, мл; V – объем воды, взятой для определения.
б) Определение содержания общего железа при высоких концентрациях (для производственных вод)
В промышленные сточные воды железо попадает в результате процессов травления металла сильными кислотами. Концентрация железа (по иону железа) в этих водах колеблется в пределах 0,4–2 г/л. В этих водах железо встречается как в форме двухвалентного железа (закисного железа), так и в виде трехвалентного (окисного) железа. Чаще всего содержание общего железа в воде Feo определяется биохроматным методом.
Сущность определения содержания железа в сточных водах бихроматным методом:
Метод основан на взаимодействии бихромата калия с двухвалентным железом
![]() .
.
Все железо, находящееся в растворе, восстанавливается при нагреве с металлическим цинком, а затем титруется бихроматом калия. Конец реакции определяют по индикатору дифениламина, который дает сине-фиолетовую окраску при взаимодействии с бихроматом калия после связывания с железом.
Содержание железа рассчитывается по формуле:
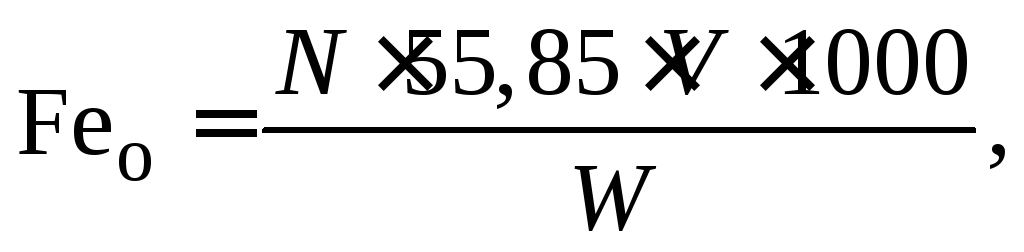 мг/л, (1.8)
мг/л, (1.8)
где V – количество раствора бихромата калия, затраченного на титрование, мл;
W – объем исследуемой воды, мл; N – нормальность раствора бихромата калия.
Ход определения. Отбирают 50–100 мл исследуемой воды, прибавляют 1 мл концентрированной HCl, бросают 2–3 гранулы цинка и кипятят до обесцвечивания. После остывания приливают 25 мл смеси кислот, добавляют 2–3 капли индикатора дифениламина и тут же титруют 0,1 н раствором бихромата калия до перехода окраски от светло-зеленой в сине-фиолетовую. Содержимое колбы во время титрования энергично размешивают вращениями.
