
Л_р № 16 олово
.docФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Восточно-Сибирский государственный технологический университет
Лабораторная работа
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОТЫ
КРИСТАЛЛИЗАЦИИ И ИЗМЕНЕНИЯ ЭНТРОПИИ
ПРИ ОХЛАЖДЕНИИ ОЛОВА.
Составители: Санеев Э.Л.
Шелкунова З.В.
Улан-Удэ, 2007 г.
Теоретические основы работы
Кристаллизация – процесс перехода вещества из жидкого состояния в твердое. Процесс кристаллизации связан с выделением количества теплоты, равного теплоте плавления. Для химически чистых веществ, процесс кристаллизации протекает при постоянной температуре, равной температуре плавления.
Применим закон сохранения энергии к квазистатическому процессу охлаждения твердого олова после кристаллизации:
![]() (1)
(1)
Здесь
![]() <0
– количество теплоты, отданное телом
среде при его охлаждении за время
<0
– количество теплоты, отданное телом
среде при его охлаждении за время
![]() ;
;
![]() >0
– количество теплоты, полученное
окружающей средой через поверхность
ампулы площадью
>0
– количество теплоты, полученное
окружающей средой через поверхность
ампулы площадью
![]() за время
за время
![]() .
В (1) с0, са
– удельные теплоемкости олова и материалы
ампулы, М0, Ма
– массы олова и ампулы; Т – температура
твердого олова; Тср
– температура окружающей среды; α –
коэффициент теплоотдачи с поверхности
ампулы в окружающую среду. В дальнейшем
считаем, что значение α в течение всего
опыта постоянно.
.
В (1) с0, са
– удельные теплоемкости олова и материалы
ампулы, М0, Ма
– массы олова и ампулы; Т – температура
твердого олова; Тср
– температура окружающей среды; α –
коэффициент теплоотдачи с поверхности
ампулы в окружающую среду. В дальнейшем
считаем, что значение α в течение всего
опыта постоянно.
Применяя закон сохранения энергии к процессу кристаллизации олова, можно получить уравнение
![]() (2)
(2)
Здесь Q
= λкрМ0
– количество теплоты, отданное оловом
при его кристаллизации за время
кристаллизации
![]() .
Так как тепло отдано окружающей среде,
то Q
< 0. Второй член суммы в (2):
.
Так как тепло отдано окружающей среде,
то Q
< 0. Второй член суммы в (2):
![]() -
количество теплоты, полученное окружающей
средой через поверхность ампулы за
время кристаллизации.
-
количество теплоты, полученное окружающей
средой через поверхность ампулы за
время кристаллизации.
Из соотношений (1) и (2) следует
![]() (3)
(3)
В принятой модели процесс охлаждения твердого олова от точки полной кристаллизации описывается уравнением (1). Решение этого уравнения имеет вид
![]() ,
(4)
,
(4)
где θ = Т – Тср;
θкр
= Ткр-
Тср;
![]() .
.
Коэффициент m называют темпом охлаждения. Он характеризует относительную скорость изменения температуры тела. Темп охлаждения можно определить из линейной зависимости, полученной логарифмированием функции (4):
![]() (5)
(5)
Следовательно:
![]() (6)
(6)
Энтропия – функция состояния термодинамической системы. Изменение энтропии в равновесном процессе равно отношению количества теплоты, сообщенного системе, к термодинамической температуре системы:
![]() (7)
(7)
Энтропия определяется с точностью до постоянной. Разность энтропий в двух состояниях при обратимом процессе равна
![]() (8)
(8)
Здесь δQ – элементарное количество теплоты, полученное или отданное при бесконечно малом изменении параметров термодинамической системы; Т – температура. В процессе кристаллизации олово отдает тепло окружающей среде при Т = соnst. При этом количество теплоты, отданное окружающей среде
Q = λкрМ0 (9)
Здесь М0 – масса олова. Так как Q – количество теплоты, отданное окружающей среде, то Q < 0.
Из (8) и (9) следует, что
![]() (10)
(10)
Следовательно, для определения
![]() необходимо измерить температуру
кристаллизации Ткр,
время кристаллизации, Δτк
а также вычислить производную
необходимо измерить температуру
кристаллизации Ткр,
время кристаллизации, Δτк
а также вычислить производную
![]() функции Т =
функции Т =
![]() во время охлаждения твердого олова
после полной кристаллизации. Эти величины
можно найти, измеряя температуру олова
в процессе охлаждения от полного расплава
до температуры остывшего олова Т0
в конце опыта.
во время охлаждения твердого олова
после полной кристаллизации. Эти величины
можно найти, измеряя температуру олова
в процессе охлаждения от полного расплава
до температуры остывшего олова Т0
в конце опыта.
Реальный процесс охлаждения сопровождается явлениями, вносящими погрешность в определение λкр. Главными источниками погрешности являются
- отклонение процесса охлаждения от квазистатического;
- изменения температуры окружающей среды.
Эти процессы приводят к
методической погрешности определения
λкр,
не превышающей
![]() 10%.
10%.
Описание экспериментальной установки
На рисунке 1 изображена принципиальная схема установки. В плавильную печь 1 с помощью подъемного устройства 2 опускается ампула с оловом 3, в которой размещена ХК – термопара 4, соединенная с первым каналом измерителя температуры 5 (2ТРМО). По окончании плавления всей массы олова ампула поднимается из печи и подъемное устройство стопорится винтом 7. Термопара 6, измеряющая температуру воздуха вблизи поднятой из печи ампулы, соединена со вторым каналом измерителя температуры. Для ускорения охлаждения ампулы используется вентилятор 8.
На рисунке 2 изображена передняя панель установки, на которой размещено подъемное устройство 7, регулятор температуры 10, измеритель температуры 5, тумблер 9 включения измерителя температуры, тумблер 11 «СЕТЬ», тумблер включения вентилятора 15, тумблер включения питания электропечи 13 «НАГРЕВ».


Рис.1.
Порядок выполнения работы
Цель работы: Определение изменения энтропии при фазовом переходе первого рода на примере кристаллизации олова из расплава при его охлаждении. Определение теплоты кристаллизации олова из закона сохранения энергии.
Приборы:
|
Приборы |
Предел измерения |
Точность |
Погрешность |
|
Измеритель температуры 2ТРМО |
|
|
|
|
Секундомер |
|
|
|
Принадлежности:
- ампула с оловом (масса ампулы Ма – 100 г., масса олова – Мо – 90 г., Са = 380 Дж/кг*К, С0 = 230 Дж/кг*К);
- хром-копелевая термотара;
- термопара для измерения температуры воздуха;
- вентилятор;
- плавильная печь.
Измеряемые величины и расчетные соотношения:
![]() - разность энтропий в двух состояниях;
- разность энтропий в двух состояниях;
Т – температура твердого олова;
Ткр – температура кристаллизации олова;
Тср – температура окружающей среды;
m – темп охлаждения твердого олова;
λкр – удельная теплота кристаллизации;
Со, Са – удельные теплоемкости олова и материала ампулы;
Мо, Ма – массы олова и ампулы
τ, с – время;
Δτкр – время кристаллизации.
![]() ,
где θкр
= Ткр
– Тср,
θ = Т – Ткр
(11)
,
где θкр
= Ткр
– Тср,
θ = Т – Ткр
(11)
![]() (12)
(12)
![]() (13)
(13)
Ход работы
1. С помощью подъёмного устройства 7 опустить ампулу с оловом 3 в электрическую печь 1.
2. Включить питание установки тумблером 11.
3. Включить питание печи тумблером 13 «НАГРЕВ». Ручку регулятора температуры повернуть по часовой стрелке до её среднего положения (жёлтая метка 14).
4. Тумблером 9 включить измеритель температуры.
5. Следить за показаниями первого канала измерителя температуры. При достижении точки плавления олова ( tпл = 232 °C ) выключить питание электропечи.
6. При достижении температуры 2400 С поднять ампулу из печи и зафиксировать её крепёжным винтом подъёмного устройства.
7. Включить секундомер (или секундную стрелку любого таймера) и произвести измерения температуры олова при его охлаждении до полной кристаллизации и
далее до t - 100 °С через равные промежутки времени (15 сек.).
8. Данные занести в таблицу.
9. а) Построить график зависимости 1:

б) Построить график зависимости 2:

Определить по графикам Δτкр, Ткр, Т.
10. Произвести расчеты λкр и ΔS по формулам (11) и (13).
11.Расчитать погрешность определения удельной теплоты кристаллизации и изменения энтропии методом наименьших квадратов.
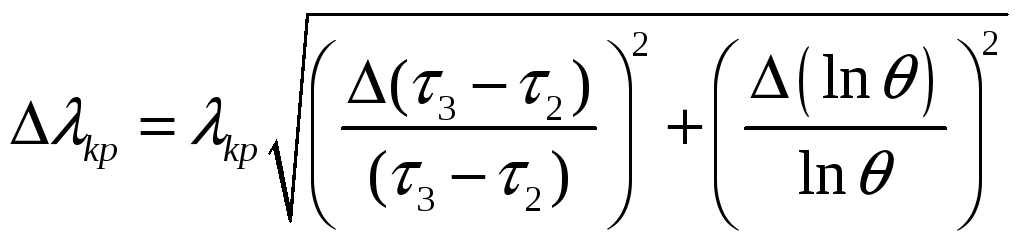

(ΔM0 = 0,005 кг)
12. Записать окончательные результаты:
λкр
= λкр
![]() Δλкр
Δλкр
ΔS
= ΔS
![]() ΔΔS
ΔΔS
Контрольные вопросы:
-
Что называется: кристаллизацией, удельной теплотой кристаллизации.
-
Как изменяется температура вещества от начала процесса кристаллизации до его окончания?
-
Как изменяется внутренняя энергия вещества при его переходе из жидкого состояния в твердое?
-
Сформулируйте второе начало термодинамики. Объясните, что называется энтропией. Каковы свойства этой функции состояния термодинамической системы? В каких единицах измеряется энтропия?
-
Чему равно изменение температуры при переходе вещества из одного агрегатного состояния в другое?
Литература.
-
И.В.Савельев. Курс физики, М, 2000 г., т.1.
-
Т.И.Трофимова. Курс физики, М., 1990 г.
-
Е.М.Гершензон и др. Молекулярная физика, М, 2000 г.
