
Способы выражения концентрации растворов.
1) Массовая доля раствора ω (х). Выражается отношением массы растворенного вещества m(х) к массе раствора.
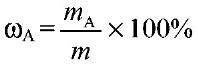
Является величиной безразмерной или выражается в процентах:
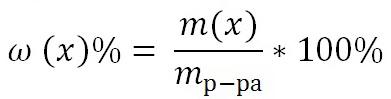
Например, 15%-ный раствор: массовая доля ω (х) = 0,15
2) Молярная концентрация раствора С(х). Выражается отношением количества растворенного вещества n(x) к объему раствора, выраженному в литрах.
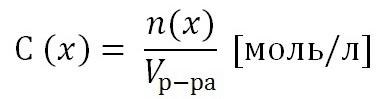
Т.к. количество вещества n(x) выражается отношением массы вещества m(x) к его молярной массе M(x), то молярную концентрацию раствора удобно выразить как
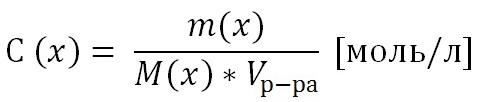
25) Растворы. Растворимость твердых, жидких и газообразных веществ. Термодинамика процесса растворения.
Растворимость твердых веществ всегда ограничена. В данном объеме жидкости может растворяться строго определенное количество твердого вещества, т.е. растворение протекает до достижения концентрации, при которой устанавливается равновесие между растворением и кристаллизацией вещества из раствора. Такой раствор называется насыщенным.
Концентрация насыщенного раствора при данной температуре величина постоянная и характеризует растворимость твердого вещества. По растворимости все вещества можно разделить на:
– растворимые (соли щелочных металлов и аммония, сахароза, фруктоза и др.) – в 100 г воды при 20 оС растворяется более 10 г вещества;
– малорастворимые (гидроксид кальция, хлорид свинца, сульфат серебра и др.) – в 100 г воды при 20 оС растворяется менее 1 г вещества;
– практически нерастворимые (сульфат бария, карбонат кальция, гидроксид железа) – в 100 г воды при 20 оС растворяется менее 0,01 г вещества.
Полностью нерастворимых веществ не бывает.
Как правило, растворение твердых тел сопровождается поглощением теплоты (т.к. необходимо затратить энергию на разрыв связей в кристалле). Поэтому при повышении температуры растворимость возрастает. Но может быть и наоборот (растворение щелочей, солей магния и алюминия и др.). Зависимость растворения от температуры принято изображать кривыми растворимости.
Растворимость газов зависит от температуры и давления, растворимость твердых и жидких веществ от давления практически не зависит.
Термодинамика
процессов растворения
Растворение
– это физико-химический процесс. При
растворении идут как физические процессы
(диффузия), так и химические (сольватация
– образование химических связей между
частицами растворяемого вещества и
растворителя). Если растворителем
является вода, то процесс называется
гидратацией.
Согласно 2-му закону
термодинамики при р=const и Т=const вещества
самопроизвольно будут растворяться,
если энергия Гиббса системы будет при
этом понижаться, т.е.
![]() G
= (
G
= (![]() H
– T
H
– T![]() S)
< 0.
Величина
S)
< 0.
Величина
![]() H
называется энтальпийным фактором
растворения.
Величина T
H
называется энтальпийным фактором
растворения.
Величина T![]() S
называется энтропийным фактором
растворения.
При растворении твердых
и жидких веществ энтропия системы обычно
возрастает (
S
называется энтропийным фактором
растворения.
При растворении твердых
и жидких веществ энтропия системы обычно
возрастает (![]() S
>0); при растворении газов энтропия
системы обычно уменьшается (
S
>0); при растворении газов энтропия
системы обычно уменьшается (![]() S
<0).
Энтальпия при растворении может
как увеличиваться (NaCl), так и уменьшаться
(KOH).
Таким образом, образование
растворов (в отличие от механических
смесей) сопровождается изменением
энтальпии, энтропии и объёма системы.
S
<0).
Энтальпия при растворении может
как увеличиваться (NaCl), так и уменьшаться
(KOH).
Таким образом, образование
растворов (в отличие от механических
смесей) сопровождается изменением
энтальпии, энтропии и объёма системы.
26) Растворы. Коллигативные свойства растворов неэлектролитов. Осмос. Закон Вант-Гоффа.
Коллигативные свойства растворов —— это те их свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
Коллигативные свойства растворов электролитов
В растворах электролитов число частиц увеличивается за счет диссоциации молекул растворенного вещества. Представим, что в раствор введено N молекул растворенного вещества, способного распадаться на р ионов, а степень диссоциации растворенного вещества α. Тогда число молекул, распавшихся на ионы будет N α, а число образовавшихся ионов – N α р. Число нераспавшихся молекул составит N - N α или N (1- α).
Общее число частиц в растворе электролита будет суммой числа молекул и числа ионов:
Nэл-та = Nαр + N (1- α) = N (αр + (1- α)) = N (α (р - 1) + 1)
Если бы диссоциации не произошло (неэлектролит), то число введенных в раствор частиц осталось бы неизменным, равным N (для неэлектролита Nнеэл-та).
Отношение числа частиц растворенного вещества в растворе электролита к числу частиц недиссоциирующего растворенного вещества составляет
I
=
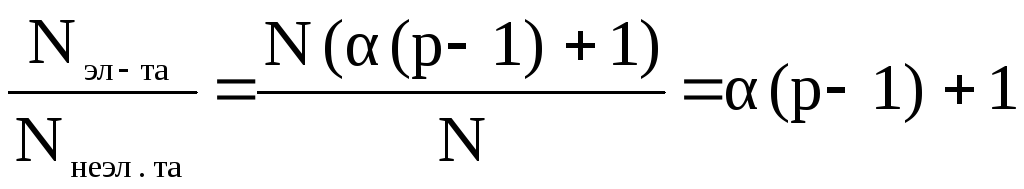
Такую же величину составляет отношение величин описывающих коллигативные свойства растворов, измеренных для электролитов, к величинам, рассчитанным для неэлектролитов.
Эту величину i Вент-Гофф назвал изотоническим коэффициентом.
i
=
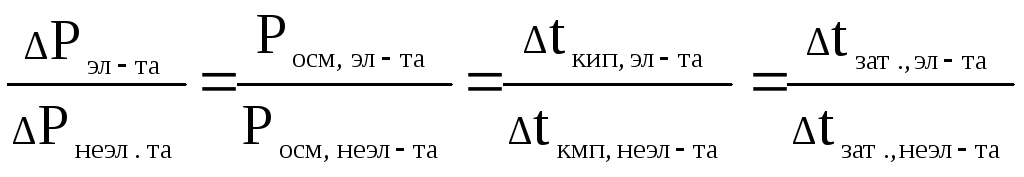
Таким образом, величина коллигативного свойства для растворов электролитов в i раз больше чем для соответствующего количества растворенного неэлектролита.
Осмос
Осмосом называют диффузию растворителя через полупроницаемую перегородку, разделяющую раствор и чистый растворитель или два раствора различной концентрации.
Осмотическое давление (Росм.) – это давление , которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным о него полупроницаемой перегородкой.
Теоретическое выражение для осмотического давления получил Вант-Гофф, рассматривавший поведение частиц вещества в растворе аналогично поведению молекул газа, занимающего одинаковый с раствором объем.
Осмотическое давление
Если привести в соприкосновение два раствора с разными концентрациями, то молекулы будут диффундировать преимущественно в том направлении, где их концентрация ниже. Двусторонняя диффузия приведет к выравниванию концентраций.
Диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя.
Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом.
Значение осмоса
Осмос играет важную роль в биологических процессах, обеспечивая поступление воды в клетки.
Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного – гипотоническим.
Гипертонические растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, т.к. вызывают удаление воды из микроорганизмов.
Закон Вант-Гоффа
Осмотическое давление разбавленного раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, занимая в виде газа при данной температуре объем, равный объему раствора.
Росм = См ∙ R ∙ Т.
Осмотическое давление прямо пропорционально молярной концентрации раствора и температуре.
Закон Вант-Гоффа позволяет вычислить осмотическое давление раствора, если известны его концентрации и температура. Основанием для расчетов могут служить следующие рассуждения.
Если 1 моль газа заключить в сосуд емкостью 22,4 л, то при 0оС давление окажется равным 1 атм. То же количество газа, помещенное в сосуд емкостью 1 л, окажет при той же температуре давление в 22,4 раза больше, то есть 22,4 атм. Переходя к осмотическому давлению, рассуждаем таким же образом. Если 1 моль растворенного вещества находится в22,4 л раствора, то осмотическое давление такого раствора при 0оС равно 1 атм. То же количество растворенного вещества, находясь в 1 л раствора, создает осмотическое давление 1 л одномолярного раствора неэлектролита при 0оС составляет 22,4 атм.
|
Состояние вещества |
Количество вещества |
Т |
V |
следова-тельно |
давление |
|
газ раствор |
1 моль 1 моль |
273 К 273 К |
22,4 л 1 л |
=> => |
Р = 1 атм Росм= 22,4 атм |
27) Растворы. Коллигативные свойства растворов неэлектролитов. Закон Рауля и следствие из него.
Коллигативные свойства растворов —— это те их свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
Коллигативные свойства растворов электролитов
В растворах электролитов число частиц увеличивается за счет диссоциации молекул растворенного вещества. Представим, что в раствор введено N молекул растворенного вещества, способного распадаться на р ионов, а степень диссоциации растворенного вещества α. Тогда число молекул, распавшихся на ионы будет N α, а число образовавшихся ионов – N α р. Число нераспавшихся молекул составит N - N α или N (1- α).
Общее число частиц в растворе электролита будет суммой числа молекул и числа ионов:
Nэл-та = Nαр + N (1- α) = N (αр + (1- α)) = N (α (р - 1) + 1)
Если бы диссоциации не произошло (неэлектролит), то число введенных в раствор частиц осталось бы неизменным, равным N (для неэлектролита Nнеэл-та).
Отношение числа частиц растворенного вещества в растворе электролита к числу частиц недиссоциирующего растворенного вещества составляет
I
=

Такую же величину составляет отношение величин описывающих коллигативные свойства растворов, измеренных для электролитов, к величинам, рассчитанным для неэлектролитов.
Эту величину i Вент-Гофф назвал изотоническим коэффициентом.
i
=

Таким образом, величина коллигативного свойства для растворов электролитов в i раз больше чем для соответствующего количества растворенного неэлектролита.
Закон Рауля.
Относительное
понижение упругости пара растворителя
над раствором равно мольной доле
растворенного нелетучего компонента.

барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
Δtкип=Э x Смоляльн,
где Э – эбуллиоскопическая константа, +0,52.
Δtзам=К x Смоляльн,
где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа
– разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа
– разница между температурой замерзания раствора и температурой чистого растворителя.
Для
решения задач об этих константах
необходимо знать массу растворенного
вещества и массу раствора. Например,
масса хлороформа (трихлорметан CHCl3)
рассчитывается по формуле:

где m 1 – масса растворенного вещества;
m 2 – масса растворителя;
Δt – величина, показывающая на сколько градусов понизилась температура;
К – криоскопическая константа.
28) Теория электролитической диссоциации. Сильные и слабые электролиты. Изотонический коэффициент.
Классическая теория электролитической диссоциации была создана С.Аррениусом и В.Оствальдом в 80-х гг. 19 в. Она основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита КА выражается уравнением типа
КА <-> К+ + А-.
Константа диссоциации Кд определяется активностями катионов аК+, анионов аА- и недиссоциированных молекул аКА следующим образом:
Кд=аК+аА- / аКА
Значение Кд зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации (α) может быть рассчитана при любой концентрации электролита с помощью соотношения:
Кд= α2 с f± / 1 - α
где f± — средний коэффициент активности электролита.
Степень диссоциации — величина, характеризующая состояние равновесия реакции диссоциации в гомогенных (однородных) системах (газообразных, жидких).
Степень электролитической диссоциации α равна отношению числа диссоциированных молекул n к сумме n+N, где N — число недиссоциированных молекул. Часто α выражают в процентах. Например, для уксусной кислоты CH3COOH величина α равна 4% (в 0,01М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, т.е. находятся в виде ионов Н+ и СН3СОО-, остальные же 96 молекул не диссоциированы.
Степень диссоциации можно определить различными методами: по электропроводности раствора, по понижению температуры замерзания и др. Степень диссоциации зависит как от природы растворенного электролита, так и от концентрации раствора.
Слабые электролиты - химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
K=cλ2/λ∞(λ∞-λ)
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
λ / λ∞ = α где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Диссоциация слабых электролитов
Суть диссоциации слабых электролитов в том, что они диссоциируют на ионы не полностью, обратимо.
Диссоциация слабых электролитов:
Диссоциация слабых электролитов имеет две количественные характеристики:
1) λ - степень диссоциации. Степень диссоциации не является константой, она зависит от двух факторов:
от температуры (прямая зависимость);
от концентрации раствора (обратная зависимость).
2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
Кр=КД=[A+]р*[B+]р/[AB]р.
Константа диссоциации изменяется с температурой, причём зависимость прямая. От концентрации растворов константа диссоциации не зависит.
Сильные электролиты - химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы.
Степень диссоциации таких электролитов близка к 1.
К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i)— безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:

где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp— температура кипения, а Tmp— температура плавления (замерзания).
Изотонический коэффициент в растворах сильных электролитов
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0 (для раствора сульфата магния той же концентрации и вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
 ,
,
где nimg— мнимое, а ndisslv. — реальное количество частиц в растворе.
29) Слабые электролиты. Константа и степень диссоциации слабых электролитов. Закон разбавления Оствальда.
Слабые электролиты - химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
K=cλ2/λ∞(λ∞-λ)
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
λ / λ∞ = α где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Константа диссоциации Кдхарактеризует способность данного электролита в среде данного растворителя распадаться на ионы. Чем выше ее значение, тем больше концентрация ионов в сравнении с концентрацией нераспавшихся на ионы молекул электролита.
В общем виде для процесса электролитической диссоциации, выражаемого уравнением:
KmAn↔ mKn++ nAm-
константа диссоциации равна:
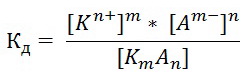
Например, для HF выражение константы диссоциации смеет следующий вид:
HF ↔ H+ + F¯
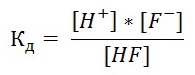
Значение константы диссоциации зависит от природы электролита, природы растворителя, температуры и не зависит от концентрации раствора. Данное свойство константы диссоциации позволяет определять силу слабых электролитов, пользуясь табличными значениями Кд. Чем больше константа диссоциации кислоты (основания), тем сильнее кислота (основание).
Например, КдHCN = 7,2 ∙ 10-10; КдHF = 7,2 ∙ 10-4, следовательно, плавиковая кислота (HF) более сильная, чем синильная (HCN).
30) Сильные электролиты. Ионная сила раствора, коэффициенты активности и активности ионов.
Сильные электролиты - химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы.
Степень диссоциации таких электролитов близка к 1.
К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Активность ионов — эффективная (кажущаяся) концентрация ионов с учетом электростатического взаимодействия между ними в растворе. Активность отличается от общей концентрации на некоторую величину. Отношение активности (a) к общей концентрации вещества в растворе (c, в моль/л), то есть активность ионов при концентрации 1 моль/л, называется коэффициентом активности Y=a\c
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионнов в растворе на квадрат их заряда. См. также - коэффициент активности
Коэффициент активности — отношение активности данного компонента раствора к его концентрации, характеризующее отклонение свойств реальных растворов от свойств идеальных растворов. В идеальных растворах и при бесконечном разбавлении К. а. равен единице.
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
|
|
|
|
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
31) Ионное произведение воды. Водородный и гидроксильный показатели (pH и pОH) растворов. Значение рН и окраска индикаторов в нейтральной,кислой и щелочной средах. Расчёт рН сильных и слабых электролитов.
Одним из важнейших растворителей является вода. Являясь слабым электролитом, вода в незначительной степени диссоциирует на ионы:
H2O H+ + OH-.
В чистой воде концентрации ионов водорода и гидроксид-ионов равны:
[H+]=[OH-].
Измерения электропроводности чистой воды показали, что при 22 °С степень ее ионизации a = 1,8.10-9. Так как в 1 литре воды содержится
1000/M(H2O) = 1000/18 = 55,55 моль,
то концентрация ионов будет равна
[H+] = [OH-] = 1,8.10-9.55,54 = 10-7 моль/л,
а произведение равновесных концентраций:
[H+][OH-] = 10-14 = Kw.
При данной температуре величина Kw является постоянной и называется ионным произведением воды. Постоянство величины Kw позволяет утверждать, что при увеличении в растворе концентрации ионов водорода H+ (растворение кислоты) происходит уменьшение концентрации гидроксид-ионов, и наоборот.
Если [H+]=[OH-]=10-7 моль/л, то среда раствор нейтральная;
если [H+]>10-7 моль/л, то раствор кислый;
если [OH-]>10-7 моль/л, то раствор щелочной.
Ионное произведение воды — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, показатель уровня кислотности раствора.
Водородный показатель pH – величина, характеризующая концентрацию ионов водорода и кислотность среды. pH – это отрицательный логарифм концентрации ионов водорода: pH=-lg[H+].
Гидроксидный показатель pOH – величина, характеризующая концентрацию гидроксид-ионов и щелочность среды. pOH – это отрицательный логарифм концентрации гидроксид-ионов
pOH=-lg[OH-]. pOH + pH = 14.
Ионное произведение воды. Вода является слабым электролитом и диссоциирует по схеме:
2Н2О ↔ Н3О++ ОН-
Ионы Н+ в воде и водных растворах практически отсутствуют, т.к. равновесие реакции
Н2О + Н+ ↔ Н3О+
полностью смещено влево, обычно реакцию диссоциации воды записывают упрощенно
Н2О ↔ Н++ ОН-
Константу диссоциации воды можно
записать:

В чистой воде концентрации ионов водорода
и гидроксида очень малы и вместо
активностей можно использовать
аналитические концентрации. Диссоциация
практически не влияет на концентрацию
воды, поэтому

Эта величина носит название ионное произведение воды. При 295 К (22оС) ионное произведение равно точно 10-14.
Диссоциация воды протекает с
поглощением тепла, поэтому при повышении
температуры КW возрастает Из ур-ния
(7.31) следует, что в чистой воде концентрации
ионов водорода и гидроксила равны и
составляют при 295 К

Такой раствор называют нейтральным.
Если
 то раствор будет кислым, а если
то раствор будет кислым, а если
 то раствор щелочной.
то раствор щелочной.
Для характеристики кислотности
среды обычно используют вместо
концентрации водородный показатель
(рН) – отрицательный десятичный логарифм
активности (концентрации) ионов водород:

При 295 К в нейтральной среде рН=7, в кислой – рН<7, в щелочной - pH>7.
Несколько реже используют
гидроксидный покадатель (рОН) отрицательный
десятичный логарифм активности
(концентрации) ионов гидроксила:

При 295 К в нейтральной среде рОН=7, в кислой – pОH>7, в щелочной - рОН<7.
рН+рОН=14.
Величина рН может контролироваться с помощью приборов (рН-метров) или посредством специальных реактивов, называемых индикаторами. Окраска индикаторов изменяется в зависимости от концентрации ионов водорода. Кислотно-основные индикаторы представляют собой слабые органические кислоты (HInd) или основания (IndOH), диссоциирующие по схемам:
HInd↔H+ + Ind-
IndOH↔Ind+ + OH-
Молекулярная и ионная формы индикаторов имеют разные окраски. При избытке ионов водорода HInd находится преимущественно в молекулярной форме, а IndOH – в ионной, а при избытке ионов гидроксила, наоборот - HInd находится преимущественно в ионной форме, а IndOH –в молекулярной.

Изменение окраски индикатора происходит в некотором интервале рН, называемом интервал перехода индикатора, определяемом величиной рКHind.
Для справки:
Кислая среда - рН<7
Щелочная среда - рН >7
Нейтральная среда рН =7
Следует учитывать только, что фенолфталеин имеет одинаковую окраску в кислой и в нейтральной средах, а метилоранж следует добавлять самую малость, иначе, при высокой его концентрации, будет трудно уловить границу перехода цветов.
32) Ионно-молекулярные уравнения. Произведение растворимости.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между Sn(OH)2 и HCl;
Sn(OH)2 + 2HCl = SnCl2 + 2H2O
Sn(OH)2 + 2H+ = Sn 2+ + 2H2O
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3это равновесие можно записать в виде:
![]()
Константа этого равновесия рассчитывается по уравнению:
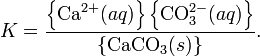
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
![]()
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+и n ионов Bm- , рассчитывается по уравнению:
![]()
где [A n+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
33) Гидролиз солей. Типы солей, подвергающихся гидролизу. Константа и степень гидролиза. Факторы, влияющие на гидролиз.
Гидролиз — взаимодействие веществ с водой с образованием различных соединений (кислот, оснований и др.). Гидролизу подвергаются соединения различных классов: соли, углеводы, белки, сложные эфиры, жиры и др.
Гидролиз солей
Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH
CO32- + H2O = HCO3- + OН-
(раствор имеет щелочную реакцию, реакция протекает обратимо)
2. Гидролиз соли сильной кислоты и слабого основания:
СuСl2 + Н2О = CuClOH + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую реакцию, реакция протекает обратимо)
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OН)3 + 3H2S
2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3 + ЗН2S
(Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален
Гидролиз– это разложение веществ водой. Гидролизу подвергаются углеводы, белки, жиры; в промышленности ведут гидролиз древесины. В неорганической химии чаще приходится иметь дело с гидролизом солей.
Гидролиз солей – это обменное взаимодействие ионов соли с молекулами воды, приводящее к образованию слабого электролита и смещению равновесия электролитической диссоциации воды.
В результате гидролиза в растворе появляется избыток ОНˉ или Н+, среда становится основной или кислой.
Гидролиз является результатом поляризационного взаимодействия ионов солей с их гидратной оболочкой. Чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз. Сущность гидролиза можно представить следующим образом.
Катионы соли связываются в растворе с гидратирующими их молекулами воды донорно–акцепторной связью. Донор – атомы кислорода воды, акцепторы – катионы, имеющие свободные атомные орбитали.
Анионы соли связываются с молекулами воды водородной связью. Сильное воздействие анионов соли на воду может привести к отрыву протона и тогда образуется анион вида .
В зависимости от силы поляризационного влияния катиона и аниона соли на молекулы воды образуются различные продукты гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:
![]()
![]()
Уравнение константы равновесия для данной реакции будет иметь вид:
![]() или
или
![]()
Так как концентрация молекул воды в
растворе постоянна, то произведение
двух постоянных
![]() можно заменить одной новой — константой
гидролиза:
можно заменить одной новой — константой
гидролиза:
![]()
Численное значение константы гидролиза
получим, используя ионное произведение
воды
![]() и константу диссоциации азотистой
кислоты
и константу диссоциации азотистой
кислоты
![]() :
:
![]()
![]()
подставим в уравнение константы гидролиза равна:
![]()
В общем случае для соли, образованной слабой кислотой и сильным основанием:
![]() где Ka— константа диссоциации
слабой кислоты, образующейся при
гидролизе
где Ka— константа диссоциации
слабой кислоты, образующейся при
гидролизе
для соли, образованной сильной кислотой и слабым основанием:
![]() где Kb— константа диссоциации
слабого основания, образующегося при
гидролизе
где Kb— константа диссоциации
слабого основания, образующегося при
гидролизе
для соли, образованной слабой кислотой и слабым основанием:
![]() .
.
Какие типы гидролиза возможны?Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
гидролиз по катиону (в реакцию с водой вступает только катион);
гидролиз по аниону (в реакцию с водой вступает только анион);
совместный гидролиз (в реакцию с водой вступает и катион, и анион);
Алгоритм написания уравнений гидролиза.
Когда школьники поняли суть реакции гидролиза, даем (а лучше составляем вместе с ними) алгоритм написания уравнений гидролиза. Рассмотрим его на конкретных примерах.
1. Определяем тип гидролиза. На этом этапе школьники могут написать уравнение диссоциации соли. Можно дать им “правило цепочки”: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита.
Пример 1. Гидролиз сульфата меди(II): CuSO4= Cu2++ SO42–
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду
Cu2++H-OH«CuOH++H+;
образуется катион гидроксомеди(II) и ион водорода, среда кислая
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два. Получаем:
2CuSO4+ 2H2O « (CuOH)2SO4+ H2SO4
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названия аниона и названия катиона, в данном случае соль назовем сульфат гидроксомеди(II). (Приставка “ди” не нужна, не говорим же мы “сульфат динатрия”). Называть эту соль “гидроксосульфат меди”, на наш взгляд, значит нарушать всю логику номенклатуры солей. Разве есть в растворе, или в узлах кристаллической решетки частица “гидроксосульфат”? Нет! А катион гидроксомеди есть. В дальнейшем этот подход распространяется на номенклатуру комплексных солей.
Факторы, влияющие на степень гидролиза.
Поскольку гидролиз обратимая реакция, то на состояние равновесия гидролиза влияют температура, концентрации участников реакции, добавки посторонних веществ. Если в реакции не участвуют газообразные вещества, практически не влияет давление. Исключается из рассмотрения вода, так как ее концентрация в водных растворах практически постоянна (~55 моль/л). Так для наших примеров 1 и 2 выражения констант равновесия (констант гидролиза) имеют вид:
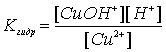 и
и
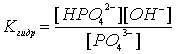
Температура.Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье, повышение концентрации ионов водорода (для примера 1) приведет к смещению равновесия влево. Степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции рассмотренной в примере 2.
Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это помогает константа равновесия. Да, при добавлении соли, то есть фосфат-ионов (пример 2), равновесие будет смещаться вправо, концентрация гидрофосфат и гидроксид-ионов будет возрастать. Но из рассмотрения константы равновесия этой реакции ясно, что для того, чтобы увеличить концентрацию гидроксид-ионов вдвое, нам надо концентрацию фосфат-ионов увеличить в 4 раза! Ведь значение константы должно быть неизменным. А это значит, что степень гидролиза, под которой можно понимать отношение [OH–] / [PO43–], уменьшится вдвое.
Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье, такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает. К этому же выводу придем из рассмотрения константы гидролиза.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди (пример 1) раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
34) Окислительно-восстановительные реакции. Типы окислительно-восстановительных реакций. Окислители и восстановители. Метод ионно-электронного баланса( метод полуреакций.)
(ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Описание. В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление. Окисление - процесс отдачи электронов, с увеличением степени окисления. При окислении вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление. Восстановлением называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др. Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель: Несвязанный, свободный электрон является сильнейшим восстановителем.
восстановитель — e− ↔ сопряжённый окислитель.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2→ S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2+ O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например:
Cl2+ H2O → HClO + HCl
Репропорционирование (компропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3→ N2O + 2H2O
Следущее уровнять методом ионно-электронного баланса
FeSO4+HNO3+H2SO4= Fe2(SO4)3+NO+H2O
Там скорее всего NO2 получается
2FeSO4 + 2HNO3 + H2SO4 = Fe2(SO4)3 + 2NO2 + 2H2O
2Fe+2 - 2e = 2Fe+3
N+5 + 1e = N+4
35) Электрохимические процессы. Равновесные электродные потенциалы. Уравнение Нернста.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Уравнение Нернста связывает окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
E=E^0 - RT\nF * Ln (red\ox)
Гальванический элемент Якоби - Даниэля состоит из двух металлов с различными электродными потенциалами, например, меди и цинка. Электроды соединены между собой двояко. Металлические электроды соединены между собой металлическим проводником, а солевые растворы соединены либо полупроницаемой мембраной (рисунок), либо электролитическим ключом (рисунок).
Электролитический ключ проводит анионы. Таким образом, в гальваническом элементе двоякая проводимость: электронная и ионная. Анодом является активный металл, катодом - пассивный.
Чем меньше алгебраическая величина электродного потенциала, тем более активным является металл. В данном гальваническом элементе по соотношению потенциалов цинковый электрод является анодом, а медный - катодом.
Анод окисляется: (-A)Zn^0 - 2e = Zn ^ 2+
Освободившиеся электроны с анода переходят на катод, а ионы уходят в раствор. Ионы меди из солевого раствора подходят к металлу и здесь восстанавливаются: (+k)Cu^2+ +2e = Cu
Избыток анионов из катодного солевого раствора в силу диффузии по электролитическому ключу переходит в катодный раствор, замыкая цепь.
Во внутренней цепи гальванического элемента возникает электроток. Окислительно – восстановительная реакция
является причиной возникновения электротока. Кроме того, гальванический элемента обладает ЭДС, которая представляет собой разность между катодным и анодным потенциалами:
Эдс = фи к - фи а = ( фи к + 0.058\n *lg[Me^n+ k]) - ( фи а + 0.058\n *lg[Me^n+ а])
Электрохимическая схема гальванического элемента
(-А)Zn|ZnSo4||CuSO4|Cu(+K)
Уравнение Нернста— уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
![]()
где
E— электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
R— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T— абсолютная температура;
F— число Фарадея, равное 96485,35 Кл/моль;
n— число моль электронов, участвующих в процессе;
aOxиaRed— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
![]()
36) Гальванические элементы. ЭДС гальванического элемента. Направление протекания окислительно-восстановительных реакций. Константа равновесия окислительно-восстановительных процессов.
О направлении ОВР можно судить по изменению энергии Гиббса ∆G. Если ∆G < 0 – реакция возможна, если ∆G > 0 - невозможна. Из термодинамики известно, что ∆G = -n·F·E; E = φок-ля -φв-ляили φок-ля > φв-ля, что возможно при Е > 0 и ∆G < 0.
Рассмотрим реакцию:
![]()
Она состоит из двух полуреакций:
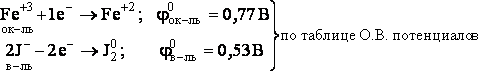
Т.к. φок-ля> φв-ля, то возможно самопроизвольное протекание реакции слева направо.
2FeCl3+ 2KJ → 2FeCl2+ J2+ 2KCl
Из всех возможных при данных условиях О.В.Р. в первую очередь протекает та, которая имеет наибольшую разность окислительно – восстановительных потенциалов.
О.В.Р. протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
ВЫЧИСЛЕНИЕ КОНСТAHТ РАВНОВЕСИЯ ДЛЯ ОКИСЛИТЕЛЬНО-ВОССТAHОВИТЕЛЬНЫХ РЕАКЦИЙ
Выше было указано, что электродный потенциал полуэлемента несколько изменяется в зависимости от концентрации ионов в растворе. Если записать уравнение электродной полуреакции в общем виде следующим образом:
Окисленные частицы + ze -> восстановленные частицы
то соотношение между концентрацией и
электродным потенциалом определяется
уравнением Нернста
![]()
где R-молярная газовая постоянная, T-абсолютная температура, z—число электронов, присоединяемых к окисленным частицам при образовании восстановленных частиц, F-заряд одного моля электронов (фарадей), Е°-стандартный электродный потенциал и In - натуральный логарифм.
Применим уравнение Нернста, в качестве примера, к гальваническому элементу Даниэля. Как было показано выше, на левом электроде элемента Даниэля протекает следующая полуреакция:
![]()
Окисленными частицами являются ионы
Zn2+(вода.), а восстановленными - атомы
Zn(TB.). Для этого электрода уравнение
Нернста записывается так:
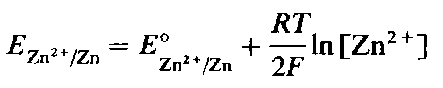
Уравнение полуреактга на правом электроде
имеет вид
![]()
для этого электрода уравнение Нернста
таково:
![]()
Эти два уравнения Нернста можно скомбинировать, и в результате получится соотношение, определяющее зависимость э.д.с. гальванического элемента от концентрации ионов в каждом из полуэлементов. Поскольку
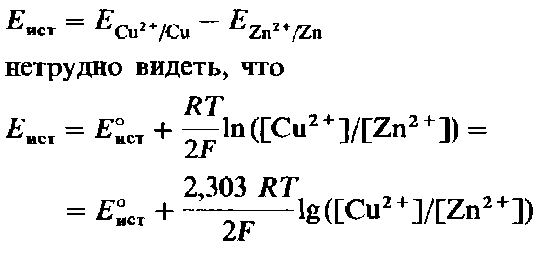
(Напомним, что In х = 2,303 Lg х).
Когда окислительно-восстановительная реакция, протекающая в элементе Даниэля, достигает положения равновесия, э.д.с. этого источника тока становится равной нулю. Это позволяет записать
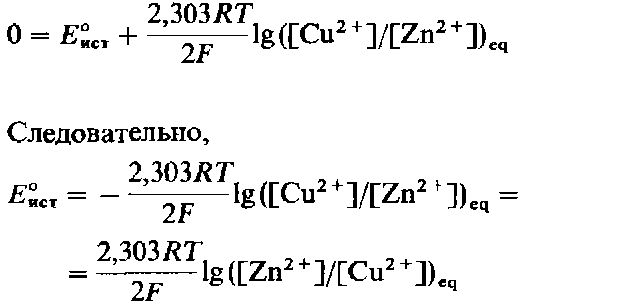
авновесие окислительно-восстановительной
реакции, протекающей в элементе Даниэля,
описывается уравнением
![]()
Константа этого равновесия определяется
выражением
![]() Подставляя это выражение в полученное
выше уравнение, получим
Подставляя это выражение в полученное
выше уравнение, получим
![]()
При стандартных условиях коэффициент 2,303RTfF численно равен 0,059 В*. Это позволяет записать
![]()
Таким образом, мы получили уравнение, которое связывает стандартную э.д.с. элемента Даниэля с константой равновесия окислительно-восстановительной реакции, протекающей в этом элементе. Аналогичные уравнения можно вывести и для других окислительно-восстановительных реакций. На использовании подобных уравнений основан простой способ нахождения констант равновесия окислительно-восстановительных реакций путем экспериментального определения стандартных электродных потенциалов.
Например, для элемента Даниэля стандартная э.д.с. равна 1,10 В. Значит,
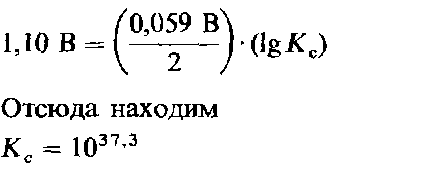
Большое численное значение константы равновесия указывает на то, что реакция протекает практически до полного завершения.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ, единичные ячейки хим. источников тока, предназначенных для однократного электрич. разряда (непрерывного или прерывистого). После разряда гальванические элементы, в отличие от аккумуляторов, теряют работоспособность. Иногда термин "гальванические элементы" применяют и для обозначения единичных ячеек аккумуляторных батарей, к-рые предназначены для многократного использования, т. е. после разряда м. б. снова заряжены. Главные составные части гальванических элементов: два электрода разл. природы и электролит. Обычно электроды - это металлич. пластинки или сетки, на к-рые нанесены реагенты ("активные в-ва"); на отрицат. электрод - восстановитель (Zn, Li и др.), на положительный -окислитель (оксиды Mn, Hg и др., а также соли). На каждом из электродов, погруженных в электролит, устанавливается определенный потенциал (окислит.-восстановит. потенциал данной электродной р-ции); разность этих потенциалов в отсутствие тока наз. напряжением разомкнутой цепи (НРЦ). При соединении электродов между собой с помощью внеш. электрич. цепи электроны начинают перетекать от отрицат. электрода к положительному - возникает электрич. ток. Суммарная электрохим. р-ция на обоих электродах наз. токообразующей; по мере ее протекания восстановитель отдает, а окислитель присоединяет электроны. Ток прекращается при размыкании внеш. цепи, а также после израсходования запаса хотя бы одного из реагентов. Побочные хим. или электрохим. р-ции приводят к саморазряду гальванических элементов, ограничивающему длительность их хранения, к-рая для лучших образцов может достигать 10 лет. Гальванические элементы применяют гл. обр. для питания переносной аппаратуры (напр., транзисторных радиоприемников) и поэтому изготавливают преим. с невыливающимся электролитом (загущенным или твердым). В отличие от аккумуляторов, гальванические элементы не нуждаются в особом уходе при эксплуатации.
37) Гальванические элементы. Водородный электрод. Определение стандартных электродных потенциалов. Ряд стандартных электродных потенциалов.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ, единичные ячейки хим. источников тока, предназначенных для однократного электрич. разряда (непрерывного или прерывистого). После разряда гальванические элементы, в отличие от аккумуляторов, теряют работоспособность. Иногда термин "гальванические элементы" применяют и для обозначения единичных ячеек аккумуляторных батарей, к-рые предназначены для многократного использования, т. е. после разряда м. б. снова заряжены. Главные составные части гальванических элементов: два электрода разл. природы и электролит. Обычно электроды - это металлич. пластинки или сетки, на к-рые нанесены реагенты ("активные в-ва"); на отрицат. электрод - восстановитель (Zn, Li и др.), на положительный -окислитель (оксиды Mn, Hg и др., а также соли). На каждом из электродов, погруженных в электролит, устанавливается определенный потенциал (окислит.-восстановит. потенциал данной электродной р-ции); разность этих потенциалов в отсутствие тока наз. напряжением разомкнутой цепи (НРЦ). При соединении электродов между собой с помощью внеш. электрич. цепи электроны начинают перетекать от отрицат. электрода к положительному - возникает электрич. ток. Суммарная электрохим. р-ция на обоих электродах наз. токообразующей; по мере ее протекания восстановитель отдает, а окислитель присоединяет электроны. Ток прекращается при размыкании внеш. цепи, а также после израсходования запаса хотя бы одного из реагентов. Побочные хим. или электрохим. р-ции приводят к саморазряду гальванических элементов, ограничивающему длительность их хранения, к-рая для лучших образцов может достигать 10 лет. Гальванические элементы применяют гл. обр. для питания переносной аппаратуры (напр., транзисторных радиоприемников) и поэтому изготавливают преим. с невыливающимся электролитом (загущенным или твердым). В отличие от аккумуляторов, гальванические элементы не нуждаются в особом уходе при эксплуатации.
Стандартный водоро́дный электро́д— электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит[уточнить] от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н++ 2e−= H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из "пары" электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен стандартный водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
(ур-е 1) Fe3++ 3e−--> Fe(тв) −0.036 В
(ур-е 2) Fe2++ 2e−--> Fe(тв) −0.44 В
Для получения третьего уравнения:
(ур-е 3) Fe3++ e−--> Fe2+(+0.77 В)
следует умножить потенциал первого ур-я на 3, перевернуть ур-е 2 (поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал ур-я 3.
38) Электролиз растворов и расплавов солей. Законы электролиза. Применение электролиза в промышленности.
Электролиз– это совокупность процессов, проходящих на электродах при прохождении электрического тока через раствор или расплав электролита. Электролиты – проводники второго рода. При электролизе катод служит восстановителем (отдает электроны катионам), а анод – окислителем (принимает электроны от анионов). Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций – восстановления на катоде (К) и окисления на аноде (А). Эти процессы называются процессами (реакциями) электровосстановления и электроокисления. Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических окислителей и восстановителей. Различают электролиз расплавов и растворов электролитов.
Электролиз расплавов солей
1) Все катионы металлов восстанавливаются на катоде:
К(-): Zn2++ 2e- → Zn0; Na++ 1e-→ Na0
2) Анионы бескислородных кислот окисляются на аноде:
А(+): 2Cl¯ - 2e-→Cl2
3) Анионы кислородсодержащих кислот образуют соответствующий кислотный оксид и кислород:
А(+): 2SO42ˉ- 4e-→ 2SO3+ O2
Электролиз водных растворов электролитов
На ход процесса электролиза и характер конечных продуктов большое влияние оказывают природа растворителя, материал электродов, плотность тока на них и другие факторы. В водных растворах электролитов, кроме гидратированных катионов и анионов, присутствуют молекулы воды, которые также могут подвергаться электрохимическому окислению и восстановлению. Какие именно электрохимические процессы будут протекать на электродах при электролизе, зависит от значения электродных потенциалов соответствующих электрохимических систем.
Катодные процессы.
При прочих равных условиях ионы металлов восстанавливаются на катоде тем легче, чем менее активен металл, чем дальше вправо он расположен в ряду напряжений.
1) Катионы металлов, имеющие электродный потенциал более высокий, чем у ионов водорода Н+ (в ряду напряжений эти металлы стоят после Н2), при электролизе практически полностью восстанавливаются на катоде:
Cu2++ 2e-→ Cu0
2) Катионы металлов, имеющие низкую величину электродного потенциала (от начала ряда напряжения по алюминий включительно), не восстанавливаются на катоде и остаются в растворе, на катоде идет процесс электрохимического восстановления водорода из молекул воды:
2H2O + 2e-→ H2 + 2OH¯
3) Катионы металлов, имеющие электродный потенциал ниже , чем у ионов водорода (Н+), но выше, чем у ионов алюминия (Al3+), т.е стоящих между Zn2+→ Men+← H2, при электролизе восстанавливаются на катоде одновременно с водородом.
Fe3+ + 3e- → Fe0
2H2O + 2e- → H2 + 2OH¯
Таким образом, характер катодного процесса при электролизе водных растворов электролитов определяется, прежде всего, положением соответствующего металла в ряду напряжения.
Анодные процессы.
При электролизе веществ используется инертные, не изменяющиеся в процессе электролиза аноды (графитовые, платиновые) и растворимые аноды, окисляющиеся в процессе электролиза легче, чем анионы (из цинка, никеля, серебра, меди и других металлов).
1) Анионы бескислородных кислот (S2ˉ, I¯, Br¯, Cl¯) при их достаточной концентрации легко окисляются до соответствующих простых веществ.
2) При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также плавиковой кислоты и фторидов происходит электрохимическое окисление воды с выделение кислорода:
в щелочных растворах: 4OH¯ - 4e-→ O2+ 2H2O
в кислых и нейтральных растворах: 2H2O - 4e-→ O2+ 4H+
С количественной стороны процесс электролиза впервые был изучен в 30-х годах XIX века выдающимся английским физиком Фарадеем, который в результате своих исследований установил следующие законы электролиза:
1.Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества.
Этот закон вытекает из сущности электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс — взаимодействие ионов или молекул электролита с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Ясно, что количество вещества, получающегося у электрода .всегда будет пропорционально числу прошедших по цепи электронов, т.е. количеству электричества.
2.При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств вещества.
Применение в промышленности
Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов. В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Металлы, которые не могут быть выделены из водных растворов вследствие высокого отрицательного потенциала получают в цветно
39) Металлическая связь и физические свойства металлов. Общие химический свойства металлов( привести примеры реакций). Получение чистых и сверхчистых металлов.
Мета́ллы(от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 [1] химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
6 элементов в группе щелочных металлов,
6 в группе щёлочноземельных металлов,
38 в группе переходных металлов,
11 в группе лёгких металлов,
7 в группе полуметаллов,
14 в группе лантаноиды + лантан,
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
вне определённых групп бериллий и магний.
Таким образом, к металлам возможно относится 96 элементов из всех открытых.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.
Температуры плавления металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Гладкая поверхность металлов отражает большой процент света — это явление называется металлическим блеском. Однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
4Li + O2= 2Li2O оксид лития
2Na + O2= Na2O2пероксид натрия
K + O2= KO2надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Na2O2+ 2Na = 2Na2O
Со средними и малоактивными металлами реакция происходит при нагревании:
3Fe + 2O2 = Fe3O4
2Hg + O2 = 2HgO
2Cu + O2= 2CuO
С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
6Li + N2= 2Li3N
При нагревании:
2Al + N2 = 2AlN
3Ca + N2 = Ca3N2
С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
Fe + S = FeS
С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
2Na + H2 = 2NaH
Mg + H2 = MgH2
С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
2Na + H2 = 2NaH
Легирование
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
40) Легкие конструкционные металлы. Алюминий. Физические и химический свойства , способы получения. Кислородосодержащие соединения алюминия и их свойства. Применение легких металлов в холодильной промышленности.
Алюми́ний — элемент главной подгруппы третьей группы третьего периода периодической системы химических элементов Д. И. Менделеева, атомный номер 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости (после кислорода и кремния) химический элемент в земной коре.
Простое вещество алюминий - лёгкий, немагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Физические свойства
Металл серебристо-белого цвета, легкий, плотность 2,7 г/смі, температура плавления у технического 658 °C, у алюминия высокой чистоты 660 °C, температура кипения 2500 °C, временное сопротивление литого 10-12 кг/ммІ, деформируемого 18-25 кг/мм2,сплавов 38-42 кг/ммІ.
Твердость по Бринеллю 24-32 кгс/ммІ, высокая пластичность: у технического 35 %, у чистого 50 %, прокатывается в тонкий лист и даже фольгу.
Алюминий обладает высокой электропроводностью и теплопроводностью, 65 % от электропроводности меди, обладает высокой светоотражательной способностью.
Алюминий образует сплавы почти со всеми металлами.
Химические свойства
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3(без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной индустрией. Однако, при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель.
Легко реагирует с простыми веществами:
с кислородом:
4Al + 3O2= 2Al2O3
с галогенами:
2Al + 3Br2= 2AlBr3
с другими неметаллами реагирует при нагревании:
с серой, образуя сульфид алюминия:
2Al + 3S = Al2S3
с азотом, образуя нитрид алюминия:
2Al + N2= 2AlN
с углеродом, образуя карбид алюминия:
4Al + 3С = Al4С3
Сульфид и карбид алюминия полностью гидролизуются:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
Со сложными веществами:
с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи):
2Al + 6H2O = 2Al(OH)3+ 3H2
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2(NaOH•H2O) + 2Al = 2NaAlO2+ 3H2
Легко растворяется в соляной и разбавленной серной кислотах:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
2Al + 6H2SO4(конц) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(конц) = Al(NO3)3 + 3NO2 + 3H2O
восстанавливает металлы из их оксидов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Сплавы на основе алюминия
Алюминиево-магниевые сплавы обладают высокой коррозионной стойкостью и хорошо свариваются; из них делают, например, корпуса быстроходных судов. Алюминиево-марганцевые сплавы во многом аналогичны алюминиево-магниевым. Алюминиево-медные сплавы (в частности, дюралюминий) можно подвергать термообработке, что намного повышает их прочность. К сожалению, термообработанные материалы нельзя сваривать, поэтому детали самолётов до сих пор соединяют заклёпками. Сплав с бо́льшим содержанием меди по цвету внешне очень похож на золото, и его иногда применяют для имитации последнего. Алюминиево-кремниевые сплавы (силумины) лучше всего подходят для литья. Из них часто отливают корпуса разных механизмов. Комплексные сплавы на основе алюминия: авиаль. Алюминий переходит в сверхпроводящее состояние при температуре 1,2 Кельвина.
41) Легкие конструкционные металлы. Титан. Физические и химический свойства , способы получения. Кислородосодержащие соединения титана и их свойства. Применение легких металлов в холодильной промышленности.
Титан(лат. Titanium) - химический элемент IV группы периодической системы Менделеева, 4 периода, имеет номер 22. Атом Титана содержит 22 электрона на 7 оболочках вокруг ядра с зарядом +22. Атомная масса приблизительно равна 48.
Титан - легкий серебристо-белый металл, по внешнему виду похож на сталь. Обладает низкой теплопроводностью, которая в 13 раз меньше теплопроводности алюминия и в 4 раза - железа. Титан относится к переходным элементам. Данный металл плавится при довольно высокой температуре (1668°С) и кипит при 3300 °С. Его плотность сравнительно мала (4500 кг/м3). Стоит также отметить, что его механическая прочность примерно вдвое больше, чем чистого железа, и почти в шесть раз выше прочности алюминия.
Свойства титана во многом зависят от степени его чистоты, поэтому разработка способов массового производства особо чистого титана является одной из важнейших проблем промышленности. Дело в том, что союз титана с кислородом (а именно в виде такого соединения элемент обычно и встречается в природе) является одним из самых прочных в химии. Ни электрический ток, ни высокие температуры не в силах вырвать титан из объятий кислорода.
Применяемый в промышленности технический титан содержит примеси кислорода, азота, железа, кремния и углерода, повышающие его прочность, снижающие пластичность и влияющие на температуру полиморфного превращения, которое происходит в интервале 865-920 °C.
Физические свойства
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой (a=2,951 Å; с=4,679 Å; z=2; пространственная группа C6mmc), β-Ti с кубической объёмноцентрированной упаковкой (a=3,269 Å; z=2; пространственная группа Im3m), температура перехода α↔β 883 °C, ΔH перехода 3,8 кДж/моль. Точка плавления 1660±20 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см³, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере. Удельное сопротивление 0,42 мкОм·м при 20 °C
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C. Титановая стружка пожароопасна.
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2−.
При нагревании на воздухе до 1200 °C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2образует титанат: TiO2+K2CO3=K2TiO3+CO2.
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется сильным гидролизом TiCl4содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, алюминием, кремнием, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3и TiCl2— твёрдые вещества с сильно восстановительными свойствами. Ti взаимодействует с Br2и I2.
С азотом N2выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с углеродом образуется карбид титана TiCx(x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх(x=1,0). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
42) Тяжелые конструкционные металлы. Железо. Физические и химический свойства , способы получения. Кислородосодержащие соединения железа и их свойства. Применение тяжелых металлов в холодильной промышленности.
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
На самом деле железом обычно называют его сплавы с малым содержанием примесей (до 0,8%), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2% углерода) и чугун (более 2% углерода), а так же нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа)
в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика
в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой
выше 1394 °C устойчив δ-Fe с объёмоцентрированной кубической решёткой
Металловедение не выделяет β-Fe, как отдельную фазу[4], и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
От абсолютного нуля до 910 ºC устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой. Твёрдый раствор углерода в α-железе называется ферритом.
От 910 до 1400 ºC устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой. Твёрдый раствор углерода в γ-железе называется аустенитом.
От 910 до 1539 ºC устойчива δ-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решеткой. Твёрдый раствор углерода в δ-железе (так же, как и в α-железе) называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо-углерод).
В области высоких давлений (свыше 104 МПа, 100 тыс. атм.) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α- γ переходам кристаллической решетки происходит термообработка стали. Без этого явления железо, как основа стали не получило бы такого широкого применения.
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — около 3200 °C.
Химические свойства
Основные степени окисления железа — +2 и +3.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2О3·хН2О.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3О4, при сгорании в чистом кислороде — оксид Fe2О3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами. Так как FeF3нелетуч, железо устойчиво к действию фтора до температуры 200—300 °C. При хлорировании железа (при температуре около 200 °C) образуется летучий FeCl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeCl3и, особенно, FeBr3отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) СО, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-С5Н5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная плёнка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl → FeCl2 + H2↑;
Fe + H2SO4 → FeSO4 + H2↑.
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа(III):
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O.
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(ОН)2.Оксид железа(III) Fe2O3слабо амфотерен, ему отвечает ещё более слабое, чем Fe(ОН)2, основание Fe(ОН)3, которое реагирует с кислотами:
2Fe(ОН)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Гидроксид железа(III) Fe(ОН)3проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами щелочей:
Fe(ОН)3+ 3КОН → К3[Fe(ОН)6].
Образующиеся при этом гидроксокомплексы железа(III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3→ 3FeCl2.
При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III):
4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2.
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2О.
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2— железокалиевые квасцы, (NH4)Fe(SO4)2— железоаммонийные квасцы и т. д.
При действии газообразного хлора или озона на щелочные растворы соединений железа(III) образуются соединения железа(VI) — ферраты, например, феррат(VI) калия K2FeO4. Имеются сообщения о получении под действием сильных окислителей соединений железа(VIII).
Для обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+с тиоцианат-ионами SCN-. При взаимодействии ионов Fe3+с анионами SCN-образуется ярко-красный роданид железа Fe(SCN)3. Другим реактивом на ионы Fe3+служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтой кровяная соль). При взаимодействии ионов Fe3+и [Fe(CN)6]4-выпадает ярко-синий осадок берлинской лазури:
4K4[Fe(CN)6] + 4Fe3+→ 4KFeIII[FeII(CN)6]↓ + 12K+.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+и [Fe(CN)6]3-выпадает осадок турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+→ 3KFeII[FeIII(CN)6]↓ + 6K+.
Интересно, что берлинская лазурь и турнбулева синь — две формы одного и того же вещества, так как в растворе устанавливается равновесие:
KFeIII[FeII(CN)6] ↔ KFeII[FeIII(CN)6].
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (Fe3O4).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод кокса окисляется до монооксида углерода (угарного газа) кислородом воздуха:
2C + O2→ 2CO↑.
В свою очередь, угарный газ восстанавливает железо из руды:
3CO + Fe2O3→ 2Fe + 3CO2↑.
Флюс добавляется для извлечения нежелательных примесей из руды, в первую очередь силикатов, таких, как кварц (диоксид кремния). Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Против других примесей используют другие флюсы.
Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь):
CaCO3→ CaO + CO2↑.
Оксид кальция соединяется с диоксидом кремния, образуя шлак:
CaO + SiO2→ CaSiO3.
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности и его можно сливать отдельно от металла. Шлак затем употребляется в строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишний углерод и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используют и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, содержащими водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор — обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
43) Тяжелые конструкционные металлы. Хром . Физические и химический свойства , способы получения. Кислородосодержащие соединения хрома и их свойства. Применение тяжелых металлов в холодильной промышленности.
К металлам побочных подгрупп периодической системы Д. И. Менделеева относятся все d-элементы. Таких подгрупп 10: скандия, титана, ванадия, хрома, марганца, железа, кобальта, никеля, меди и цинка. Здесь рассматриваются общие характеристики подгрупп хрома и семейства железа.
Побочную подгруппу VIгруппы составляют следующие элементы — хром Cr, молибден Мо и вольфрамW. Хром возглавляет побочную подгруппу 4 группы. Его электронная формула+24Cr1s2|2s22p6|3s23p63d5|4s1
На внешнем энергетическом уровне атомов хрома и молибдена содержится по одному электрону, вольфрама — два электрона, что обусловливает металлический характер этих элементов и отлично от элементов главной подгруппы. В соответствии с числом валентных электронов они проявляют максимальную степень окисления +6 и образуют оксиды типа RO3, которым соответствуют кислоты общей формулыH2RO4. Сила кислот закономерно снижается от хрома к вольфраму. Большинство солей этих кислот в воде малорастворимо, хорошо растворяются только соли щелочных металлов и аммония.
Элементы подгруппы хрома проявляют также степени окисления +5, +4, +3, +2. Но наиболее типичны соединения высшей степени окисления, которые во многом весьма похожи на соответствующие соединения серы. С водородом элементы подгруппы хрома соединений не образуют.
С ростом порядкового номера в подгруппе возрастает температура плавления металлов. Вольфрам плавится при 3390 °С. Это самый тугоплавкий металл. Поэтому его используют для изготовления нитей в электрических лампочках накаливания.
Металлы подгруппы хрома в обычных условиях весьма устойчивы к воздействию воздуха и воды. При нагревании взаимодействуют с кислородом, галогенами, азотом, фосфором, углем, кремнием и др. Известны их многочисленные сплавы с другими металлами. Сплавы и сами металлы — весьма ценные материалы современной техники.
По физическим и химическим свойствам молибден и вольфрам сходны между собой и несколько отличаются от хрома. Химическая активность металлов в ряду хром — молибден — вольфрам заметно понижается.
Физические свойства
Хром — серовато-белый блестящий металл по внешнему виду похож на сталь. Из металлов он самый твердый, его плотность 7,19 г/см3, т. пл. 1855 °С. Природный хром состоит из смеси пяти изотопов с массовыми числами 50, 52, 53, 54 и 56. Радиоактивные изотопы получены искусственно.
Хром обладает всеми характерными свойствами металлов — хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имеет присущий большинству металлов блеск. Любопытна одна особенность хрома: при температуре около 37°С он ведет себя явно "вызывающе" — многие его физические свойства резко, скачкообразно меняются. В этой температурной точке внутреннее трение хрома достигает максимума, а модуль упругости падает до минимальных значений. Так же внезапно изменяются электропроводность, коэффициент линейного расширения, термоэлектродвижущая сила. Пока ученые не могут объяснить эту аномалию.
Даже незначительные примеси делают хром очень хрупким, поэтому в качестве конструкционного материала его практически не применяют, зато как легирующий элемент он издавна пользуется у металлургов почетом. Небольшие добавки его придают стали твердость и износостойкость. Такие свойства присущи шарикоподшипниковой стали, в состав которой, наряду с хромом (до 1,5%), входит углерод (около 1%). Образующиеся в ней карбиды хрома отличаются исключительной твердостью — они-то и позволяют металлу уверенно сопротивляться одному из опаснейших врагов — износу.
В качестве представителя металлов, относящихся к побочным подгруппам периодической системы, рассмотрим хром: он возглавляет побочную подгруппу VIгруппы. Хром — металл, по внешнему виду похожий на сталь. От ранее рассмотренных металлов он, как и все металлы с достраивающимся предпоследним электронным слоем атома, отличается тугоплавкостью и твердостью. По твердости хром превосходит все металлы, он царапает стекло.
Химические свойства
Расположение электронов на 3d- и 4s-орбиталях атома хрома можно представить схемой:

Отсюда видно, что хром может проявлять в соединениях различные степени окисления — от +1 до +6; из них наиболее устойчивы соединения хрома со степенями окисления +2, +3, +6. Таким образом, в образовании химических связей участвует не только электрон внешнего уровня, но и пять электронов d-подуровня второго снаружи уровня.
Как и у алюминия, на поверхности хрома образуется оксидная пленка Сr2О3. Поэтому хром в разбавленных серной и соляной кислотах начинает растворяться не сразу, а после растворения оксидной пленки:
Cr + 2H+=Cr5++ H2
В азотной и концентрированной серной кислотах хром не растворяется, так как его оксидная пленка упрочняется, т. е. хром переходит в пассивное состояние. По этой же причине не взаимодействуют с хромом разбавленные серная и соляная кислоты, содержащие растворенный кислород. Пассивацию хрома можно устранить очисткой поверхности металла.
При высокой температуре хром горит в кислороде, образуя оксид Cr2О3. Раскаленный хром реагирует с парами воды:
2Cr + ЗН2О = Cr2О3+ ЗН2
Металлический хром при нагревании реагирует также с галогенами, галогеноводородами, серой, азотом, фосфором, углем, кремнием и бором. Например:
Cr + 2HF = CrF2 + H2 ; 2Cr + N2 = 2CrN
2Cr + 3S = Cr2S3; Cr + Si = CrSi
На воздухе хром совершенно не изменяется. Поэтому хромом с помощью электролиза его соединений покрывают — хромируют — стальные изделия для предохранения их от ржавления и механического износа. Эти же качества хром придает своим сплавам с железом — хромистым сталям. К ним относится нержавеющая сталь, содержащая около 12% хрома.
В быт нержавеющая сталь вошла в виде вилок, ножей и других предметов домашнего обихода. Блестящие, серебристого цвета полосы нержавеющей стали украшают арки станции "Маяковская" Московского метрополитена.
При химических реакциях атом хрома может отдавать, кроме единственного электрона наружного слоя, до 5 электронов предпоследнего слоя, т. е. проявлять высшую степень окисления (+6). Но, как и все элементы с достраивающимся предпоследним слоем атома, хром проявляет несколько значений степеней окисления, т. е. кроме высшего и низшие значения, а именно + 2 и + 3. У металлов с переменной валентностью, как и у элементов одного и того же периода, например III, с возрастанием степени окисления уменьшается радиус иона. Так, у хрома:
Радиус иона

При этом соблюдается та же самая закономерность в изменении химических свойств соединений металла с возрастанием его степени окисления, как у элементов одного и того же периода, а именно:
1. С возрастанием степени окисления основные свойства гидроксидов ослабляются, а кислотные усиливаются.
2. При одинаковых значениях степени окисления и близких значениях ионного радиуса химические свойства гидроксидов элементов оказываются сходными. Это мы и наблюдаем на гидроксидах хрома, учитывая близость численных значений радиусов ионов Сг2иMg2; Сг3и А13; С г6иS6*:
Гидроксиды хрома

Гидроксиды элементов IIIпериода
Хром образует три ряда соединений:

Познакомимся с важнейшими из этих соединений. При растворении хрома в кислотах получаются соли, в которых хром двухвалентен, например:

Соединения двухвалентного хрома сходны по составу и свойствам с соединениями магния; гидроксид хрома (II) является основанием.
Проявляют все соединения, в которых содержится хром в степени окисления +6: оксид.
45) Электрохимическая коррозия. Механизм протекания электрохимической коррозии. Коррозия в кислой, нейтральной, щелочной средах с кислородной и водородной деполяризацией.
Электрохимическая коррозия - самый распространенный вид коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии.
Механизм электрохимической коррозии может протекать по двум вариантам:
