
- •Основные понятия химии
- •Основные законы химии.
- •Основные классы неорганических веществ
- •Электрохимический ряд напряжений Ме:
- •Основные этапы развития представлений о строении атома и ядра. Квантово-механическая модель
- •Понятие об электронном облаке. Волновая функция.
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Водородная связь. Механизм образования водородной связи
- •I закон термодинамики. Понятие об энтальпии.Термохимические
- •Уравнения. Закон Гесса. Стандартное состояние и стандартная энтальпия образования вещества. Расчеты тепловых эффектов химических реакций.
- •II закон термодинамики. Понятие энтропии. Зависимость энтропии от различных факторов
- •Направление самопроизвольно протекающих процессов. Свободная энергия Гиббса. Энтальпийный и энтропийный факторы процесса
- •Скорость химической реакции. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Сильные и слабые электролиты.
- •Влияние концентрации реагентов на скорость химической реакции. Закон действующих масс. Константа скорости химической реакции и ее физический смысл.
- •Вода. Ионное произведение воды. Водородный показатель среды.
- •Катализ. Понятие о гомогенном и гетерогенном катализе. Влияние катализа на скорость прямой и обратной реакции
- •Окислительно-восстановительный (Redox) потенциал.
Катализ. Понятие о гомогенном и гетерогенном катализе. Влияние катализа на скорость прямой и обратной реакции
Катализаторы – вещества, изменяющие скорость реакции, но не расходующиеся в процессе реакции. Могут увеличивать скорость реакции (активаторы) или замедлять (ингибиторы). Бывают твердыми, жидкими и газообразными. Гомогенный катализ. Реагирующие вещества и катализатор образуют однородную, однофазную систему. Например: 2SO2+O2=2SO3 Механизм катализа объясняется образованием промежуточного соединения катализатора с одним из реагирующих веществ. Схема действия катализатора в две стадии O2+2NO(катализатор)=2NO(пром. соединение)
NO2+SO2=SO3
(продукт)+NO(катализатор).
Геторогенный
катализ.
Реагирующие вещества и катализатор
составляют неоднородную, многофазную
систему, в которой катализатор находится
в виде отдельной фазы. Примеры: синтез
аммиака Катализ -
изменение скорости реакции под действием
особых веществ (катализаторов)
Катализаторы
не оказывают влияния на свободную
энергию.
Роль
катализатора - уменьшение потенциального
барьера, т.е увеличение скорости реакции.
Уменьшении Еа реагентов через обр-ие
промежуточного активированного
комплекса.
Катализ -
изменение скорости реакции под действием
особых веществ (катализаторов)
Катализаторы
не оказывают влияния на свободную
энергию.
Роль
катализатора - уменьшение потенциального
барьера, т.е увеличение скорости реакции.
Уменьшении Еа реагентов через обр-ие
промежуточного активированного
комплекса.
Н2+I2=2HI
I2->2I
I+H2->H2I-ПРОМЕЖ АКТ КОМПЛЕКС(НЕУСТОЙЧИВ)
H2I+I->2HI
Растворы, определение, классификация. Понятие о
концентрации растворов, способы ее выражения.
Растворы – это гомогенные многокомпонентные системы , не имеющие строго определенного состава. В них нет отдельных различных фаз и нет границ раздела . Если один из компонентов раствора находится в большем количестве, чем другие, то его называют растворителем. Другие компоненты в этом случае называют растворенными веществами. Растворителем считают также то вещество, агрегатное состояние которого при образовании раствора не изменяется. Растворы классифиц: по размерам раств частиц, по агрегатному состоянию, водные р-ры(электролиты, не)
Процентная концентрация или массовая или объемная доля (С) когда состав раствора указывается в процентном отношении массы или объема растворенного вещества к общей массе или общему объему раствора. Молярная концентрация или молярность (См) – это число молей вещества, приходящееся на один литр раствора. Моляльная концентрация или моляльность ( m) – это число молей растворенного вещества, приходящееся на 1 кг или 1000 г растворителя. m=n/G2 моль /растворителя.
Эквивалентная концентрация (Сн) или нормальность – это число эквивалентов растворенного вещества в молях приходящееся на один литр раствора. Их значения получают делением числа эквивалентов растворенного вещества в молях на объем раствора в литрах.
Титр раствора (Т0 – это число граммов растворенного вещества в 1 см3( 1 мл) раствора. Он определяется отношением массы растворенного вещества G1 в граммах к объему раствора (V3 в мл).
Окислительно-восстановительные реакции. Основные виды
окислительно-восстановительных реакций. Типичные окислители и восстановители.
Окислительно-восстановительные реакции – такие реакции которые протекают с изменением степеней окисления элементов, входящих в состав соединений. К ним относятся а) реакции замещения Zn+H2SO4=ZnSО4+H2, б) реакции разложения и соединения 2KclO3=2KCl+3O2, H2+Cl2=2HCl, в)сложные реакции взаимодействия 2 и более веществ 4FeS2+11O2=2Fe2O3+8O2. выделяют три типа. 1. Реакции межмолекулярного окисления- восстановления. Окислитель и восстановитель находятся в составе различных веществ. 2. Реакции внутримолекулярного окисления-восстановления. Ион-окислитель и ион-восстановитель входят в состав одного вещества. 3. Реакции самоокисления-восстановления. Окислителем и восстановителем являются атомы одного и того же элемента – хлора в промежуточной степени окисления. Теория основана на следующих положениях а) реакции сопровождаются переходом электронов от элемента-восстановителя к элементу-окислителю; б)Окисление-восстановление – единый взаимосвязанный процесс; в) Окисление – процесс отдачи электронов, который сопровождается повышением степени окисления элемента-восстановителя; г) Восстановление – процесс присоединения электронов, который сопровождается понижением степени окисления элемента-окислителя.Окислительно-восстановительные свойства зависят от положения элементов в периодической системе. Атомы металлов только отдают электроны т.е. являются восстановителями. Восстановительные свойства убывают в пределах периода слева на право. Возрастают в пределах подгрупп сверху вниз. Окислительные свойства возрастают в пределах главных подгрупп снизу вверх. Окислительные свойства элементов возрастают в пределах периода слева направо. Окислители. Неметаллы F2 Cl2 O2 I2 S, сложные вещ-ва с высшей степенью окисления, положительно заряженные ионы малоактивных металлов. Восстановители. Активные металлы (К, Na,Са), сложные вещества содержащие атомы неметаллов с отрицательной степенью окисления, сложные вещества содержащие элементы с переменной валентности, органические восстановители.
Обратимость химических реакций. Влияние концентрации,
давления и температуры на химическое равновесие. Принцип Ле - Шателье. Константа химического равновесия.
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях
Химическое
равновесие
– состояние системы при котором скорости
прямой и обратной реакции равны.
 Выводится из равенства скоростей прямой
и обратной реакций и выражается константой
равновесия К. Для обратимой реакции в
общем виде
Выводится из равенства скоростей прямой
и обратной реакций и выражается константой
равновесия К. Для обратимой реакции в
общем виде
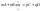
В
соответствии с законом действующих
масс кинетический. Скорость хим. реакции
прямо пропорционально произведению
концентраций реагирующих веществ,
взятых в степенях их стехиометрических
коэффициентов.
 преобразуем
и получаем закон действующих масс
термодинамический. Константа
равновесия
хим. реакции = произведению концентраций
продуктов реакции, взятых в степенях
их стехиометрических коэффициентов в
уравнении реакции, деленному на
произведение концентраций исходных
веществ, взятых в степенях стехиометрических
коэффициентов.
преобразуем
и получаем закон действующих масс
термодинамический. Константа
равновесия
хим. реакции = произведению концентраций
продуктов реакции, взятых в степенях
их стехиометрических коэффициентов в
уравнении реакции, деленному на
произведение концентраций исходных
веществ, взятых в степенях стехиометрических
коэффициентов.
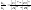 константа
равновесия величина постоянная для
данной реакции при данной температуре.
Концентрация продуктов > концентрации
исходных веществ. Если наоборот, то
реакция практически не шла. При повышении
температуры равновесие сместиться в
сторону эндотермической реакции, при
понижении в сторону экзотермической.
При увеличении давления равновесие
смещается в направлении реакции, идущей
с уменьшением объема газообразных
веществ, при понижении давления в сторону
реакции идущей с увеличением объема.
При увеличении концентрации исходных
веществ равновесие смещается в сторону
прямой реакции. Принцип Ле-Шателье-Брауна.
Если на систему, находящуюся в равновесии,
оказывать внешнее воздействие, то
равновесие сдвигается в направлении,
ослабляющем это воздействие. Реакции
с участием газообразных веществ.
константа
равновесия величина постоянная для
данной реакции при данной температуре.
Концентрация продуктов > концентрации
исходных веществ. Если наоборот, то
реакция практически не шла. При повышении
температуры равновесие сместиться в
сторону эндотермической реакции, при
понижении в сторону экзотермической.
При увеличении давления равновесие
смещается в направлении реакции, идущей
с уменьшением объема газообразных
веществ, при понижении давления в сторону
реакции идущей с увеличением объема.
При увеличении концентрации исходных
веществ равновесие смещается в сторону
прямой реакции. Принцип Ле-Шателье-Брауна.
Если на систему, находящуюся в равновесии,
оказывать внешнее воздействие, то
равновесие сдвигается в направлении,
ослабляющем это воздействие. Реакции
с участием газообразных веществ.
 уменьшение
объема
уменьшение
объема
Активность, коэффициент активности. Ионная сила растворов.
Связь между коэффициентом активности и ионной силой раствора.
Активность
– эффективная
концентрация вещества в растворе в
соответствии с которой оно участвует
в различных процессах а=f/С,
где f
- коэффициент активности, С – концентрация.
Ионная
сила.
 ,
,
 .
Активность
и ионная сила раствора -
Различие в свойствах концентрированных
и разбавленных растворов электролитов
связано главным образом со значительным
электростатическим взаимодействием
ионов в концентрированных растворах.
В связи с этим вместо понятия концентрация
используется понятие активность.
Активность i-й ионной частицы а связана
с ее концентрацией с, уравнением:
a=fici,
где fi -
коэффициент активности; его значение
определяется концентрациями и зарядами
всех ионных частиц раствора
Активность является
мерой концентрации с учетом
электростатических межионных
взаимодействий.
Связь
концентраций ионов и зарядов ионов со
значением коэффициента активности
ионной частицы fi выражается
уравнением:
-lg(fi)=k√μ;
где k - константа, μ - ионная сила
При
этом многозарядные ионы оказывают более
сильное влияние на значение fi,
чем однозарядные. Степень этого влияния
выражается ионной
силой раствора согласно
уравнению:
μ=½Σ(c1z12+c2z22c3z32+...+ckzk2)=½Σcizi2
.
Активность
и ионная сила раствора -
Различие в свойствах концентрированных
и разбавленных растворов электролитов
связано главным образом со значительным
электростатическим взаимодействием
ионов в концентрированных растворах.
В связи с этим вместо понятия концентрация
используется понятие активность.
Активность i-й ионной частицы а связана
с ее концентрацией с, уравнением:
a=fici,
где fi -
коэффициент активности; его значение
определяется концентрациями и зарядами
всех ионных частиц раствора
Активность является
мерой концентрации с учетом
электростатических межионных
взаимодействий.
Связь
концентраций ионов и зарядов ионов со
значением коэффициента активности
ионной частицы fi выражается
уравнением:
-lg(fi)=k√μ;
где k - константа, μ - ионная сила
При
этом многозарядные ионы оказывают более
сильное влияние на значение fi,
чем однозарядные. Степень этого влияния
выражается ионной
силой раствора согласно
уравнению:
μ=½Σ(c1z12+c2z22c3z32+...+ckzk2)=½Σcizi2
Газовые электроды. Расчет потенциалов водородного и
кислородного электродов
Газовый
электрод — это электрод (см.), в котором
в качестве одного из компонентов
электродной пары используется газ,
например водород или хлор. Газ адсорбируется
на химически инертном электроде, что
способствует передаче электронов через
границу раздела; как правило, используют
платинированную платину, которая к тому
же катализирует электродную реакцию.
Электродный потенциал (см.) зависит от
давления газа и активности ионов в
растворе. Так, для хлорного электрода
![]()
в электрохимии обычно платинированная пластина, погруженная в раствор кислоты с определенной концентрацией ионов Н+ и омываемая газообразным водородом. При давлении водорода 0,1 МПa и термодинамической активности его ионов, равной единице. E = Eo+ RT/nF ln [H+] Eo - стандартный потенциал водородного электрода при 25° в одномолярном растворе кислоты и давлении водорода 1 атм. принят зо 0. Преобразуем уравнение для температуры 25° и переходя к десятичным логарифмам: схема:Н2,Рт/Н+; реакция: 2(Н+)+2е=Н2 E = 0.059 Lg[H+] = -0.059 pH = -0.059*5 =-0.295 [В] = -259 мВ
Кислородному электроду соответствует электродная реакция O2 + 4H⁺ + 4e = 2H2O, потенциал кислородного электрода может быть рассчитан по формуле Eo 2/H2O = E° O2/H2O +R • T / ( z • F ) • ln ( pO2 • a ⁴H⁺ / a² H2O ). При стандартных условиях давление кислорода pO2 принимают равным 1 атм. Активность воды принимают равной 1.
Определение и классификация электрохимических процессов.
Понятие об электродном потенциале. Стандартный электродный потенциал. Уравнение Нернста для расчета потенциала металлического электрода.
Электрохимия – раздел химии, изучающий процессы взаимного превращения электр формы энергии в хим. Э/хим процессы делятся на 1) превращение хим энергии самопроизаольно протекающую ОВР в электрическую – ГЭ. 2) превращение электр энергии в хим энергию за счет процесса электролиза. Электродный потенциал, разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение электродного потенциала обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз Стандартный электродный потенциал — потенциал электрода в растворе, в котором ионы, определяющие электродный процесс, имеют активность, равную единице. Величина Стандартного электродного потенциала измеряется относительно нормального водородного электрода, потенциал кот условно принимается 0
![]() .о-в-э
.о-в-э
Е=Е0-0,059pH водородный
E = E0 + 0,059/n*lg[Ме]- металлический
E0O2/H2O + 0,059/4 • ln ( pO2 • a4H+ / a2H2O )-кислор
