
- •Основные понятия химии
- •Основные законы химии.
- •Основные классы неорганических веществ
- •Электрохимический ряд напряжений Ме:
- •Основные этапы развития представлений о строении атома и ядра. Квантово-механическая модель
- •Понятие об электронном облаке. Волновая функция.
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Водородная связь. Механизм образования водородной связи
- •I закон термодинамики. Понятие об энтальпии.Термохимические
- •Уравнения. Закон Гесса. Стандартное состояние и стандартная энтальпия образования вещества. Расчеты тепловых эффектов химических реакций.
- •II закон термодинамики. Понятие энтропии. Зависимость энтропии от различных факторов
- •Направление самопроизвольно протекающих процессов. Свободная энергия Гиббса. Энтальпийный и энтропийный факторы процесса
- •Скорость химической реакции. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса.
- •Сильные и слабые электролиты.
- •Влияние концентрации реагентов на скорость химической реакции. Закон действующих масс. Константа скорости химической реакции и ее физический смысл.
- •Вода. Ионное произведение воды. Водородный показатель среды.
- •Катализ. Понятие о гомогенном и гетерогенном катализе. Влияние катализа на скорость прямой и обратной реакции
- •Окислительно-восстановительный (Redox) потенциал.
Основные этапы развития представлений о строении атома и ядра. Квантово-механическая модель
Резерфорд предл.1 модель атом состоит из ядра, имеющ. + заряд и вращ. вокруг него ê. Ядро имеет бесконечно малые размеры, однако в нем сосредоточ. почти вся m атома. r орбиты ê и его V меняются как угодно и непрерывно. Впоследствии было показано, что ядра состоят из нуклонов протонов и нейтронов. Состав атома 1) Заряд электрона ê = - 1,6 10-19 Кул. ( -1) mê = 9,1 10-31кг 2) Заряд протона р = + 1,6 10-19 Кул. (+1) mР 1836mê 3) Заряд нейтрона n = 0 mn 1840mê. Кол-во р в ядре, а также ê у нейтрона атома можно опр. по порядковому номеру эл-та z. Кол-во n опр. По разности атомной m и порядк. номера (Аr - z ). Кол-во эл-нов в атомах одного элемента может разл. Это изотопы. Недостатки теории Резерфорда (противоречия). 1)Любое движение тела по круговой орбите происходит с ускорением электроны, двигаясь по круг. Орбитам, дожны непременно излучать энергию и вскоре должны упасть на ядро, т. е атомы должны быть неуст. системами. 2)Непрерывно излучая энергию спектр должен быть сплошным. Были получены линейчатые спектры теория Резерфорда не могла объяснить уст. состояния атома и просхожд. линий в спектре атома. Теория Бора
А)Бор создал первую колич. Теорию для атома . Теория Бора основана на законах классич. механики и на законах квантовой теории излучения Макса Планка. Б)Е = h, - частота излучения, h – постоянная Планка = 6,62 10-34 Джсек. . Бор ввел понятие стационарных орбит (энерг. уровеней), момент кол-ва движения на которых = h(2 n), h – постоянная Планка, n – главное квантовое число. Достоинства теории Бора Бор объяснил, почему атомы явл. уст системами (1 постулат). Бор объяснил просхожд. Линий в спектре атома ( 2 постулат).
Понятие об электронном облаке. Волновая функция.
эл. облако-это место обитания электронов вокруг ядра атома, а 1s и 2s-отличаются тем, что 1s это первый уровень. на нем может быть 1 или два электрона, а 2s-это второй уровень на нем меньше двух и больше 2 электронов быть не может! Электронные облака - орбитали s-орбиталь Единственный электрон атома водорода образует вокруг ядра сферическую орбиталь - шарообразное электронное облако. (самая устойчивая и располагается довольно близко к ядру). Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и наконец превращается в гантелеобразную p-орбиталь: p-орбиталь Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. d-орбитали Кроме s- и p-орбиталей, существуют электронные орбитали еще более сложной формы; их обозначают буквами d и f. Попадающие сюда электроны приобретают еще больший запас энергии, двигаются по сложным путям. Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре. Движение электрона в атоме описывается волновой функцией. Эта функция приобретает разные значения в разных точках атомного пространства. Если ядро простейшего атома водорода поместить в центре системы декартовых координат, то электрон можно описать функцией у (х, y, z). Поскольку движение электрона - это волновой процесс, то определение волновой функции сводится к нахождению амплитуды волны. Она количественно находится из дифференциального уравнения Шредингера (1926).
Квантовые числа Главное квантовое число - n - определяет энергетический уровень электрона, удалённость энергетического уровня от ядра и размер электронного облака. Главное квантовое число принимает значения от 1 до беск и соответствует номеру периода. Орбитальное квантовое число - l - определяет форму атомной орбитали. Орбитальное квантовое число принимает значения, начиная с l=0 до (n-1). Каждому значению орбитального квантового числа соответствует орбиталь особой формы.
|
n l число подур обозн подур 1 0 1 s- 2 01 2 s-,p- 3 012 3 s-,p-,d- 4 0123 4 s-,p-,d-,f- Магнитное квантовое число - ml - определяет ориентацию орбитали относительно внешнего магнитного или электрического поля. Магнитное квантовое число принимает любые значения от -l до +l, Схематически обоз квантовыми ячейками Подур l ml max S 0 0 2 P 1 -1,0,1 6 D 2 -2,-1,0,1,2 10 F 3 -3,-2,-1,0,1,2,3 14 Спиновое квантовое число - ms - определяет магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона - спинам. |
s-орбиталь |
1 |
|
Порядок заполнения орбиталей электронами. Принцип минимума энергии. Принцип Паули. Правило Хунда. Правило Клечковского. Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел: n, l,Z (n, l, , ) = 0 или 1, где Z (n, l, , ) - число электронов, находящихся в квантовом состоянии, описываемых набором четырех квантовых чисел: n, l, , . Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме различаются значениями, по крайней мере, одного квантового числа.
Правило Хунда - в пределах подуровня электроны распределяются по орбиталям таким образом, чтобы модуль суммы их спиновых квантовых чисел был максимальным. Правило Клечковского: Заполнение орбиталей происходит в порядке увеличения суммы квантовых чисел n+l; при постоянной сумме n+l заполнение происходит в порядке возрастания n. Применение правила Клечковского дает последовательность возрастания энергии орбиталей. Принцип наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией. Атомные орбитали располагаются в порядке увеличения их энергии следующим образом: 1s2 <2s2 <2p6<3s2<3p6<4s2<3d104p6<5s2<4d10<5p6<6s2<4f14<5d10<6p6<7s2<5f14<6d10 Li 1822S1
Al18 1S22S22P63S23P63d0
K19 1S22S22P63S23P64S1
Емкость энергетических уровней и подуровней. Строение
электронных оболочек атомов и связь периодической системы со строением атомов.
Изотопы
– атомы одного и того же элемента,
имеющих одинаковый заряд ядра, но разную
массу. Изобары
– атомы
разных элементов имеющие разный заряд
ядра, но одинаковую атомную массу.
Современная модель основана на 2
фундаментальных принципах квантовой
физики. 1. электрон имеет свойства и
частицы и волны одновременно. 2. частицы
не имеют строго определенных координат
и скоростей движения. Энергетический
уровень
(квантовое число n) – расстояние от ядра.
С увеличением n энергия электрона
возрастает. Число энергетических уровней
= номеру периода в котором находится
элемент. Максимальное число электронов
определяется N=2n2.
Энергетический
подуровень
обозначают буквами s (сферическая), p
(гантелеобразная), d (4 лепестковая
розетка), f (более сложная). Магнитное
квантовое число взаимодействие
электронного облака с внешними магнитными
полями. Спиновое квантовое число
собственное вращение электрона вокруг
своей оси. Периодический
закон. Свойства
элементов, а также строение и свойства
их соединений находятся в периодической
зависимости от заряда ядер их атомов.
Порядковый номер элемента = заряду его
ядра и количеству электронов. Число
нейтронов = атомная масса – порядковый
номер. Каждый период начинается s -
элементов (s1
щелочной металл) и заканчивается p –
элементом 
Энергия ионизации, энергия сродства к электрону,
электроотрицательность. Ионизационный потенциал
1).Энергия, которую необходимо затратить, чтобы оторвать электрон от атома и переместить его на бесконечно далёкий от него уровень. Причём атом становится полностью заряженным.
Эта энергия называется энергией ионизации. Li: 5,39 Эл. Вольт.
Энергия
отрыва одного электрона от атома Li
–75,6 ЭВ, для второго атома Li
– 122,4 ЭВ…Потенциал ионизации изменяется
скачком 1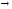 .Электронные
оболочки имеют ступенчатые (слоистые)
строения.2). Энергия
сродства к
электрону – изменение энергии атома
при его присоединении к нейтральному
атому с образованием отрицательного
иона при 01К.
.Электронные
оболочки имеют ступенчатые (слоистые)
строения.2). Энергия
сродства к
электрону – изменение энергии атома
при его присоединении к нейтральному
атому с образованием отрицательного
иона при 01К.
А
+ е
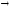 А-.
А-.
Электрон занимает нижнюю орбиталь с соблюдением правила Гунда.
Наиболее высокие энергии сродства у галогенов. Сумма всех энергий ионизации = Е полная.
3). Универсальная характеристика, объединяющая 1,2 электроотрицательность. сумма энергии ионизации и энергии сродства. Чем больше электроотрицательность, тем легче атом превращается в заряженный ион.
Электроотрицательность: Li =1, Na =0.9, K = 0.8, Cs = 0.7, Be = 1.5, Mg = 1.2, B = 2, F = 4, p = 2.5.
.
Природа химической связи. Теория валентности. Понятие о
степени окисления.
Химическая связь – взаимодействие двух атомов, осуществляемое путем обмена электронами. Существует несколько видов химической связи : ионная,ковалентная,металлическая, водородная, межмолекулярная и многоцентровая. Валентность – число химических связей, которыми данный атом соединен с другими атомами в молекуле. При этом электроны, принимающие участие в образовании химических связей, называются валентными. Способность атома присоединять или замещать определенное число других атомов называют валентностью. Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу (ЭHn, ЭOm), при условии, что водород одно- , а кислород двухвалентен. Согласно спиновой теории, валентность атома определяется числом его неспаренных электронов, способных участвовать в образовании химических связей с другими атомами, поэтому понятно, что валентность всегда выражается небольшими целыми числами. степень окисления — это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. Понятие степени окисления было введено в предположении о полном смещении пар электронов к тому или другому атому (показывая при этом заряд ионов, образующих ионное соединение). Поэтому в полярных соединениях степень окисления означает число электронов, лишь смещенных от данного атома к атому, связанному с ним.
