
7 Зертханалық жұмыс
ГИДРОДИСПЕРСИЯЛАРДЫҢ КОАГУЛЯЦИЯСЫ МЕН СТАБИЛИЗАЦИЯСЫ
Коллоидтық жүйелердің жалпы сипаттамасы
Коллоидтық-химиялық сипаттаманың негізі ретінде дисперстілік, яғни заттың ұнтақтылығы жатады. Дисперстік бөлшектер өлшемдері - жай молекулалармен салыстырғанда үлкенірек бөлшектерден бастап, көзге көрінетін бөлшектер аралығын қамтиды ( 10-7 -ден 10-2 см дейін).
Сонымен, дисперлену кезінде беттік аудан So едәуір шамаға дейін жетіп артады. So артқан сайын фаза бөлу қабатындағы молекулалардың үлесі артады, олардың энергетикалық күйлері көлемдегі молекулалармен салыстырғанда ерекше болып келеді. Ерекше молекулалардың үлесі f = 6/n тең, мұндағы n – қабырғадағы молекулалар саны. Куб тәріздес осы молекулалар үшін мынандай дәлірек өрнек ұсынылады:
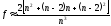 (8.1)
(8.1)
Едәуір жоғары дисперстілікте ерекше молекулалардың үлесі кемиді, себебі көлемдегі молекулалардың үлесі азаяды., ал n=2 болғанда мүлдем жоғалады. Бұл жағдайда So –дің физикалық мағынасы жойылады.
Беттік ерекше молекулалардың артық бос энергиясы болады, олар жүйеде дисперлену арқылы істелінетін жұмыс нәтижесінде үзілетін байланыстар әсерінен пайда болады.
Сонымен, коллоидтық жүйелер артық беттік (бос) энергиямен сипатталады, демек, олар термодинамикалық тұрақсыз. Бұдан тұрақтылық деп, ортада дисперстік дәреженің уақыт бойынша өзгеріссіз сақталуы мен дисперстік фазаның біркелкі таралу қабілеттілігін айтамыз. Бірақ бөлшектердің іріленуі беттік энергияны кемітуге әкеп соғатынын ескерсек, онда шегіне жеткенде коллоидтар тепе-теңдік күйге ұмтылады, оған min бөлу қабаты бар жүйенің екі фазаға бөлінуі сай келеді (Мұндай тепе-теңдік күй іс жүзінде болуы мүмкін емес).
Тұрақтылық проблемасы, басқаша айтқанда, диспертік жүйелердің өмірі мен өлімі ең маңызды және күрделі болып саналады. Тұрақтылықты қарастырғанда лиофильдік және лиофобтық коллоидтар арасындағы айырмашылықтарға көңіл аударған жөн.
Лиофильдік коллоидтар – молекулалық коллоидтар, тағы да лиофильдік суспензоидтар (саз, сабын) – өздігінен дисперленеді сол кезде термодинамикалық тұрақты жүйелер түзіледі. Жоғарыда дисперлену кезінде беттік (бос) энергия артады деп көрсетілген болатын. Лиофильдік жүйелер үшін бос энергия(F) кемиді:
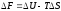 0
(8.2)
0
(8.2)
-
бұл өрнек лиофильдіктің критериі деп
есептелінеді (Ребиндер және басқалар).
Дисперлену кезінде энтропияның артуы
әдетте, F
азайтуға тырысады, яғни ортадағы жүйе
дисперстік фазаның біркелкі таралуына
себеп болады (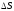 араласу
0).
араласу
0).
Дисперлену кезіндегі ішкі энергияның балансы (U) молдекулалық байланыстарды айырып жаңа бет түзілуге жұмсалатын энергиямен (когезия жұмысы Wc) және фаза-аралық сольватациялық әрекеттесу (адгезия жұмысы Wa) нәтижесінде бөлінетін энергиядан тұрады. Лиофильдік жүйелер үшін Wa Wc, бұл дисперлену нәтижесінде жүйенің ішкі энергиясы кемитінін көрсетеді (U 0).
Бұдан дисперлену мен еру процестерінің ұқсастығын көрге болады, себебі мысалы, кристалдардың еруі сольватация энергиясы Wa мен кристалл торларының бұзылу энергиясының Wc арақатынастары арқылы және араласу энтропиясын ескеруі бойынша анықталады. Лиофобтық коллоидтар дисперстік фазалардың ішінара байланысу энергиясы фаза-аралық әрекеттесу энергиясынан көбірек болу арқылы (Wc Wa) сипатталады және бұл айырмашылық энтропиялық фактормен компенсацияланбайды:
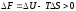 (8.3)
(8.3)
Бұл жағдайда дисперлену өздігінен жүрмейді, сыртқы күш әсер етуді талап етеді. Лиофобтық жүйелер термодинамикалық тұрақсыз және фаза-аралық шекарада беттік керілудің мәні жоғары болады (Wa - min).
Сонымен, лиофобтық жүйелер үшін тұрақтылық проблемасының маңызы зор. Термодинамикалық тұрақсыздығына қарамастан көптеген лиофобтық жүйелер метастабильді күйде көп уақыт бойы тұрақтылығын сақтайды. Тұрақтылық түрлері туралы түсінікті Песков енгізді: седиментациялық және агрегативтік.
Седиментациялық – тұрақтылықта дисперстік фазалар ауырлық күшіне қарсы тұрады. Седиментациялық тұрақтылықтың бұзылуын тудыратын жағдайлар: дөрекі дисперстік жүйелердегі бөлшектердің шөгуі; изотермиялық айдауда ұсақ бөлшектердің үлкен бөлшектерге айналып шөгуі; әртүрлі факторлардың әсерінен бөлшектердің бірігуі арқылы (коагуляция) агрегативтік тұрақтылықтың жойылуы.
Агрегативтік тұрақтылық – дисперстік жүйенің дисперстілігі мен дисперстік фазаның дара бөлшектілігін сақтап қалу қабілеттілігі.
Агрегативтік тұрақтылықтың коагуляция нәтижесінде жойылуы дисперстік жүйенің бұзылуына әкеп соғады. Қандай себептердің әсерінен коллоидтық бөлшектер коагуляцияға ұшырайды Көптеген байқалған құбылыстар коагуляцияға ұшыратудың алуан-түрлі себептері бар екенін көрсетеді. Ыстық пен суықтың, электромагниттік өрістің, тұрақты сәуле шығарудың әсерлері, механикалық әсерлесу, химиялық агенттерді қосу коагуляцияға әкеп соғады. Аталған факторлардың бәрі бөлшектерді жақындатуға кедергі жасайтын энергетикалық тосқауылды бұзады, ал метастабильді жүйе тұрақтырақ күйге ауысады оған min бөлу қабаты бар жүйенің екі фазаға бөлінуі сай келеді. Коагуляцияға ұшырататын барлық факторлардың ішінде маңыздысы электролиттердің әсері болып саналады.
